Синтез экстрагента на основе неодекановой кислоты для концентрирования и разделения редкоземельных металлов
1435
Журнал прикладной химии. 2019. Т. 92. Вып. 11
УДК 547.327:542.61:546.66
СИНТЕЗ ЭКСТРАГЕНТА НА ОСНОВЕ НЕОДЕКАНОВОЙ КИСЛОТЫ
ДЛЯ КОНЦЕНТРИРОВАНИЯ И РАЗДЕЛЕНИЯ РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
© С. О. Бондарева, Т. Р. Нугуманов, И. С. Назаров, Ю. И. Муринов
Уфимский институт химии Уфимского федерального исследовательского центра РАН,
450054, г. Уфа, пр. Октября, д. 69
E-mail: bondarevaso@anrb.ru
Поступила в Редакцию 6 марта 2019 г.
После доработки 28 июня 2019 г.
Принята к публикации 20 августа 2019 г.
Термической конденсацией диэтилентриамина с неодекановой кислотой получен N,N′-(иминодиэтан-
2,1-диил)ди(неодеканамид). Показана принципиальная возможность применения смеси синтезиро-
ванного диамида с неодекановой кислотой для экстракции редкоземельных металлов из хлоридных
растворов. Определены коэффициенты разделения пар Er-Gd, Er-Y и Lu-Er; изучены условия реэкс-
тракции редкоземельных металлов и регенерации экстрагента.
Ключевые слова: диэтилентриамин; неодекановая кислота; N,N′-(иминодиэтан-2,1-диил)ди(неодека-
намид); экстракция; редкоземельные металлы; иттриевая подгруппа
DOI: 10.1134/S0044461819110100
Диэтилентриамины, ацилированные жирными
му центру обусловливает стерические затруднения
карбоновыми кислотами, являются промежуточным
при конденсации изомеров неодекановой кислоты с
продуктом в процессе получения катионоактивных
диэтилентриамином. Однако проблема утилизации
и амфолитных поверхностно-активных веществ.
непрореагировавшей неодекановой кислоты легко
Как правило, нетоксичные, биоразлагаемые и тер-
решается, если целевым продуктом синтеза будет не
мостабильные, они синтезируются в одну стадию
диамид неодекановой кислоты, а его смесь с непро-
с высоким выходом, а исходным сырьем для син-
реагировавшей неодекановой кислотой — экстрагент
теза являются недорогие и доступные промышлен-
для извлечения редкоземельных металлов.
ные реагенты. Диэтилентриамин, диацилированный
Целью настоящей работы было оптимизировать
α,α′-разветвленными синтетическими жирными
реакцию термической конденсации диэтилентриами-
кислотами С8-С14, был предложен нами в качестве
на с неодекановой кислотой и оценить возможность
экстрагента платиновых металлов из солянокислых
применения синтезированного экстрагента для кон-
растворов [1, 2], а его смесь с α,α′-разветвленны-
центрирования и разделения редкоземельных метал-
ми кислотами С8-С14 показала себя эффективным
лов.
экстрагентом редкоземельных металлов [3]. В на-
стоящее время в России фактически прекращено
Экспериментальная часть
производство высших изомерных кислот. Наиболее
доступной и подходящей для синтеза экстрагентов
Для синтеза использовали диэтилентриамин
карбоновой кислотой является неодекановая кисло-
(ОАО «Каустик», Стерлитамак), предварительно пе-
та [4], которую в промышленных объемах произво-
регнанный при 59-60°С (2 мм рт. ст.), и неодекано-
дят в Европе, США и Китае. Неодекановая кислота
вую кислоту (техн., ExxonMobil Chemical, США) без
представляет собой смесь 10-15 изомерных α,α′-,
предварительной очистки. N,N′-(Иминодиэтан-2,1-диил)-
α,α′,β- и α,α′,δ,δ′-разветвленных карбоновых кислот
ди(неодеканамид) (диамид) синтезировали термиче-
общей формулы R1R2R3CCOOH. Наличие замести-
ской конденсацией неодекановой кислоты с диэти-
телей в α- и особенно в β-положениях к реакционно-
лентриамином в атмосфере азота, за ходом реакции
1436
Бондарева С. О. и др.
следили с помощью ГЖХ. Синтез осуществляли при
мя контакта фаз 5 мин, экстракцию и реэкстракцию
мольном соотношении диэтилентриамин:неодекано-
проводили при комнатной температуре (21-22°С),
вая кислота 1:2, 1:3 и 1:4; температуру варьировали
поскольку ранее было показано [3], что в интерва-
в интервале 170-250°С, вес исходной реакционной
ле 0-40°С температура оказывает незначительное
смеси во всех экспериментах составлял 10 ± 0.1 г.
влияние на извлечение редкоземельных металлов
Синтез диамида. Реакционную смесь переме-
смесью α,α′-замещенных карбоновых кислот и ди-
шивали при 80-100°С в течение 0.5 ч, затем нагре-
ацилированного диэтилентриамина. Для реэкстрак-
вали до требуемой температуры и выдерживали в
ции редкоземельных металлов использовали 0.1 М
течение 6-10 ч при перемешивании с отводом па-
раствор соляной кислоты, содержащий 3.0 М хло-
ров воды, выделяющейся в процессе конденсации
рида натрия. В процессе экстракции образования
диэтилентриамина с неодекановой кислотой, затем
третьей фазы не наблюдали, для каждой эксперимен-
охлаждали в токе азота до комнатной температуры
тальной точки рассчитывали материальный баланс:
и отмывали от примесей по методике [3]. Диамид,
[РЗМ]реэкс + [РЗМ]раф = [РЗМ]исх, где [РЗМ] — со-
вязкое бледно-желтоe вещество, представляет со-
держание редкоземельных металлов соответ-
бой высококипящую смесь изомеров. ИК спектр,
ственно в реэкстракте, рафинате и исходном рас-
ν, см-1: 3348 ср (NH), 1635 c (C=O), 1533 c [δ(NH)].
творе. В расчет принимались только результаты
Спектр ЯМР 1Н (500 MГц, CDCl3), δ, м. д.: 0.81-
[РЗМ]исх ∈ ≤ 95; 105 ≥ %.
1.62 м (38Н, С9Н19), 2.77 т (4Н, J = 5.7 Гц, СН2NH),
Разделение редкоземельных металлов изуча-
3.34 т (4H, J = 5.5 Гц, CH2NHCO), 6.37 уш. с (2Н,
ли на модельных растворах следующего состава
NHCO). Спектр ЯМР 13C (125.47 MГц, CDCl3), δC,
(моль·дм-3): [Er] = 0.0105, [Lu] = 0.0100, [NaCl] =
м. д.: 39.04 уш. с (CH2NHCO); 41.98, 42.07, 45.29,
= 3.0, [HCl] = 0.05 (раствор 1); [Er] = 0.0465, [Y] =
45.39, 45.67, 45.74 (Счетв); 48.89 (СН2NH); 177.41,
= 0.0485, [NaCl] = 3.0, [HCl] = 0.05 (раствор 2); [Er] =
177.50, 177.59, 177.65, 177.72, 178.18, 178.48, 178.73
= 0.0520, [Gd] = 0.0505, [NaCl] = 3.0, [HCl] = 0.05
(С=О). Масс-спектр (ХИАД), m/z (%): 412 [M + H]+
(раствор 3); [Er] = 0.0480, [Lu] = 0.0495, [NaCl] =
(100), 410 [M-H]- (100).
= 3.0, [HCl] = 0.05 (раствор 4). При совместном при-
Для удаления побочного амида неодекановой кис-
сутствии редкоземельных металлов концентрацию
лоты 5%-ный раствор синтезированного продукта в
эрбия в реэкстрактах, рафинатах и модельных раство-
толуоле («чистый») промывали 0.5 М раствором HCl
рах определяли спектрофотометрическим методом,
до образования бесцветной водной фазы, затем орга-
используя хорошо разрешенные полосы поглоще-
ническую фазу нейтрализовали 1-2%-ным водным
ния λmax = 380 нм (ε = 4.4) и λmax = 523 нм (ε = 2.8),
раствором аммиака (до рН равновесной водной фазы
связанные со сверхчувствительными электронными
6-7), промывали 3 М раствором хлорида натрия и
переходами 4I15/2 → 4G11/2 и 4I15/2 → 2H11/2 соответ-
использовали в качестве экстрагента. Концентрацию
ственно. Содержание иттрия, гадолиния и лютеция
диамида и неодекановой кислоты в растворе экстра-
в реэкстрактах, рафинатах и модельных растворах
гента определяли методом потенциометрического
определяли по разности суммарной концентрации
титрования в 60%-ном водном изопропиловом спирте
редкоземельных металлов, определяемой прямым
(фоновый электролит — 0.5 М NaClO4).
комплексонометрическим титрованием, и концен-
Исходные растворы эрбия(III) и лютеция(III) гото-
трации эрбия.
вили соответственно из хлоридов эрбия ErCl3·6H2O
ИК-спектр записывали на ИК-Фурье-спектрометре
(«чистый») или лютеция LuCl3·6H2O (х.ч.), а так-
TENSOR 27 (Bruker) в пленке. Спектры ЯМР ре-
же хлорида натрия (х.ч.). Исходный раствор ит-
гистрировали на импульсном спектрометре
трия(III) готовили растворением карбоната иттрия
Bruker Avance III, рабочие частоты 500.13 (1H)
Y2(CO3)3·3H2O (х.ч.) в растворе 1 М соляной кислоты
и 125.47 МГц (13C), растворитель — CDCl3, вну-
(х.ч.), добавляя необходимое количество хлорида на-
тренний стандарт — ТМС. Анализ реагентов ме-
трия (х.ч.). Концентрацию редкоземельных металлов
тодом ГЖХ осуществляли на приборе Shimadzu
в исходных растворах, рафинатах и в реэкстрактах
GC-2014 при 200-320°С: для анализа неодекано-
определяли прямым комплексонометрическим ти-
вой кислоты использовали колонку HP-INNOWax
трованием комплексоном III с ксиленоловым оран-
(30 м × 0.25 мм × 0.25 мкм), для анализа диамида —
жевым в присутствии ацетатного буфера. Методика
колонку SE-30 (30 м × 0.25 мм × 0.25 мкм). Масс-
проведения экстракционного эксперимента подробно
спектры были зарегистрированы на жидкостном
описана в работе [3], в настоящей работе соотноше-
квадрупольном масс-спектрометре Shimadzu LCMS-
ние водной и органической фаз составляло 1:1, вре-
2010EV химической ионизацией при атмосферном
Синтез экстрагента на основе неодекановой кислоты для концентрирования и разделения редкоземельных металлов
1437
давлении (ХИАД) в режиме детектирования положи-
Обсуждение результатов
тельных и отрицательных ионов. Электронные спек-
Ацилирование диэтилентриамина линейными
тры регистрировали на спектрофотометре Specord
карбоновыми кислотами с заметной скоростью про-
M40 в области 333-909 нм. Потенциометрические
текает при температурах 150-180°С [5, 6], образо-
исследования выполняли на рН-метре ОР-211/1 с ком-
вавшиеся диамиды при увеличении температуры или
бинированным стеклянным электродом ЭСК 10601/7.
времени реакции циклизуются в соответствующие
имидазолины:
Для оптимизации термической конденсации ди-
Как и ожидалось, в отличие от линейных карбо-
этилентриамина с неодекановой кислотой был прове-
новых кислот ацилирование диэтилентриамина про-
ден ряд синтезов, в которых варьировали мольное со-
странственно-затрудненной неодекановой кислотой в
отношение диэтилентриамин:неодекановая кислота,
интервале температур 170-180°С было неэффектив-
температуру и время проведения реакции, результаты
ным (кривая 1). Проведение реакции в интервале тем-
опытов представлены на рис. 1.
ператур 200-240°С (кривая 2) приводило к умерен-
ному выходу целевого диамида (8-10 ч, выход около
50%). При этом наиболее реакционноспособные из
изомеров неодекановой кислоты полностью расхо-
довались, а наименее реакционноспособные еще не
вступали в реакцию. Повышение температуры и (или)
времени синтеза приводило к циклизации диамида в
соответствующий замещенный имидазолин и сопро-
вождалось осмолением продуктов. Это означает, что
мольное соотношение диэтилентриамин:неодекано-
вая кислота, равное 1:2, в выбранных условиях синте-
за фактически не достигалось. Из сравнения кривых
1, 3 и 4 на рис. 1 следует, что оптимальным является
мольное соотношение диэтилентриамин:неодека-
новая кислота, равное 1:3. Небольшое повышение
температуры синтеза на 20-30° (кривая 5) через 4-5 ч
привело к выходу диамида 55-60% (в пересчете на
исходный диэтилентриамин), при этом фактическое
содержание целевого диамида в реакционной смеси
составило около 40%. В этом случае представляется
рациональным не выделять диамид из реакционной
смеси, а использовать эту смесь в качестве экстра-
Рис. 1. Влияние времени, мольного соотношения ди-
гента редкоземельных металлов. Синтезированный
этилентриамин:неодекановая кислота и температуры
продукт (мольное соотношение диэтилентри-
на выход целевого диамида: 1:2, Т = 170-180°С (1);
1:2, Т = 200-240°С (2); 1:3, Т = 170-180°С (3); 1:4, Т =
амин:неодекановая кислота = 1:3, Т = 180-210°С,
= 170-180°С (4); 1:3, Т = 180-210°С (5).
5.5 ч) представлял собой смесь целевого диамида
1438
Бондарева С. О. и др.
(42%), побочного амида неодекановой кислоты (17%)
и непрореагировавшей неодекановой кислоты (41%).
После отмывки от побочного амида неодекановой
кислоты получали готовый к применению экстрагент:
смесь диамида и неодекановой кислоты с мольным
соотношением 1:2.3 соответственно. В последующих
экспериментах применяли 5%-ный раствор экстра-
гента в толуоле, содержащий примерно 0.05 М диа-
мида и 0.115 М неодекановой кислоты.
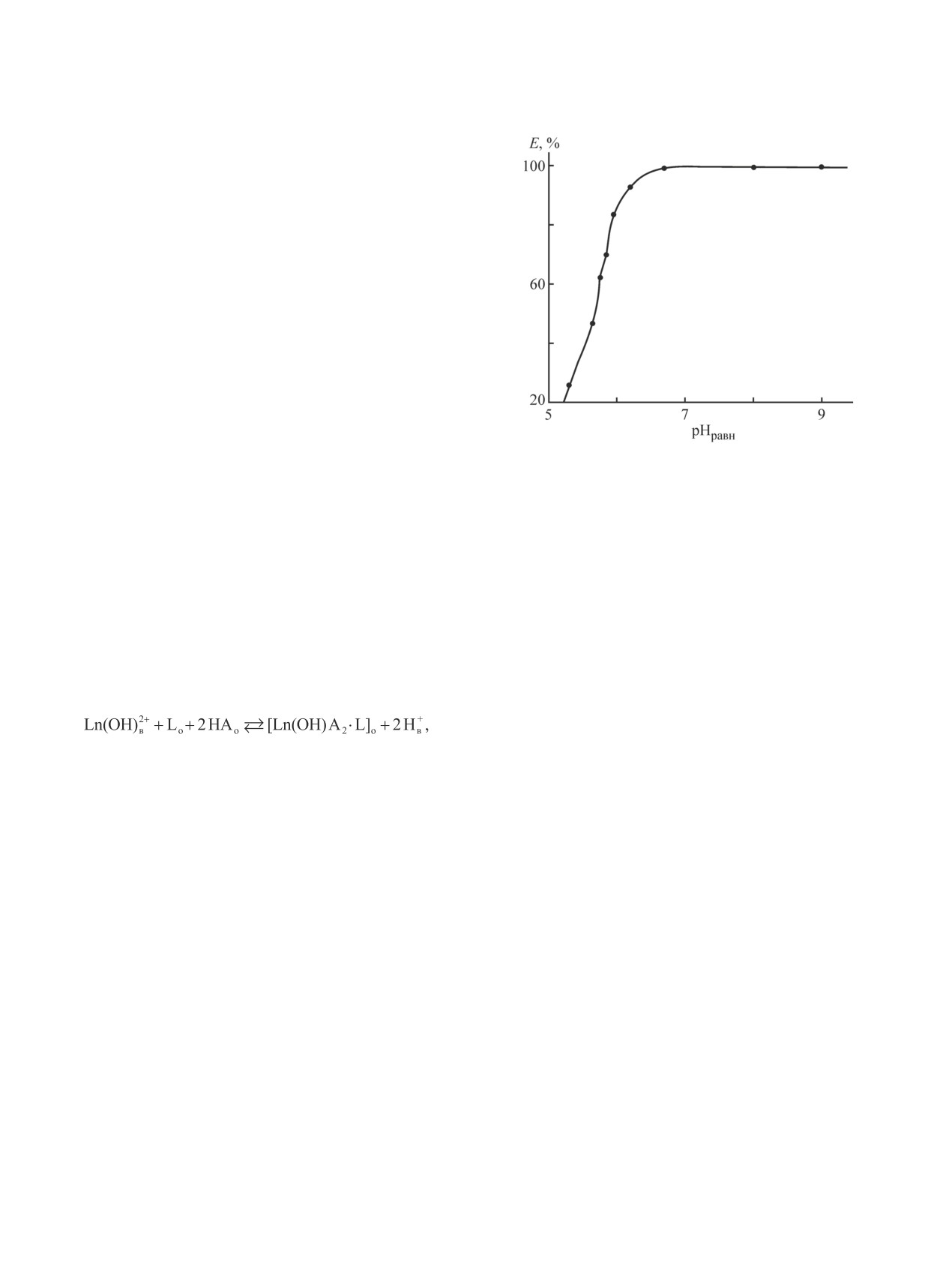
На рис. 2 представлена зависимость степени из-
влечения эрбия(III) экстрагентом от кислотности рав-
новесной водной фазы.
С увеличением рН водной фазы извлечение эрбия
резко увеличивается, не сопровождаясь образованием
третьей фазы, и в интервале рН 6.7-7.0 кривая экс-
тракции выходит на «плато», где достигается прак-
тически 100%-ное извлечение эрбия. На практике
Рис. 2. Зависимость степени извлечения эрбия(III)
целесообразно проводить извлечение редкоземель-
5%-ным раствором экстрагента в толуоле от кислотно-
ных металлов в интервале рН 5.5-7.0, так как с уве-
сти равновесной водной фазы, cEr(III) = 0.031 моль·л-1,
cNaCl = 3 моль·л-1.
личением рН растет доля ионизированных молекул
неодекановой кислоты и ее переход в водную фазу.
Как видно из рис. 2, металл не выделяется в третью
лотности (в области рН 5.5-6.0), а предлагаемый
фазу даже в слабощелочной области. Как это было
нами экстрагент позволяет извлекать редкоземельные
показано ранее [3], механизм экстракции редкозе-
металлы в интервале рН 5.5-7.0.
мельных металлов из хлоридных растворов смесью
Возможность экстракционного разделения пар
α,α′-разветвленных карбоновых кислот С8-С14 с ди-
редкоземельных металлов при их совместном при-
ацилированным диэтилентриамином можно описать
сутствии раствором экстрагента изучали на примере
следующим уравнением:
иттриевой подгруппы. В таблице приведены коэффи-
циенты разделения пар лютеций-эрбий, эрбий-гадо-
(1)
линий и эрбий-иттрий.
В условиях отсутствия конкуренции между иона-
где L — молекула диамида, HA — молекула карбо-
ми (суммарное содержание редкоземельных металлов
новой кислоты, индексы (в) и (о) относятся соответ-
в модельном растворе составляло 0.020 моль·дм-3 и
ственно к водной и органической фазам.
не превышало экстракционную емкость экстрагента)
Именно способностью смесевого экстрагента из-
коэффициент разделения пары Lu-Er при значении
влекать редкоземельные металлы в гидролизованной
рН равновесной водной фазы, близком к рН 50%-ной
форме объясняется отсутствие в экстракционной си-
экстракции, равнялся 3.3. В условиях конкуренции
стеме третьей фазы. Кроме того, в экстрагенте при-
между ионами редкоземельных металлов (суммарное
сутствует небольшой избыток неодекановой кисло-
содержание редкоземельных металлов в модельном
ты, которая сольватирует экстрагируемый комплекс
растворе составляло 0.100 ± 0.005 моль·дм-3) и не-
эрбия.
большом увеличении рН равновесной водной фазы
В отсутствие неодекановой кислоты диамид не-
коэффициент разделения пары заметно увеличился.
эффективно извлекает редкоземельные металлы [3]:
По сравнению с карбоновыми кислотами явным пре-
как известно, алкилзамещенные диамиды эффек-
имуществом экстрагента является возможность раз-
тивно экстрагируют лантаниды из растворов с со-
деления редкоземельных металлов в более щелочной
держанием азотной кислоты выше 1 моль·л-1 [7, 8].
области. В дальнейшем подбор оптимальных усло-
Напротив, зависимость извлечения редкоземельных
вий, возможно, позволит несколько увеличить коэф-
металлов неодекановой кислотой от рН водной фазы
фициенты разделения пар редкоземельных металлов.
[9] непринципиально отличается от аналогичной за-
Из данных таблицы видно, что экстрагент облада-
висимости на рис. 2. Однако эффективная экстракция
ет относительно высокой экстракционной емкостью:
редкоземельных металлов неодекановой кислотой
так, за один цикл из модельных растворов с концен-
достигается в относительно узком интервале кис-
трацией редкоземельных металлов 0.1 моль·л-1 при
Синтез экстрагента на основе неодекановой кислоты для концентрирования и разделения редкоземельных металлов
1439
Суммарное извлечение редкоземельных металлов Е и коэффициенты разделения пар редкоземельных
металлов β при экстракции из хлоридных растворов 5%-ным раствором экстрагента в толуоле
Соотношение водной и органической фаз 1:1, время контакта фаз 5 мин, Т = 22°С
Разделяемая пара
Исходный
рН равновесной
Е, %
β
редкоземельных металлов
раствор*
водной фазы
Lu-Er
1
5.45
54.5 ± 0.5
3.2 ± 0.2
Er-Y
2
39.5 ± 0.5
3.1 ± 0.2
Er-Gd
3
6.0 ± 0.1
42.0 ± 0.5
5.0 ± 0.3
Lu-Er
4
43.0 ± 0.5
8.9 ± 0.4
* Состав исходных модельных растворов 1-4 приведен в экспериментальной части.
рН равновесной водной фазы 6.0 ± 0.1 в 5%-ный
ской фазы редкоземельные металлы за одну стадию
раствор экстрагента извлекали от 5.32 (раствор 2)
количественно реэкстрагируются разбавленными
до 7.29 г·дм-3 (раствор 4) редкоземельных металлов.
растворами минеральных кислот. На примере иттрие-
На основании уравнения (1) теоретическая емкость
вой подгруппы показана возможность разделения пар
5%-ного раствора смесевого экстрагента по редкозе-
эрбий-гадолиний, эрбий-иттрий и лютеций-эрбий.
мельным металлам может составлять ~0.055 моль·л-1
(до 9 г·дм-3 по эрбию).
Благодарности
Из органической фазы редкоземельные метал-
лы эффективно реэкстрагируются разбавленными
Работа выполнена с использованием оборудования
растворами минеральных кислот. Так, при контак-
Центра коллективного пользования «Химия» УфИХ
те с 0.1 М соляной кислотой и соотношении фаз
УФИЦ РАН.
1:1 100%-ная реэкстракция Er(III), Gd(III), Lu(III) и
Y(III) достигается за одну ступень в течение 3-5 мин.
Финансирование работы
Органическая фаза регенерируется нейтрализацией
Работа выполнена по темам госзадания «Ком-
1-2%-ным водным раствором аммиака (до рН равно-
плексообразование моно- и полидентатных сера-азо-
весной водной фазы 6-7) с последующей промывкой
торганических соединений с ионами металлов и фар-
3 М раствором NaCl.
маконами» № АААА-А17-117011910033-1 и «Методы
хроматографии, масс-спектрометрии, ИК, УФ, ЭПР
Выводы
и ЯМР-спектроскопии для установления структуры
и идентификации органических, биоорганических
Предложен простой одностадийный метод синте-
молекул и полимеров» № AAA-A17-117011910027-0.
за N,N′-(иминодиэтан-2,1-диил)ди(неодеканамид)а
из недорогих и доступных промышленных реаген-
тов: диэтилентриамина и неодекановой кислоты.
Конфликт интересов
Присутствие избытка неодекановой кислоты позво-
Авторы заявляют об отсутствии конфликта инте-
лило сократить время синтеза диамида с 8-10 до 4-5
ресов, требующего раскрытия в данной статье.
ч. Полученная смесь диамида и непрореагировавшей
неодекановой кислоты является практически готовым
Информация об авторах
экстрагентом редкоземельных металлов, эффектив-
но извлекая редкоземельные металлы из хлоридных
Бондарева Светлана Олеговна, к.х.н., ORCID:
растворов в интервале рН 5.5-7.0. Смесевый экстра-
гент обладает относительно высокой экстракционной
Нугуманов Тимур Римович, к.х.н., ORCID: https://
емкостью: при экстракции в 5%-ный раствор экстра-
orcid.org/0000-0003-3355-7262
гента емкость составила от 5.32 до 7.29 г·дм-3 в зави-
симости от извлекаемых редкоземельных металлов.
org/0000-0002-9107-347X
Экстракция и реэкстракция редкоземельных металлов
Муринов Юрий Ильич, д.х.н., проф., ORCID:
характеризуются быстрой кинетикой. Из органиче-
1440
Бондарева С. О. и др.
Список литературы
diethylenetriamines and carboxylic acids // Solvent
Extr. Ion Exc. 2017. V. 35. N 5. P. 332-344. DOI:
[1] Хисамутдинов Р. А., Бондарева С. О., Муринов Ю.
10.1080/07366299.2017.1344485
И., Байкова И. П. Экстракция палладия(II), плати-
[4] Fefer M. J. Neo acids: Synthetic highly branched
ны(II) и платины(IV) из солянокислых растворов
organic acids // Am. Oil Chem. Soc. 1978. V. 55.
бисацилированным диэтилентриамином // ЖНХ.
P. A342-A345. DOI: 10.1007/BF02911888
2008. Т. 53. № 3. C. 512-519 [Khisamutdinov R. A.,
[5] Wu Y., Herrington Ph. R. Thermal reactions of fatty acids
Bondareva S. O., Murinov Yu. I., Baikova I. P. Extraction
with diethylene triamine // J. Am. Oil Chem. Soc. 1997.
of palladium(II), platinum(II), and platinum(IV) by
V. 74. N 1. P. 61-64. DOI: 10.1007/s11746-997-0120-2
bisacylated diethylenetriamine from hydrochloric acid
[6] Tyagi R., Tyagi V. K., Pandey S. K. Imidazoline and its
solutions // Russ. J. Inorg. Chem. 2008. V. 53. N 3.
derivatives: an overview // J. Oleo. Sci. 2007. V. 56.
P. 462-469. DOI: 10.1134/S0036023608030236].
N 5. P. 211-222. DOI: 10.5650/jos.56.211
[2] Афзалетдинова Н. Г., Муринов Ю. И., Хад-
[7] Paiva A. P., Malik P. Recent advances on the chemistry
жиев Ш. Ю., Бондарева С. О., Муслухов Р. Р.
of solvent extraction applied to the reprocessing of spent
Экстракция родия(III) производным бисацилирован-
nuclear fuels and radioactive wastes // J. Radioanal.
ного диэтилентриамина из солянокислых растворов
Nucl. Chem. 2004. V. 261. N 2. P. 485-496. DOI:
// ЖНХ. 2010. Т. 55. № 3. С. 481-488 [Afzaletdinova
10.1023/B:JRNC.0000034890.23325.b5
N. G., Murinov Yu. I., Khazhiev Sh. Yu., Bondare-
[8] Sasaki Y., Sugo Y., Morita K., Nash K. L. The effect
va S. O., Muslukhov R. R. Extraction of rhodium(III)
of alkyl substituents on actinide and lanthanide
by a bisacylated diethylenetriamine derivative
extraction by diglycolamide compounds // Solvent
from hydrochloric acid solutions // Russ. J. Inorg.
Extr. Ion Exch. 2015. V. 33. N 7. P. 625-641. DOI:
Chem. 2010. V. 55. N 3. P. 460-467. DOI: 10.1134/
10.1080/07366299.2015.1087209
S0036023610030290].
[9] Singh D. K., Singh H., Mathur J. N. Extraction of
[3] Bondareva S. O., Spirikhin L. V., Lobov A. N.,
rare earths and yttrium with high molecular weight
Murinov Yu. I. Solvent extraction of neodymium(III)
carboxylic acids // Hydrometallurgy. 2006. V. 81. N 3-4.
from chloride solutions using a mixture of diacylated
P. 174-181. DOI: 10.1016/j.hydromet.2005.12.002