Журнал прикладной химии. 2019. Т. 92. Вып. 12
РАЗЛИЧНЫЕ ТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ
УДК 544.4; 544.45
ВЛИЯНИЕ ДОБАВОК ВОДОРОДА И МОНООКСИДА УГЛЕРОДА
НА ПАРЦИАЛЬНОЕ ОКИСЛЕНИЕ МЕТАНА ПРИ ПОВЫШЕННЫХ ДАВЛЕНИЯХ
© И. Г. Фокин1, А. В. Озерский1,2, А. В. Никитин1,2, В. И.Савченко1,
В. С. Арутюнов1,2,3, И. В. Седов1,3
1 Институт проблем химической физики РАН,
142432, г. Черноголовка Московской обл., пр. Академика Семенова, д. 1
2 Институт химической физики им. Н. Н. Семенова РАН,
119334, г. Москва, ул. Косыгина, д. 4
3 Московский государственный университет им. М. В. Ломоносова,
119991, г. Москва, Ленинские горы, д. 1, стр. 51
E-mail: ilia@icp.ac.ru
Поступила в Редакцию 3 октября 2019 г.
После доработки 21 октября 2019 г.
Принята к публикации 22 октября 2019 г.
Экспериментально исследовано влияние добавок монооксида углерода и водорода на парциальное
газофазное окисление метана при высоких давлениях. Определены предельно допустимые концентра-
ции этих компонентов в рециркулируемом газе. Обоснована оптимальная кратность рециркуляции
углеводородного газа при организации технологического процесса.
Ключевые слова: природный газ; метан; парциальное окисление; метанол, оксигенаты; монооксид
углерода; водород
DOI: 10.1134/S0044461819120107
Прямое парциальное окисление метана в метанол
стадийной организации процесса эта величина мо-
(ПОММ) является одним из перспективных методов
жет быть увеличена до 9-12% [1], но и это не всегда
малотоннажной химической конверсии природных и
достаточно для достижения экономической привле-
попутных газов малых и удаленных месторождений,
кательности процесса.
а также альтернативных источников углеводородного
Естественным способом повышения конверсии
сырья [1-4], поскольку позволяет избежать сложной
исходного сырья в технологических процессах явля-
и энергозатратной стадии получения синтез-газа.
ется его рециркуляция. Однако при этом возникают
Среди наиболее привлекательных областей приме-
вопросы, связанные с отделением побочных газо-
нения ПОММ — малотоннажное производство мета-
фазных продуктов, которые могут накапливаться в
нола в промысловых условиях для его последующего
рециркулируемом газе, и их влиянием на кинетику
использования в качестве ингибитора гидратообра-
процесса. Если такие инертные компоненты, как N2
зования. Однако серьезным недостатком процесса,
и CO2, которые могут накапливаться в рециркулиру-
влияющим на перспективы его практической реали-
емом газе, не влияют на процесс [1-4], то влияние
зации, является низкая конверсия газа за проход через
таких химически активных газофазных продуктов
реактор. Принципиальные особенности механизма
ПОММ, как СО и Н2, требует тщательного исследо-
процесса ограничивают ее величиной 3-4%. За счет
вания.
1590
Влияние добавок водорода и монооксида углерода на парциальное окисление метана при повышенных давлениях
1591
Кинетический анализ процесса ПОММ в циркуля-
в данной работе, основная часть окисления СО до
ционном режиме был проведен в [5], но лишь началь-
СО2 протекала гетерогенно на поверхности реактора.
ной фазы накопления продуктов, до достижения их
Согласно данным [7], небольшие, до 5% добавки СО,
стационарных концентраций в рециркулируемом газе,
так же как и такие же добавки Н2, не влияют заметным
устанавливающихся при сдувке определенной части
образом на процесс. Но при увеличении концентрации
реакционного газа. Было показано, что концентрации
СО с 5 до 15% наблюдается существенное снижение
СО и Н2, несмотря на то что эти газы также подвер-
выхода жидких продуктов. При высоких концентра-
гаются окислению в процессе ПОММ, могут расти
циях СО это могло быть частично связано с соответ-
и достигать в стационарных условиях значительных
ствующим снижением концентрации метана в смеси.
величин. При этом окисление СО и Н2 требует до-
Кроме того, при таких концентрациях часть кислорода
полнительного расхода кислорода, что также может
вступает в реакцию с СО, снижая его количество,
влиять на кинетику образования метанола.
участвующее в окислении метана. Однако, согласно
До сих пор опубликовано всего несколько работ,
данным работы [9], допустимая начальная концен-
в той или иной степени посвященных изучению
трация СО в процессе ПОММ может достигать 12%.
влияния СО или Н2 на процесс ПОММ, результа-
Экспериментальное исследование процесса
ты которых неоднозначны и недостаточно надежны.
ПОММ в циклическом режиме на пилотной установ-
В [6] отмечено, что добавление 10% Н2 при 34 атм,
ке производительностью по газу до 1000 м3·ч-1 при
430°С, отношении [CH4]/[O2] = 16 и почти полной
использовании в качестве окислителя атмосферного
конверсии кислорода лишь незначительно снижало
воздуха и давлении 100 атм было проведено в [10].
селективность образования метанола, не влияя на
При повышении кратности циркуляции стационар-
конверсию метана. Исследование влияния СО или Н2
ная концентрация азота в смеси возрастала с 9 при
на процесс ПОММ показало [7], что присутствие до
прямоточном режиме до 54%, что и служило ее ме-
5% этих газов в смеси практически не сказывается на
рой. На основании этой величины авторы заключают,
выходе жидких продуктов окисления. При более вы-
что максимально достигнутая кратность циркуляции
соких концентрациях водорода полный выход жидких
превышала 5. По условиям экспериментов поддержи-
продуктов остается постоянным, но выход метанола
вали постоянный расход воздуха, что обеспечивало
снижается за счет образования соответствующего
постоянную начальную концентрацию кислорода в
количества воды. При этом сама концентрация во-
газовом потоке 2.5%. Но по мере увеличения крат-
дорода на выходе из реактора остается практически
ности циркуляции это приводило к возрастанию кон-
такой же, как на входе, или даже немного возрастает,
центрации кислорода от 2.5 до 4.9% по отношению
но не превышает конечную концентрацию водорода
к сумме метана и кислорода в реакторе. Согласно
в экспериментах без его добавки.
данным [1-4], изменение концентрации кислорода в
Оксид углерода является основным газофазным
этом диапазоне незначительно влияет на конечную
продуктом процесса ПОММ, способным к дальней-
концентрацию и выход метанола, хотя селективность
шему окислению в условиях процесса, поэтому его
его образования снижается. С увеличением кратности
влияние может быть значительным. Влияние концен-
циркуляции начальную температуру процесса повы-
трации СО на выход метанола и оксидов углерода
шали с 716 до 753 K для компенсации уменьшения
исследовали при Т = 375°С, P = 300 атм, tr = 9 с и
скорости реакции вследствие повышения относитель-
[О2] = 3.0-3.8% [8]. Конечная концентрация СО в
ной концентрации кислорода [1, 2]. Одновременно
продуктах росла линейно с его начальной концентра-
из-за снижения теплоемкости смеси по мере увеличе-
цией. При этом разность между концентрациями СО,
ния в ней концентрации азота ее разогрев в реакторе
образующегося в реакции без добавок, и суммы до-
увеличивался от 108 до 180 K.
бавленного СО и его конечного значения, практически
С увеличением кратности циркуляции стационар-
точно соответствовала количеству образовавшегося
ные концентрации СО и Н2 росли линейно. При уве-
СО2. Это свидетельствует о том, что СО2 полностью
личении концентрации азота с 9 до 54% концентрация
образуется в результате окисления СО. Выход мета-
СО выросла с 0.7 до 4.7%, водорода — с 0.8 до 4.9%.
нола монотонно падал с увеличением концентрации
Концентрация СО2 с ростом кратности циркуляции в
добавленного СО, что авторы трактуют как снижение
полном соответствии c результатами кинетического
доли кислорода, уходящего на образование метано-
моделирования [5] росла нелинейно и при 5-кратной
ла вследствие его увода на окисление СО. Можно
циркуляции уже превышала 5.4%, что в 11 раз выше
предполагать, что в условиях реактора с химически
значения при прямоточном варианте. При максималь-
активной медной поверхностью, использованного
ной кратности циркуляции объем свежего газа сни-
1592
Фокин И. Г. и др.
зился до 58 нм3·ч-1 от исходного значения 760 нм3·ч-1
задавалось давление в линии газа. Расход каждого
при прямоточном режиме, т. е., по данным авторов,
реагента устанавливался регулятором расхода газа
конверсия метана увеличилась примерно в 10 раз,
(РРГ) 3. Далее реагенты попадали в смесительную
хотя селективность образования метанола упала при
камеру реактора 6. Для того чтобы обеспечить бы-
этом в 2 раза. Концентрация метанола в получаемых
строе и качественное смешивание компонентов, вход
жидкофазных продуктах снизилась примерно с 40 до
реагентов в смесительную камеру был выполнен в
20% при практически неизменившейся концентрации
виде системы сопло-диффузор. Смесительная камера
альдегидов. Сдувочный газ имел достаточно высокую
оборудована электрическим нагревателем для одно-
калорийность для использования в качестве топлива.
временного со смешением нагрева газовой смеси до
Приведенных в литературе данных недостаточ-
190-210°С. Реактор парциального окисления 7 пред-
но для технологической проработки и оптимизации
ставлял собой трубку из нержавеющей стали длиной
циркуляционного процесса ПОММ. Целью данной
250 мм, внутрь которой для уменьшения влияния
работы явилось экспериментальное исследование и
внутренней поверхности реактора на процесс окис-
кинетическое моделирование влияния добавок Н2 и
ления помещена кварцевая вставка внутренним диа-
СО на парциальное газофазное окисление метана и
метром 7 мм. Нагрев реактора осуществляли внешней
обоснование кратности рециркуляции при организа-
спиралью из нихромовой проволоки, регулирование
ции технологического процесса.
температуры — ПИД-регулятором 9. Для регистра-
ции температуры газовой смеси по длине реактора с
интервалом 50 мм установлены пять термопар типа
Экспериментальная часть
хромель-алюмель 8, спай которых помещен в центр
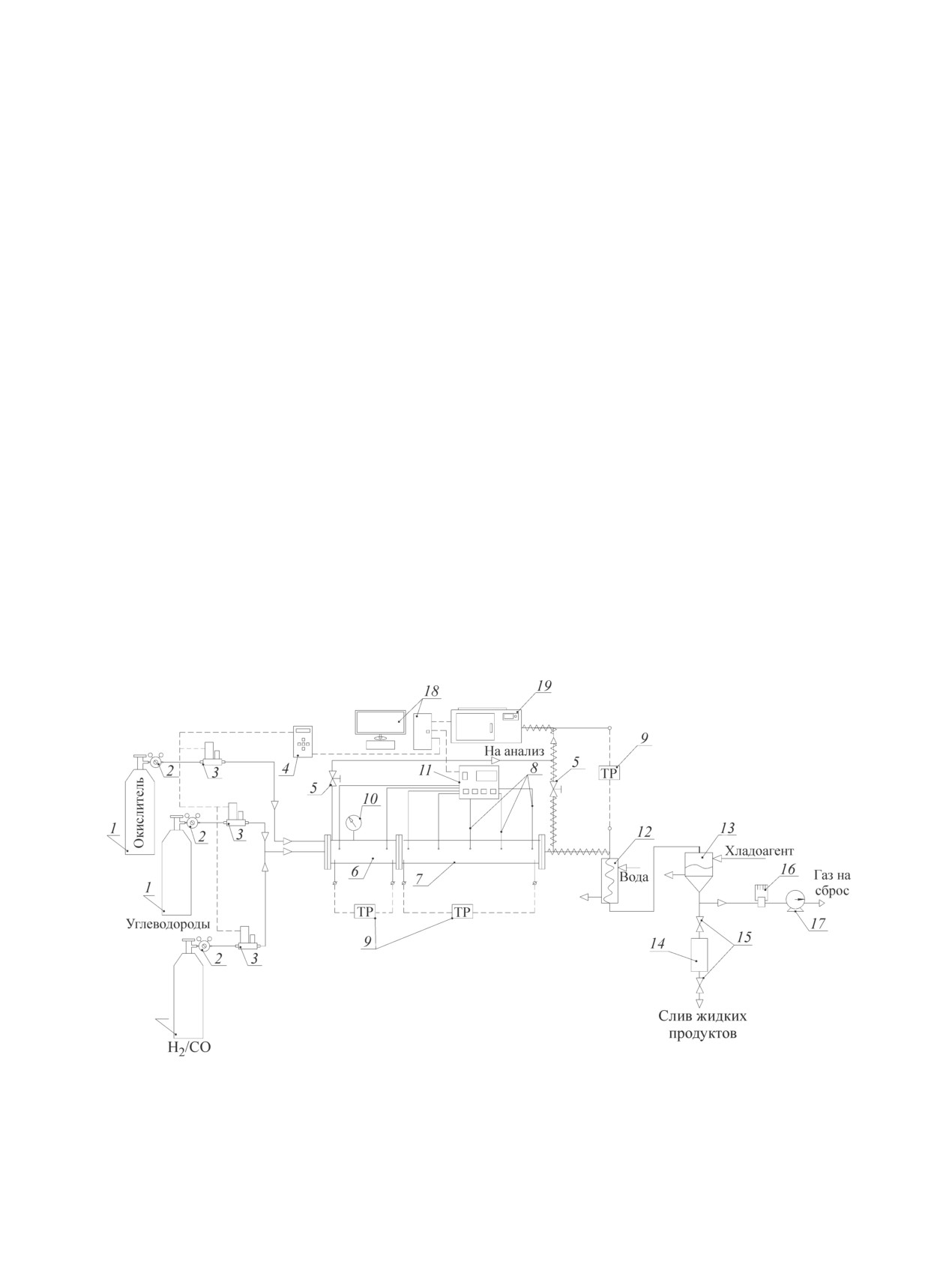
Экспериментальные исследования проводили
газового потока. Давление в реакторе регистрирова-
на проточной установке парциального газофазного
лось образцовым манометром 10.
окисления легких алканов в реакторе струевого типа
Пробы входящего и выходящего из реактора газа
(рис. 1).
через пробоотборные краны 5 направлялись на хро-
Природный газ, водород и монооксид углерода
матографический анализ в газовый хроматограф 19.
подавали из баллонов 1 через редуктор 2, которым Во избежание конденсации жидкофазных продуктов
Рис. 1. Схема экспериментальной установки.
1 — газовый баллон, 2 — газовый редуктор, 3 — регулятор расхода газа (РРГ), 4 — блок управления РРГ, 5 — про-
боотборный вентиль, 6 — смесительная камера, 7 — реактор, 8 — термопара, 9 — ПИД-регулятор, 10 — манометр,
11 — аналого-цифровой преобразователь (АЦП), 12 — водяной холодильник, 13 — сепаратор с охлаждаемой рубашкой,
14 — шлюзовая камера, 15 — шлюзовые краны, 16 — регулятор давления «до себя», 17 — газовый счетчик (газовые
часы), 18 — персональный компьютер, 19 — газовый хроматограф Хроматэк-Газохром 2000.
Влияние добавок водорода и монооксида углерода на парциальное окисление метана при повышенных давлениях
1593
окисления отбор проб выходящего газа производился
данная модель содержит блоки реакций окисления
через обогреваемую линию. Парогазовая смесь из
и образования водорода, монооксида углерода, этана
реактора по обогреваемому трубопроводу направля-
и этилена.
лась в водяной холодильник 12 и далее в сепаратор с
Один из главных параметров процесса, на который
охлаждаемой рубашкой 13. Жидкость из сепаратора
влияет начальная концентрация кислорода [O2]0, —
периодически перепускали в шлюзовую камеру 14, а
температурный профиль реакции. В реакторах не-
газовый поток поступал на вход регулятора давления
большого диаметра он определяется не только те-
«до себя» 16 и далее через газовый счетчик 17 сбра-
пловыделением в реакции, но и теплообменом между
сывался в атмосферу.
газом и поверхностью реактора, а также теплопере-
Использовали технический метан — компримиро-
дачей вдоль стенок реактора. Поэтому использование
ванный природный газ (КПГ), содержащий 97.8% ме-
реального температурного профиля крайне важно для
тана. В качестве реагентов использовали технический
адекватного кинетического моделирования процесса.
водород марки Б (99.95%), а также технический оксид
В настоящей работе при проведении кинетического
углерода (99.95%). В качестве окислителя использо-
моделирования в компьютерной программе Сhemical
вали сжатый воздух. Хроматографический анализ
Workbench были использованы реальные температур-
проводили на хроматографе Хроматэк-Газохром 2000.
ные профили реактора, полученные при проведении
Водород, кислород, азот, метан и монооксид углеро-
экспериментальных исследований.
да разделяли на насадочной колонке, заполненной
цеолитом NaX, фракция 60/80. Длина колонки 2 м,
Обсуждение результатов
внутренний диаметр 2 мм. Газ-носитель — аргон,
расход 27 мл·мин-1. Диоксид углерода и углеводоро-
Одна из принципиальных особенностей процесса
ды С2+ разделяли на насадочной колонке, заполнен-
ПОММ — быстрое снижение селективности обра-
ной порапаком Т, фракция 50/80. Длина колонки 3 м,
зования и соответственно выхода метанола с уве-
внутренний диаметр 2 мм. Газ-носитель — гелий,
личением конверсии газа [1-4]. Это ограничивает
расход 20 мл·мин-1. Температурный режим хрома-
оптимальную концентрацию кислорода, подаваемого
тографии — изотермический, температура анализа
в процесс, диапазоном 3-5%. В работе предваритель-
80°С.
но была проведена серия экспериментов по исследо-
Кинетическое моделирование. Моделирование
ванию влияния изменения начальной концентрации
проводили в компьютерной программе Сhemical
кислорода [O2]0 в интервале 3.1-5.4% на основные
Workbench. При расчете использовалась модель
характеристики процесса ПОММ.
реактора идеального вытеснения Plug flow reactor
Исходная смесь, выходящая из секции смешения
(Subtype: predefined temperature profiles) c возможно-
и подогрева, имела на входе в реактор температуру
стью задавать распределение температуры по длине
210-250°С, при которой процесс окисления еще не
реактора. Для построения модели процесса использо-
протекает. При внешнем обогреве реактора обеспе-
вали значения температуры, давления, концентраций
чивается нагрев реакционной смеси до температуры
исходных газов, которые были получены в экспери-
начала процесса окисления T0 = ~450°С, за которым
менте. Длина реактора принималась равной 24 см,
следует ее саморазогрев до максимальной для данно-
внутренний диаметр — 0.7 см.
го значения [O2]0 температуры, которая затем посте-
Подробный анализ кинетических схем парциаль-
пенно снижается. Достигаемые максимальные темпе-
ного окисления метана показал [11], что наиболее
ратуры газовой смеси существенно ниже температур
адекватными для кинетического моделирования
ее адиабатического разогрева (>600°С при [O2]0 = 5%
процесса являются кинетические схемы Веденеева
и ~550°С при [O2]0 = 3%). А полученные температур-
[11, 12] и Ranzi [13]. Из них предпочтительнее схе-
ные профили отражают две противоречивые тенден-
ма Веденеева, так она дает более сбалансированное
ции: резкий взрывной характер повышения темпера-
соотношение между каналами образования метано-
туры процесса после длительного периода индукции,
ла и формальдегида. Поэтому для моделирования в
показанный кинетическим моделированием [11, 12]
данной работе использовали обобщенную кинети-
и экспериментально [15], и нивелирующее влияние
ческую модель Веденеева [12]. Кинетическая схема
теплоотдачи в металлическую стенку реактора и те-
включает 27 компонентов, 198 элементарных стадий
плопроводности вдоль нее. При большом отношении
(прямых и обратных), 34 из которых относятся к бло-
длины реактора к его диаметру, составляющем для
ку окисления и расходования метанола. Помимо бло-
данной установки 250:7, вклад этих процессов значи-
ка элементарных реакций, связанных с метанолом,
телен. Полученные температурные профили позволя-
1594
Фокин И. Г. и др.
ют более адекватно моделировать процесс с учетом
реального распределения температуры в реакторе.
К сожалению, полученный профиль достаточно гру-
бый из-за большого промежутка между термопарами
по сравнению с характерным периодом взрывного
нарастания температуры процесса.
Следует отметить, что в исследуемом интервале
давлений 50-80 атм конечные концентрации основ-
ных продуктов — метанола, СО и Н2, а также второ-
степенных продуктов — СО2, этилена и пропилена
практически не зависят от давления.
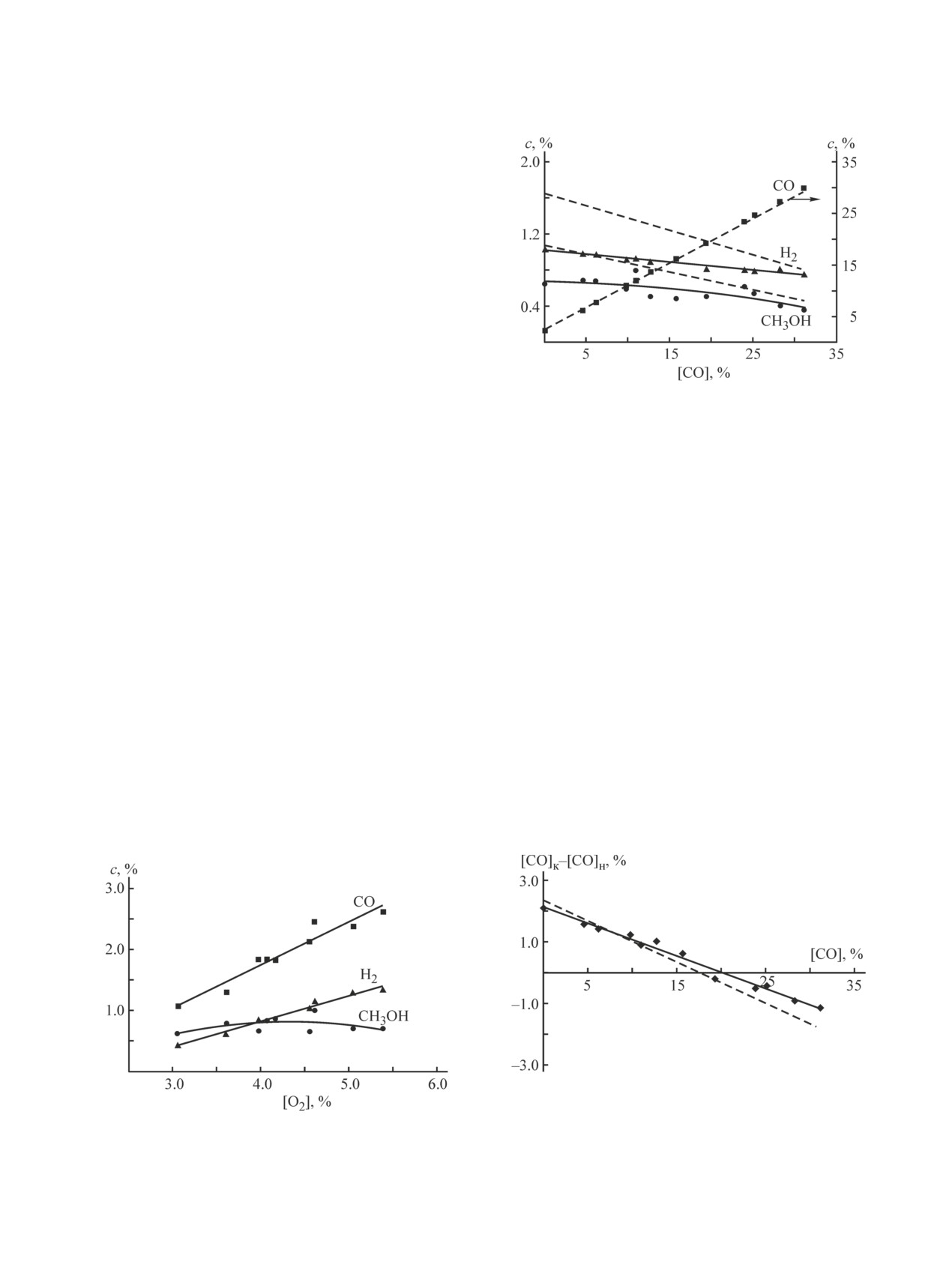
В интервале концентраций [O2]0 3-5% конеч-
ная концентрация метанола в реакционной смеси
в полном соответствии с литературными данными
Рис. 3. Зависимость концентрации основных продуктов
[1-4] незначительно зависит от концентрации [O2]0
парциального окисления метана от начальной концен-
трации оксида углерода, Р = 60 атм, [О2]0 = 4.5-4.6%.
(рис. 2), но с увеличением [O2]0 существенно воз-
растает концентрация СО и, следовательно, увели-
Значки и сплошные линии — эксперимент, штриховые
линии — модель.
чивается удельный расход кислорода на получение
метанола, а также растут концентрации Н2 и воды.
Основные результаты работы связаны с определе-
кислорода на окисление СО до СО2. Расчет вполне
нием зависимости конечной концентрации метанола
удовлетворительно соответствует экспериментальным
от начальной концентрации СО и Н2 в исходной сме-
данным и отражает характер наблюдаемых тенденций.
си. Присутствие СО (при его начальных концентраци-
Это дает основания использовать данную кинетиче-
ях, не превышающих 10-12%) практически не влияет
скую модель для определения характеристик про-
на конечную концентрацию метанола (рис. 3) (то
цесса, которые трудно получить экспериментально.
же отмечено и в [9]). Видимо, такую концентрацию
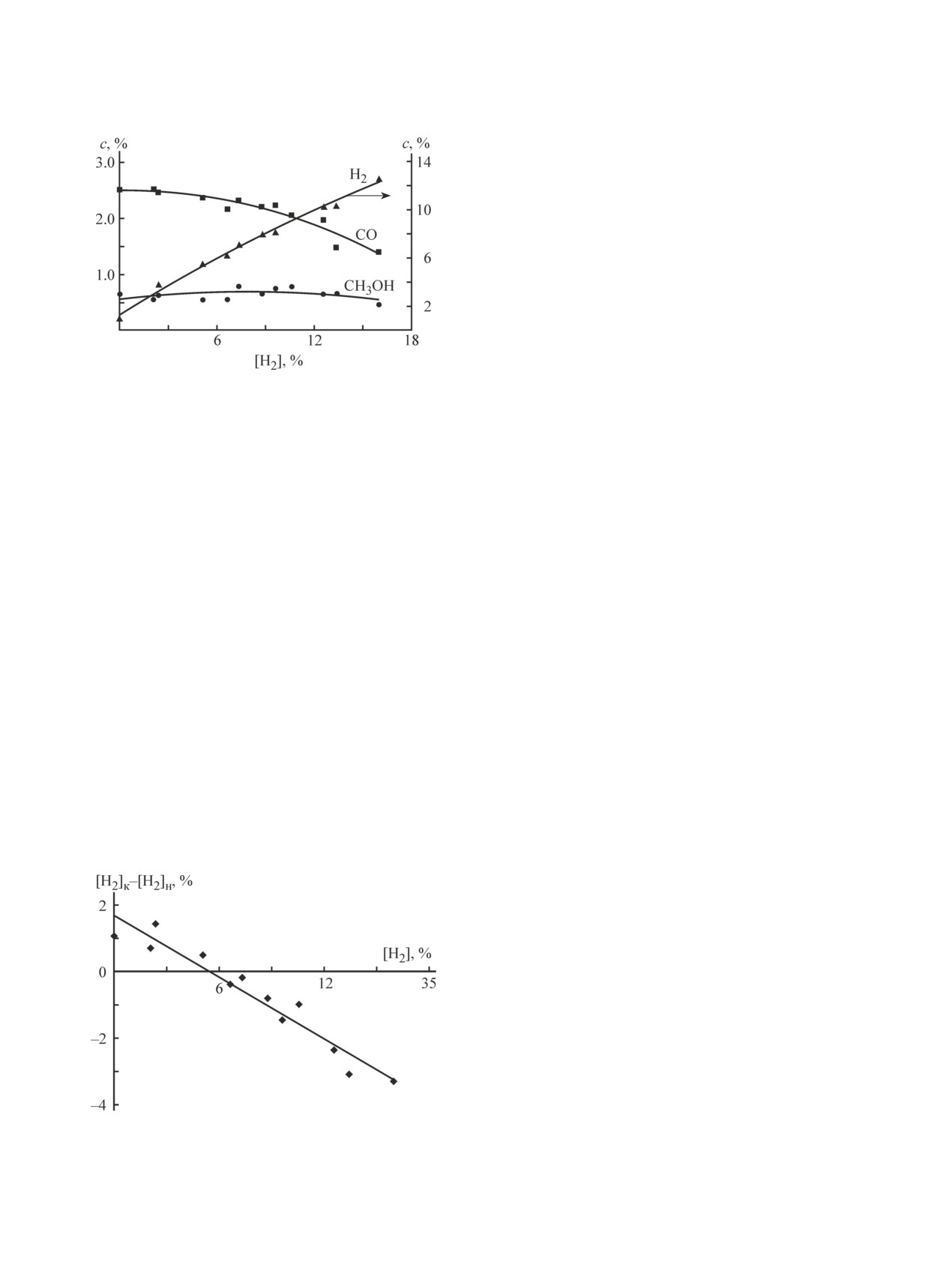
В отношении водорода это условие, видимо, не-
СО в рециркулируемом газе можно считать вполне
сколько жестче. Хотя концентрация метанола также
допустимой.
остается практически постоянной почти до началь-
При начальной концентрации СО 10-12% разность
ной концентрации водорода 15% (рис. 5), разность
между его конечной и начальной концентрациями
между конечной и начальной концентрациями водо-
[СО]к-[СО]н остается положительной и не более чем
рода [Н2]к-[Н2]н остается положительной лишь до
в 2 раза ниже концентрации СО, образующегося в
концентрации [H2]0 приблизительно 5% (рис. 6). Это
процессе с нулевой начальной концентрацией СО
совпадает с выводами о его предельно допустимой
(рис. 4). Но при этом есть дополнительный расход
концентрации в рециркулируемом газе, сделанными
Рис. 4. Зависимость разности между конечной и началь-
ной концентрациями оксида углерода от его начальной
Рис. 2. Зависимость концентрации основных продуктов
концентрации, Р = 60 атм, [О2]0 = 4.5-4.6%.
парциального окисления метана от начальной концен-
Значки и сплошная линия — эксперимент, штриховая ли-
трации кислорода, Р = 60 атм.
ния — модель.
Влияние добавок водорода и монооксида углерода на парциальное окисление метана при повышенных давлениях
1595
выход метанола может достигать 60-200 кг/1000 нм3
газа. Однако при окислении природного газа атмос-
ферным воздухом и воздухом, обогащенным кисло-
родом (до 50%), увеличение кратности циркуляции
(отношения расходов потока реакционного газа на
рециркуляцию к потоку газа, выводимого в качестве
сдувки) быстро приводит к росту концентрации азота
и других инертных примесей в реакционной смеси
и сдувочном газе. Вследствие этого растет объем
проходящего через реактор газа, а сдувочный газ пе-
рестает удовлетворять требованиям, предъявляемым
к природным горючим газам промышленного и ком-
мунально-бытового назначения (ГОСТ 27577-2000.
Рис. 5. Зависимость концентрации основных продуктов
Газ природный топливный компримированный для
парциального окисления метана от начальной концен-
двигателей внутреннего сгорания. Технические ус-
трации водорода, Р = 60 атм, [О2]0 = 4.5-4.6%.
ловия) или к топливным газам для газопоршневых
установок [18]. В соответствии с этими требованиями
в [7]. При окислении метана с добавками водорода
содержание метана должно быть более 70 об%, низ-
при температурах процесса выше 500°С возможно
шая теплотворная способность — 30-36 МДж·м-3,
прямое окисление водорода [16]. Действительно, в
содержание азота — менее 7%. Поэтому для обеспе-
наших экспериментах с добавками водорода наблю-
чения высокой кратности циркуляции необходимо
далось существенное изменение температурного ре-
использовать или обогащенный кислородом воздух,
жима процесса: при содержании водорода в исходной
или технический кислород.
смеси более 12% происходил разогрев смеси выше
Однако увеличение за счет рециркуляции выхода
550°С.
метанола и снижение удельного расхода природного
Видимо, это является следствием более высокой
газа связано с ростом энергетических и капиталь-
реакционной способности водорода по сравнению с
ных затрат на организацию рециркуляции и затрат
оксидом углерода в данных условиях.
на получение кислорода или обогащение воздуха.
Обоснование предельно допустимой кратности
Необходимо также учитывать, что накопление в смеси
рециркуляции. Возможность существенного повы-
при рециркуляции Н2 и СО приводит к дополнитель-
шения выхода метанола при переходе на циркуляци-
ному расходу кислорода на их окисление. Это видно
онный режим процесса с использованием в качестве
из приведенных в таблице расчетных характеристик
окислителя как кислорода, так и воздуха была обо-
процесса получения метанола парциальным окис-
снована в работах [1, 5]. По оценкам в зависимости от
лением природного газа техническим кислородом с
используемого окислителя и кратности циркуляции
рециркуляцией части получаемой после окисления
и конденсации жидких продуктов газовой смеси.
Для расчета процесса ПОММ в циркуляционном
режиме использовалась модель адиабатического
реактора идеального вытеснения Plug flow reactor
(Subtype: Q) с начальной температурой в реакторе
480°С. Потери тепла через стенки реактора были
приняты равными 200 Дж·см-1·с-1. Площадь вну-
треннего сечения была равна 100 см2. Расчеты прово-
дили в компьютерной программе Сhemical Workbench
по кинетической модели Веденеева [12], поскольку
выше было показано ее удовлетворительное соответ-
ствие экспериментальным результатам. Параметры
получаемого сдувочного газа: низшая теплотворная
способность и метановое число —рассчитывали в
программе AVL methane calculator.
Рис. 6. Зависимость разности между конечной и на-
чальной концентрациями водорода от его начальной
Из полученных результатов следует, что при
концентрации, Р = 60 атм, [О2]0 = 4.5-4.6%.
кратности циркуляции (5-12):1 выход метанола на
1596
Фокин И. Г. и др.
Расчетные характеристики процессов парциального окисления природного газа (СН4 — 98%,
примеси в пересчете на N2 — 2%) техническим кислородом (95% — О2, 5% — N2) с рециркуляцией
и без рециркуляции реакционного газа
Концентрация кислорода в газовой смеси 2.8 об%
Расход
Расход
Выход
природного
технического
Низшая
метанола
газа
кислорода
Состав получаемой газовой смеси, об%
теплотвор-
Кратность
на 1000 м3
Метановое
на 1 т син-
на 1 т син-
ная спо-
циркуляции
природного
число
тезируемого
тезируемого
собность,
газа,
метанола,
метанола,
кДж·м-3
кг·10-3·м-3
СН4
Н2
СО
СО2
С2Н6
N2
м3·т-1
м3·т-1
Без цирку-
15
65353
1961
95.13
0.99
1.40
0.13
0.18
2.16
99.0
34.7
ляции
1:1
28
36221
2079
92.89
1.68
2.05
0.73
0.34
2.31
98.3
34.0
3:1
49
20504
2219
89.28
2.57
2.7
2.24
0.61
2.59
98.1
33.1
5:1
67
14877
2300
86.34
3.08
3.01
3.85
0.85
2.87
98.6
32.3
8:1
92
10828
2370
82.57
3.49
3.23
6.3
1.15
3.27
99.7
31.2
12:1
122
8180
2414
78.34
3.67
3.31
9.47
1.45
3.77
101.6
29.9
1000 м3 природного газа увеличивается в 4.5-8 раз
мую кратность рециркуляции газа в процессе парци-
по сравнению с прямоточным режимом, но это при-
ального окисления метана в метанол.
водит к увеличению расхода кислорода. Поэтому
организация процесса с рециркуляцией и экономи-
Финансирование работы
чески целесообразная кратность циркуляции опре-
деляются в первую очередь соотношением затрат
Работа выполнена в рамках Программы фунда-
на получение кислорода и стоимости природного
ментальных научных исследований государственных
газа для выбранных условий производства метанола.
академий наук на 2013-2020 гг. (шифр темы 0089-
Необходимо также оценивать, при каких условиях
2018-0228) с использованием оборудования Центра
снижение стоимости природного газа на 1 т произ-
коллективного пользования «Новые нефтехимиче-
водимого метанола компенсирует помимо затрат на
ские процессы, полимерные композиты и адгезивы»
получение кислорода рост капитальных и энергети-
(№ 77601).
ческих расходов на организацию циркуляции. В соот-
ветствии с данными таблицы кратность циркуляции,
Конфликт интересов
при которой возможно получение сдувочного газа,
соответствующего требованиям для топливных газов,
Авторы заявляют об отсутствии конфликта инте-
не должна превышать 12:1.
ресов, требующего раскрытия в данной статье.
Выводы
Информация об авторах
Экспериментально установлено, что предельно до-
Фокин Илья Геннадьевич, к.т.н., ORCID: https://
пустимые концентрации оксида углерода и водорода
orcid.org/0000-0003-3652-2575
в рециркулируемом газе процесса парциального окис-
Озерский Алексей Валерьевич, ORCID: https://
ления метана в метанол не должны превышать соот-
orcid.org/0000-0002-6765-1401
ветственно 12 и 5%. Их более высокое содержание
Никитин Алексей Витальевич, к.х.н., ORCID:
ведет к повышению расхода кислорода и снижению
селективности образования метанола. Полученные
Савченко Валерий Иванович, д.х.н., проф., ORCID:
данные позволяют обосновать предельно допусти-
Влияние добавок водорода и монооксида углерода на парциальное окисление метана при повышенных давлениях
1597
Арутюнов Владимир Сергеевич, д.х.н., проф.,
[9] Симченко В. П., Щербаков П. М., Веденеев В. И.,
Арутюнов В. С. Окисление природного газа в ме-
Седов Игорь Владимирович, к.х.н., ORCID: https://
танол в циклическом режиме // ТОХТ. 2001. Т. 20.
№ 2. С. 221-224.
orcid.org/0000-0001-9648-4895
[10] Беляев А. А., Никитин А. В., Токталиев П. Д.,
Власов П. А., Дмитрук А. С., Арутюнов А. В.,
Арутюнов В. С. Анализ литературных моделей
Список литературы
окисления метана в области умеренных температур
[1] Арутюнов В. С. Окислительная конверсия природ-
// Горение и взрыв. 2018. Т. 11. № 1. С. 19-26.
ного газа. М.: КРАСАНД, 2011. С. 258.
[11] Арутюнов В. С., Басевич В. Я., Веденеев В. И.,
[2] Arutyunov V. S. Recent results on fast flow gas-phase
Романович Л. Б. Кинетическое моделирование пря-
partial oxidation of lower alkanes // J. Natural Gas
мого газофазного окисления метана в метанол при
Chem. 2004. V. 13. N 1. P. 10-22.
высоком давлении // Кинетика и катализ. 1996.
[3] Arutyunov V. Low-scale direct methane to methanol —
Т. 37. С. 20-28.
modern status and future prospects // Catal. Today.
[12] Vedeneev V. I., Krylov O. V., Arutyunov V. S.,
2013. V. 215. P. 243-250.
Basevich V. Ya., Goldenberg M. Ya., Teitelboim M. A.
The role of initiation in oxidative coupling of methane
[4] Басевич В. Я., Веденеев В. И., Арутюнов В. С.,
// Appl. Catal. A: General. 1995. V. 127. P. 51-63.
Романович Л. Б. Циклический режим при газофаз-
ном окислении метана в метанол // ТОХТ. 1997.
[13] Ranzi E., Frassoldati A., Grana R., Cuoci A.,
Т. 31. № 1. С. 77-81.
Faravelli T., Kelley A. P., Law C. K. Hierarchical and
[5] Chellappa A. S., Fuangfoo S., Viswanath D. S.
comparative kinetic modeling of laminar flame speeds
Homogeneous oxidation of methane to methanol: effect
of hydrocarbon and oxygenated fuels // Prog. Energ.
of CO2, N2, and H2 at high oxygen conversions // Ind.
Combust. 2012. V. 38. P. 468-501.
Eng. Chem. Res. 1997. V. 36. P. 1401-1409.
[6] Арутюнов В. С., Веденеев В. И., Климовецкая С. Ю.,
[14] Симченко В. П., Щербаков П. М., Веденеев В. И.,
Леонов В. Е., Павлий Л. В. Влияние водорода, оксида
Арутюнов В. С. Кинетика окисления метана при
углерода и азота на процесс неполного окисления
высоком давлении // ТОХТ. 1999. Т. 33. С. 401-403.
метана // ТОХТ. 1995. Т. 29. № 1. С. 71-76.
[15] Гонтковская В. Т., Гордополова И. С., Басевич В. Я.
[7] Фурман М. С., Шестакова А. Д. Окисление метана
Кинетика окисления водорода в широкой области
под давлением // Тр. ГИАП. 1956. № 6. С. 98-108.
давлений и температур // Физика горения и взрыва.
[8] Bjorklund M. C., Carr R. W. Enhanced methanol
1982. С. 64-68.
yields from the direct partial oxidation of methane in a
[16] Иванов С. С., Тарасов М. Ю. Требования к подго-
simulated countercurrent moving bed chromatographic
товке растворенного газа для питания газопоршне-
reactor // Ind. Eng. Chem. Res. 2002. V. 41. P. 6528-
вых двигателей // Нефт. хоз-во. 2011. № 1. C. 102-
6536.
105.