516
Заболотных С. А. и др.
Журнал прикладной химии. 2019. Т. 92. Вып. 4
УДК 542.61:544.344.012-14
СРАВНЕНИЕ ЭКСТРАКЦИОННЫХ ВОЗМОЖНОСТЕЙ СИСТЕМ
НА ОСНОВЕ СУЛЬФОНОЛА, ДОДЕЦИЛСУЛЬФАТА НАТРИЯ
ИЛИ АЛКИЛБЕНЗОЛСУЛЬФОКИСЛОТЫ
© С. А. Заболотных1, К. О. Гилева1, А. Е. Леснов1,2, С. А. Денисова3
1 Институт технической химии УрO РАН, Пермь
2 Пермский государственный аграрно-технологический университет им. акад. Д. Н. Прянишникова
3 Пермский государственный национальный исследовательский университет
E-mail: zabolotsveta@mail.ru
Поступила в Редакцию 13 ноября 2018 г.
После доработки 31 января 2019 г.
Принята к публикации 2 февраля 2019 г.
Исследовано влияние органических комплексообразующих реагентов: диантипирилметана, диантипи-
рилбутана, диантипирилгептана, 1,10-фенантролина и 1,2,3-бензотриазола — на фазовое состояние
и экстракционные возможности систем, содержащих в качестве фазообразователя анионные ПАВ:
сульфонол, додецилсульфат натрия или алкилбензолсульфокислоту, в качестве высаливателя — не-
органическую кислоту (серную или хлороводородную). Найдены оптимальные условия во всех рассмо-
тренных комбинациях ПАВ и реагента для применения в процессах разделения и концентрирования.
Выбраны наиболее экстракционно-эффективные комбинации ПАВ-реагент.
Ключевые слова: экстракция; водные расслаивающиеся системы; сульфонол; додецилсульфат натрия;
алкилбензолсульфокислота; комплексообразующие реагенты
DOI: 10.1134/S0044461819040121
Водные растворы анионных поверхностно-актив-
центными методами. Разделение фаз возможно при
ных веществ (АПАВ) способны расслаиваться на
комнатной температуре, что позволяет извлекать не-
две жидкие фазы под действием различных факто-
стабильные при повышенной температуре и легколе-
ров: изменения кислотности, нагревания, введения
тучие компоненты. Параметры экстракции не зависят
высаливателей, химического взаимодействия в си-
от времени нахождения фаз в равновесии, что опре-
стеме [1-3]. Подобный подход позволяет избегать
деляет высокую экспрессность метода. Экстракция
использования высокотоксичных пожароопасных
легко совмещается с различными инструментальны-
органических растворителей, получать растворимые
ми методами анализа [5-7]. АПАВ в своем составе
в воде экстракты, что удобно при осуществлении
имеют сильногидратированную анионную группу,
последующих стадий анализа. Введение в раство-
поэтому обладают хорошей растворимостью в воде.
ры АПАВ неорганических электролитов приводит
Как правило, неорганические кислоты являются
к уменьшению значения критической концентрации
более сильными высаливателями по отношению к
мицеллообразования, увеличению размера мицелл
АПАВ, чем неорганические соли и органические
[4], уменьшению гидратной оболочки гидрофиль-
вещества. В этом случае при малых концентрациях
ной части мицеллы, понижению температуры точки
кислоты системы расслаиваются на две жидкие фазы
помутнения. В результате происходит ассоциация
вследствие высаливания образующейся малодиссоци-
мицелл и выделение новой жидкой фазы.
ирующей кислоты. С увеличением содержания кис-
Достоинством АПАВ являются отсутствие в их
лот расслаивание может сопровождаться гидролизом
молекулах хромофоров, поглощающих в УФ- и ви-
ПАВ в соответствующий спирт [8].
димой области спектра, что позволяет сочетать экс-
Одним из наиболее распространенных классов
тракцию со спектрофотометрическими и люминес- АПАВ являются алкилсульфаты и алкилсульфона-
Сравнение экстракционных возможностей систем на основе сульфонола, додецилсульфата натрия...
517
ты. Они широко применяются в различных отраслях
где n = 12-18, ТУ 2481-135-07510508-2007) и ал-
промышленности, а в последние годы нашли приме-
килбензолсульфокислоту (АБСК, общей формулы
нение в методиках разделения и концентрирования.
CnH2n+1C6H4SO3Н, где n = 10-14, ТУ 2481-026-
В процессах экстракции наиболее часто применя-
05766480-2006). В качестве комплексообразующих
емым АПАВ, содержащим сульфогруппу, является
реагентов изучены диантипирилметан (ДАМ, х.ч.),
додецилсульфат натрия. Его растворы расслаиваются
диантипирилбутан (ДАБ, х.ч.), диантипирилгептан
при изменении температуры и введении неорганиче-
(ДАГ, х.ч.), 1,10-фенантролин (Phen, ч.д.а.), 1,2,3-бен-
ских солей [9, 10] или кислот [11]. Системы на основе
зотриазол (БТА, «чистый»). Кислоты H2SO4 и HCl,
додецилсульфата натрия применяют для концентри-
х.ч., соли металлов квалификации х.ч. или ч.д.а.
рования гидрофобных органических субстратов ка-
Для установления влияния реагентов на фазовое
тионной природы [12], протеинов [13], для отделения
состояние систем в смеси при постоянном содер-
меди от цинка [14] или никеля [15], никеля и меди от
жании ПАВ (0.6 г сульфонола или ДДСН или 0.5 г
палладия и платины [16], экстракции благородных
АБСК, Vобщ = 10 мл) вводили различные количества
металлов и свинца [17], природных масел [18] а также
комплексообразователей и определяли интервал кон-
полиароматических углеводородов [19]. Недостатком
центраций кислоты, в котором наблюдалось расслаи-
данного АПАВ является его относительно высокая
вание. Изменение фазового состояния фиксировали
стоимость. Вследствие этого изучены фазовые и экс-
визуально. По результатам исследований выбирали
тракционные равновесия в системах, содержащих
оптимальные количества реагента, позволяющие
сходные с додецилсульфатом натрия по строению
получить расслаивающиеся системы с соотноше-
технические АПАВ сульфонол и алкилбензолсульфо-
нием двух жидких фаз, наиболее подходящим для
кислота, производимые в промышленных масштабах
экстракции.
и имеющие меньшую стоимость.
Для изучения распределения индивидуальных
Построены диаграммы растворимости систем на
ионов металлов в градуированные пробирки с при-
основе додецилсульфата натрия [20], сульфонола [21]
тертыми пробками вводили 1 мл 0.1 М раствора соот-
или алкилбензолсульфокислоты [22] и неорганиче-
ветствующей соли металла, рассчитанные количества
ских кислот — серной и хлороводородной. Во всех
ПАВ, комплексообразователя и раствора кислоты,
системах установлено наличие областей двухфазного
доводили объем системы до 10 мл дистиллированной
жидкого равновесия в широких интервалах содержа-
водой и перемешивали. После расслаивания фазы
ний компонентов.
разделяли и определяли остаточное содержание ио-
Результаты исследования распределения ионов
нов металлов в рафинате комплексонометрически или
металлов показали, что системы обладают слабыми
на атомно-абсорбционном спектрометре iCE 3500 c
экстракционными способностями, а ПАВ выступа-
пламенной атомизацией.
ют преимущественно в качестве фазообразовате-
Исследование совместной экстракции палладия(II)
лей. В связи с этим предложено введение в системы
с другими ионами металлов проводили, вводя в гра-
дополнительных органических комплексообразо-
дуированные пробирки с притертыми пробками 1 мл
вателей. Основными критериями выбора реагента
4·10-4 М раствора палладия, различные количества
являлись его малая растворимость в воде и наличие
раствора соли металла, 0.35 г БТА, 0.5 г АБСК, рас-
основных свойств. Данным условиям соответству-
считанное количество HCl для создания кислотности
ют диантипирилметан (ДАМ), диантипирилбутан
1.5 моль·л-1 в общем объеме системы 10 мл, доводи-
(ДАБ), диантипирилгептан (ДАГ), 1,10-фенантролин,
ли объем дистиллированной водой и перемешивали.
1,2,3-бензотриазол.
После расслаивания фазы разделяли и определяли
Для различных комбинаций ПАВ и реагента най-
остаточное содержание ионов металлов в рафинате
дены оптимальные условия для проведения экстрак-
методом атомно-абсорбционной спектроскопии.
ции. В работе рассмотрены наиболее экстракцион-
но-эффективные комбинации ПАВ-реагент.
Обсуждение результатов
Системы вода-АПАВ-неорганическая кислота-
Экспериментальная часть
диантипирилалкан. Введение диантипирилалканов
В работе использовали анионные ПАВ доде-
(ДАА) в системы с АПАВ сохраняет двухфазное жид-
цилсульфат натрия (ДДСН, C12H25OSO3Na, ч.д.а.),
кое равновесие в системах, а также стабилизирует
сульфонол (натрий алкилбензосульфонаты на ос-
объем фазы ПАВ. Следует отметить, что в системах
нове керосина общей формулы CnH2n+1C6H4SO3Na,
с техническими ПАВ (сульфонол и АБСК) интервал
518
Заболотных С. А. и др.
Таблица 1
Концентрационные параметры экстракции ионов металлов с диантипирилалканами (Vобщ = 10.0 мл)
Система
mПАВ, г
Реагент
mреагента, г
скислоты, моль·л-1
Vф. ПАВ, мл
Вода-сульфонол-HCl
ДАМ
0.4
0.3-7.0
1.0-1.2
ДАБ
0.3
0.3-7.0
1.0-1.2
0.6
ДАГ
0.3
0.3-7.0
1.0-1.2
Вода-сульфонол-H2SO4
ДАМ
0.4
0.2-5.0
1.0-1.2
ДАБ
0.3
0.2-5.0
1.0-1.2
Вода-ДДСН-HCl
ДАМ
0.4
0.3-6.0
1.0-1.2
ДАБ
0.3
0.25-6.0
1.0-1.2
0.75
ДАГ
0.3
0.25-6.0
1.0-1.2
Вода-ДДСН-H2SO4
ДАМ
0.4
0.2-5.0
1.0-1.2
ДАБ
0.3
0.2-5.0
1.0-1.2
Вода-АБСК-HCl
ДАМ
0.4
0.1-2.0
1.0-1.3
ДАБ
0.35
0.2-8.0
1.0-1.3
0.5
ДАГ
0.35
0.2-8.0
1.0-1.3
Вода-АБСК-H2SO4
ДАМ
0.4
0.1-2.0
1.0-1.3
кислотности немного шире, чем в системах с ДДСН,
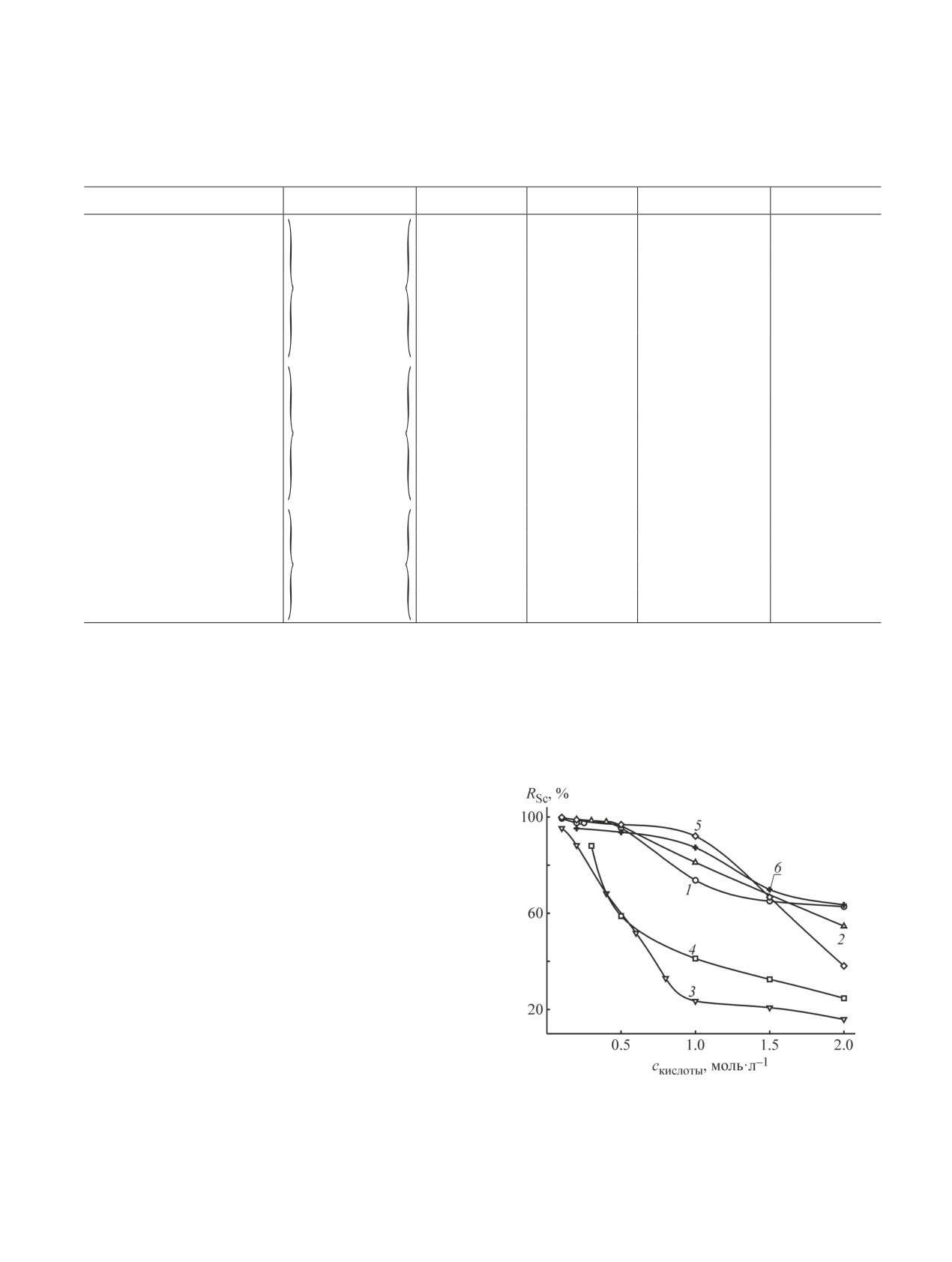
кислот [25]. Для экстракции Sc(III) наиболее пригод-
и расслаивание более устойчивое.
ны системы на основе АБСК (рис. 1). Система на ос-
ДАА способны образовывать с ионами металлов
нове сульфонола и серной кислоты показала лучшие
комплексы различного типа. При малых концентраци-
результаты по извлечению Zr(IV) с ДАМ. При этом в
ях кислоты преобладает координационный механизм
системе вода-АБСК-HCl возможна количественная
извлечения. С ростом содержания кислоты реагент
протонируется и ионы металлов экстрагируются в ви-
де ацидокомплексов по анионообменному механизму
[23]. Концентрационные параметры проведения экс-
тракции в присутствии ДАА представлены в табл. 1.
Введение реагентов требует нагревания систем
до 75°С для ускорения взаимодействия компонентов.
Фаза ПАВ прозрачная, вязкая, окрашена в желтый
цвет; водная фаза прозрачная, бесцветная; между
фазами наблюдается четкая граница раздела.
Узкий интервал концентраций кислот в системах с
АБСК и ДАМ связан с тем, что при высоких концен-
трациях кислоты ДАМ образует труднорастворимое
соединение с соотношением ДАМ:кислота, равным
1:2, а диссоциация АБСК при этом подавляется [24].
ДАБ и ДАГ не образуют солей с кислотами с соотно-
шением 1:2, поэтому интервал содержаний кислот в
Рис. 1. Распределение 0.01 моль·л-1 ионов Sc(III) с ди-
системах с ними значительно шире.
антипирилметаном в системах вода-сульфонол-H2SO4
Найдены условия количественного извлечения
(1), вода-сульфонол-HCl (2), вода-ДДСН-H2SO4 (3), во-
ионов скандия(III), циркония(IV) , галлия, железа(III),
да-ДДСН-HCl (4), вода-АБСК-H2SO4 (5), вода-АБСК-
таллия(III) и олова(II) с ДАА из растворов различных
HCl (6) (mДАМ = 0.4 г, Vобщ = 10.0 мл).
Сравнение экстракционных возможностей систем на основе сульфонола, додецилсульфата натрия...
519
По результатам исследований можно заключить,
что системы на основе АБСК и сульфонола более
пригодны для экстракции как из разбавленных, так
и из концентрированных растворов кислот. В си-
стемах с додецилсульфатом натрия количественное
извлечение веществ наблюдается преимущественно
из сильнокислых сред. При этом ДАМ более эффек-
тивен при экстракции в виде хелатных комплексов с
металлами, а ДАБ и ДАГ - в виде ионных ассоциатов
с ацидокомплексами металлов.
Системы вода-АПАВ-неорганическая кисло-
та-1,10-фенантролин. Производные пиразолона
показали удовлетворительные результаты при экс-
тракции ионов металлов, относящихся к «жестким»
по классификации Пирсона [26]. Ионы Co(II), Cu(II),
Ni(II) относятся к «мягким», поэтому их экстракция
Рис. 2. Распределение 0.01 моль·л-1 ионов Zr(IV) с ди-
антипирилметаном в системах вода-сульфонол-H2SO4
с ДАА из сернокислых растворов практически не на-
(1), вода-АБСК-H2SO4 (2), вода-ДДСН-H2SO4
(3) и с
блюдается, а извлечение из солянокислых растворов в
ДАГ в системах вода-ДДСН-HCl (4), вода-сульфонол-
виде хлоридных ацидокомплексов неколичественное.
= 0.3 г,
HCl (5), вода-АБСК-HCl (6) (mДАМ = 0.4 г, mДАГ
В связи с этим рассмотрена возможность замены
Vобщ = 10.0 мл).
ДАА на «мягкий» органический комплексообразу-
ющий реагент, проявляющий основные свойства, —
экстракция Zr(IV) с ДАГ при высоких концентрациях
1,10-фенантролин. Являясь бидентатным лигандом,
кислоты (рис. 2). Галлий экстрагируется количествен-
Phen образует с ионами Fe(III), Fe(II), Co(II), Ni(II),
но практически во всех системах при содержании
Cu(II) устойчивые окрашенные хелаты с пятичлен-
HCl выше 3 моль·л-1 (рис. 3). Интерес вызывает тот
ными циклами в соотношении М:L = 1:2 или 1:3 [27].
факт, что кривые извлечения рассмотренных ионов с
В системах с АБСК интервал концентраций кис-
ДАА в хлороформ и в изученных системах без орга-
лот, в котором смеси расслаивались, очень узкий, и
нического растворителя имеют подобный характер,
для целей экстракции они непригодны. Оптимальные
что может свидетельствовать о схожем механизме
количества компонентов для извлечения ионов ме-
экстракции.
таллов с Phen представлены в табл. 2. В присутствии
Phen фаза ПАВ мутная, вязкая, в отсутствие ионов
металлов окрашена в бледно-розовый цвет; водная
фаза прозрачная, бесцветная; между фазами наблю-
дается четкая граница раздела. Расслаивание наблю-
дается при комнатной температуре. Как и в случае с
ДАА, в системах с сульфонолом интервал концентра-
ций кислот шире, чем в системах с ДДСН. При этом
двухфазное жидкостное равновесие более устойчивое
и устанавливается быстрее.
Во всех системах найдены условия количествен-
ного извлечения ионов Ni(II), Cu(II), Co(II), Fe(II) и
Fe(III) [28]. При экстракции ионов металлов орга-
ническая фаза приобретает окраску: в присутствии
никеля — ярко-розовую, кобальта — оранжевую,
меди — бирюзовую, железа(II, III) — ярко-красную.
С увеличением концентраций кислот извлечение
практически всех ионов падает в связи с ростом кон-
куренции с ионами водорода за реагент, экстракция
Рис. 3. Распределение 0.01 моль·л-1 ионов Ga(III) с
ионов металлов протекает по координационному ме-
диантипирилбутаном в системах вода-АБСК-HCl (1),
вода-сульфонол-HCl (2), вода-ДДСН-HCl (3) (mДАБ =
ханизму. Наибольший интервал кислотности коли-
= 0.3 г, mДАГ = 0.3 г, Vобщ = 10.0 мл).
чественного извлечения имеет никель, так как его
520
Заболотных С. А. и др.
Таблица 2
Концентрационные параметры экстракции ионов металлов с 1,10-фенантролином
(mPhen = 0.15 г, Vобщ = 10.0 мл)
Система
mПАВ, г
скислоты, моль·л-1
Vф. ПАВ, мл
Вода-сульфонол-HCl
0.6
0.25-5.0
1.0-1.2
Вода-сульфонол-H2SO4
0.6
0.1-5.0
1.0-1.2
Вода-ДДСН-HCl
0.75
0.5-5.0
1.5-2.0
Вода-ДДСН-H2SO4
0.75
0.5-4.0
1.5-2.0
комплекс с Phen имеет самую высокую константу
в уксуснокислой среде (рН 2-5.3) и солянокислых
устойчивости. Сравнение кривых извлечения ионов
растворах [29].
никеля в различных системах показало, что для его
Введение в системы БТА сохраняет двухфазное
экстракции наиболее пригодны системы на основе
жидкое равновесие. В системах с индивидуальным
додецилсульфата натрия (рис. 4).
ДДСН интервал кислотности, в котором наблюда-
Образование окрашенных комплексов металлов
лось расслаивание, был уже, чем в системах с тех-
с реагентом, количественно извлекающихся в фазу
ническими АПАВ, а экстракция катионов металлов
ПАВ, позволяет в дальнейшем рассмотреть возмож-
неколичественная. Вследствие этого системы на ос-
ность разработки методики их экстракционно-фото-
нове ДДСН и БТА оказались малоэффективными для
метрического определения после растворения экс-
целей экстракции.
тракта в водно-спиртовом растворе.
Соотношения компонентов, выбранные для изу-
Системы вода-АПАВ-неорганическая кисло-
чения экстракции катионов металлов с БТА в систе-
та-1,2,3-бензотриазол. В качестве «мягкого» ли-
мах, представлены в табл. 3. Во всех системах фаза
ганда также изучен 1,2,3-бензотриазол (БТА), кото-
ПАВ мутная, вязкая, в отсутствие ионов металлов
рый применяют для гравиметрического определения
окрашена в светло-коричневый цвет; водная фаза
Ag(I), Сu(II), Zn(II), Os(VIII), Cd(II) и Ni(II) и ти-
прозрачная, бесцветная; между фазами наблюдается
триметрического определения Ag(I). Палладий(II)
четкая граница раздела. Смеси расслаиваются при
реагирует с БТА в широком интервале кислотности:
комнатной температуре. В системах с АБСК при
концентрации кислоты более 2.0 моль·л-1 HCl или
1.0 моль·л-1 H2SO4 требовалось кратковременное
(15 мин) нагревание до 75°C.
При введении БТА в растворы АБСК расслаивание
наблюдалось даже в отсутствие кислоты в смесях, что
позволяет рассматривать систему вода-БТА-АБСК в
экстракции как систему с протолитическим взаимо-
действием по аналогии с системами вода-антипирин-
АБСК [30] или вода-антипирин-нафталин-2-суль-
фокислота [31]. В этом случае расслаивание на две
жидкие фазы происходит в результате химического
взаимодействия БТА и АБСК.
Количественная экстракция ионов меди(II), нике-
ля(II), кобальта(II), железа(III) и цинка(II) наблюда-
ется при концентрациях кислот менее 0.2 моль·л-1
H2SO4 или 0.3 моль·л-1 HCl. С увеличением содержа-
ния кислоты происходит протонирование БТА и раз-
рушение его комплексов с металлами, и извлечение
Рис. 4. Распределение 0.01 моль·л-1 ионов Ni(II) с
катионов падает, что показано на примере извлечения
1,10-фенантролином в системах вода-сульфонол-HCl
Cu(II) (рис. 5). С ионами меди(II) БТА образует окра-
(1), вода-сульфонол-H2SO4 (2), вода-ДДСН-HCl (3),
шенное соединение, количественно извлекающееся в
вода-ДДСН-H2SO4 (4) (mPhen = 0.15 г, Vобщ = 10.0 мл).
Сравнение экстракционных возможностей систем на основе сульфонола, додецилсульфата натрия...
521
Таблица 3
Концентрационные параметры экстракции ионов металлов с 1,2,3-бензотриазолом
(mБТА = 0.35 г, Vобщ = 10.0 мл)
Система
mПАВ, г
скислоты, моль·л-1
Vф. ПАВ, мл
Вода-сульфонол-HCl
0.6
0.1-2.0
1.0-1.2
Вода-сульфонол-H2SO4
0.6
0.05-2.0
1.0-1.2
Вода-АБСК-HCl
0.5
0.0-4.0
1.0-1.2
Вода-АБСК-H2SO4
0.5
0.0-3.0
1.0-1.2
фазу ПАВ, что дает возможность разработки методи-
ки ее экстракционно-фотометрического определения
[32].
Особый интерес вызывает экстракция ионов пал-
ладия(II) с БТА. Во всех системах в широком интер-
вале концентраций его извлечение превышало 98%
(рис. 6). Лучшие результаты получены для системы
вода-АБСК-HCl, поэтому в ней изучена экстрак-
ция палладия в присутствии меди(II), никеля(II),
кобальта(II) и железа(III). Результаты совместной
экстракции ионов показали, что количественному
извлечению палладия не мешают 500-кратный моль-
ный избыток меди, 300-кратный — кобальта, 70-крат-
ный — никеля. Присутствие более чем двухкратного
избытка ионов железа(III) снижает экстракцию палла-
дия до 93%. Экстракция самих мешающих ионов при
Рис. 5. Распределение 0.01 моль·л-1 ионов Cu(II) с
этом не превышает 2%. Максимальные коэффициен-
1,2,3-бензотриазолом в системах вода-сульфонол-
ты разделения составили: SPd/Ni = 4060, SPd/Fe = 1973,
H2SO4 (1), вода-АБСК-H2SO4 (2), вода-АБСК-HCl (3),
SPd/Cu = 1480, SPd/Co = 1390.
вода-сульфонол-HCl (4) (mБТА = 0.35 г, Vобщ = 10.0 мл).
Выводы
Экстракционные системы на основе технических
анионных ПАВ сульфонола и алкилбензолсульфо-
кислоты оказались более эффективными в процессах
экстракции, чем системы с индивидуальным додецил-
сульфатом натрия. Расслаивание сохраняется в более
широком интервале кислотности, равновесие двух
фаз устанавливается быстрее, а извлечение ионов
металлов выше. Достоинствами алкилбензолсульфо-
кислоты и сульфонола также являются их невысокая
стоимость и доступность.
Рассмотренные системы могут являться при-
емлемой альтернативой как традиционным экс-
тракционным системам, содержащим токсичные и
пожароопасные органические растворители, так и
изученным ранее системам на основе индивидуаль-
Рис. 6. Распределение 0.002 моль·л-1 ионов Pd(II) с
ных анионных ПАВ. Кроме того, они применимы для
1,2,3-бензотриазолом в системах вода-сульфонол-
H2SO4 (1), вода-сульфонол-HCl (2), вода-АБСК-H2SO4
решения задач по разделению, концентрированию и
(3), вода-АБСК-HCl (4) (mБТА = 0.35 г, Vобщ = 10.0 мл).
определению элементов.
522
Заболотных С. А. и др.
Финансирование работы
[Goryacheva I. Yu., Loginov A. S., Lavrova T. N.,
Popov M. A. // J. Analyt. Chem. 2007. V. 62. N 5.
Работа выполнена по теме государственного зада-
P. 411-415].
ния № АААА-А18-118032790022-7.
[12]
Старова В. С., Куличенко С. А. // Изв. вузов. Химия
и хим. технология. 2009. Т. 52. № 11. С. 74-78.
[13]
Старова В. С., Куличенко С. А. // ЖАХ. 2010. Т. 65.
Конфликт интересов
№ 12. С. 1244-1249 [Starova V. S., Kulichenko S. A.
Авторы заявляют об отсутствии конфликта инте-
// J. Analyt. Chem. 2010. V. 65. N 12. P. 1215-1220].
ресов, требующего раскрытия в данной статье.
[14]
Nakai T., Murakami Y., Sasaki Y., Fujiwara Is.,
Tagashira Sh. // Analyt. Sci. 2004. V. 20. P. 235-237.
[15]
Murakami Y., Kajii A., Sasaki Y., Nozaki K., Fuji-
Информация об авторах
wara Is., Tagashira Sh. // Solvent Extraction Res.
Develop. Japan. 2010. V. 17. P. 237-242.
Заболотных Светлана Александровна, ORCID:
[16]
Nakai T., Murakami Y., Sasaki Y., Tagashira Sh. //
Talanta. 2005. V. 66. N 1. P. 45-50.
Гилева Ксения Олеговна, к.х.н., ORCID: https://
[17]
Tagashira Sh., Kimoto S., Nozaki K., Murakami Y. //
orcid.org/0000-0001-6898-3646
Analyt. Sci. 2009. V. 25. N 5. P. 723-726.
Денисова Светлана Александровна, к.х.н., ORCID:
[18]
Tuntiwiwattanapun N., Tongcumpou Ch., Haagen-
son D., Wiesenborn D. // J. Am. Oil Chem. Soc. 2013.
Леснов Андрей Евгеньевич, д.х.н., ORCID: https://
V. 90. N 7. P. 1089-1099.
orcid.org/0000-0001-8054-0709
[19]
Доронин С. Ю., Чернова Р. К. // Бутлеровские со-
общ. 2014. Т. 40. № 12. С. 94-102.
[20]
Заболотных С. А., Леснов А. Е., Денисова С. А. //
Список литературы
ЖФХ. 2016. Т. 90. № 10. С. 1458-1464 [Zabolot-
[1] Pena-Pereira F., Tobiszewski M. The Application of
nykh S. A., Lesnov A. E., Denisova S. A. // Russ. J.
Green Solvents in Separation Processes. Elsevier,
Phys. Chem. A. 2016. V. 90. N 1. P. 1942-1947].
2017. 560 p.
[21]
Заболотных С. А., Денисова С. А. // Вестн. Перм.
[2] Елохов А. М., Кудряшова О. С., Леснов A. E. //
ун-та. Сер. Химия. 2014. Вып. 1 (13). С. 50-57.
Вестн. Перм. ун-та. Сер. Химия. 2015. Вып. 1 (17).
[22]
Заболотных С. А., Леснов А. Е., Денисова С. А. //
С. 30-43.
Вода. Химия и экология. 2017. № 1. С. 73-79.
[3] Леснов А. Е., Денисова С. А., Кудряшова О. С.,
[23]
Петров Б. И. // ЖАХ. 1983. Т. 38. № 11. С. 2051-2076.
Чепкасова А. В., Катаева Е. Ю., Мохнаткина Н. Н.
[24]
Шевелёва А. Д. // Учен. зап. Молотовского ун-та.
// ЖПХ. 2010. Т. 83. № 8. С. 1379-1382 [Lesnov A.
1955. Т. 9. № 4. С. 133-141.
E., Denisova S. A., Kudryashova O. S., Chepkasova A.
[25]
Заболотных С. А., Денисова С. А. // Вестн. Перм.
V., Kataeva E. Yu., Mokhnatkina N. N. // Russ. J. Appl.
ун-та. Сер. Химия. 2016. Вып. 1 (21). С. 7-15.
Chem. 2010. V. 83. N 8. P. 1485-1488].
[26]
Алимарин И. П., Петрухин О. М., Багреев В. В. //
[4] Os N. M., Haak J. R., Rupert L. A. M. Physico-Chemical
Теория и практика экстракционных методов. М.:
Properties of Selected Anionic, Cationic and Nonionic
Наука, 1985. С. 5-40.
Surfactants. Amsterdam: Elsevier, 1993. 608 p.
[27]
Гурбанов А. Н., Салахова Ф. И. // Изв. вузов. Химия
[5] Куличенко С. А., Дорощук В. А., Старова B. C. //
и хим. технология. 2009. Т. 52. № 12. С. 33-35.
ЖПХ. 2008. Т. 81. № 8. С. 1263-1268 [Kulichen-
[28]
Заболотных С. А., Леснов А. Е., Денисова С. А. //
ko S. A., Doroshchuk V. A., Starova V. S. // Russ. J.
Вестн. Перм. ун-та. Сер. Химия. 2018. Т. 8. № 1.
Appl. Chem. 2008. V. 81. N 8. P. 1342-1347].
С. 29-38.
[6] Moradi M., Yamini Y., Ebrahimpour B. // J. Iran.
[29]
Гинзбург С. И., Езерская Н. А., Прокофьева И. В.,
Chem. Soc. 2014. V. 11. N 4. Р. 1087-1101.
Федоренко Н. В., Шленская В. И., Бельский Н. К.
[7] Ruiz F. J., Rubio S., Perez-Bendito D. // J. Chromatogr.
Аналитическая химия платиновых металлов. М.:
A. 2004. V. 1030. P. 109-115.
Наука, 1972. 616 с.
[8] Charboneau J., Wandruszka R. // J. Surfactant Deter-
[30]
Заболотных С. А., Желнина В. О., Денисова С. А.,
gents. 2010. V. 13. P. 281-286.
Елохов А. М., Леснов А. Е. // Журн. Сиб. федерал.
[9] Hryniewicka M., Starczewska B., Syperek I. // J. Mole-
ун-та. Химия. 2017. Т. 10. № 4. С. 536-544.
cular Liquids. 2013. V. 187. P. 320-325.
[31]
Петров Б. И., Денисова С. А., Леснов А. Е., Шес-
[10] Tagashira Sh., Ichimaru T., Nozaki K., Murakami Y. //
такова Г. Е. // Изв. вузов. Химия и хим. техноло-
Solvent Extraction Res. Develop. Japan. 2013. V. 20.
гия. 1999. Т. 42. № 1. С. 21-23.
P. 39-52.
[32]
Заболотных С. А., Денисова С. А., Манылова К. О.
[11] Горячева И. Ю., Логинов А. С., Лаврова Т. Н.,
// Вестн. Перм. ун-та. Сер. Химия. 2018. Т. 8. № 3.
Попов М. А. // ЖАХ. 2007. Т. 62. № 5. С. 459-464
С. 292-299.