Журнал прикладной химии. 2019. Т. 92. Вып. 5
СОРБЦИОННЫЕ И ИОНООБМЕННЫЕ ПРОЦЕССЫ
УДК 541.183
СОРБЦИЯ ИОНОВ Co2+, Pb2+ И Sr2+ ГИДРОКСИАПАТИТОМ,
ПОЛУЧЕННЫМ В ПРИСУТСТВИИ
ОКСИЭТИЛИДЕНДИФОСФОНОВОЙ КИСЛОТЫ
© И. Л. Шашкова, А. И. Иванец,* Н. В. Китикова
Институт общей и неорганической химии НАН Беларуси, Минск
* E-mail: Andreiivanets@yandex.ru
Поступила в Редакцию 18 января 2018 г.
После доработки 8 февраля 2019 г.
Принята к публикации 7 марта 2019 г.
Изучены физико-химические и сорбционные свойства гидроксиапатита, синтезированного в присут-
ствии ингибитора кристаллизации — оксиэтилидендифосфоновой кислоты. Установлено влияние
концентрации кислоты и фосфатно-кальциевых реагентов на сорбционные свойства гидрокси-
апатита по отношению к ионам Co2+, Pb2+ и Sr2+. Показано, что сорбционная емкость аморфного
гидроксиапатита, полученного в присутствии 1.0 мол% оксиэтилидендифосфоновой кислоты, по
отношению к ионам Co2+ и Sr2+ увеличивается в 2-2.5 раза, а к ионам Pb2+ — в 4-5 раз по сравнению
с кристаллическим гидроксиапатитом, полученным без введения добавок кислоты. Выявлено, что
наблюдаемые различия в сорбционной емкости аморфного и кристаллического гидроксиапатита по
отношению к изученным ионам металлов обусловлены различными механизмами их поглощения.
Ключевые слова: гидроксиапатит; ингибитор кристаллизации; оксиэтилидендифосфоновая кислота;
адсорбция из водных растворов; ионы тяжелых металлов; очистка водных сред
DOI: 10.1134/S0044461819050074
Фосфаты кальция различного химического соста-
среды, концентрацией и скоростью сливания реа-
ва характеризуются высокой поглощающей способ-
гентов, временем созревания осадка, условиями его
ностью в отношении ионов тяжелых металлов [1-10].
сушки и термообработки и др. Для очистки реальных
В случае кислого и среднего фосфатов кальция вы-
водных объектов преимущественно используют сор-
сокое сродство к ионам многовалентных металлов
бенты на основе природного фосфатного сырья [11,
обусловлено низкой растворимостью образующихся
12], гидроксиапатит биогенного происхождения [13]
фосфатов металлов [1-3]. Для гидроксиапатита в
или продукты переработки костной муки животных
отличие от фосфатов кальция неапатитовой структу-
[14, 15]. Высокое содержание сорбционноактивного
ры механизм поглощения ионов тяжелых металлов
компонента и доступность данных материалов об-
преимущественно ионообменный [4-10]. Емкость
условливает экономическую целесообразность их
всех кальций-фосфатных сорбентов изменяется в
практического применения. Гидроксиапатит и другие
широком диапазоне от 1-2 до 10-12 ммоль·г-1 и за-
фосфаты кальция могут применяться в динамическом
висит от их фазового и химического состава, кристал-
режиме. Для этого используют гранулированные фор-
лической и пористой структуры, что определяется
мы сорбента [16] либо нанесенные на различные по-
условиями синтеза: температурой и рН реакционной
ристые матрицы [17]. Линейная скорость фильтрации
590
Сорбция ионов Co2+, Pb2+ и Sr2+ гидроксиапатитом, полученным в присутствии оксиэтилидендифосфоновой кислоты
591
при сорбции в динамическом режиме, как правило, не
использованием малых количеств (0.01-1.0 мол%)
превышает 5 м·ч-1.
ингибиторов кристаллизации на примере ОЭДФ и
Как правило, аморфные фосфаты кальция (АФК)
Mg2+, показали, что даже такое количество ингиби-
с разупорядоченной структурой характеризуются
тора приводит к изменению их химического состава,
наиболее высокими сорбционными свойствами в от-
кристаллической структуры и адсорбционно-тек-
ношении ионов многовалентных металлов. Авторами
стурных характеристик. Механизм действия ОЭДФ
[9] установлено, что сорбционная емкость гидрокси-
как ингибитора кристаллизации не является до конца
апатита по отношению к ионам металлов возрастает
изученным. Наиболее вероятно, протекает адсорбция
со снижением степени его кристалличности и ро-
ОЭДФ на поверхности зародышей фосфата кальция,
стом удельной поверхности. Таким образом, АФК и
что препятствует их агломерации, росту и после-
аморфный гидроксиапатит являются перспективными
дующей кристаллизации. Важно отметить, что эф-
сорбентами для извлечения ионов тяжелых метал-
фективность действия ингибиторов кристаллизации
лов. Считается, что основной структурной единицей
существенно зависит от концентрации фосфатного и
АФК является сферический кластер ионов соста-
кальциевого реагентов.
ва Ca9(РО4)6 диаметром 9.5 Å, содержащий около
Целью настоящей работы являлось исследование
10-20 мас% связанной воды [18-21] и выступаю-
сорбционных свойств гидроксиапатита, синтезиро-
щий в роли первичных центров кристаллизации [22].
ванного в присутствии ОЭДФ как ингибитора кри-
Синтез АФК, как правило, проводят в присутствии
сталлизации, по отношению к ионам двухвалентных
веществ, влияющих на процессы кристаллизации
металлов различной природы — Sr2+, Co2+ и Pb2+.
гидроксиапатита. К наиболее эффективным инги-
Выбор данных металлов обусловлен высокой ток-
биторам кристаллизации фосфатов кальция относят
сичностью ионов Co2+ и Pb2+, присутствующих в
ионы некоторых металлов (Mg2+, Zn2+ и др.) [23, 24],
природных и сточных водах, и наличием долгожи-
а также фосфорорганические производные [окси-
вущих радионуклидов 90Sr и 60Co в составе жидких
этилидендифосфоновая кислота (ОЭДФ), β-глицеро-
радиоактивных отходов.
фосфата динатриевая соль и др.] [25-27].
Природа повышенной сорбционной активности
Экспериментальная часть
АФК не является до конца изученной. Так, увеличе-
ние обменной емкости гидроксиапатита по отноше-
Образцы фосфатов кальция получали методом
нию к ионам Cd2+ авторы связывают с ускорением
химического осаждения из растворов при комнатной
протекания диффузионных процессов и увеличением
температуре с использованием в качестве исходных
количества доступных сорбционных центров, что
реагентов Ca(NO3)2·4H2O и H3PO4, а также NH4OH
обусловлено снижением степени кристалличности,
для поддержания pH 10. Все реагенты квалифика-
уменьшением размеров частиц и увеличением удель-
ции ч.д.а. Концентрация катионов Ca2+ в реакци-
ной поверхности сорбентов. В отличие от такой точ-
онном растворе после смешения составляла 0.083,
ки зрения авторы [28], изучив влияние отклонения
0.20 и 0.42 моль·л-1, анионов PO43- — 0.05, 0.12 и
состава гидроксиапатита от стехиометрического на
0.25 моль·л-1. Концентрация PO43- использована
сорбционные свойства, показали, что химический
для обозначения соответствующих серий образцов.
состав, в том числе наличие катионных вакансий, ока-
Синтез образцов гидроксиапатита осуществляли
зывает существенное влияние на поглощение ионов
медленным добавлением P-содержащего раствора к
Cd2+, поскольку индуцирует процесс растворения-
Са-содержащему раствору при постоянном переме-
осаждения фазы сорбента.
шивании. Полученную суспензию выдерживали под
Различные точки зрения обусловлены, с одной сто-
маточным раствором в течение 24 ч без перемешива-
роны, большим количеством параметров, от которых
ния для созревания. Отделенный на воронке Бюхнера
зависит структура получаемых соединений. При этом
осадок промывали горячей водой и этанолом (образ-
трудно предположить, что авторы различных работ
цы 0-0.05, 0-0.12, 0-0.25). Синтез образцов в присут-
могли осуществить синтез фосфатов полностью в
ствии ингибитора кристаллизации проводили ана-
тождественных условиях. С другой стороны, рас-
логично. Добавку ОЭДФ вводили в раствор H3PO4
хождения в интерпретации различной сорбционной
из расчета 0.01, 0.10, 0.50 и 1.0 мол% относительно
активности фосфатов кальция могут быть обусловле-
ионов PO43- (серии образцов P-0.05, P-0.12, P-0.25).
ны влиянием природы сорбируемых ионов металлов.
Влажный осадок сначала сушили на воздухе при
Проведенные нами исследования состава и свойств
комнатной температуре, затем при 100°С в течение
образцов фосфатов кальция, синтезированных с
24 ч. Для изучения физико-химических свойств вы-
592
Шашкова И. Л. и др.
сушенные образцы измельчали и отсеивали фракцию
извлекаемых ионов металлов, а в отдельных экспе-
0.125-0.250 мм.
риментах также концентрацию ионов Са2+ и РО43-,
Рентгенофазовый анализ (РФА) был выполнен
перешедших в раствор. Измерение концентрации
на рентгеновском дифрактометре D8 Advanced
Sr2+, Co2+ и Pb2+ в анализируемых растворах, а также
(Bruker, Германия) с использованием CuKα-излучения.
ионов Са2+ и РО43- в растворах после сорбции про-
Содержание Ca2+ в составе синтезированных об-
водили при помощи оптического эмиссионного спек-
разцов определяли методом обратного титрования
трометра с индукционно связанной плазмой ICP-OES,
растворами трилона Б и ZnSO4, анализ на содержа-
модель iCAP 6300 (Thermo Electron Corporation,
ние фосфора проводили методом фотометрии окра-
USA). Определение концентрации ионов Pb2+ в рас-
шенного фосфорованадомолибдатного комплекса.
творах повышенной концентрации (0.10 моль·л-1)
Характеристики пористой структуры образцов оцени-
проводили методом комплексонометрического ти-
вали по изотермам низкотемпературной адсорбции-
трования по индикатору ксиленоловому оранжевому.
десорбции азота, измеренным объемным методом
Расчет сорбционной емкости q (ммоль·г-1) и степе-
(анализатор ASAP 2020 МР, Micromeritics, США).
ни извлечения ионов металлов Sr2+, Co2+ и Pb2+ α (%)
Удельную поверхность рассчитывали методом БЭТ
проводили по формулам (1) и (2), количество пере-
(ABET) и одноточечным методом БЭТ (Asp), объем
шедших в раствор ионов Са2+ LCa (ммоль·г-1) и РО43-
пор рассчитывали одноточечным методом по адсо-
LP (ммоль·г-1) рассчитывали по формулам (3) и (4):
рбционной (Vsp.ads) и десорбционной (Vsp.des) ветвям
(1)
изотермы. Средний диаметр пор для адсорбционной
(Dsp.ads) и десорбционной (Dsp.des) ветвей изотермы
рассчитывали по уравнению 4V/A. Предварительно
(2)
образцы вакуумировали при температуре 150°С в
течение 1 ч. Относительная ошибка определения
(3)
объема пор составляла ±1%, удельной поверхности
и размера пор — ±15%.
Для приготовления модельных растворов, содер-
(4)
жащих ионы Co2+, Sr2+ и Pb2+, использовали соот-
ветствующие соли (Sigma-Aldrich): CoCl2, SrCl2 и
где с0, с, сСа и сР (ммоль·л-1) — исходная и остаточ-
Pb(NO3)2. Концентрации исходных растворов CoCl2
ная концентрации ионов металлов и РО43- в фильтра-
и SrCl2 составляли 0.010 ± 0.002 моль·л-1. Изучение
те после сорбции; V (л) — объем аликвоты раствора;
сорбции ионов Pb2+ проводили на двух концентраци-
m (г) — масса навески.
ях Pb(NO3)2 — 0.01 и 0.10 моль·л-1. В первом случае
изучали обменные процессы и частичное растворение
Обсуждение результатов
образцов гидроксиапатита, во втором — исследовали
влияние ОЭДФ в зависимости от концентрации ис-
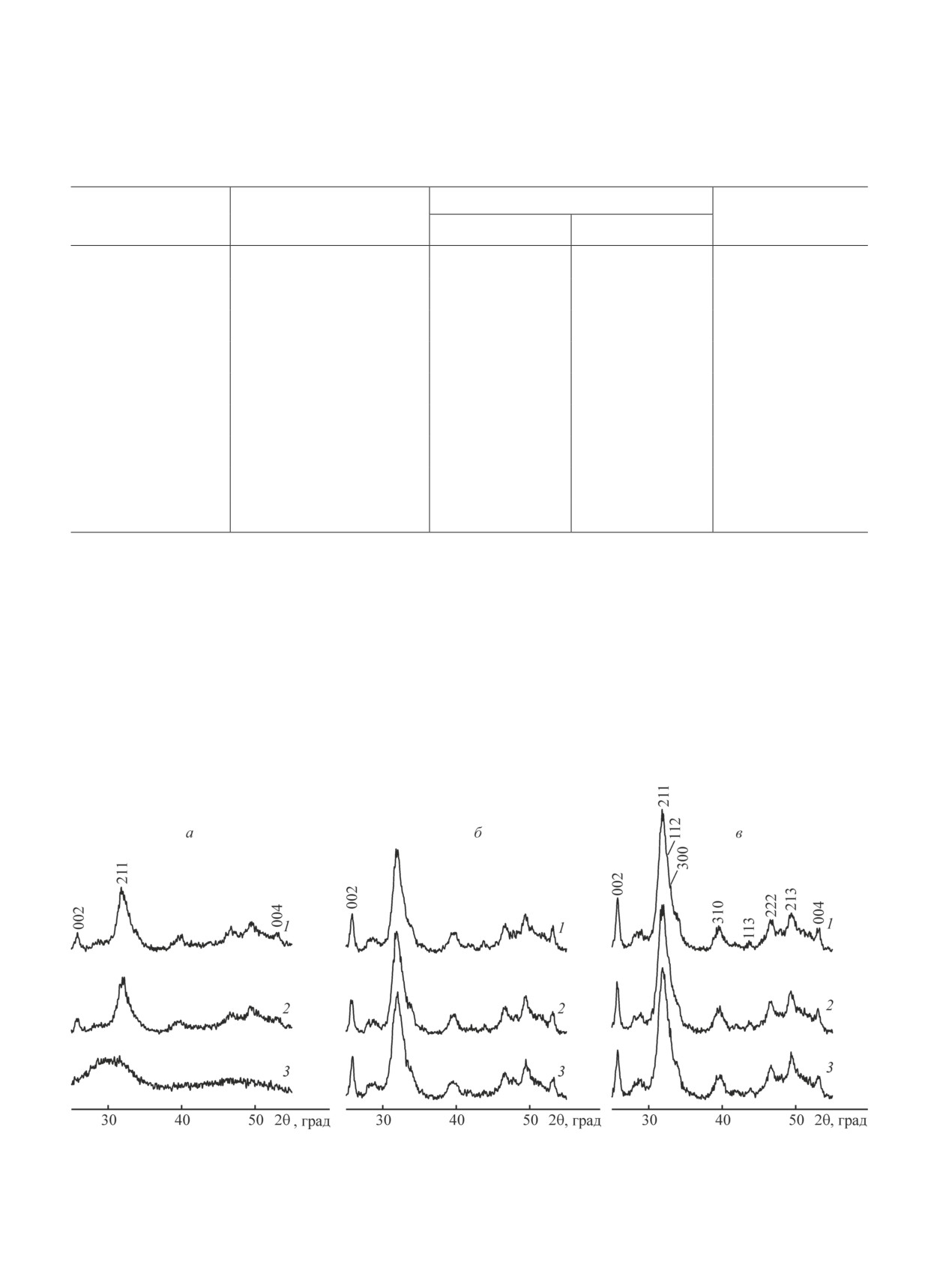
Согласно данным РФА синтезированные образцы
ходных растворов, количества используемой добавки
характеризуются рефлексами гидроксиапатита, за
и продолжительности сорбции на величину сорбци-
исключением аморфного образца, синтезированного
онной емкости.
из раствора концентрацией 0.05 моль·л-1 PO43- в при-
При проведении сорбционных экспериментов на-
сутствии 1.0 мол% ОЭДФ (рис. 1, а, дифрактограм-
веску сорбента массой 0.060 г заливали раствором
ма 3). При этом концентрация ионов PO43- и введение
соли объемом 15.0 мл, что соответствует отноше-
добавок ОЭДФ оказывают существенное влияние на
нию V/m = 250 мл/г. Для сравнительного исследо-
кристаллическую структуру получаемых фосфатов
вания сорбционных свойств образцов, полученных
кальция. Так, рост концентрации PO43- сопровожда-
из растворов различной концентрации, в отсутствие
ется увеличением интенсивности рефлексов гидрок-
ингибитора кристаллизации и в его присутствии сор-
сиапатита, что обусловлено увеличением степени
бенты выдерживали в модельных растворах 24 ч при
кристалличности. Обратная зависимость наблюдается
постоянном встряхивании на роторном шейкере ST15
при изменении концентрации вводимого ингибитора
(CAT, M. Zipperer GmbH, Germany). В случае изуче-
кристаллизации ОЭДФ — с увеличением содержания
ния влияния времени контакта сорбента с адсорбатом
от 0.01 до 1.0 мол% наблюдается существенное сни-
продолжительность выдержки варьировали от 0.5
жение степени кристалличности образцов.
до 48 ч. Далее сорбент фильтрованием отделяли от
Данные химического состава синтезированных
раствора и определяли остаточную концентрацию
образцов (табл. 1) хорошо согласуются с результа-
Сорбция ионов Co2+, Pb2+ и Sr2+ гидроксиапатитом, полученным в присутствии оксиэтилидендифосфоновой кислоты
593
Таблица 1
Химический состав синтезированных фосфатов кальция
Содержание элементов, ммоль·г-1
Молярное
Образец
Содержание ОЭДФ, мол%
отношение Са/Р
Ca
Р
0-0.05
—
9.402
5.690
1.65
Р-0.05-3
0.10
9.092
5.774
1.57
Р-0.05-5
1.0
8.922
5.757
1.56
0-0.12
—
9.321
5.517
1.69
Р-0.12-3
0.10
9.339
5.611
1.66
Р-0.12-5
1.0
9.062
5.729
1.58
I-0.25
—
9.147
5.444
1.68
Р-0.25-3
0.10
9.191
5.490
1.67
Р-0.25-5
1.0
8.932
5.307
1.68
тами РФА (рис. 1). Образцы, синтезированные без
уменьшается от 1.66 до 1.56. В последнем случае
добавки ОЭДФ, отличаются более высоким моляр-
это отношение близко к трикальцийфосфату [ТКФ,
ным отношением Са/Р, изменяющимся в интервале
Ca3(PO4)2·xH2O]. При более высокой концентрации
1.65-1.69. Введение в реакционную смесь ингиби-
реагентов (0.25 моль·л-1) введение ингибитора прак-
тора кристаллизации ОЭДФ оказывает существен-
тически не влияет на молярное отношение Са/Р, кото-
ное влияние на химический состав гидроксиапатита,
рое не снижается и остается близким к значению для
причем это влияние зависит от концентрации ионов
гидроксиапатита стехиометрического состава.
PO43-. Для растворов с невысокой исходной кон-
Основные характеристики пористой структуры
центрацией PO43- (0.05 и 0.12 моль·л-1) с увеличе-
синтезированных фосфатов кальция представлены
нием содержания ОЭДФ молярное отношение Са/Р
в табл. 2. Несмотря на некоторую разницу в значе-
Рис. 1. Рентгенограммы образцов гидроксиапатита, синтезированных из растворов с концентрацией ионов PO43-
0.05 (a), 0.12 (б) и 0.25 моль·л-1 (в) без ОЭДФ (1) и в присутствии ОЭДФ в количестве 0.1 (2) и 1.0 мол% (3).
594
Шашкова И. Л. и др.
Таблица 2
Параметры пористой структуры синтезированных фосфатов кальция
Удельная поверхность, м2·г-1
Объем пор, см3·г-1
Размер пор, нм
Образец
Asp
ABET
Vsp.ads
Vsp.des
Dsp.ads
Dsp.des
0-0.05
106
116
0.337
0.331
12.7
12.5
0-0.12
146
151
0.397
0.377
10.9
10.3
0-0.25
165
172
0.639
0.646
15.5
15.6
P-0.05
75
79
0.516
0.735
27.6
39.3
P-0.12
81
90
0.361
0.346
17.9
17.1
P-0.25
207
251
0.779
0.854
15.0
16.5
ниях параметров, рассчитанных разными метода-
взаимосвязи с концентрацией реагентов в исходных
ми, можно отметить общие закономерности влия-
растворах. При синтезе фосфата кальция в присут-
ния условий синтеза на характеристики пористой
ствии ОЭДФ в более концентрированных растворах
структуры. Увеличение концентрации реагентов при
образуется хорошо окристаллизованный гидроксиа-
синтезе приводит к образованию образцов с наиболь-
патит с высокими значениями удельной поверхности
шей величиной удельной поверхности и объема пор.
(207-250 м2·г-1) и объема пор (0.779-0.854 см3·г-1).
При этом средний размер пор не находится в прямой
В разбавленных растворах введение ОЭДФ приводит
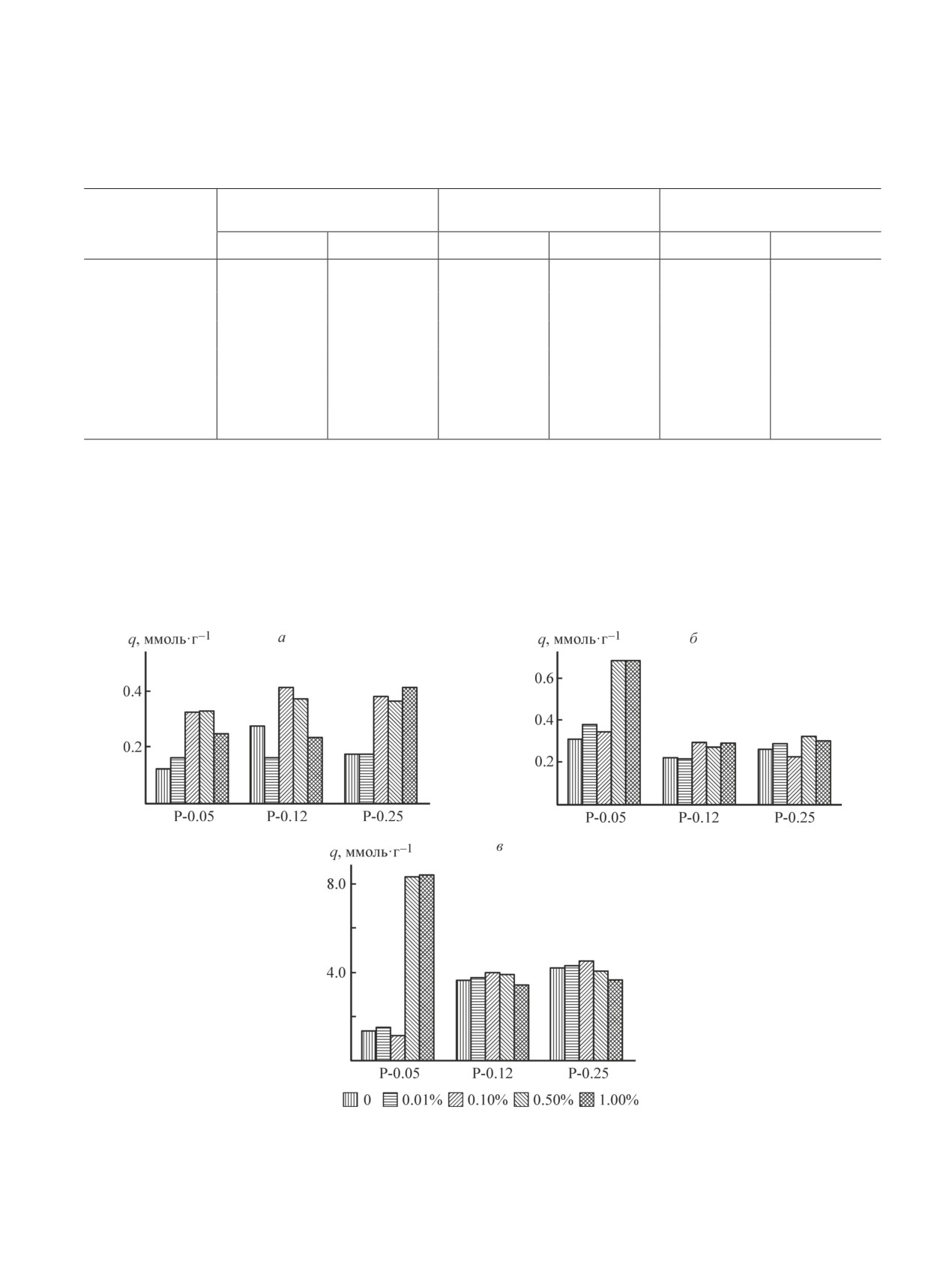
Рис. 2. Диаграммы сорбции ионов Sr2+ (а), Co2+ (б) и Pb2+ (в) образцами гидроксиапатита в зависимости от концен-
трации исходных растворов и количества добавки ОЭДФ.
Время контакта 24 ч, исходные концентрации ионов металлов 0.01 (а, б) и 0.1 моль·л-1 (в).
Сорбция ионов Co2+, Pb2+ и Sr2+ гидроксиапатитом, полученным в присутствии оксиэтилидендифосфоновой кислоты
595
к формированию слабоокристаллизованной фазы
честве 0.50-1.00 мол%, достигает максимального зна-
ТКФ с невысокой удельной поверхностью (79 м2·г-1).
чения (8.4 ммоль·г-1), что согласуется с данными, по-
С учетом существенного влияния условий синтеза
лученными для ТКФ [2, 3]. Для образцов, имеющих
и введения ОЭДФ на параметры кристаллической и
кристаллическую структуру, прослеживается рост
пористой структуры фосфатов кальция является ожи-
сорбционной емкости с увеличением концентрации
даемым различие в сорбционных характеристиках
исходных реагентов независимо от добавки ОЭДФ
синтезированных образцов по отношению к ионам
Sr2+, Co2+ и Pb2+ (рис. 2). Так, увеличение концен-
трации реагентов и введение 0.01 мол% ОЭДФ мало
сказывается на сорбционной емкости по отноше-
нию к ионам Sr2+, значения которой составляют 0.12,
0.28 и 0.17 ммоль·г-1 при концентрациях фосфатно-
го реагента 0.05, 0.12 и 0.25 моль·л-1 соответствен-
но, хотя для образцов без ОЭДФ отмечается рост и
удельной поверхности, и объема пор. Для сорбентов,
полученных при этих же концентрациях реагентов
в присутствии ОЭДФ, наблюдается более чем дву-
кратное увеличение сорбционной емкости, достига-
ющей 0.41-0.42 ммоль·г-1 при всех концентрациях
реагентов и содержании ингибитора кристаллизации
0.10-1.0 мол%. При этом рост сорбционной емкости,
по-видимому, обусловлен не только пористой струк-
турой. Максимальное поглощение ионов Sr2+ прояв-
ляют сорбенты с молярным отношением, близким к
стехиометрическому гидроксиапатиту, и обладающие
более совершенной кристаллической структурой.
При извлечении ионов Co2+ максимальное погло-
щение проявляют образцы, полученные из разбавлен-
ных растворов с добавлением 0.50-1.0 мол% ОЭДФ и
превосходящие по сорбционной емкости остальные
примерно в 2 раза (рис. 2, б). Образцы, полученные в
этих условиях, отличаются наибольшим отклонением
от гидроксиапатита по химическому составу (табл. 1)
и по данным РФА (рис. 1) являются практически
аморфными. Увеличение концентрации реагентов и
введение ОЭДФ в реакционную смесь не оказывает
существенного влияния на сорбционные свойства
гидроксиапатита (рис. 2, б).
Интересная зависимость наблюдается при по-
глощении ионов Pb2+ из более концентрированного
раствора (рис. 2, в). Согласно предыдущим исследо-
ваниям [1, 2, 4], фосфаты кальция именно при взаи-
модействии с ионами Pb2+ проявляют максимальную
сорбционную емкость, поэтому сорбция ионов Pb2+
может служить критерием сорбционной активности
сорбентов. В разбавленных растворах может проис-
ходить полное извлечение ионов Pb2+ [2, 3], в связи
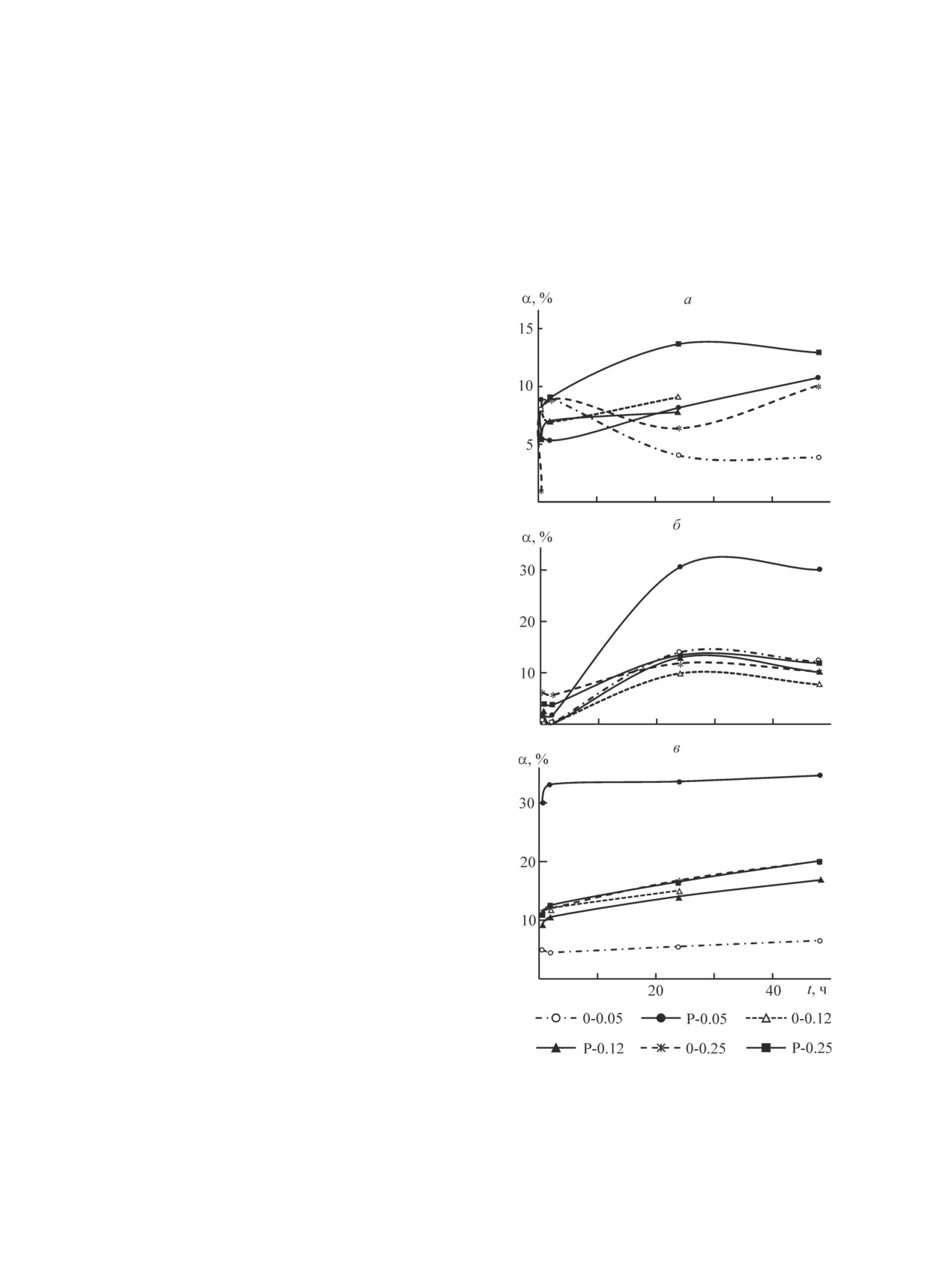
Рис. 3. Зависимость степени извлечения ионов Sr2+ (а),
с чем для сравнительного исследования сорбентов
Co2+ (б) и Pb2+ (в) образцами гидроксиапатита, синте-
концентрация раствора Pb(NO3)2 была увеличена.
зированными в отсутствие и с добавлением 1.0 мол%
Аналогично процессу взаимодействия с ионами Co2+,
ОЭДФ, от времени контакта.
сорбционная емкость аморфного гидроксиапатита,
Исходные концентрации ионов металлов 0.01 (а, б)
полученного с применением добавки ОЭДФ в коли-
и 0.1 моль·л-1 (в).
596
Шашкова И. Л. и др.
от 1.14 до 4.57 ммоль·г-1. Так же как при извлечении
рованных растворов. Степень извлечения ионов Со2+
ионов Sr2+, это может быть обусловлено более разви-
для большинства сорбентов изменяется в интервале
той пористой структурой сорбентов.
7.7-14.0%, максимум же составляет 30.6% для об-
Анализ кинетических кривых сорбции показыва-
разца, полученного из разбавленных растворов с до-
ет, что для большинства сорбентов при извлечении
бавлением 1.0 мол% ОЭДФ. При сорбции ионов Pb2+
ионов Sr2+ и Со2+ равновесие устанавливается в те-
для большинства образцов равновесие не достигается
чение 24 ч (рис. 3, а, б). Некоторое снижение количе-
даже в течение 48 ч контакта, а степень извлечения
ства поглощаемых ионов Sr2+ при длительном кон-
возрастает от 6.5 до 20.1% с увеличением концентра-
такте сорбентов с раствором SrCl2 свидетельствует об
ции исходных растворов (рис. 3, в). Исключение со-
обратимости ионообменной реакции. Максимальная
ставляет образец, синтезированный из разбавленных
степень извлечения ионов Sr2+ не превышает 14%,
растворов с использованием ОЭДФ, для которого рав-
при этом преимущество имеют образцы, полученные
новесие достигается в течение первых 2 ч, а степень
в присутствии ОЭДФ, особенно из более концентри-
извлечения составляет 30%.
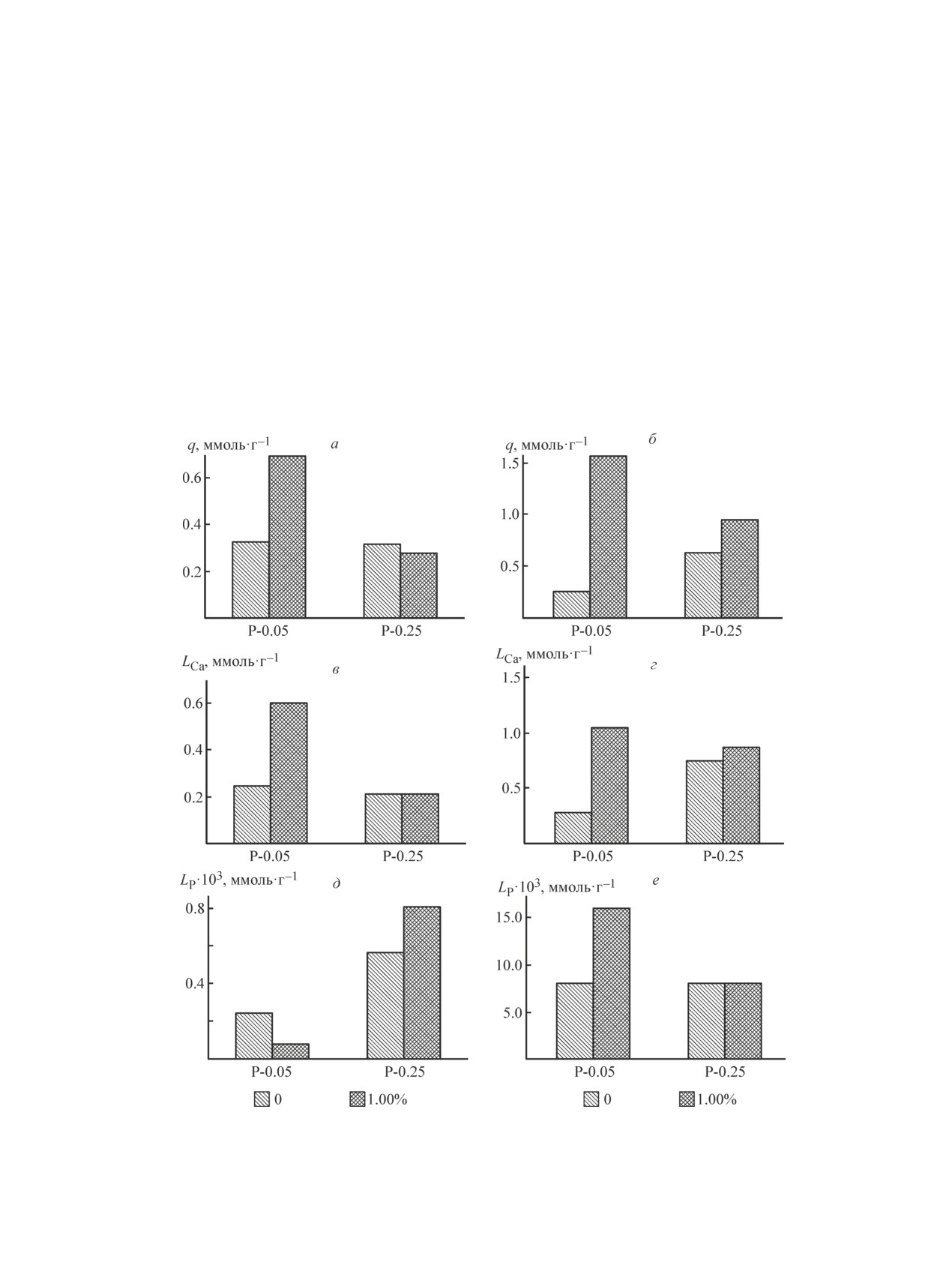
Рис. 4. Диаграммы сорбции ионов Co2+ (а) и Pb2+ (б) образцами гидроксиапатита и соответствующее количество
перешедших в раствор ионов Са2+ (в, г) и РО43- (д, е).
Время контакта 24 ч, исходные концентрации ионов металлов 0.01 моль·л-1.
Сорбция ионов Co2+, Pb2+ и Sr2+ гидроксиапатитом, полученным в присутствии оксиэтилидендифосфоновой кислоты
597
Наблюдаемые существенные различия в поведе-
ионному радиусу, электроотрицательности и кон-
нии сорбентов с разной степенью кристалличности
станте гидролиза. Так, ионы Pb2+ характеризуются
и пористой структурой при поглощении ионов Sr2+,
наибольшей электроотрицательностью и константой
Со2+ и Рb2+, а также существенные отклонения по-
гидролиза, что способствует преимущественному
лученного значения сорбционной емкости Рb2+ по
протеканию специфической адсорбции [10], а так-
сравнению с литературными данными для кристал-
же растворению-осаждению [4]. Ионы Со2+ имеют
лического гидроксиапатита (1-2 ммоль·г-1) свиде-
наименьший ионный радиус и взаимодействуют с
тельствуют о сложном характере взаимодействия
гидроксиапатитом посредством ионного обмена с Н+
изученных металлов с сорбентами. Для уточнения
P-OH-группы и поверхностным комплексообразова-
особенностей протекающих сорбционных процессов
нием [6, 7]. Извлечение ионов Sr2+ авторы чаще всего
было изучено молярное соотношение перешедших в
характеризуют как ионообменный процесс [4, 8, 10],
раствор ионов Са2+ и поглощенных ионов металлов.
поскольку ионы Sr2+ наиболее близки к ионам Са2+ по
Соответствующие экспериментальные данные пред-
ионному радиусу и элетроотрицательности. В пользу
ставлены на рис. 4.
протекания именно этого процесса служит также и
Как известно, поглощение ионов двухвалентных
отмеченное увеличение сорбционной емкости для
металлов фосфатами кальция, в том числе гидрок-
хорошо окристаллизованных образцов, обладающих
сиапатитом, может быть обусловлено различными
сравнительно низкой растворимостью (рис. 2, а), по-
процессами: ионным обменом, специфической ад-
этому мы ограничились более детальным изучением
сорбцией, растворением сорбента с последующим
процессов взаимодействия с ионами Pb2+ и Со2+ при
осаждением новой фазы фосфата, поверхностным
равной концентрации.
комплексообразованием [1-10]. Механизм взаимо-
Для ионообменных процессов при поглощении
действия зависит как от свойств сорбента, так и осо-
ионов двухвалентных металлов гидроксиапатитом
бенностей извлекаемых ионов. Выбранные нами для
отношение Ca/M согласно схематичному уравнению
исследования катионы существенно различаются по
(5) составляет 1:
Ca10(PO4)6(OH)2 + xM2+
Ca10-xМx(PO4)6(OH)2 + xCa2+,
(5)
где х = 0-10.
в растворе и меньшее отношение LCa/LP, чем в случае
Представленные данные для сорбции ионов Со2+
сорбции ионов Со2+ (рис. 4, д, е).
свидетельствуют об отличии от ионообменного ме-
ханизма сорбции, поскольку отношение ионов Ca2+ и
Выводы
Co2+ (LCa/qCo) значительно меньше 1, что согласуется
1. Установлено существенное влияние концентра-
с данными [6, 7]. Исключение составляет аморфный
ции фосфатно-кальциевых реагентов и ингибитора
образец ТКФ, для которого наибольшее значение
кристаллизации оксиэтилидендифосфоновой кисло-
отношения LCa/qCo может означать протекание ионо-
ты на физико-химические и сорбционные свойства
обменной реакции
гидроксиапатита.
Ca3(PO4)2 + 3Co2+
Co3(PO4)2 + 3Ca2+.
(6)
2. Показано, что с увеличением концентрации ис-
ходных фосфатно-кальциевых растворов и введением
В случае взаимодействия этого образца с ионами
оксиэтилидендифосфоновой кислоты происходит
Рb2+, а также образца Р-0.25-5 наблюдается превы-
возрастание сорбционной емкости по ионам Sr2+.
шение количества поглощенных ионов Рb2+ над ко-
Увеличение сорбционной емкости по ионам Co2+ и
личеством перешедших в раствор ионов Са2+, что в
Pb2+ наблюдается для аморфного образца трикаль-
первом случае может быть связано с образованием
цийфосфата. Наблюдаемые различия сорбционных
пироморфита по уравнению [2, 3]
свойств обусловлены различными механизмами по-
глощения металлов.
3Ca3(PO4)2 + 10Pb2+
Pb10(PO4)6(OH)2 + 9Ca2+. (7)
3. Кристаллический гидроксиапатит с развитой
пористой структурой поглощает ионы Co2+, Sr2+ и
Для остальных образцов, полученных без исполь-
Pb2+ по механизму ионного обмена. Аморфный ги-
зованием ОЭДФ, LCa/qPb ˃ 1, что хорошо согласуется
дроксиапатит взаимодействует с ионами Pb2+ по ме-
с возможным протеканием реакции взаимодействия
ханизму растворения-осаждения, что обусловливает
по механизму растворения-осаждения. Это под-
значительное увеличение его сорбционной емкости.
тверждает и более высокое содержание фосфат-ионов
По эффективности извлечения ионы металлов рас-
598
Шашкова И. Л. и др.
полагаются в ряд для кристаллического гидрокси-
[10]
Lazarevic S., Jankovic-Castvan I., Tanaskovic D.,
апатита — qPb2+ ˃˃ qSr2+ ˃ qCo2+, для аморфного —
Pavicevic V., Janackovic Dj., Petrovic R. // J. Environ.
qPb2+ ˃˃ qCo2+ ˃ qSr2+.
Eng. 2008. V. 134. N 8. P. 683-688.
[11]
Elouear Z., Bouzid J., Boujelben N., Feki M., Jamous-
si F., Montiel A. // J. Hazard. Mater. 2008. V. 156.
Конфликт интересов
P. 412-420.
[12]
Ivanets A. I., Kitikova N. V., Shashkova I. L., Olek-
Авторы заявляют об отсутствии конфликта инте-
siienko O. V., Levchuk I., Sillanpää M. // J. Water Proc.
ресов, требующего раскрытия в данной статье.
Eng. 2016. V. 9. P. 246-253.
[13]
Oliva J., Pablo J. D., Cortina J.-L., Cama J., Ayora C.
Информация об авторах
// J. Hazard. Mater. 2011. V. 194. P. 312-323.
[14]
Smiciklas I., Dimovic S., Sljivic M., Plecas I.
Шашкова Ирина Лукинична, к.х.н., ORCID: https://
// J. Environ. Sci. Health. Part A. 2007. V. 43.
orcid.org/0000-0002-3448-7887
P. 210217.
Иванец Андрей Иванович, д.х.н., доцент, ORCID:
[15]
Goto T., Sasaki K. // Ceram. Int. 2014. V. 40. P. 10777-
10785.
Китикова Наталья Владиленовна, к.х.н., ORCID:
[16]
Ivanets A., Kitikova N., Shashkova I., Matrunchik Y.,
Kul′bitskaya L. // Environ. Technol. Innov. 2016. V. 6.
P. 152-164.
[17]
Fernando M. S., Silva R. M., Silva K. M. N. // Appl.
Список литературы
Surf. Sci. 2015. V. 351. P. 95-103.
[1] Sugiyama S., Ichii T., Fujisawa M., Kawashiro K.,
[18]
Posner A. S., Betts F. // Acc. Chem. Res. 1975. V. 8.
Tomida T., Shigemoto N., Hayashi H. // J. Colloid
P. 273-281.
Interface Sci. 2003. V. 259. N 2. P. 408-410.
[19]
Posner A. S., Betts F., Blumenthal N. C. // Prog. Cryst.
[2] Shashkova I. L., Rat′ko A. I., Kitikova N. V. // Colloid
Growth Charact. 1980. V. 3. P. 49-64.
Surf. A. 1999. V. 160. N 3. P. 207-215.
[20]
Boskey A. L. // J. Dent. Res. 1997. V. 76. P. 1433-
[3] Шульга Н. В., Шашкова И. Л., Самускевич В. В. //
1436.
ЖПХ. 1999. Т. 72 № 11. С. 1852-1858 [Shul′ga N. V.,
[21]
Betts F., Blumenthal N. C., Posner A. S., Becker G. L.,
Shashkova I. L., Samuskevich V. V. // Russ. J. Appl.
Lehninger A. L. // Proc. Nat. Acad. Sci. U. S. A. 1975.
Chem. 1999. V. 72. N 11. P. 1963-1969].
V. 72. P. 2088-2090.
[4] Smiciklas I., Onjia A., Raicevic S., Janackovic D.,
[22]
Onuma K., Ito A. // Chem. Mater. 1998. V. 10. P. 3346-
Mitric M. // J. Hazard. Mater. 2008. V. 152. P. 876-884.
3351.
[5] Gomez del Rio J. A., Morando P. J., Cicerone D. S. //
[23]
Kanzaki N., Onuma K., Treboux G., Tsutsumi S., Ito A.
J. Environ. Manage. 2004. V. 71. P. 169-177.
// J. Phys. Chem. B. 2000. V. 104. P. 4189-4194.
[6] Wakamura M., Kandori K., Ishikawa T. // Colloid Surf.
[24]
Ding H., Pan H., Xu X., Tang R. // Cryst. Growth Des.
A. 1998. V. 142. P. 107-116.
2014. V. 14. N 2. P. 763-769.
[7] Tarasevich Yu. I., Shkutkova E. V., Janusz W. // J. Water
[25]
Nowak B. // Water Res. 2003. V. 37. P. 2533-2546.
Chem. Technol. 2012. V. 34. N 3. P. 125-132.
[26]
Amjad Z. // Langmuir. 1987. V. 3. P. 1063-1069.
[8] Lazic S., Vukovic Z. // J. Radioanal. Nucl. Chem. 1991.
[27]
Ding G.-J., Zhu Y.-J., Qi C., Sun T.-W., Wu J., Chen F.
V. 149. N 1. P. 161-168.
// RSC Adv. 2015. V. 5. P. 40154-40162.
[9] Stötzel C., Müller F. A., Reinert F., Niederdraenk F.,
[28]
Feng Y., Gong J.-L., Zeng G.-M., Niu Q.-Y.,
Barralet J. E., Gbureck U. // Colloids Surf. B. 2009.
Zhang H.-Y., Niu C.-G., Deng J.-H., Yan M. // Chem.
V. 74. P. 91-95.
Eng. J. 2010. V. 162. P. 487-494.