Журнал прикладной химии. 2019. Т. 92. Вып. 6
НЕОРГАНИЧЕСКИЙ СИНТЕЗ И ТЕХНОЛОГИЯ НЕОРГАНИЧЕСКИХ ПРОИЗВОДСТВ
УДК 546.271+543.57
СИНТЕЗ И ОСОБЕННОСТИ ТЕРМОЛИЗА
ДИГИДРАТА БОРОГИДРИДА НАТРИЯ
© И. В. Архангельский1, О. В. Кравченко2, М. В. Цветков2*, Ю. А. Добровольский2,
А. В. Шиховцев2, М. В. Соловьев2, А. А. Зайцев2
1 Московский государственный университет им. М. В. Ломоносова
2 Институт проблем химической физики РАН, г. Черноголовка Московской обл.
* E-mail: tsvetkov@icp.ac.ru
Поступила в Редакцию 22 ноября 2018 г.
После доработки 6 марта 2019 г.
Принята к публикации 7 марта 2019 г.
Рассмотрен процесс термолиза образцов дигидрата борогидрида натрия, полученных из раствора
и через пар. Исследование ядерного магнитного резонанса ацетонитрильного раствора показало,
что в обоих случаях соблюдается стехиометрия. Рентгенофазовый анализ позволяет говорить о
дефектности образца, полученного через пар. Установлено, что в обоих случаях процесс начинается
после протекания реакции перитектического распада исходного соединения и образования жидкой
фазы. Определена энтальпия перитектической реакции ∆Hreact = 18.6 ± 1.5 кДж·моль-1 для образца,
выкристаллизованного из щелочного раствора. Для образца, полученного через пар, эта величина за-
метно меньше. Кинетика низкотемпературного термолиза (40-80°С) обоих образцов описывается
уравнением Аврами-Ерофеева.
Ключевые слова: дигидрат борогидрида натрия; перитектическая реакция; термический анализ;
неизотермическая кинетика
DOI: 10.1134/S0044461819060021
Процесс гидролиза комплексных борогидридов
жанию водорода в элементном составе молекулы
щелочных металлов (NaBH4, LiBH4 и т. д.) достаточ-
(10.8 мас%), приемлемой цене и стабильности его
но давно используется для получения водорода [1, 2].
щелочных растворов. Процесс гидролиза боро-
Причинами их использования в качестве источников
гидрида натрия является перспективным способом
водорода являются высокая объемная плотность во-
получения высокочистого водорода [6-9]. Сугубо
дорода и относительная легкость получения [3-5].
формально процесс гидролиза можно представить
Среди гидридов борогидрид натрия (NaВН4)
уравнением
занимает особое место благодаря высокому содер-
NaВН4 + 2Н2O → NaВO2 + 4Н2 + ∆H кДж·моль-1.
(1)
Использование катализаторов обеспечивает полу-
Следует отметить, что в системе борогидрид нат-
чение водорода в температурном интервале 40-85°С,
рия-вода существует в качестве индивидуального
ускоряет процесс генерации Н2, предотвращает обра-
соединения дигидрат борогидрида натрия. Вероятно,
зование побочных продуктов [10, 11].
это соединение может быть использовано в твердом
703
704
Архангельский И. В. и др.
виде для получения водорода в процессе термолиза
воды для дигидрата. Эксикатор помещали в термостат
[12]. Однако в литературе об этом процессе практи-
при Т = 20°С и выдерживали в течение 24 ч. За это
чески не упоминается.
время вся вода поглощалась борогидридом. Все пре-
В работах [13, 14] проведено квантово-химическое
параты хранили в плотно закрывающихся пластмас-
моделирование последовательного дегидрирования
совых сосудах в холодильнике.
молекулы борогидрида натрия в воде, а также вли-
Термоаналитические исследования осуществля-
яния агрегации дигидрата борогидрида натрия на
ли с использованием синхронного комплекса STA
энергетический барьер отрыва молекулы водоро-
449 Jupiter (Netzsch). В качестве держателей образца
да. Показано, что отщепление молекулы водорода
использовали алюминиевые тигли диаметром 6 мм
от комплекса NaBH4·nH2O идет через объединение
и высотой 8 мм. Масса образца составляла 3-5 мг.
ионов Н- и Н+ из ВН4- и Н2О и формирование про-
Эксперименты проводили при различных скоростях
межуточных фрагментов ВН3 и ОН-, разделенных
нагревания — 2.5, 5, 7.5 и 10 град·мин-1 в токе осу-
молекулами воды. Найдено, что объединение ком-
шенного воздуха с расходом 70 мл·мин-1 в интер-
плексов NaBH4·2Н2О в кластеры и добавление одной
вале температур 30-550°С. Аналогично проводили
молекулы воды приводит к снижению потенциальных
эксперименты в токе аргона в интервале 30-200ºC.
барьеров на пути отрыва молекулярного водорода до
Полученные экспериментальные данные, а также
величин 0.8-0.9 эВ.
обратная и прямая кинетические задачи решались и
Известно, что безводный NaBH4 хорошо раство-
обрабатывались с помощью пакетов программ фирмы
рим в воде, а его щелочные растворы устойчивы к
Netzsch: Proteus Analysis, Thermokinetics.
гидролизу [15]. Поэтому NaBH4·2Н2О может быть
Нагревание препаратов в алюминиевых тиглях
выкристаллизован из щелочных водных растворов.
могло привести к взаимодействию щелочного рас-
Кристаллический безводный борогидрид натрия до-
твора с металлом, однако образующаяся при отно-
статочно гигроскопичен и образует дигидрат при
сительно низкой температуре жидкая фаза обладала
взаимодействии с парами воды. Как показала наша
высокой вязкостью и не смачивала металл, т. е. взаи-
практика, препараты, полученные из раствора и из
модействия смеси с тиглем не наблюдалось.
пара, морфологически различны. Таким образом,
Дифрактограммы исследованных образцов были
главной целью настоящей работы является термоана-
получены на дифрактометре Siemens Kristalloflex с
литическое исследование NaBH4·2Н2О, полученного
графитовым монохроматором и никелевым филь-
разными методами.
тром. Данные были собраны в диапазоне 2θ = 5-60°.
Идентификацию фаз проводили по данным работы
[16].
Экспериментальная часть
Спектры ядерного магнитного резонанса (ЯМР)
Синтез дигидрата борогидрида натрия.
1H (300 МГц), 11B (96.3 МГц) были записаны по стан-
Исходный безводный борогидрид натрия (99%, Acros)
дартным методикам в поле 7.04 Тл на спектрометре
растворяли в 0.1 М растворе NaOH (~50 г NaBH4 в
Bruker AVANCE 300 в интервале температур 25-70°C.
50 мл 0.1 М NaOH), раствор перемешивали при тем-
Образцы помещали в стандартные ампулы диаметром
пературе 35-36°С, затем фильтровали в токе азота.
5 мм. Температуру образца с точностью ±0.1° уста-
Прозрачный раствор в плотно закрытой колбе поме-
навливали с помощью блока BVT-3200. Для устране-
щали в холодильник на 24 ч при температуре 0°С.
ния градиента температур по длине ампулы исполь-
Выпавшие кристаллы отделяли от маточного раство-
зовали направленный поток воздуха со скоростью
ра фильтрованием, хорошо отжимали между листами
400-500 л·мин-1. Химические сдвиги ЯМР 11B были
фильтровальной бумаги и слегка подсушивали в ва-
измерены относительно внешнего эталона — водного
кууме. Кристаллы дигидрата, полученные из водной
раствора B(OH)3, сдвиги ЯМР 1Н — относительно
фазы [NBH(I)], использовали во всех представленных
тетраметилсилана.
исследованиях.
В качестве основного растворителя были исполь-
Для получения дигидрата через паровую фазу
зованы спектрально «сухой» CH3CN и CD3CN, не
[препарат NBH(II)] использовалась следующая про-
содержащий воды.
цедура. В эксикатор помещали чашку Петри с 10 г
безводного борогидрида натрия. Препарат равномер-
Обсуждение результатов
но распределяли по всей поверхности чашки. Здесь
же помещался стаканчик с 9.55 мл воды, что незна-
Кристаллизация образцов. Выпадение дигидрата
чительно превышает стехиометрическое содержание
NBH(I) из водного раствора приводит к образованию
Синтез и особенности термолиза дигидрата борогидрида натрия
705
крупных пластинчатых кристаллов [16], имеющих
то образец NBH(II) дефектен. Можно полагать, что
слоистую структуру, подобно моноклинной структуре
дефектность этого образца связана с неполным об-
NaBr·2H2O. Характерной особенностью структуры
разованием диводородных связей, что приводит к
дигидрата является образование диводородной связи,
образованию турбостратной структуры, характерной
т. е. взаимодействие атомов водорода борогидрид-
для слоистых кристаллов.
аниона с водородом молекул воды, обеспечивающее
В то же время состав обоих препаратов по содер-
связь плоских слоев структуры, образованных иона-
жанию воды практически одинаков. Исследовались
ми натрия [16].
насыщенные растворы NBH(I) и NBH(II) в ацетони-
Образование образца NBH(II) протекает иначе.
триле. Состав донной фазы не определялся. В спек-
Процесс является гетерогенным и протекает сначала
трах протонно-магнитного резонанса (ПМР) раство-
на границе раздела твердое тело-пар, затем твердое
ров соединений NBH(I) и NBH(II) в ацетонитриле и
тело-жидкость, так как на поверхности безводного
CD2HCN при комнатной температуре регистрировали
борогидрида проходит частичная конденсация воды.
сигналы тетраборогидрида BH4- при -0.12 м. д. в
При этом кубическая гранецентрированная решетка
виде квартета с КССВ J(1H-11B) = 81 Гц, сигналы
борогидрида трансформируется в слоистую моно-
воды при 3.05 м. д. и остаточный сигнал от частич-
клинную. Такая перестройка приводит к возникнове-
но дейтерированного ацетонитрила CD2HCN в виде
нию структурных дефектов в кристаллах дигидрата
квинтета при ~1.8 м. д. с КССВ J(1H-2H) = 2.3 Гц.
[16]. Из данных рентгенофазового анализа (РФА)
Отношение интенсивностей протонных сигналов
(табл. 1) видно, что положения большинства брэггов-
воды и тетраборогидрида было 1:1, что точно соот-
ских рефлексов совпадают, т. е. образцы относятся
ветствовало исходному составу. Следовательно, в аце-
к одному структурному типу. Однако интенсивно-
тонитрильном растворе оба препарата присутствуют
сти многих рефлексов заметно различаются. Если
как дигидраты. Таким образом, данные РФА дают
считать, что образец NBH(I) вполне соответствует
основание полагать, что образцы NBH(I) и NBH(II)
структурному типу дигидрата борогидрида натрия,
не идентичны.
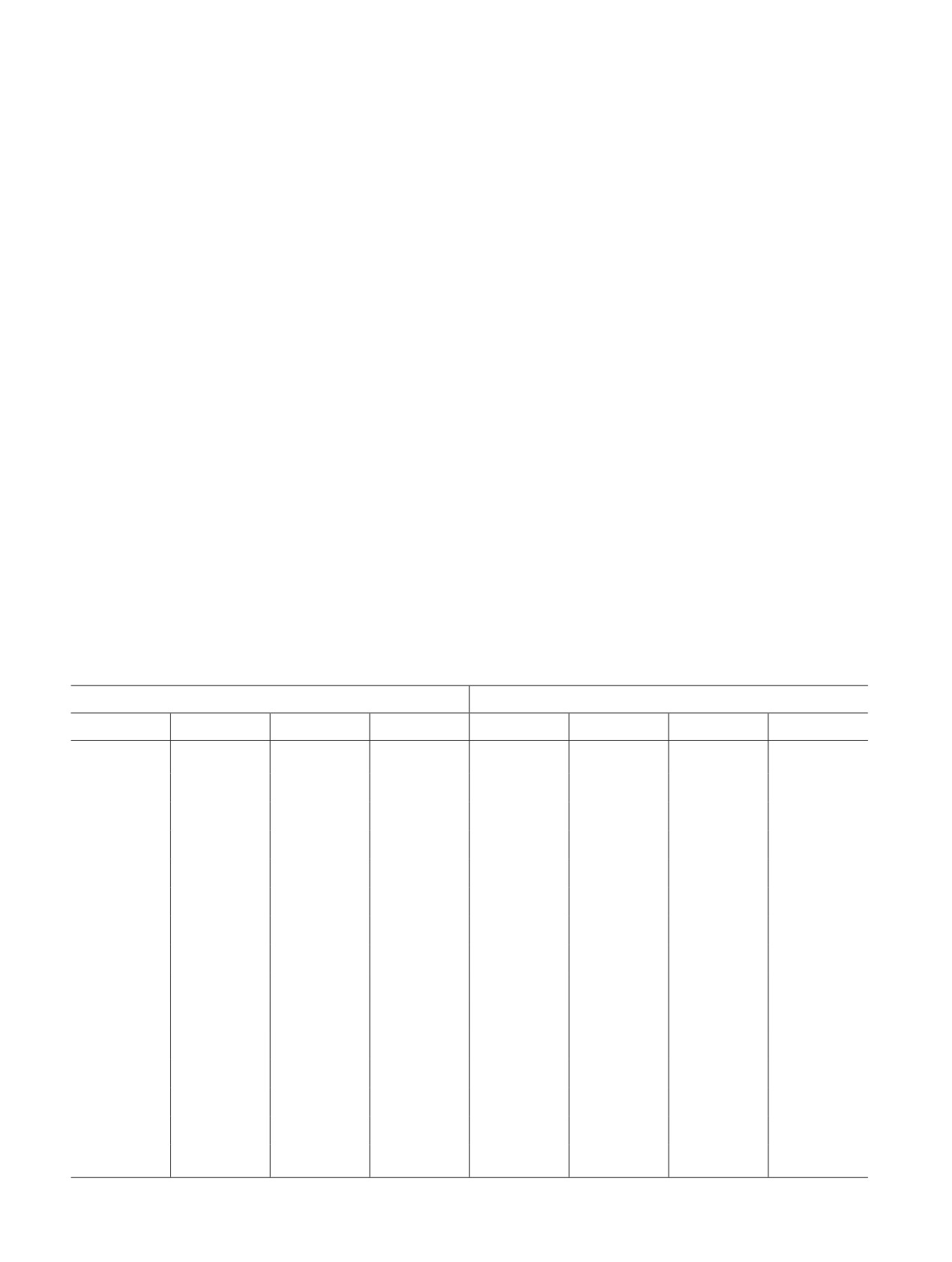
Таблица 1
Рентгенофазовый анализ образцов дигидрата борогидрида натрия
NaBH4·2H2O из раствора
NaBH4·2H2O из пара
2θ, град
d, Ǻ
I
Irelat
2θ, град
d, Ǻ
I
Irelat
14.55
6.088
8269
100
14.50
6.109
7253
100
17.00
5.216
592
7
17.00
5.216
983
14
26.80
3.326
689
8
26.80
3.326
639
9
29.20
3.058
2575
31
29.20
3.058
1079
15
30.95
2.889
481
6
30.95
2.889
602
8
32.25
2.776
846
10
32.25
2.776
1470
20
33.95
2.640
438
5
33.95
2.640
614
8
35.10
2.557
383
5
35.10
2.557
425
6
36.25
2.478
711
9
36.30
2.475
932
13
39.30
2.292
318
4
39.30
2.292
404
6
41.40
2.181
227
3
41.35
2.183
173
2
43.00
2.103
275
3
42.90
2.108
297
4
45.30
2.002
363
4
45.45
1.996
258
4
60.50
1.530
815
10
77.95
1.226
360
4
706
Архангельский И. В. и др.
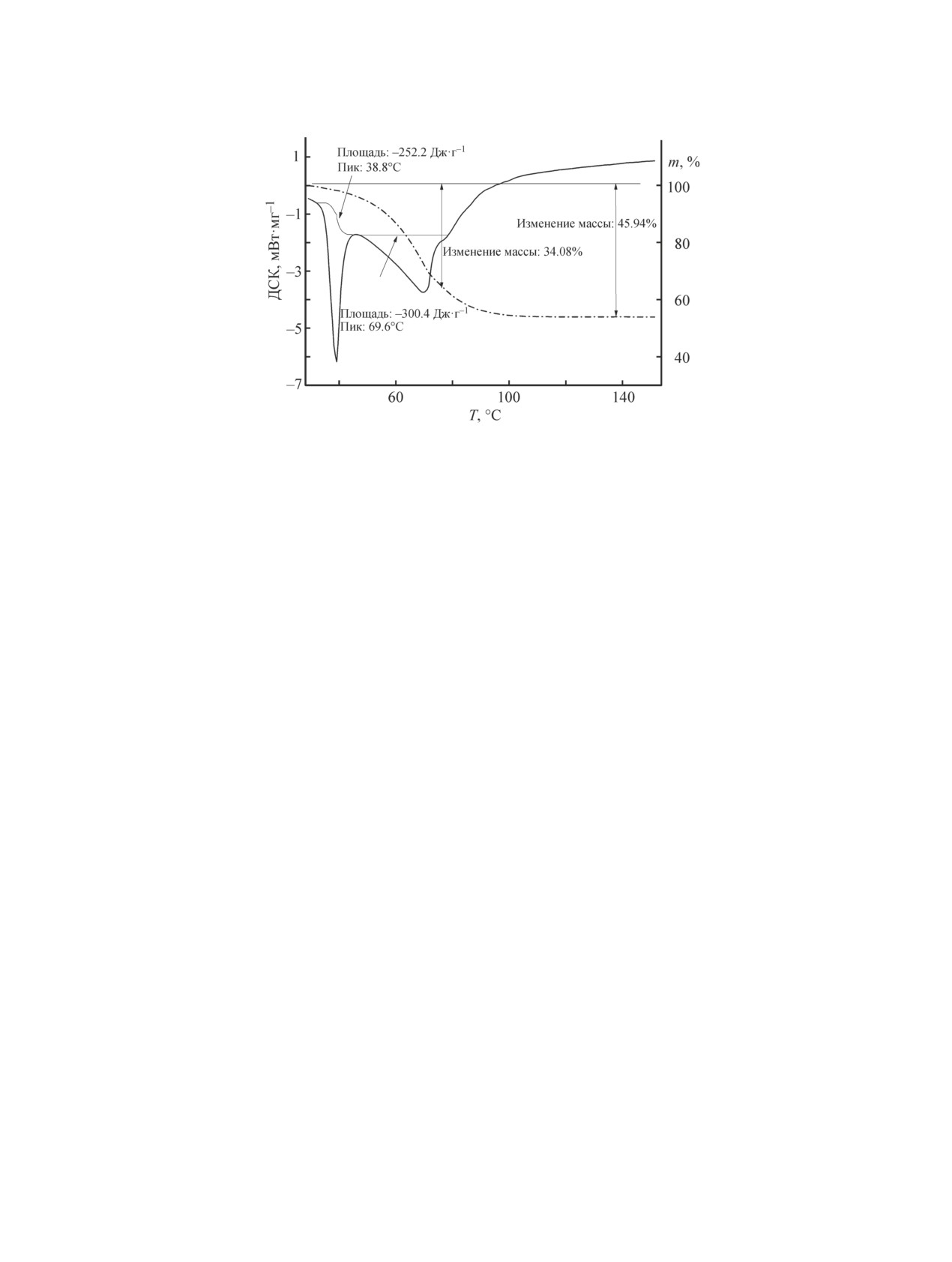
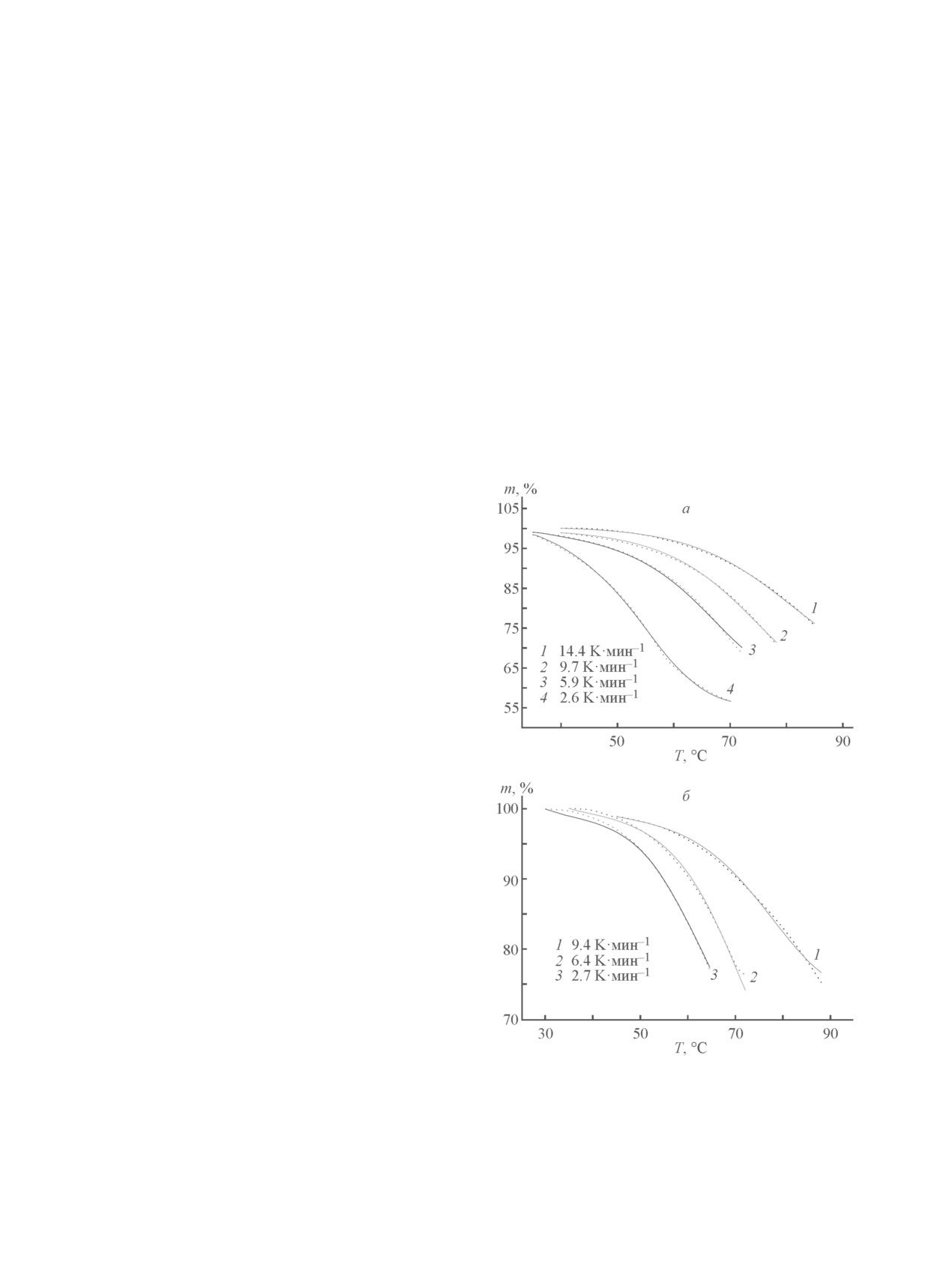
Рис. 1. Термоаналитические кривые термолиза NBH(I) в сухой воздушной атмосфере.
Термолиз. На рис. 1 представлены термоанали-
Политерма растворимости двойной системы
тические кривые процесса нагревания препарата
NaBH4-H2O [17] показывает, что при температу-
NBH(I) в интервале температур 30-150°С в сухой
ре 36.4°С в равновесии с насыщенным раствором
воздушной атмосфере. При этих температурах про-
борогидрида натрия находится безводный NaBH4.
исходит потеря массы (~46%), и на кривой диффе-
Нонвариантная точка (36.4°С; 45.2 мас% NaBH4)
ренциальной сканирующей калориметрии (ДСК)
соответствует перитектической реакции
наблюдаются эндотермические эффекты. Следует
NaBH4·2H2O NaBH4 + раствор.
(2)
отметить, что в атмосфере аргона процесс протекает
аналогично. Если бы процесс протекал согласно урав-
Следовательно, процесс термолиза на началь-
нению (1), то должен был наблюдаться значительный
ном этапе эндотермичен и протекает в жидкой фазе.
экзотермический эффект [9]. Следовательно, в термо-
Первый эндотермический эффект отвечает перитек-
аналитическом эксперименте процесс существенно
тическому процессу и может быть представлен сле-
иной, чем это следует из уравнения (1).
дующим уравнением:
NaBH4·2H2O = 0.45NaBH4solid + [0.55NaBH4 + 2H2O + ∆Hdissol]liq + ∆Hreact.
(3)
С использованием данных работы [18] рассчита-
водорода. Таким образом, для рассматриваемого об-
на величина энтальпии реакции перитектического
разца более характерен процесс дегидратации.
распада, которая составила ∆Hreact = 17 кДж·моль-1.
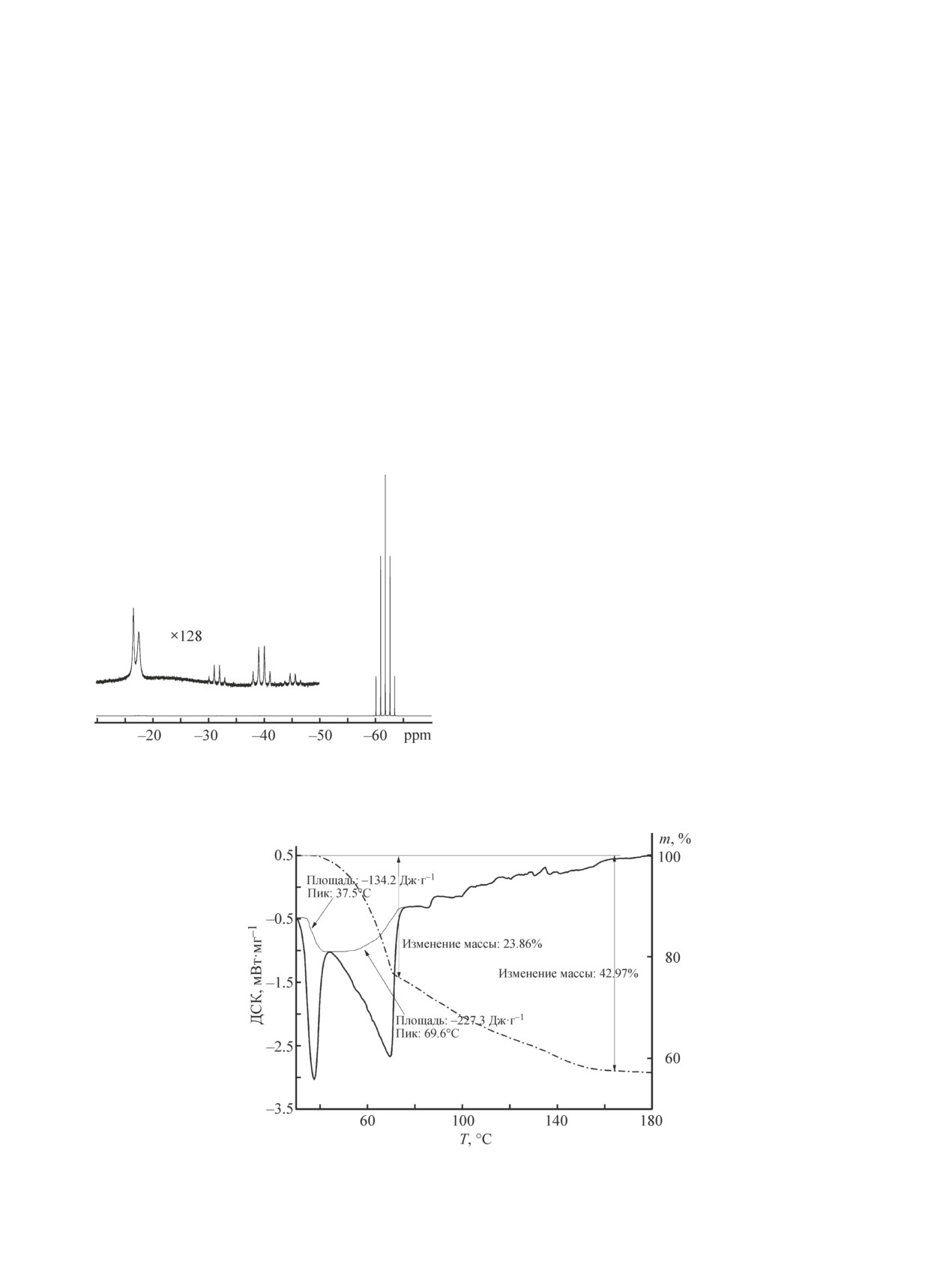
При 70°С в спектрах ЯМР 11В для образца
По данным ДСК энтальпия эндотермического эф-
NBH(I) наблюдали квинтет с относительными ин-
фекта в интервале температур 30-40°С составля-
тенсивностями 1:4:6:4:1 при -60 м. д. и КССВ
ет 252 ± 20 Дж·г-1, или 18.6 ± 2 кДж·моль-1, т. е. рас-
J(11B-1H) = 81 Гц, обусловленный наличием тетра-
четные и экспериментальные величины совпадают.
борогидрид-аниона BH4¯ как основной частицы, со-
Дальнейшее нагревание препарата в интервале
держащей атомы бора. Помимо сигналов от BH4¯ в
температур 40-150ºС приводит к значительному эн-
спектрах ЯМР 11В регистрировали группу мульти-
дотермическому эффекту и потере массы ~45%. Это
плетов в виде трех квартетов, что свидетельствует о
свидетельствует о ступенчатом гидролизе и образова-
возможности образования гидроксогидридоборатов в
нии промежуточных гидроксопроизводных по схеме
виде, например, аниона BH3OH¯ и (или) (BH3)2OH¯ с
NaBH4-NaBH3OH-NaBH2OH2- и т. д. [19]. При этом
мостиковой OH-группой или их контактных ионных
процесс сопровождается частичной потерей воды.
пар с катионом натрия (рис. 2). Формирование таких
Полная дегидратация NaBH4·2H2O составляет 49%
структур показано в [19, 20]. Синглет при -17 м. д.
потери массы, а полный гидролиз — 10.8% убыли
также появляется в этом температурном диапазоне.
массы по уравнению (1), т. е. чем меньше убыль мас-
Его появление связано с образованием метаборат-
сы в процессе термолиза, тем больше генерируется
аниона в соответствии с реакцией (1).
Синтез и особенности термолиза дигидрата борогидрида натрия
707
«Плечо» на кривой ДСК при 75°C отвечает пе-
может быть обусловлена процессом, представленным
реходу к твердофазному процессу термолиза, что
следующим уравнением:
наблюдается визуально. Убыль массы 34% (рис. 1)
NaBH4·2H2O = 0.5NaBH4 + 0.25NaBO2 + 0.25NaBH3OH + 1.25H2 + 1.25H2O.
(4)
Таким образом, термолиз образца NBH(I) прохо-
соответственно не участвует в реакции перитекти-
дит в значительной мере по механизму дегидратации.
ческого распада. Эти молекулы участвуют только в
Термолиз препарата NBH(II) (рис. 3) протекает иначе.
образовании раствора борогидрида. Потеря массы у
Прежде всего энтальпия перитектического перехода
этого образца в интервале 40-80°C составляет ~24%,
заметно меньше, чем у NBH(I). Следует полагать, что
что заметно меньше, чем у NBH(I). Значит, процесс
в турбостратной структуре образца NBH(II) часть
при невысоких температурах (ниже 80°C) можно
молекул воды не образует диводородных связей и
описать следующим уравнением:
NaBH4·2H2O → 0.34NaBH4 + 0.33NaBH3OH + 0.33NaBO2·0.6H2O + 1.7H2 + 0.8 H2O.
(5)
Таким образом, термолиз образца NBH(II) проте-
кает в значительной мере по механизму образования
водорода.
Следует полагать, что дальнейший термолиз обо-
их образцов протекает аналогично твердофазному
процессу, о чем свидетельствует сходное изменение
массы в интервале температур до 160ºС и близкие
значения энтальпий процессов.
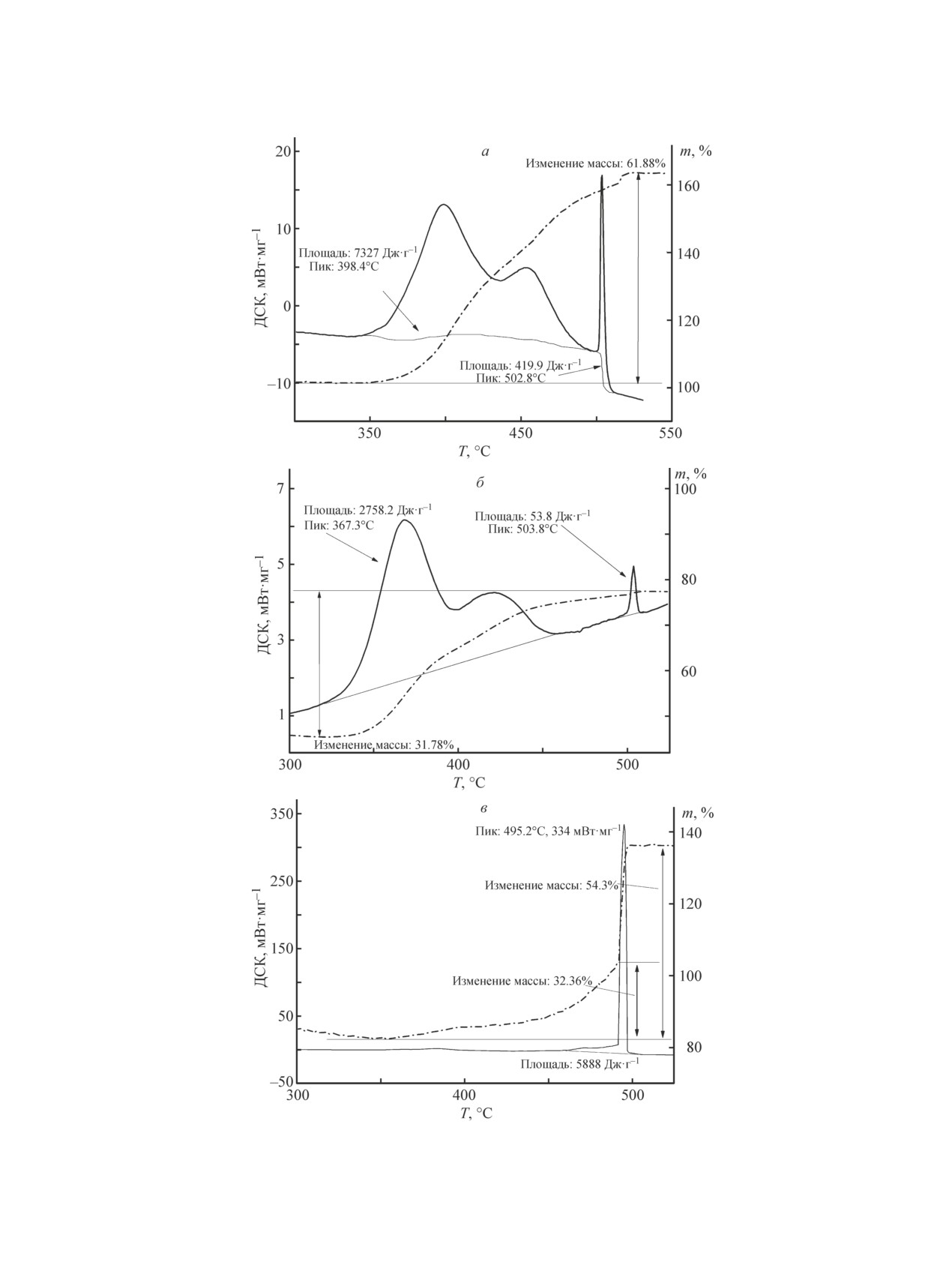
Нагревание образца NBH(I) до 550°С на воздухе
приводит к экзотермическим эффектам и заметному
приросту массы (~65%) в интервале температур 350-
520°C (рис. 4, а). Надо полагать, что экзотермические
эффекты в области 350-470°С характеризуют процесс
окисления продуктов гидролиза. Увеличение массы в
процессе окисления обусловлено образованием ме-
табората натрия. В интервале температур 150-350°C
Рис. 2. ЯМР-спектр 11B NaBH4·H2O в CH3
CN, T = 343 K. нет заметного изменения массы, следовательно, в
процессе термолиза не происходит образования ги-
Рис. 3. Термоаналитические кривые NBH(II) в сухой воздушной атмосфере.
708
Архангельский И. В. и др.
Рис. 4. Кривые ДСК и ТГ окисления продуктов термолиза в сухой воздушной атмосфере.
а — NBH(I), б — NBH(II), в — NaBH4.
Синтез и особенности термолиза дигидрата борогидрида натрия
709
дратов метабората натрия, как в случае гидролиза
родышеобразования в реакционном объеме [21].
в водном растворе [15]. Таким же образом протека-
Исследуемая реагирующая система является суспен-
ет процесс окисления продуктов термолиза образца
зией безводного борогидрида натрия в его растворе.
NBH(II). На рис. 4, б представлены термоаналитиче-
Можно полагать, что образование зародышей гидрок-
ские кривые окисления образца NBH(II) в интервале
согидридоборатов происходит на поверхности ча-
температур 350-550°C. Здесь, как и у образца NBH(I),
стиц. Кроме гидроксоформ в качестве продукта обра-
также наблюдаются два экзотермических эффекта в
зуется еще и метаборат натрия. Если процесс является
интервале температур 350-470°C. Однако это только
одностадийным, тогда образование этих продуктов
качественное сходство, которое свидетельствует о
протекает одновременно. Метаборат натрия хорошо
сходных продуктах гидролиза. Так, эффект при 500°C
растворяется в воде, образуя пересыщенные раство-
для образца NBH(II) существенно меньше, чем у об-
ры. Следовательно, в данном случае образуются за-
разца NBH(I). Следует отметить, что интенсивный
родыши только гидроксоформ. В уравнении Аврами-
острый экзотермический эффект при 500°С вызван
Ерофеева параметр n пропорционален числу атомов
окислением безводного борогидрида натрия, который
продукта реакции, требующихся для образования
образуется в результате перитектического распада,
активных зародышей. В табл. 2 представлены кине-
что подтверждает рис. 4, в. Причиной же разницы
тические параметры процессов термолиза. Из данных
в интенсивностях является дефектность структуры
NBH(II), о чем сказано выше.
Таким образом, эндотермические эффекты в тем-
пературном интервале 30-100°С (рис. 1, 3) обуслов-
лены несколькими процессами, протекающими в
реагирующей системе: во-первых, реакцией перитек-
тического распада, во-вторых, ступенчатым гидро-
лизом борогидрид-аниона в жидкой фазе, в-третьих,
дегидратацией твердых промежуточных продуктов
реакции. В интервале температур 120-150°С процесс
убыли массы практически заканчивается. Наличие
трех экзотермических эффектов в области темпера-
тур 350-550ºС и данные ЯМР дают основание счи-
тать, что твердыми продуктами термолиза являют-
ся гидроксопроизводные и безводный борогидрид
натрия.
Кинетика термолиза. С использованием результа-
тов термогравиметрического эксперимента, получен-
ных при различных скоростях нагревания, был прове-
ден анализ кинетики процесса термолиза. Уравнение
(3) характеризует процесс термолиза, протекающий
в жидкой фазе в интервале температур 40-80ºС. Мы
полагали, что процесс в данном температурном ин-
тервале является одностадийным. Решение обратной
кинетической задачи показало, что лучшее описание
эксперимента в данных условиях дает уравнение
Аврами-Ерофеева вида
f(α) = n(1 - α) [-ln(1 - α)]n-1/n,
где α — степень превращения образца, n — пара-
Рис. 5. Результаты моделирования кинетики процесса
метр порядка процесса зародышеобразования. Такое
термолиза дигидрата борогидрида натрия.
уравнение характеризует процессы термолиза обоих
а — NBH(I), б — NBH(II) по одностадийной модели со-
образцов (рис. 5, а, б).
гласно уравнению Аврами-Ерофеева (табл. 2).
Известно, что уравнение Аврами-Ерофеева ха-
Коэффициент корреляции R2 = 0.999, сплошная линия —
рактеризует гетерогенный процесс случайного за-
расчет.
710
Архангельский И. В. и др.
Таблица 2
Результаты расчета кинетических параметров по термогравиметрическим кривым согласно уравнению
Аврами-Ерофеева
Предэкспонентный
Энергия
Показатель
Погрешность
коэффициент
Погрешность
Погрешность
Образец
активации Ea,
степени
МНК* tS
в уравнении
МНК* tS
МНК* tS
кДж·моль-1
реакции, n
Аррениуса lgA
NaBH4·2H2O из раст-
48.6
0.25
5.22
0.25
1.40
0.01
вора
NaBH4·2H2O из пара
102.5
13
13.4
2.0
0.83
0.08
* t — коэффициент Стьюдента, S — стандартное отклонение.
табл. 2 видно, что параметр n для образца NBH(II)
го раствора, наблюдали квинтет с относительны-
существенно меньше, чем для NBH(I). Это свидетель-
ми интенсивностями 1:4:6:4:1 при -60 м. д. и КССВ
ствует о том, что NBH(II) в меньшей степени подвер-
J(11B-1H) = 81 Гц, обусловленный тетрабороги-
жен гидролизу. Эти результаты согласуются с термо-
дрид-анионом BH4- как основной формой. Помимо
аналитическими данными по окислению продуктов
сигналов от BH4- в спектрах ЯМР 11В регистрировали
гидролиза в интервале температур 300-550°С (рис. 4).
группу мультиплетов в виде трех квартетов, что сви-
Таким образом, образование жидкой фазы в ре-
детельствует о возможности образования гидроксоги-
зультате перитектического распада морфологически
дридоборатов в виде, например, аниона BH3OH- или
различных соединений приводит к сходному кинети-
(BH3)2OH- с мостиковой OH-группой.
ческому механизму низкотемпературного (40-80ºС)
Нагрев NaBH4·2H2O [образцы NBH(I) и NBH(II)]
термолиза по уравнению Аврами-Ерофеева. При
на воздухе до температуры 550°C приводит к ин-
этом кинетические параметры различны (табл. 2),
тенсивным экзотермическим эффектам при 300-
что обусловлено различием в соотношении оксо- и
490°C и острому интенсивному экзотермическому
гидроксоформ борогидрида в продуктах из-за раз-
эффекту при температуре 500°C. Появление этих
личной начальной концентрации раствора. Об этом
эффектов связано с окислением гидроксогидридобо-
свидетельствует большое различие энтальпий низко-
ратов как продуктов частичного гидролиза. Высоко-
температурного эффекта (рис. 1, 3).
температурный эффект обусловлен окислением без-
водного борогидрида натрия.
Кинетические расчеты показали, что образование
Выводы
жидкой фазы в результате перитектического распада
морфологически различных соединений приводит
Энтальпия эндотермического эффекта для образца
к сходному кинетическому механизму низкотем-
дигидрата борогидрида натрия, полученного кри-
пературного (40-80°С) термолиза по уравнению
сталлизацией из водного раствора, в интервале тем-
Аврами-Ерофеева. При этом кинетические параме-
ператур 30-45°С составляет 18.6 ± 1.5 кДж·моль-1.
тры различны (табл. 2), что обусловлено различием
Этот эффект вызван перитектической реакцией, ко-
в соотношении оксо- и гидроксоформ борогидрида
торая приводит к образованию суспензии безвод-
из-за разной начальной концентрации раствора.
ного борогидрида натрия в насыщенном растворе.
Можно полагать, что проведение термолиза образ-
Аналогичный эффект для образца, полученного об-
ца NBH(II), полученного через паровую фазу, в ин-
работкой безводного борогидрида натрия парами
тервале 60-80ºС в атмосфере водяного пара позволит
воды, составляет 10 ± 1.5 кДж·моль-1. Столь суще-
получить максимальное количество водорода, избегая
ственная разница в значении энтальпии реакции пе-
перегрева реагирующей системы.
ритектического распада для этих образцов связана с
образованием в образце NBH(II), полученном через
Благодарности
паровую фазу, турбостратной дефектной структуры,
характерной для слоистых кристаллов.
Работа выполнена в рамках государственно-
При 70°С в спектрах ЯМР 11В для образца
го задания № 0089-2019-0007, гос. регистрация
NBH(I), полученного кристаллизацией из водно-
№ 01201361853.
Синтез и особенности термолиза дигидрата борогидрида натрия
711
Конфликт интересов
[9] Beaird A. M., Davis T. A., Matthews M. A. // Ind. Eng.
Chem. Res. 2010. V. 49. N 20. P. 9596-9599.
Авторы заявляют об отсутствии конфликта инте-
[10] Simagina V. I., Komova O. V., Ozerova A. M., Netski-
ресов, требующего раскрытия в данной статье.
na O. V., Odegova G. V., Kellerman D. G., Bulav-
chenko O. A., Ishchenko A. V. // Appl. Catal. A:
Информация об авторах
General. 2011. V. 394. N 1-2. P. 86-92.
[11] Netskina O. V., Ozerova A. M., Komova O. V., Odego-
Кравченко Олег Владимирович, к.х.н., с.н.с.,
va G. V., Simagina V. I. // Catal. Today. 2015. V. 245.
P. 86-92.
Архангельский Игорь Валентинович, к.х.н., с.н.с.,
[12] Arkhangelskii I. V., Tarasov V. P., Kravchenko O. V.,
Kirakosyan G., Tsvetkov M. V., Solovev M. V., Dobro-
Цветков Максим Вадимович, к.х.н., с.н.с., ORCID:
volskii Yu. A., Shihovzev A. V. // J. Therm. Anal.
Calorim. 2018. V. 132. N 1. P. 155-163.
Добровольский Юрий Анатольевич, д.х.н., про-
[13] Зюбин А. С., Зюбина Т. С., Кравченко О. В., Соловь-
ев М. В., Добровольский Ю. А. // ЖНХ. 2016.
Шиховцев Алексей Владимирович, ORCID: https://
Т. 61. № 6. С. 767-775 [Zyubin A. S., Zyubina T. S.,
orcid.org/0000-0003-3307-6768
Kravchenko O. V., Solov′ev M. V., Dobrovol′skii Yu. A.
Соловьев Михаил Владимирович, к.х.н., с.н.с.,
// Russ. J. Inorg. Chem. 2016. V. 61. N 6. P. 731-
739].
Зайцев Алексей Александрович, ORCID: https://
[14] Зюбин А. С., Зюбина Т. С., Кравченко О. В., Со-
ловьев М. В., Цветков М. В., Добровольский Ю. А.
orcid.org/0000-0002-3446-4167
// ЖНХ. 2017. Т. 62. № 3. С. 305-313 [Zyubin A. S.,
Zyubina T. S., Kravchenko O. V., Solov′ev M. V., Tsvet-
Список литературы
kov M. V., Dobrovol′skii Yu. A. // Russ. J. Inorg. Chem.
[1] Schlesinger H. I., Brown H. C., Finholt A. E., Gil-
2017. V. 62. N 3. P. 309-317].
breath J. R., Hoekstra H. R., Hyde E. K. // J. Am. Chem.
[15] Мальцева Н. Н., Хаин В. С. // Борогидрид натрия.
Soc. 1953. V. 75. N 1. P. 215-219.
М.: Наука, 1985.207 с.
[2] Solovev M. V., Chashchikhin O. V., Dorovatovskii P. V.,
[16] Filinchuk Y., Hagemann H. // Eur. J. Inorg. Chem.
Khrustalev V. N., Zyubin A. S., Zyubina T. S., Krav-
2008. V. 2008. N 20. P. 3127-3133.
chenko O. V., Zaytsev A. A., Dobrovolsky Yu. A. // J.
[17] Хаин B. C., Волков A. A. // ЖПХ. 1980. Т. 53. № 11.
Power Sources. 2018. V. 377. P. 93-102.
С. 2404-2407.
[3] Kojima Y., Kawai Y., Kimbara M., Nakanishi H.,
[18] Marrero-Alfonso E. Y., Gray G. R., Davis T. A.,
Matsumoto S. // Int. J. Hydrogen Energy. 2004. V. 29.
Matthews M. A. // Int. J. Hydrogen Energy. 2007.
N 12. P. 1213-1217.
V. 32. N 18. P. 4723-4730.
[4] Xu D., Wang H., Guo Q., Ji S. // Fuel. Process. Technol.
[19] Хаин В. С., Мальцева Н. Н., Волков А. А. // Борогид-
2011. V. 92. N 8. P. 1606-1610.
риды металлов. Т. 1. Борогидриды щелочных ме-
[5] Demirci U. B. // Int. J. Hydrogen Energy. 2015. V. 40.
таллов и тетраалкиламмония. Ухта: УТГУ, 2001.
N 6. P. 2673-2691.
223 с.
[6] Orimo S. I., Nakamori Y., Eliseo J. R., Züttel A., Jen-
[20] Arkhangelsky I. V., Dunaev A. V., Makarenko I. V.,
sen C. M. // Chem. Rev. 2007. V. 107. N 10. P. 4111-
Tikhonov N. A., Belyaev S. S., Tarasov A. V. Non-
4132.
Isothermal Kinetic Methods. Workbook and La-
[7] Amendola S. C., Sharp-Goldman S. L., Janjua M. S.,
boratory Manual. Berlin: Edition Open Access, 2013.
Spencer N. C., Kelly M. T., Petillo P. J., Binder M. //
76 p.
Int. J. Hydrogen Energy. 2000. V. 25. N 10. P. 969-975.
[21] Барре П. Кинетика гетерогенных процессов / Пер. с
[8] Marrero-Alfonso E. Y., Beaird A. M., Davis T. A.,
фр. под ред. В. В. Болдырева. М.: Мир, 1976. 574 с.
Matthews M. A. // Ind. Eng. Chem. Res. 2009. V. 48.
[Barrett P. Cinetique Heterogene. Paris: Gauthier-
N 8. P. 3703-3712.
Villars, 1973].