894
Кайнарбаева Ж. Н. и др.
Журнал прикладной химии. 2019. Т. 92. Вып. 7
УДК 547.1:547.9:667.042.2
ОЦЕНКА ПРИМЕНИМОСТИ БИОМАССЫ МИКРОВОДОРОСЛЕЙ
ДЛЯ ПОЛУЧЕНИЯ НА ИХ ОСНОВЕ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ
© Ж. Н. Кайнарбаева, А. М. Картай, Р. Б. Сариева,
Б. К. Доненов, М. Б. Умерзакова*
Институт химических наук им. А. Б. Бектурова, Алматы, Казахстан
* Е-mail: umerzak@mail.ru
Поступила в Редакцию 21 февраля 2019 г.
После доработки 22 марта 2019 г.
Принята к публикации 25 мая 2019 г.
Из сухой биомассы микроводорослей (cпирулина, Botryococcus balkhashus и дикого штамма культуры
содового озера Сугур) выделены масла, осуществлена их переэтерификация метанолом с последую-
щей модификацией моноэтаноламином и этиленгликолем. Проведена оценка поверхностно-активных
свойств масел полученных продуктов реакций. Выявлено, что они обладают способностью снижать
показатель поверхностного натяжения воды до 16-32 мН·м-1, что свидетельствует о возможно-
сти использования биомассы изучаемых культур в качестве сырья для производства биоразлагаемых
поверхностно-активных веществ. Показано, что по поверхностно-активным свойствам пиролизные
липиды исследованных образцов культур микроводорослей в порядке убывания их активности рас-
полагаются в ряд Botryococcus balkhashus > культура Сугур > cпирулина, связанный с составом их
липидных фракций. Приведены сравнительные данные по определению количественных показателей
процесса накопления биомассы cпирулины в различных питательных средах. Показано, что использо-
вание альтернативных ресурсов: источника основного биогенного элемента углерода в питательной
среде (сода-сырец) и геотермальной гидрокарбонатной воды в качестве жидкой основы — приводит
к увеличению выхода производимой биомассы.
Ключевые слова: биомасса; экстракция; липиды; переэтерификация; эфиры жирных кислот; поверх-
ностно-активные свойства
DOI: 10.1134/S0044461819070119
Известно, что биомасса cпирулины очень богата
землях, в соленой воде, а также использовать солнеч-
аминокислотными соединениями (65-70% белко-
ный свет и газ CO2 в качестве питательных веществ
вых соединений), вторым лидирующим компонен-
[2]. Биомасса микроводоросли также содержит глико-
том ее состава являются углеводы (полисахариды),
липиды, фосфолипиды и нейтральные липиды, кроме
в количестве 7-8% находятся липиды, и их можно
того, сахара, стеролы, терпены и жирные кислоты, ко-
производить для создания поверхностно-активных
торые служат основными функциональными компо-
веществ (ПАВ) [1]. ПАВ, получаемые из биомассы
нентами природных ПАВ [3]. В частности, сахариды,
микроводорослей, в основном характеризуются био-
пептиды и аминокислоты могут быть использованы в
разлагаемостью, что является их преимуществом.
качестве исходного материала со значительными ги-
Хотя биоразлагаемые ПАВ традиционно производят-
дрофильными свойствами в производстве биоразла-
ся из масел высших растений, желательно исполь-
гаемых ПАВ. В качестве гидрофобного соединения из
зование альтернативных возобновляемых источни-
липидной составляющей микроводоросли могут вы-
ков, которые не конкурируют с цепочкой поставок
ступать жирные спирты. Поэтому с целью создания
пищевых продуктов, таких как микроводоросли.
сырьевой базы для синтеза новых биоразлагаемых
Микроводоросли обладают высокой продуктивно-
ПАВ были начаты работы по получению биомассы
стью биомассы, высокими скоростями роста, возмож-
cпирулины в условиях Казахстана с использованием
ностью произрастать на маргинальных и бесплодных
различных альтернативных источников биогенных
Оценка применимости биомассы микроводорослей для получения на их основе поверхностно-активных веществ
895
элементов питательной среды и энергии, оценке по-
Экспериментальная часть
верхностно-активных свойств липидной фракции
Получение биомассы микроводорослей. Биомассу
сухой биомассы микроводоросли [4]. Для исследо-
cпирулины получали культивированием в разных
вания использовали биомассу cпирулины, вырабо-
питательных средах, различающихся основой жидкой
танную способом автотрофного ее культивирования
питательной среды, в качестве которой служили ди-
[5]. Поскольку применение дистиллированной воды
стиллированная вода и подземная минеральная вода,
при производстве cпирулины в больших масштабах
имеющая гидрокарбанатную природу, добываемая
является экономически неоправданным, дистилли-
из глубины 1800 м с температурой у устья скважины
рованная вода была заменена на более доступную
75°С, расположенной в п. Шаульдер Отырарского
природную, не содержащую посторонних примесей
района Туркестанской области Казахстана. В каче-
[4]. Учитывая, что стандартная питательная среда
стве минералов питательной среды использовали
для Спирулины имеет щелочную природу, применяли
раствор Заррука: макроэлементы (г·л-1) — NaHCO3,
геотермальную воду подземной скважины № 20а
8.0; KNO3, 2.0; (NH4)2HPO4, 0.12; NaCl, 1.0; карбамид,
(Шауельдерская группа геотермальных вод, располо-
0.02; Na2EDTA, 0.08; а также микроэлементы (г·л-1) —
женная в северо-западной части Арысского артезиан-
Na2EDTA, 0.5; H3BO3, 2.86; MnCl2·4H2O, 1.81;
ского бассейна, на территории райцентра Шаульдер
ZnSO4·7H2O, 0.222; CuSO4·5H2O, 0.079; MoO3,
Отырарского района Туркестанской области, Казах-
0.015; NH4VO3, 0.02296; Co(NO3)2·6H2O, 0.04398;
стан). Изучением химического состава и некоторых
K2Cr2(SO4)4·24H2O, 0.0960; NiSO4·7H2O, 0.04398;
характеристик этой воды показано, что подземная
Na2WO4·2H2O, 0.01794; Ti(SO4)3, 0.040. Время вы-
вода имеет гидрокарбонатную природу и вполне мо-
ращивания микроводоросли составляло 17 дней в
жет быть пригодной для использования в качестве
условиях естественного освещения при температуре
основы питательной среды для культивирования в
окружающего воздуха 20-30°С, среду аэрировали с
промышленных условиях cпирулины.
помощью подачи чистого воздуха или смеси газа СО2
Известно, что природа питательной среды являет-
с воздухом. Биомассу отделяли путем фильтрации су-
ся основным фактором, предопределяющим процесс
спензии. Затем ее промывали пресной водой, сушили
формирования компонентного состава образующей-
и после этого подвергали измельчению. В предлагае-
ся биомассы и в итоге ее поверхностно-активные
мой нами питательной среде товарный NaHCO3 в сре-
свойства, что позволяет целенаправленно проводить
де Заррука был замещен эквивалентным количеством
биосинтез сырья для производства ПАВ. Авторами
раствора природной соды-сырца. Компонентный
работы [6] показана возможность управления поверх-
состав соды-сырца (%): гидрат карбоната натрия
ностно-активными свойствами экстракта биомассы
Na2CO3·7H20, 39.9; трона Na3H(CO3)2(H2O)2, 23.5; тер-
микроводоросли Спирулины: полное исключение
монатрит NA2CO3H2O, 24.4; буркейт Na6(CO3)(SO4)2,
фосфора и повышенное содержание азота в питатель-
12.3%.
ной среде привели к получению экстракта биомассы,
Определение количественных показателей роста
которому соответствует низкий уровень показателя
и накопления биомассы cпирулины в среде Заррука и
поверхностного натяжения (31.2 мН·м-1). Кроме того,
экспериментальной среде на базе гидрокарбонатной
от состава питательной среды зависит выход биомас-
воды и соды-сырца проводили путем измерения оп-
сы микроводоросли [7]. При этом в результате замены
тической плотности питательной среды культур на
части известной среды Заррука на органическую вы-
УФ-спектрометре Perkin Elmer lambda-35 в интервале
тяжку куриного помета (богатого азотом и фосфором)
длин волн 420-650 нм, соответствующих пикам со-
повышена продуктивность и снижена себестоимость
ставляющих биомассу компонентов, по абсолютным
биомассы.
величинам которых судили о характере роста и на-
В настоящей работе приведены результаты иссле-
копления биомассы в суспензии, конечную концен-
дований по оценке поверхностно-активных свойств
трацию биомассы определяли гравиметрическим
выделенных из биомассы микроводорослей казах-
методом после сбора биомассы.
станских озер образцов масла с целью определения
Получение липидной фракции (масло). Экстрак-
их применимости для получения на их основе ПАВ
ция. Навеску исследуемой сухой биомассы микрово-
и варьированию альтернативных ресурсов основных
доросли тщательно растирали с кварцевым песком
биогенных элементов, а именно источника углерода,
(в количестве трехкратного объема по отношению к
в питательной среде для увеличения выхода биомас-
сухой биомассе), затем соединяли с экстрагирующим
сы микроводорослей.
растворителем (метанол:хлороформ = 1:1) в соотно-
896
Кайнарбаева Ж. Н. и др.
шении навеска сухой биомассы:экстрагирующий рас-
непрерывного перемешивания реакционной смеси
творитель = 1:1 (мг:мл) и интенсивно перемешивали.
в течение всего процесса), загружали 3 г метиловых
Полученный экстракт после фильтрования собирали
эфиров жирных кислот липидов cпирулины и 3 мл
в мерную пробирку. Затем из него удалили раствори-
этиленгликоля, затем в реакционную смесь добавляли
тель испарением.
0.12 г катализатора NaOH. Реакцию проводили при
Пиролиз. 15 г исследуемой сухой биомассы микро-
175°С в течение 3 ч. Реакционную смесь промыли
водоросли помещали в трубчатый кварцевый реактор.
последовательно теплой водой, раствором 1%-ной
Пиролиз проводили в токе инертного газа (азота) со
лимонной кислоты, теплой водой. Собрали верхний
скоростью нагрева 5 град·мин-1, пробы отбирали в
эфирный слой, воду от эфирного слоя отделяли цен-
интервале температур 250-300 и 300-450°С. Выход
трифугированием. Выход продукта реакции составил
масла составил 1.3 и 1.8 г соответственно. Состав
81%. Полученные сложные эфиры этиленгликоля и
полученного масла анализировали с помощью га-
жирных кислот cпирулины анализировали методом
зожидкостной хроматографии (ГЖХ) на приборе,
ИК-спектроскопии. ИК-спектр, ν, см-1: 1070, 1090,
снабженном масс-спектрометрическим детектором.
1210 (С-О-С); 1750 (С=О); 2920, 2850 (СН2, СН,
Синтез метиловых эфиров жирных кислот.
СН3); 3300-3450 (О-Н).
В круглодонную колбу емкостью 500 мл помеща-
ИК-спектры записывали в растворе
ли 91 мл (2.25 моль) метилового спирта и 218.75 г
СНСl3:СН3ОН=1:1 на стеклах KBr на ИК-спектро-
экстракционного липида. К реакционной массе до-
метре Nicolet 5700 FTIR производства Thermo
бавляли 14.5 г (5 мас%) твердофазного катализатора
Electron Corporation (США) в области 4000-400 см-1.
KОН/активированный уголь. Реакционную смесь
Компонентные составы полученных липидов опре-
нагревали до температуры 73°C. Скорость нагрева со-
деляли с помощью метода ГЖХ на приборе Agilent
ставляла 1.2-1.3 град·мин-1. Реакционную массу вы-
Technologies 5890N с масс-селективным детектором
держивали при указанной температуре в течение 8 ч.
(подвижная фаза — смесь хлороформ:метанол = 1:1,
Катализатор отфильтровывали и промывали двумя
об%, тип колонки HP-1) по методике [8]. Начальная
порциями метанола по 200 мл и использовали повтор-
температура колонки 40°С, выдержка при начальной
но. Реакционную массу охлаждали до температуры
температуре 1 мин; увеличение температуры от 40 до
30°C и отделяли более тяжелый нижний глицерино-
220°С со скоростью 15 град·мин-1 и от 220 до 320°С
вый слой. Избыток метанола отгоняли и регенериро-
со скоростью 5 град·мин-1. Выдержка при 320°С
вали. Полученные метиловые эфиры жирных кислот
15 мин. Газ — гелий марки ос.ч. «5». Объем пробы
анализировали методами ИК-спектроскопии и ГЖХ.
1 мкл, температура испарителя 280°С. Расшифровку
ИК-спектр cпирулины, ν, см-1: 1080, 1200 (С-О-С);
хроматограмм проводили вручную путем сравнения
1750 (С=О); 2900, 2850 (СН2, СН, СН3); 3330 (О-Н).
масс-спектров исследуемых соединений с библиотеч-
Синтез амидов жирных кислот. В трехгорлую
ными данными NIST05.
колбу, снабженную затвором и электромеханической
Оценку поверхностной активности исследо-
мешалкой (для непрерывного перемешивания реак-
ванных образцов проводили методом пластины
ционной смеси в течение всего процесса), загружали
Вильгельми на тензиометре KRUSS серии K20
7.5 г метиловых эфиров жирных кислот cпирулины
EasyDyne. Измерения поверхностного и межфазного
и 1.65 мл моноэтаноламина, реакционную смесь до-
натяжения проводили в интервале температур 18-
водили до 100°С, при этой температуре добавляли
20°С при использовании термостатируемой рубашки,
0.01 г катализатора NaOH. Затем постепенно подни-
температура которой поддерживается с помощью
мали температуру до 120°С и при этой температуре
циркуляционного термостата. Поверхностное натя-
реакцию проводили в течение 3 ч. Выход продук-
жение водных растворов определяли в интервале их
та аминирования масла cпирулины составлял 92%.
концентраций 0.001-1 мас%.
Полученный амид жирных кислот cпирулины ана-
лизировали методом ИК-спектроскопии. ИК-спектр,
Обсуждение результатов
ν, см-1: 1100 (С-ОН); 1475 (амид 3); 1550 (амид 2);
1650 (амид 1); 2900, 2970 (СН2, СН, СН3); 3375 (О-Н,
Одним из основных критериев экологической
N-H).
безопасности и влияния на организм человека по-
Синтез сложных эфиров жирных кислот и эти-
верхностно-активных веществ является их биораз-
ленгликоля. В трехгорлую колбу, снабженную ло-
лагаемость. Биологическая совместимость с живыми
вушкой Дина-Старка с обратным холодильником
организмами и нетоксичность обеспечивают уси-
и затвором с электромеханической мешалкой (для
ленное их применение в фармацевтике, биомедици-
Оценка применимости биомассы микроводорослей для получения на их основе поверхностно-активных веществ
897
не, косметике и продуктах питания. Таким образом,
культуры из содового озера Сугур в том, что оно в
большой научный интерес вызывают разработки,
основном состоит из трех компонентов. Два из них
направленные на создание нетоксичных и биораз-
представляют собой достаточно длинные углерод-
лагаемых ПАВ, среди которых особо выделяются
ные ненасыщенные цепи, имеющие по две двой-
ПАВ, состоящие из сложных природных молекул
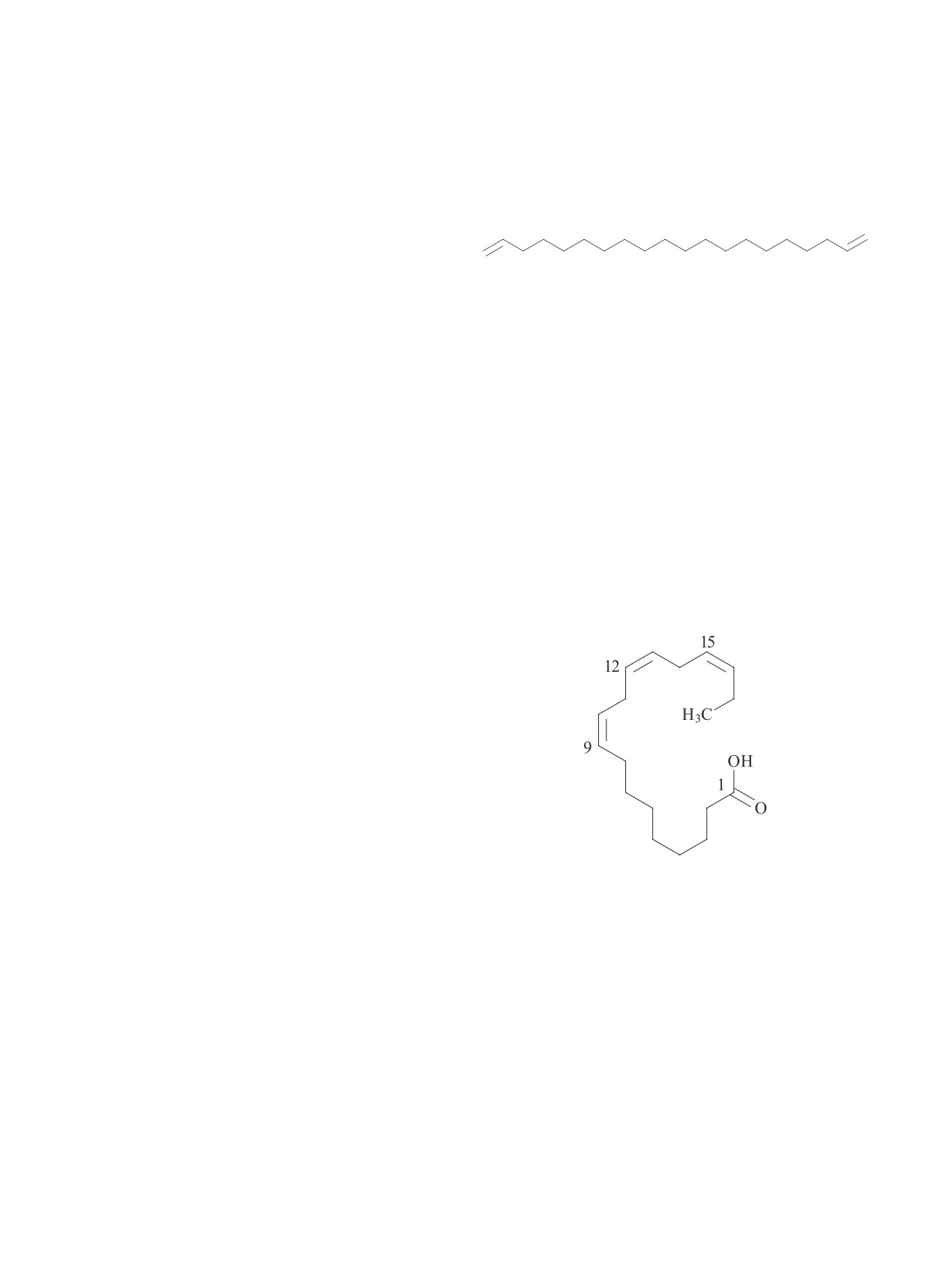
ные связи, причем у 1,19-эйкозадиена (С20:2) —
растительного сырья, обладающие отличными по-
верхностно-активными свойствами. Хотя природ-
обе функциональные связи расположены на концах
ные соединения за счет более высокой стоимости,
углеводородной цепи, что делает это соединение
дефицита исходных компонентов, осложняющих их
особо ценным. Второй ненасыщенной жирной кис-
широкое использование, не могут конкурировать эко-
лотой является линолевая кислота С18:2, имеющая
номически с их синтетическими аналогами, тем не
две двойные связи, приходящиеся на 9-й и 12-й ато-
менее получаемые из растительных масел (рапсового,
мы углерода цепи. В наибольшем количестве (около
оливкового и льняного) ПАВ уже доступны потре-
12%) присутствует ненасыщенная гексадекановая
бителям. Следует отметить, что главной проблемой
или пальмитиновая кислота. Состав продуктов пе-
при производстве ПАВ из растительных масел явля-
реэтерификации метанолом экстракционных липи-
ется наличие конкуренции с пищевой продукцией.
дов биомассы культуры Сугур представлен в табл. 1.
Поэтому использование альтернативных возобновля-
Среди органических кислот, содержащихся в продук-
емых ресурсов, не конкурирующих с производством
тах, 9Z,12Z,15Z-октадекатриеновая (α-линоленовая)
продуктов питания, таких как микроводоросли, яв-
кислота с тремя изолированными двойными связями,
ляется актуальным и практически востребованным.
которая может быть потенциальным источником сы-
Проведена оценка поверхностно-активных
рьевого ресурса биоразлагаемых ПАВ. Это соеди-
свойств метиловых эфиров жирных кислот экстрак-
нение относится к незаменимым жирным кислотам
ционного масла биомассы cпирулины, продуктов его
по классу омега-3-ненасыщенных жирных кислот со
модификации этиленгликолем и моноэтаноламином,
следующей структурой:
а также пиролизных масел дикого штамма культуры
содового озера близ лесхоза Сугур (культура Сугур)
и Botryococcus balkhashus, произрастающей в озере
Балхаш. Определен компонентный состав масел ука-
занных культур микроводорослей казахстанских озер.
Для оценки пригодности исследуемых культур
биомассы микроводорослей в качестве сырья для
получения биоразлагаемых ПАВ были выделены
липидные фракции, которые получены как путем
экстракции органическим растворителем, так и пиро-
лизом сухой биомассы исследованных микроводоро-
слей, а также продукты переэтерификации липидной
фракции метанолом. Исходная биомасса cпирули-
ны выращена с использованием питательной среды
В масле органического материала, образованного
Заррука на базе геотермальной воды гидрокарбонат-
из микроводоросли Ботрикокуса, по данным ГЖХ
ной природы методом автотрофного фотосинтеза в
содержатся углеводороды алканового и алкенового
пилотном фотобиореакторе, представляющем собой
рядов с длиной цепи С9 до С20, 2-декановая кислота
лабораторную опытно-накопительную трубчатую
(2.74%), E-15-гептадеценол (2.24%) и др. (табл. 2).
установку [4]. В аналогичных cпирулине условиях
Как было показано ранее [9], масло Botryococcus
вырастили культуру содового озера Сугур. Образцы
balkhashus также содержит соединения с более длин-
биомассы культуры Botryococcus balkhashus собирали
ными углеводородными цепями от С20 до С48, вы-
из озера Балхаш, на берегу которого со временем эта
явлено присутствие различных типов углеводоро-
культура образует залежи органического материала,
дов: алкенов, три- и тетратерпенов (С40Н64 и С40Н56).
известного под названием Балхашит.
В данном случае липиды состоят из следующих ос-
Как отмечено, компонентный состав липидов
новных функциональных компонентов: алкилглице-
в основном предопределяет их поверхностно ак-
ридов, гликолипидов, фосфолипидов, жирных кис-
тивные свойства, в связи с этим был определен их
лот микроводорослей, бутиловых эфиров жирных
состав. Особенность состава пиролизного масла
кислот, протеинов, полисахаридов, которые играют
898
Кайнарбаева Ж. Н. и др.
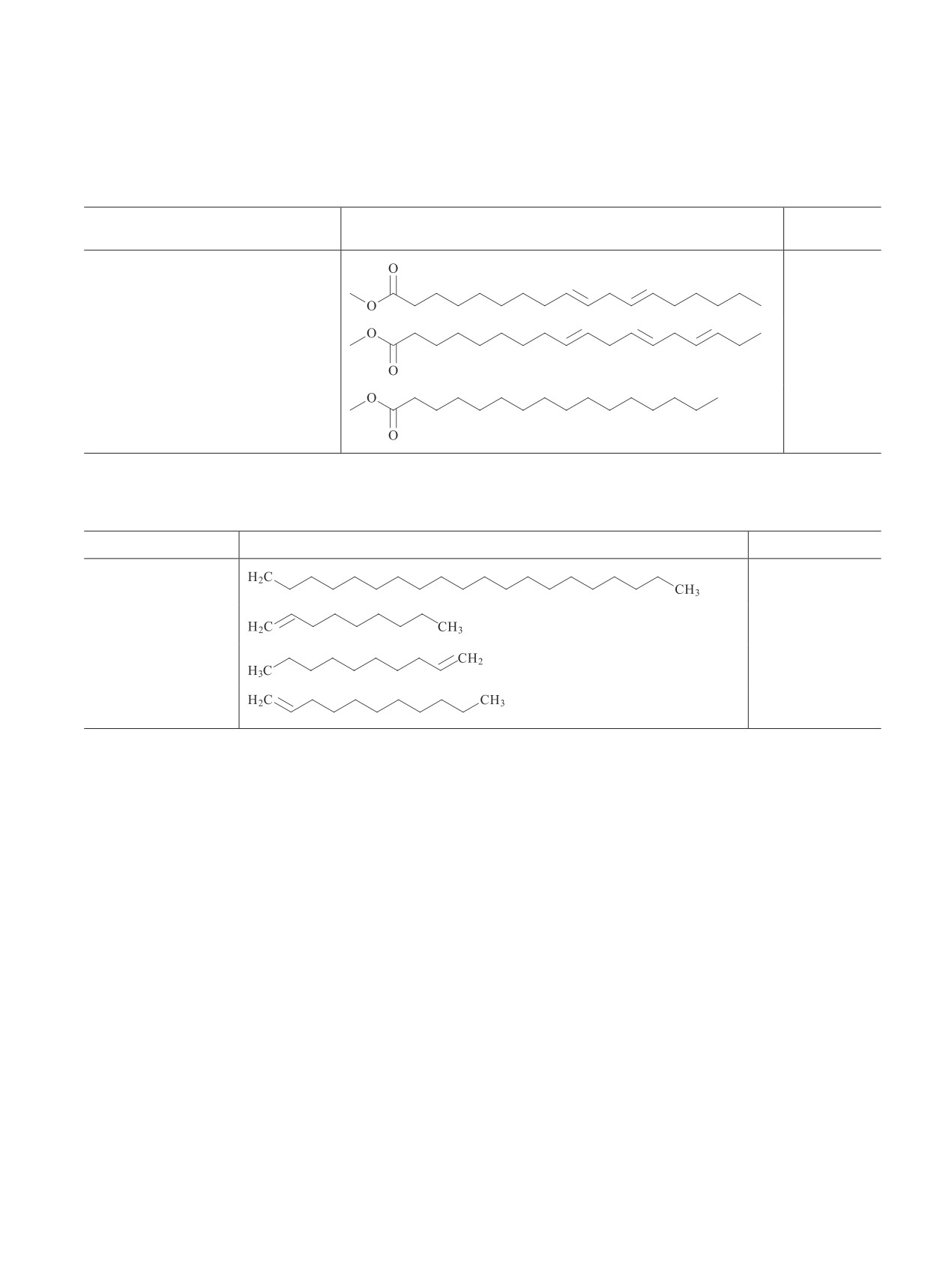
Таблица 1
Результаты хроматомасс-спектрометрического анализа продуктов переэтерификации масла культуры
Сугур
Содержание,
Компонент жирных кислот
Структурная формула
мас%
Октадекадиеновая кислота, метило-
1.01
вый эфир
9,12,15-Октадекатриеновая кислота,
12.05
метиловый эфир
Гексадекановая кислота, метиловый
32.76
эфир
Таблица 2
Некоторые соединения, содержащиеся в пиролизном липиде биомассы Botryococcus balkhashus
Соединение
Структура
Количество, %
Эйкозан, C20H42
6.57
1-Нонен, C9H18
5.18
1-Децен, C10H20
4.92
1-Ундецен, C11H22
4.50
ключевую роль в свойствах поверхностно-активных
моноэтаноламина составляет 1.65 мл (0.027 моль),
веществ.
NaOH (катализатор) 0.2 мас%, температура проведе-
В целях расширения сырьевой базы для получения
ния реакции 100-120°С, продолжительность 3.5 ч;
неионогенных биоразлагаемых ПАВ из биомассы
при использовании этиленгликоля — температура
была проведена оценка возможности синтеза новых
синтеза 175°С, продолжительность 3 ч, на 5 г ме-
функциональных производных жирных кислот ли-
тиловых эфиров жирных кислот оптимальное ко-
пидного экстракта cпирулины, компонентный состав
личество этиленгликоля равно 3 мл (0.054 моль),
которого после переэтерификации метанолом пред-
NaOH — 2 мас%. При этом выходы продуктов ре-
ставлен в табл. 3.
акций составляют 92 и 81% соответственно. Анализ
Взаимодействием метиловых эфиров жирных кис-
ИК-спектров показал, что в результате модификации
лот масла cпирулины с моноэтаноламином и эти-
метиловых эфиров жирных кислот моноэтанолами-
ленгликолем синтезированы амид и сложные эфиры
ном образуется амид (спектральные полосы, харак-
этиленгликоля, проведена оценка их поверхност-
терные для сложноэфирной связи, замещаются по-
но-активных свойств. Их получение осуществляли
лосами, соответствующими амидной связи). В случае
по аналогии с известными методиками синтеза про-
этиленгликоля в ИК-спектре кроме сложноэфирных
изводных жирных кислот растительных масел [10, 11]
полос появляется более широкая полоса в области
с подбором необходимых температурных, концентра-
3300-3450 см-1, характерная для О-Н-связи, что,
ционных и временных параметров для проведенных
по-видимому, связано с присутствием моноэфира
указанных реакций. Найдено, что в случае реакции
этиленгликоля.
аминирования в расчете на 7.5 г масла cпирулины
На последующем этапе работы было проведено
оптимальное количество аминирующего агента — изучение поверхностно-активных свойств описанных
Оценка применимости биомассы микроводорослей для получения на их основе поверхностно-активных веществ
899
Таблица 3
Жирнокислотный состав липидов cпирулины по данным газожидкостной хроматографии
Содержание,
Компонент
Структурная формула
мас%
9-Гексадеценовая кислота, ме-
3.678
тиловый эфир
Гексадекановая кислота, мети-
33.979
ловый эфир
н-Гексадекановая кислота
2.569
Гексадекановая кислота, этило-
6.227
вый эфир
6,9,12-Октадекатриеновая кис-
16.223
лота, метиловый эфир
9,12-Октадекадиеновая кисло-
13.428
та, метиловый эфир
выше масел в зависимости от их концентрации в во-
натяжения воды до 16.8-23.0 мН·м-1. При этом если
де. Как показали результаты исследований (табл. 4),
активность метиловых эфиров экстракта cпирулины
в изучаемых образцах показатель поверхностного
незначительно выше активности пиролизного масла,
натяжения снижается при увеличении концентра-
то для образцов местных микроводорослей наблю-
ции. Ранее проведенными исследованиями [4] по-
дается обратная зависимость. В последнем случае
казано, что выделенные термохимическим путем
повышение активности, по-видимому, обусловлено
пиролизные липиды cпирулины обладают приемле-
более полным в сравнении с экстракцией органи-
мыми поверхностно-активными свойствами, при этом
ческим растворителем выделением компонентов в
лучшими показателями характеризуется масло, полу-
процессе термического пиролиза биомассы. Из ана-
ченное при температурах 300-450°С. Аналогичные
лиза полученных данных (табл. 4) также следует, что
результаты получены на образцах культур Сугур и
по способности снижать показатель поверхностного
Botryococcus balkhashus. Поэтому в настоящей работе
натяжения воды пиролизные липиды исследованных
для определения данных свойств использованы мас-
образцов культур микроводорослей в порядке ее убы-
ла, полученные в указанных температурных режимах.
вания располагаются в следующий ряд: Botryococcus
Установлено, что экстракту биомассы после переэте-
balkhashus > культура Сугур > cпирулина, который
рификации метанолом — метиловым эфирам жирных
прямо согласуется с составом их липидных фрак-
кислот cпирулины соответствуют более низкие значе-
ций. Так, содержание липидов в биомассе культуры
ния показателя поверхностного натяжения по сравне-
Botryococcus balkhashus достигает более 60%, куль-
нию с исходным экстрактом (34.8 мН·м-1 [4]), пиро-
туры содового озера — около 20%, а в Спирулине не
лизные масла местных микроводорослей и продукты
превышает 7-8%. Производные метиловых эфиров
переэтерификации экстракционных липидов культу-
жирных кислот масла cпирулины, модифицирован-
ры Сугур обладают лучшей поверхностной активно-
ные моноэтаноламином и этиленгликолем, обладают
стью, чем cпирулина (табл. 4). Они характеризуются
способностью снижать показатель поверхностного
способностью снижать показатель поверхностного
натяжения воды при концентрации 1 мас% до 29.7 и
900
Кайнарбаева Ж. Н. и др.
Таблица 4
Зависимость поверхностного натяжения воды от концентрации образцов
Поверхностное натяжение, мН·м-1
пиролизные
сложные
Концентрация
метиловые
пиролизные
пиролиз-
метиловые
масла
амиды
эфиры
образца,
эфиры
масла
ные масла
эфиры
биомассы
жирных
этиленгликоля
мас%
жирных
cпирулины,
Балхашита,
жирных кислот
культуры
кислот
и жирных
кислот
Tпир =
Tпир =
культуры
Сугур, Тпир =
cпирулины
кислот
cпирулины*
= 300-450°С*
= 300-450°С
Сугур
= 300-450°С
cпирулины
0.001
63.6
44.1
41.4
37.1
55.2
59.2
45.2
0.01
61.5
43.5
33.9
28.0
42.3
41.4
34.9
0.1
54.1
35.4
32.7
23.0
36.1
30.0
30.0
1
31.0
32.2
16.8
20.0
23.0
29.7
29.4
* Результаты из источника [4], приведенные для сравнения.
29.4 мН·м-1 соответственно (табл. 4). Исходя из этого
микроводорослей, проявляющие хорошие поверх-
они могут быть предложены для разработки на их
ностно-активные свойства и пригодные для произ-
основе неионогенного ПАВ.
водства биоразлагаемых ПАВ, поскольку они полу-
Из вышеизложенного можно заключить, что как
чены из возобновляемого сырья, не вступающего в
биомасса cпирулины, так и биомасса культур мест-
конкурентную борьбу с пищевыми растительными
ных озер, получаемые по предлагаемой методике,
ресурсами.
являются подходящим сырьем для разработки на их
Потенциал применимости биомассы микроводоро-
основе биоразлагаемых ПАВ, поскольку, согласно
слей для использования в качестве сырья для получе-
[12], хорошее ПАВ обладает способностью снижать
ния каких-либо ценных веществ определяется ее эф-
показатель поверхностного натяжения воды от 72.0
фективной продуктивностью, которая обеспечивается
до 35.0 мН·м-1.
оптимизацией процесса культивирования клеток ми-
В результате экспериментальных исследований
кроводорослей [7]. Одним из основных параметров
получены производные жирных кислот липидов данного процесса является питательная среда, поэто-
Таблица 5
Условия культивирования биомассы cпирулины и ее выход
Содержание биомассы,
Основной
Питательная среда
Значение рН среды
г·л-1
биогенный
Тсреды, °С
элемент
жидкая основа
барботирование
начальное
конечное
начальное
конечное
Сода-сырец при-
Дистиллированная
Воздух
0.202
3.99
9.5
10.5
родная
вода
Воздух + СО2
0.202
2.77
9.5
9.2
То же
Воздух
0.241
3.79
9.2
10.4
25.5
Подземная гидро-
Воздух + СО2
0.241
3.65
9.2
9.4
карбонатная
То же
Гидрокарбонат
Дистиллированная
Воздух + СО2
0.208
1.62
8.6
9.1
натрия*
вода
Воздух + СО2
0.208
1.6
8.6
8.8
21.5
Подземная гидро-
карбонатная
* Ранее полученные данные [4].
Оценка применимости биомассы микроводорослей для получения на их основе поверхностно-активных веществ
901
му были проведены работы по изменению ее соста-
показателя поверхностного натяжения воды менее
ва и его влиянию на выход биомассы. Установлено,
35 мН·м-1 (пороговый уровень показателя хороших
что использование природной соды-сырца вместо
поверхностно-активных веществ), поэтому липид-
пищевой соды (NaHCO3) при неизменности всех
ные фракции могут служить основой для получения
остальных биогенных элементов состава Заррука в
биоразлагаемых поверхностно-активных веществ.
питательной среде как на базе дистиллированной
Показана возможность синтеза новых функцио-
воды, так и на базе геотермальной гидрокарбонатной
нальных производных жирных кислот cпирулины,
воды вполне применимо, поскольку такая замена по-
полученных после переэтерификации липидной
ложительно влияет на процессы роста и образования
фракции метанолом, проявляющих допустимые по-
биомассы cпирулины (табл. 5). Ростовые характери-
верхностно-активные свойства. Модифицированные
стики исследованных образцов более чем в 2 раза
моноэтаноламином и этиленгликолем производные
превосходят аналогичные показатели в сравнении
могут быть предложены для разработки на их основе
со случаем, когда основным биогенным элементом
неионогенных ПАВ.
выступает пищевая сода, при этом лучшие результаты
Выявлено, что для получения биомассы культуры
получены при использовании подземной воды.
микроводоросли содового озера Сугур возможно ис-
Таким образом, на примере биомассы cпирулины
пользование питательной среды на базе геотермаль-
показана возможность применения разработанной
ной гидрокарбонатной воды. Для выращивания био-
питательной среды на базе геотермальной гидро-
массы cпирулины предложено товарный NaHCO3 в
карбонатной воды, в которой в качестве основного
стандартной среде Заррука заменить эквивалентным
биогенного элемента взята природная сода-сырец,
количеством раствора природной соды-сырца, значи-
для культивирования биомассы микроводорослей.
тельно повышающего выход биомассы. Питательная
Питательная среда на базе геотермальной гидро-
среда на базе геотермальной гидрокарбонатной воды
карбонатной воды с природной содой-сырцом вме-
с природной содой-сырцом вместо гидрокарбоната
сто гидрокарбоната натрия при неизменности всех
натрия при неизменности всех остальных биогенных
остальных биогенных элементов состава Заррука
элементов состава Заррука может быть рекомендова-
может быть рекомендована к использованию для вы-
на к применению для выращивания биомассы микро-
ращивания биомассы микроводорослей в укрупнен-
водорослей в укрупненных масштабах.
ных масштабах. Для них предполагается применение
пилотного фотобиореактора, расположенного в непо-
Финансирование работы
средственной близости от скважины геотермальной
воды и функционирующего на базе альтернативных
Работа выполнена в Институте химических наук
ресурсов, в качестве которых кроме геотермальной
им. А. Б. Бекутрова по проекту № АР95131077 в рам-
гидрокарбонатной воды — жидкой основы пита-
ках грантового финансирования научных исследова-
тельной среды, природной соды-сырца — основного
ний на 2018-2020 годы, осуществляемого Комитетом
биогенного элемента — выступает тепловая энергия
науки Министерства образования и науки Республики
геотермальной воды для обеспечения температурного
Казахстан.
режима биотехнологического процесса.
Конфликт интересов
Выводы
Авторы заявляют об отсутствии конфликта инте-
Проведена оценка способности снижать показатель
ресов, требующего раскрытия в данной статье.
поверхностного натяжения воды липидными фракция-
ми биомассы трех образцов культур микроводорослей
Информация об авторах
(cпирулина, Botryococcus balkhashus и дикий штамм
культуры содового озера Сугур). Показано, что по
Кайнарбаева Жания Нурбековна, ORCID: https://
способности снижать показатель поверхностного
orcid.org/0000-0002-7500-1097
натяжения воды пиролизные липиды исследованных
Картай Ахметбек Маратулы, ORCID: https://
образцов культур микроводорослей в порядке убы-
orcid.org/0000-0001-5268-2777
вания располагаются в следующий ряд: Botryococcus
Сариева Рахима Баймухаметовна, к.х.н., ORCID:
balkhashus > культура Сугур > cпирулина, который
прямо согласуется с составом их липидных фрак-
Доненов Бейсен Кайнарбаевич, к.х.н., ORCID:
ций. Все полученные образцы обладают значениями
902
Кайнарбаева Ж. Н. и др.
Умерзакова Майра Бердигалиевна, д.х.н., проф.,
[6] Carvalho L. F., Oliveira M. S., Costa A. V. // J. Eng.
Res. Appl. 2014. V. 4. N 6. Р. 90-98.
[7] Горбунова С. Ю., Жондарева Я. Д. // Вестн. СПбГУ.
Сер. 3. 2015. Вып. 1. С. 70- 77.
Список литературы
[8] Mendes R. L., Reis A. D., Palavra A. F. // Food Chem.
[1] Radmann E. M., Morais E. G., Oliveira C. F., Zanfo-
2006. V. 99. N 1. P. 57-63.
nato K., Costa J. A. V.// African J. Microbiol. Res.
[9] Donenov B.K., Imanbekov K., Kainarbayeva Zh.N.,
2015. V. 9. N 47. P. 2283-2289.
Joldassov A.M., Kozybayev A. // Новости науки
[2] Saifullah A. Z. A., Karim Md. A., Ahmad-Yazid A. // Am.
Казахстана. 2015. № 4. С.55-73.
J. Eng. Res. 2014. V. 3. N 3. Р. 330-338.
[10] Карпеева И. Э., Зорина А. В., Шихалиев Х. С. //
[3] Servaes K., Maesen M., Prandi B., Sforza S., Elst K. //
Вестн. ВГУ. Сер. Химия. Биология. Фармация.
J. Agric. Food Chem. 2015. V. 63. N 15. Р. 3931-3941.
2013. № 2. С. 39-41.
[4] Kainarbayeva Zh. N., Kartay A. M., Sarieva R. B.,
[11] Гринева А. А., Зорина А. В., Столповская Н. В.,
Dоnenov B. K., Umerzakova M. B. // Хим. журн.
Фалалеев А. В., Крысин М. Ю. // Вестн. ВГУ.
Казахстана. 2018. № 3. С. 133-144.
Сер. Химия. Биология. Фармация. 2014. № 4.
[5] Zeng X., Danquah M. K., Zhang Sh., Zhang X., Wu M.,
С. 17-21.
Chen X. D., Ng I.-S., Jing K., Lu Y. // Chem. Eng. J.
[12] Mulligan C. N. // Environmental Pollution. 2005.
2012. V. 183. Р. 192-197.
V. 133 (2). P. 183-198.