Журнал прикладной химии. 2019. Т. 92. Вып. 8
КАТАЛИЗ
УДК 547.281+547.42+547.729+547.841+665.9
ПРИМЕНЕНИЕ АЗОТИСТЫХ ОСНОВАНИЙ В КАЧЕСТВЕ ПРОМОТОРОВ
РЕАКЦИИ КАРБОАЛКОКСИЛИРОВАНИЯ ЭТИЛЕНА
НА КОБАЛЬТОВОМ КАТАЛИЗАТОРЕ
© Д. Н. Горбунов, М. В. Ненашева, С. В. Кардашев
Московский государственный университет им. М. В. Ломоносова,
119991, г. Москва, Ленинские горы, д. 1, стр. 3, ГСП-1
E-mail: suskab_91@mail.ru
Поступила в Редакцию 7 ноября 2018 г.
После доработки 9 апреля 2019 г.
Принята к публикации 25 мая 2019 г.
Изучено карбонилирование этилена на кобальтовых катализаторах в присутствии промоторов.
Показано, что ароматические азотистые основания увеличивают стабильность каталитической
системы на основе диоктакарбонила кобальта и позволяют проводить карбонилирование этилена в
среде пропанола-1 в значительно более мягких условиях, чем в отсутствие промотора. Продуктами
карбонилирования этилена в среде пропанола-1 являются пропилпропионат и диэтилкетон. Наиболее
эффективными из изученных промоторов оказались фенантролин и 4-N,N-диметиламинопиридин.
Модификация диоктакарбонила кобальта фенантролином и 4-N,N-диметиламинопиридином способ-
ствует увеличению селективности реакции по диэтилкетону и пропилпропионату соответственно.
Ключевые слова: этилен; пропилпропионат; диэтилкетон; карбоалкоксилирование; 4-N,N-диметил-
аминопиридин; фенантролин; пиридин; карбонил кобальта
DOI: 10.1134/S0044461819080048
Функционализация непредельных соединений
лена, содержащегося в крекинг-газе установок ка-
путем введения в структуру молекулы субстрата
талитического крекинга нефтеперерабатывающих
CO-фрагмента представляет собой эффективный и
заводов [8, 9], и этилена, входящего в состав газовых
экономичный способ углубленной переработки угле-
смесей оксикрекинга предельных низших углево-
водородного сырья. В зависимости от выбора донора
дородов [10-13]. Актуальны вопросы превращения
протона и типа каталитической системы могут быть
исходного сырья в кислородсодержащие соединения
реализованы процессы гидроформилирования [1, 2],
без предварительного выделения и концентрирования
гидроалкоксилирования [3, 4] и карбоалкоксилиро-
этилена, что может повысить экономическую эффек-
вания (Alpha-процесс [5-7]). Указанные процессы
тивность производств. Данная работа направлена на
направлены на получение альдегидов, спиртов, кар-
изучение возможности переработки этилена в ценные
боновых кислот и сложных эфиров и являются осно-
продукты мало- и среднетоннажной химии — про-
вой крупнотоннажных производств. В современной
пилпропионат и диэтилкетон.
нефтехимии большое внимание уделяется вопросам
Процесс карбоалкоксилирования на кобальтовых
рационального использования уже существующих
катализаторах имеет ряд отличий и преимуществ
источников углеводородного сырья. В настоящий
перед альтернативным способом переработки эти-
момент перспективным является использование эти-
лена — гидроформилированием. Во-первых, кар-
985
986
Горбунов Д. Н. и др.
боалкоксилирование протекает в значительно более
для перемешивания с механическим приводом (маг-
мягких условиях (температура — 70-130°С, давле-
нитная муфта) и газозахватной мешалкой, а также
ние монооксида углерода — до 8.0 МПа); во-вторых,
устройством для термостатирования при температу-
возможно получение более широкого круга востре-
рах до 350°С. В автоклав загружали: растворитель —
бованных конечных продуктов, таких как пропил-
н-пропанол (4.0 мл), компоненты каталитической
пропионат и диэтилкетон. К недостаткам относится
системы — Co2(CO)8 (рассчитанное количество)
необходимость проведения процесса при высоких
и азотистое основание (рассчитанное количество).
концентрациях кобальтового катализатора [14, 15].
Автоклав трижды продували монооксидом углерода,
Исследованию кобальтовых каталитических си-
затем заполняли этиленом до заданного давления,
стем в карбоалкоксилировании низших газообразных
затем до заданного давления закачивали монооксид
олефинов посвящено значительное число публика-
углерода. После этого включали перемешивание
ций; осуществления процесса в сравнительно мягких
(1000 об·мин-1) и нагревали автоклав со скоростью
условиях удается достичь при использовании азоти-
3 град·мин-1, с последующим выдерживанием при
стых оснований (BN) в качестве модифицирующих
заданной температуре, вели реакцию при постоянном
добавок и при проведении процессов с относительно
перемешивании до заданного значения времени, фик-
высоким массовым содержанием кобальта в системе
сируя зависимость давления и температуры от вре-
(1-5%) [16-20].
мени реакции. После завершения реакции автоклав
Целью настоящей работы являлось изучение вли-
охлаждали до комнатной температуры и снимали
яния ряда ароматических азотистых оснований на
показания манометра. Затем осуществляли разгерме-
скорость и селективность реакции карбонилирования
тизацию автоклава и отбор пробы. Анализ продуктов
этилена на кобальтовом катализаторе в среде н-про-
проводили методом газожидкостной хроматографии
панола.
(с добавлением к пробам н-гептана — внутреннего
стандарта, 0.6 мл).
Для расчета частоты оборотов (TOF) использова-
Экспериментальная часть
лась следующая формула:
Реагенты н-пропанол, пиридин, 2-метилпиридин,
2,6-дипиколиновая кислота, 4-N,N-диметиламино-
пиридин, фенантролин (Sigma-Aldrich) были исполь-
зованы без предварительной подготовки. Подготовка
Поскольку оценивалось время полупревращения
растворителей выполнена по стандартным методи-
этилена (t*), а отношение R = этилен/Сo было одним
кам. Синтез октакарбонилдикобальта Co2(CO)8 вы-
из варьируемых параметров, формула расчета актив-
полнен по методике [21].
ности была преобразована до следующего вида:
Анализ методом газожидкостной хроматографии
смесей проводили на хроматографе Hewlett-Packard
c пламенно-ионизационным детектором, капилляр-
ной колонкой 30 м, заполненной фазой SE-30, при
программировании температуры от 60 до 230°С,
Обсуждение результатов
газ-носитель — гелий. Анализ жидких продуктов
проводили в присутствии внутреннего стандарта —
В процессе карбоалкоксилирования этилена при
н-гептана.
использовании н-пропанола в качестве реакционной
Реакции проводили в стальном автоклаве Parr
среды основным продуктом, как правило, является
Instrument емкостью 25 мл, снабженном устройством
пропилпропионат (А):
На немодифицированном кобальтовом катализато-
кетона (В) [22, 23]. Из литературных данных извест-
ре при высоких парциальных давлениях этилена (око-
но, что ускорение реакции карбоалкоксилирования
ло 7.0 МПа этилена и 7.0 МПа CO) за счет внедрения
достигается при использовании модифицирующих
второй молекулы непредельного субстрата в катали-
добавок, в основном азотистых оснований [15-20].
тический интермедиат возможно образование диэтил-
В данной работе изучено влияние нижеприведенных
Применение азотистых оснований в качестве промоторов реакции карбоалкоксилирования этилена...
987
промоторов на активность каталитической системы и селективность реакции карбопропоксилирования
этилена по кислородсодержащим продуктам:
Пиридиновый промотор в карбопропоксилиро-
го каталитического комплекса (выпадения осадка).
вании этилена. Было проведено сравнение катали-
Образование нерастворимого остатка, который, по
тической активности систем, содержащих немоди-
всей видимости, представляет собой соединения
фицированный и модифицированный пиридином
Co(II), происходит в случае использования немоди-
диоктакарбонил кобальта. Изучалось влияние соотно-
шения количества катализатора и пиридина на время
полупревращения исходного этилена (50%-ная кон-
версия). Время полупревращения является наиболее
удобным параметром для сравнения каталитических
систем, так как с его помощью каталитическая систе-
ма характеризуется в условиях схожих и достаточно
высоких парциальных давлений этилена и моноок-
сида углерода.
В ходе выполнения экспериментальной работы
установлено, что значительный избыток пириди-
на (мольное соотношение Co/Py = 1:10) повышает
скорость реакции более чем в 4 раза [относительно
скорости реакции на Co2(CO)8], и 50%-ная конверсия
этилена достигается уже при температурах 70-90°С.
Увеличение соотношения этилен/(Co/Py) в 2 раза,
достигаемое за счет двукратного уменьшения количе-
ства используемых Co2(CO)8 и Py, приводит к сниже-
нию скорости реакции относительно эксперимента 1
примерно в 2 раза.
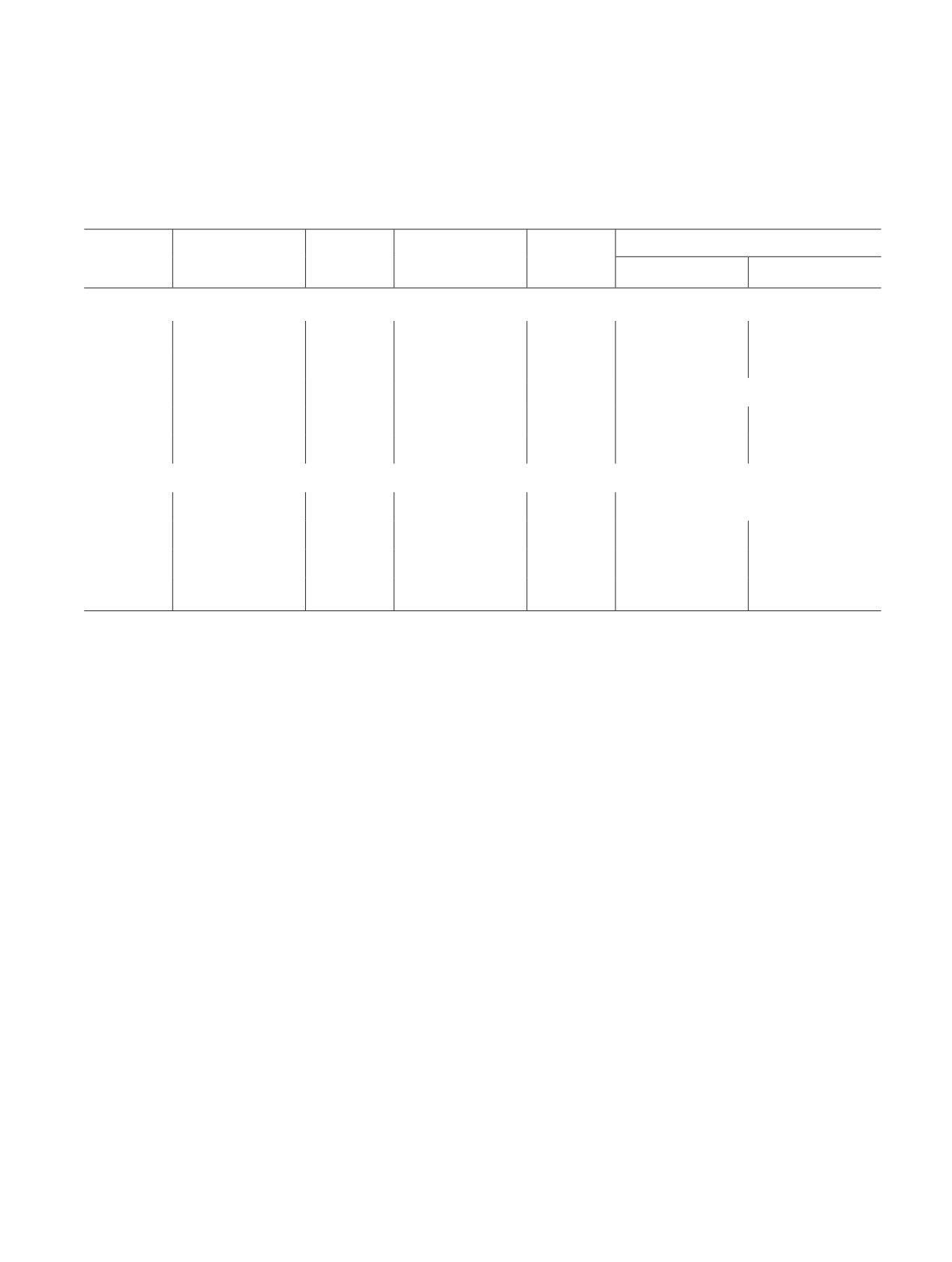
На рис. 1 представлена зависимость давления га-
зообразных компонентов в реакторе от времени про-
ведения реакции при различных условиях.
Добавка пиридина оказывает существенное вли-
Рис. 1. Карбопропоксилирование этилена на немодифи-
цированном и модифицированном пиридином кобальто-
яние на стабильность каталитического комплекса:
вом катализаторе.
при использовании избытка пиридина достигается
Условия экспериментов: н-пропанол — 4.0 мл (53.3 ммоль),
высокая конверсия газов в жидкие продукты, при
P(этилена) — 2.0 МПа, P(СО) — 6.0 МПа, нагрев до 130°С
этом вследствие поглощения монооксида углерода
(~3 град·мин-1), выдерживание при 130°С до достижения
и падения его парциального давления в реакторе не
50%-ной конверсии этилена.
происходит разложения и дезактивации гомогенно-
t1*, t2*, t3* — время полупревращения этилена.
988
Горбунов Д. Н. и др.
Таблица 1
Карбопропоксилирование этилена на немодифицированном и модифицированном пиридином
кобальтовом катализаторе
Условия экспериментов: н-пропанол — 4.0 мл (53.3 ммоль), нагрев до 130°С (~3 град·мин-1)
Время
Селективность, %
Co/Py,
СН2СН2:Со,
w(Co), %
полупревращения
TOF, ч-1
мольн.
мольн.
этилена,* мин
пропилпропионат
диэтилкетон
P(этилена) = 2.0 МПа, Р(СО) = 6.0 МПа
—
21:1
2.1
120
5
78
22
1:0.5
21:1
2.0
—
˂ 1
64
36
1:1
21:1
2.0
—
˂ 1
Не определялась
1:2
42:1
1.0
100
13
93
7
1:10
21:1
1.5
24
18
96
4
P(этилена) = 3.0 МПа, Р(СО) = 5.0 МПа
—
32:1
2.1
—
˂ 1
Не определялась
1:2
64:1
1.0
—
˂ 1
65
35
1:10
32:1
1.5
55
20
95
5
1:10
64:1
0.9
80
20
95
5
* «—» — за время эксперимента (4 ч) не достигнута 50%-ная конверсия этилена.
фицированного карбонила кобальта либо в случа-
давления СО и теряет активность в ходе продолжи-
ях, когда соотношение Co/Py составляло 1:0.5-1:1.
тельного эксперимента. Кроме того, данная каталити-
Дополнительные эксперименты, выполненные при
ческая система оказалась нестабильна в эксперименте
меньших парциальных давлениях СО, подтверждают
с соотношением этилен/СО, равным 3:5.
предположение о положительном влиянии избытка
Влияние добавок 2-MePy, 2,6-DPA, FNT и 4-DMAP.
пиридина на устойчивость каталитического комплек-
Имеющиеся литературные данные, а также сведения
са. Полученные результаты обобщены и представ-
о влиянии пиридина на протекание реакции карбо-
лены в табл. 1. В отсутствие пиридина, а также при
пропроксилирования этилена, полученные в этой
соотношении Co/Py = 1:0.5-1:1 селективность реак-
работе и описанные выше, позволяют сделать вы-
ции по пропилпропионату снижается, и в качестве
вод о том, что использование пиридина в качестве
второго продукта образуется диэтилкетон.
промотирующей добавки положительно влияет на
Каталитические системы, содержащие 100 мг
формирование стабильного каталитического ком-
(0.29 ммоль) диоктакарбонила кобальта и соответ-
плекса, на скорость реакции и ее селективность по
ственно 500 мкл (6.2 ммоль, Co/Py = 1:10) и 100 мкл
пропилпропионату; однако для этого требуется ис-
(1.2 ммоль, Co/Py = 1:2), были испытаны в более
пользование значительного избытка пиридина по
продолжительных экспериментах, направленных на
отношению к кобальту, что может затруднить ис-
достижение максимально полной конверсии этилена.
пользование пиридина в качестве промотирующей
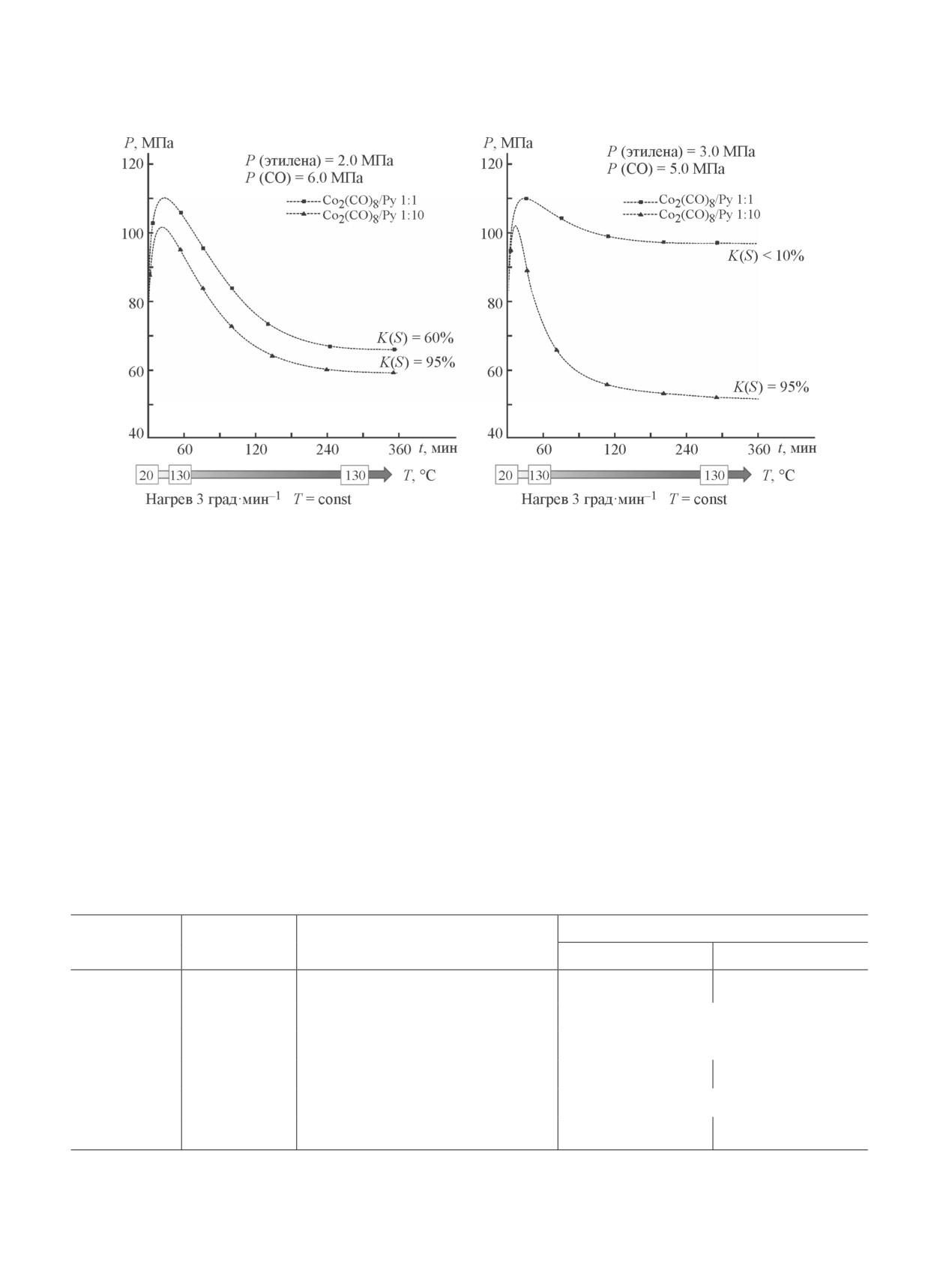
На рис. 2 приведены зависимости давления в системе
добавки при масштабировании синтеза вследствие
от времени для опытов, в которых соотношение га-
токсичности пиридина, а также сложности его отде-
зообразных реагентов (этилен/CO) составляло 1:3 и
ления от продуктов реакции и катализатора. В связи
3:5. Каталитическая система Co/Py (1:10) позволяет
с этим в качестве промотора реакции карбопропокси-
осуществлять превращение этилена до момента прак-
лирования этилена были изучены некоторые другие
тически полного падения его парциального давления
азотистые основания.
в реакторе и существенного снижения парциального
Каталитические эксперименты проводили ана-
давления СО, в то время как система с соотношением
логичным образом, при сохранении параметров ре-
Co/Py = 1:0.5 чувствительна к падению парциального
акции, с варьированием используемого основания
Применение азотистых оснований в качестве промоторов реакции карбоалкоксилирования этилена...
989
Рис. 2. Карбопропоксилирование этилена с использованием системы Сo/Py (разные соотношения).
Условия экспериментов: н-пропанол — 4.0 мл (53.3 ммоль), нагрев до 130°С (~3 град·мин-1), выдерживание при 130ºС
до достижения максимальной конверсии этилена K(S). Конечное давление определено при температуре 130°С.
BN, при соотношении Co:BN, равном 1:1. Результаты
4-N,N-диметиламинопиридином. При этом про-
испытаний и их сравнение с результатами, получен-
мотирующие добавки различным образом влия-
ными при использовании Co2(CO)8 и Co2(CO)8/Py,
ют на селективность реакции: при использовании
представлены в табл. 2.
4-DMAP с высокой селективностью образуется про-
Наибольшую активность проявляют каталити-
пилпропионат, в то время как при использовании
ческие системы, полученные при модификации
FNT может быть достигнута селективность реак-
каталитического прекурсора фенантролином и
ции по диэтилкетону более чем в 30%. Остальные
Таблица 2
Карбопропоксилирование этилена на немодифицированном и модифицированном азотистыми
основаниями кобальтовом катализаторе
Условия экспериментов: н-пропанол — 4.0 мл (53.3 ммоль), нагрев до 130°С (~3 град·мин-1),
P(S*) - 2.0 МПа, P(CO) — 6.0 МПа, Co2(CO)8 — 200 мг (0.58 ммоль), S:Co (мольн.) = 21:1,
Co:BN (мольн.) = 1:1
Селективность, %
Время полупревращения субстрата,*
BN
TOF, ч-1
мин
пропилпропионат
диэтилкетон
—
5
120
78
22
Py
˂1
—
Не определялась
2-MePy
˂1
—
»
»
FNT
5
120
64
36
2,6-DPA
˂1
—
Не определялась
4-DMAP
15
45
5
95
* «—» — за время эксперимента (4 ч) не достигнута 50%-ная конверсия субстрата.
990
Горбунов Д. Н. и др.
Таблица 3
Карбопропоксилирование этилена с использованием системы Сo/BN (BN = 4-DMAP и FNT)
Условия экспериментов: н-пропанол — 4.0 мл (53.3 ммоль), нагрев до 130°С (~3 град·мин-1),
выдерживание при 130°С до достижения 50%-ной конверсии этилена
Селективность, %
Время полупревращения
№ эксперимента
BN
Co/BN
субстрата, мин
пропилпропионат
диэтилкетон
P(этилена) = 2.0 МПа, Р(СО) = 6.0 МПа
1
4-DMAP
1:1
45
96
4
2
4-DMAP
1:2
50
97
3
3
FNT
1:1
120
72
28
4
FNT
1:2
100
70
30
P(этилена) = 3.0 МПа, Р(СО) = 5.0 МПа
5
4-DMAP
1:2
70
97
3
6
FNT
1:2
>240
Не определялась
добавки проявили ингибирующий эффект. В связи
Co:BN = 1:10 и 1:20) приводит к образованию не-
с этим были выполнены дополнительные экспери-
активных комплексов; в случае использования FNT
менты с варьированием параметров для систем Co/
происходит образование нерастворимых в реакци-
FNT и Co/4-DMAP. Установлено, что использова-
онной среде кристаллов кобальтовых комплексов
ние больших количеств промоторов (соотношение
Co/FNT. Для каталитических систем с соотношением
Таблица 4
Сопоставление каталитических систем Co/пиридиновое основание
Условия экспериментов: н-пропанол — 4.0 мл (53.3 ммоль), нагрев до 130°С (~3 град·мин-1),
Co2(CO)8 — 200 мг (0.58 ммоль)
Селективность, %
Пиридиновое
Co/BN
TOF, ч-1
основание
пропилпропионат
диэтилкетон
P(этилена) = 2.0 МПа, Р(СО) = 6.0 МПа
—
—
5
78
22
Py
1:0.5
˂ 1
Не определялась
4-DMAP
1:0.5
15
95
5
4-DMAP
1:1
15
96
4
4-DMAP*
1:1
15
95
5
P(этилена) = 3.0 МПа, Р(СО) = 5.0 МПа
—
—
˂ 1
Не определялась
Py
1:0.5
˂ 1
»
»
4-DMAP**
1:1
15
96
4
* Использовано ½ количества каталитической системы [0.29 ммоль Co2(CO)8].
** Полная конверсия этилена достигается за 110 мин, что свидетельствует о сохранении каталитической активности
системы (TOF=15 ч-1).
Применение азотистых оснований в качестве промоторов реакции карбоалкоксилирования этилена...
991
Co/BN = 1:1 и 1:2 (BN = 4-DMAP, FNT) проведена
стером [Cox(CO)y]-, отличным по составу от аниона
оценка времени 50%-ной конверсии субстрата при
[Co(CO)4]-, либо содержит в своем составе молекулу
различных парциальных давлениях компонентов
основания, что предполагается, например, для случа-
(табл. 3).
ев с использованием дифосфиновых лигандов [22].
Двукратное увеличение используемых 4-DMAP
и FNT по сравнению с экспериментами № 4 и 6
Выводы
(табл. 2) не влияет в случае 4-DMAP на скорость
В реакции карбопроксилирования этилена ката-
реакции при сохранении ее селективности либо при-
литическая система Со/4-DMAP (1:1) обладает ак-
водит к некоторому росту скорости реакций и увели-
тивностью, сравнимой с активностью системы Co/
чению селективности по диэтилкетону для реакции
Py (1:10), что открывает возможность использования
с FNT (36% против 30%, определенной для соотно-
значительно меньшего количества азотистого осно-
шения Со/FNT = 1:1).
вания для стабилизации катализатора и ускорения
Эксперименты с использованием каталитической
реакции селективного синтеза пропилпропионата из
системы Co/4-DMAP (1:0.5-1:1) для карбопропок-
этилена. Использование фенантролина (Co/FNT = 1:2)
силирования этилена с соотношением газообразных
повышает скорость реакции и ее селективность по
компонентов этилен/CO, равным 1:3 и 3:5 (общее
диэтилкетону. Повышение селективности реакции по
давление 8.0 МПа), позволили установить, что ка-
диэтилкетону может свидетельствовать о различном
талитическая система обладает высокой стабильно-
составе активных частиц в случаях использования
стью в широком диапазоне парциальных давлений
фенантролина и 4-N,N-диметиламинопиридина.
СО, что не характерно для систем Co/Py (1:0.5-1:1);
также реакция протекает с высокой селективностью
по пропилпропионату независимо от соотношения
Конфликт интересов
этилен/СО (табл. 4).
Авторы заявляют об отсутствии конфликта инте-
Общепринятая схема образования аниона
ресов, требующего раскрытия в данной статье.
[Co(CO)4]-, который выступает в качестве активной
частицы реакции карбоалкоксилирования, в при-
сутствии пиридиновых оснований (BN) может быть
Информация об авторах
представлена следующим образом [24]:
Горбунов Дмитрий Николаевич, ORCID: https://
3Co2(CO)8 + 12BN -16CO
3[Co(BN)6][Co(CO)4]2
orcid.org/0000-0002-1603-8957
2Co0
Co2+
Co-
Ненашева Мария Владимировна, ORCID: https://
orcid.org/0000-0002-0770-8277
Согласно полученным экспериментальным дан-
Кардашев Сергей Викторович, к.х.н., в.н.с.,
ным по скорости превращения субстрата можно сде-
лать вывод, что в случае использования в качестве
промотирующих добавок пиридина, 2-метилпири-
Список литературы
дина и 4-N,N-диметиламинопиридина образование
активных центров не противоречит представленной
[1] Börner A., Franke R. Hydroformylation: Fundamen-
выше схеме. Ввиду увеличения основности соедине-
tals, Processes, and Applications in Organic Synthesis.
ний в ряду Py≈4-MePy>4-DMAP стабильность катио-
V. 2. John Wiley & Sons, 2016. 702 p.
на [Co(BN)]2+ возрастает, что приводит к увеличению
[2] Frohning C., Kohlpaintner C., Gauß M., Seidel A.,
содержания активных частиц в реакционной среде и
Torrence P., Heymanns P., Höhn A., Beller M.,
Knifton F., Klausener A., Jentsch J., Tafesh A. //
скорости их накопления. Таким образом объясняется
Applied Homogeneous Catalysis with Organometallic
различие в промотирующей активности пиридиновых
Compounds / Eds B. Cornils, W. A. Herrmann. Wiley-
оснований. В случае использования фенантролина,
VCH Verlag GmbH, 2008. P. 31-34.
по всей видимости, характер образования активных
[3] Kudo K., Shibata T., Kashimura T., Mori S., Sugita N.
центров несколько иной. Вероятнее всего, катион
// Chem. Lett. 1987. P. 577-580.
также имеет заряд 2+ и содержит в структуре мо-
[4] Amer I., Alper H. // J. Org. Chem. 1988. V. 53.
лекулы FNT, однако, исходя из экспериментальных
P. 5147-5148.
данных, свидетельствующих об увеличении селек-
[5] Sievers C., Jimenez O., Knapp R., Lin X., Muller T. E.,
тивности реакции по диэтилкетону, можно предполо-
Turler A., Wierczinski B., Lercher J. A. // J. Mol. Catal.
жить, что активная частица представлена либо кла-
A. 2008. V. 279. P. 187-199.
992
Горбунов Д. Н. и др.
[6] Tullo A. H. // Chem. Eng. News. 2009. V. 87. P. 22-23.
цессов с участием окиси углерода. Пермь: ЗАО
[7] Khokarale S.G., García-Suárez E.J., Fehrmann R.,
«Сибур-Химпром», 2004. 229 с.
Riisager A. // ChemCatChem. 2017. V. 9. N 10.
[15]
Liu Y., Wang Y., Lu H., Liang S., Xu B., Fan Y. // Chem.
P. 1824-1829.
Asian J. 2016. V. 11. P. 3159-3164.
[8] Чурилин А. С., Зеленцова Н. И. // Экспозиция Нефть
[16]
Tuba R., Mika L., Bodor A., Pusztai Z., Tóth I.,
Газ. 2013. № 1. P. 49.
Horváth I. // Organometal. 2003. V. 22. P. 1582-
[9] Moser W. R., Wang A. W., Kildahl N. K. // J. Am.
1584.
Chem. Soc. 1988. V. 110. P. 2816-2820.
[17]
Matsuda A., Uchida H. // Bull. Chem. Soc. Jpn. 1965.
[10] Арутюнов В. С., Савченко В. И., Седов И. В.,
V. 38. P. 710-715.
Макарян И. А., Шмелев В. М., Алдошин С. М. //
[18]
Matsuda A. // Bull. Chem. Soc. Jpn. 1973. V.46.
НефтеГазоХимия. 2014. № 4. C. 19-23.
P. 524-530.
[11] Арутюнов В. С., Савченко В. И., Седов И. В.,
[19]
Matsuda A. // Bull. Chem. Soc. Jpn. 1973. V. 51.
Никитин А. В., Магомедов Р. Н., Прошина А. Ю. //
P. 3016-3021.
Успехи химии. 2017. Т. 86. С. 47-74 [Arutyunov V. S.,
[20]
Hofmann P., Kosswig K., Schaefer W. // Ind. Eng.
Savchenko V. I., Sedov, I. V., Nikitin A. V., Magome-
Chem. Prod. Res. Dev. 1980. V. 19. P. 330-334.
dov R. N., Proshina A. Yu. // Russ. Chem. Rev. 2017.
[21]
Wender I., Greenfield H., Orchin M. // J. Am. Chem.
V. 86. P. 47-74].
Soc. 1951. V. 73. N 6. P. 2656-2658.
[12] Wang D. L., Feng X. // Int. J. Hydrogen Energy. 2013.
[22]
Murata K., Matsuda A. // Bull. Chem. Soc. Jpn. 1981.
V. 38. P. 12968-12976.
V. 54. N 7. P. 2089-2092.
[13] Горбунов Д., Теренина М., Кардашева Ю., Макси-
[23]
Имянитов Н. С., Рудковский Д. М., Хохлова М. В.
мов А., Караханов Э. // Нефтехимия. 2017. Т. 57.
// Нефтехимия. 1971. Т. 11. № 1. С. 63-70 [Imyani-
№ 6. С. 759-762 [Gorbunov D., Terenina M., Kar-
tov N., Rudkovskii D., Khokhlova M. // Petrol. Chem.
dasheva Y., Maximov A., Karakhanov E. // Petrol.
U.S.S.R. 1971. V. 11. N 1. P. 17-26].
Chem. 2017. V. 57. N 12. P. 1137-1140].
[24]
Hebrard F., Kalck P. //Chem. Rev. 2009. V. 109.
[14] Рыбаков В., Елькин А., Тюкавин Г., Лурия В., Ря-
P. 4272-4282.
бов В. Технология оксосинтеза и родственных про-