1000
Кипнис М. А. и др.
Журнал прикладной химии. 2019. Т. 92. Вып. 8
УДК 544.47:547.27
Zr- И La-СОДЕРЖАЩИЕ КАТАЛИЗАТОРЫ
В СИНТЕЗЕ МЕТАНОЛА И ДИМЕТИЛОВОГО ЭФИРА
© М. А. Кипнис1, А. П. Косолапова2, И. А. Белостоцкий1,
Э. А. Волнина1, Г. Н. Бондаренко1, И. С. Левин1, А. Б. Пономарев2
1 Институт нефтехимического синтеза им. А. В. Топчиева РАН,
119991, г. Москва, Ленинский пр., д. 29
2 Институт элементоорганических соединений им. А. Н. Несмеянова РАН,
119991, г. Москва, ул. Вавилова, д. 28
E-mail: kipnis@ips.ac.ru
Поступила в Редакцию 27 декабря 2018 г.
После доработки 28 марта 2019 г.
Принята к публикации 24 июня 2019 г.
Синтезированные Zr-оксидные образцы, модифицированные оксидами Al, Si, W, изучены как дегидра-
тирующие компоненты бифункциональных катализаторов получения диметилового эфира. ZrO2,
модифицированный оксидами Al и Si, неактивен в дегидратации метанола, но при введении WO3 его
дегидратирующая активность сопоставима с активностью γ-Al2O3. По данным адсорбции метанола
при 46°С адсорбционнная емкость ZrO2, модифицированного SiО2, сравнима с емкостью γ-Al2O3, а в
случае ZrO2, модифицированного WО3, в 4 раза ниже. Различие в каталитическом и адсорбционном
поведении образцов объясняется данными высокотемпературной ИК-спектроскопии диффузного
отражения in situ. На поверхности ZrО2 наблюдается высокое содержание слабых бренстедовских
кислотных центров, при взаимодействии которых с метанолом происходит метоксилирование по-
верхности катализатора. При нанесении на оксид циркония оксида W на поверхности присутствуют
сильные бренстедовские кислотные центры, участвующие в реакции дегидратации метанола. Соо-
саждением из растворов нитратных солей Cu, Zn, La карбонатом Na с последующими операциями
фильтрации, промывки, термообработки получен катализатор синтеза метанола, близкий по актив-
ности к промышленному катализатору.
Ключевые слова: синтез метанола; диметиловый эфир; дегидратация; диоксид циркония
DOI: 10.1134/S0044461819080061
В связи с растущим интересом к утилизации вы-
перевод в СО по обратной реакции водяного газа
бросов углекислого газа в последнее время активно
с получением синтез-газа, пригодного для синтеза
исследуются каталитические процессы, связанные с
метанола/ДМЭ [4, 5]. Такой синтез-газ, как правило,
превращением СО2 в метанол или диметиловый эфир
содержит смесь оксидов углерода и водород, при-
(ДМЭ) [1, 2].
чем для оптимального выхода метанола при синтезе
В настоящее время принято считать, что синтез
на медьсодержащих катализаторах содержание СО2
метанола на медьсодержащих катализаторах идет
должно быть существенно ниже содержания СО [6].
из СО2 и Н2 [3]. В то же время при прямом синтезе
Катализатор синтеза метанола CuO-ZnO-Al2O3,
метанола на Cu-содержащих катализаторах из СО2 и
разработанный в 60-х годах прошлого века, до на-
Н2 часть СО2 переходит в СО с образованием воды,
стоящего времени является наиболее используемым
что снижает эффективность процесса получения ме-
промышленным катализатором [7]. В этом катализа-
танола.
торе роль активного компонента отводится Cu либо
Поэтому одним из возможных направлений пере-
комбинации Cu с ZnO, тогда как Al2O3 играет роль
работки СО2 является предварительный частичный носителя. Различные аспекты синтеза такого типа
Zr- и La-содержащие катализаторы в синтезе метанола и диметилового эфира
1001
катализаторов по-прежнему находятся в поле зрения
Данные по дегидратирующей активности диок-
исследователей [8, 9]. Активно ведутся поиски новых
сида циркония практически отсутствуют. В [18] при
катализаторов синтеза метанола как в направлении
340°С изучена дегидратирующая активность серии
модификации состава, так и в части технологии син-
смешанных оксидов TiO2-ZrO2, приготовленных со-
теза.
осаждением с последующей прокалкой 550°С, 6 ч.
Метанольные катализаторы, в которых исполь-
Найдено, что активность диоксида циркония (кон-
зован оксид Zr, модифицированный La или други-
версия метанола) почти втрое ниже, чем у диоксида
ми редкоземельными элементами, изучены в [10].
титана.
Катализаторы синтезировали соосаждением из ни-
Диоксид циркония, как можно понять из иссле-
тратных солей карбонатом натрия с последующими
дований, посвященных гидрированию СО2, в деги-
фильтрацией, сушкой, прокалкой осадка. По данным
дратации метанола, по-видимому, неактивен. Так,
каталитических тестов при синтезе метанола гидри-
образование ДМЭ не отмечено в [19-21], где изучен
рованием СО2 введение La повышает выход метано-
синтез метанола гидрированием СО2 на катализа-
ла. Аналогичный вывод следует и из данных [11], где
торах Cu-ZnO/ZrO2 с высоким содержанием ZrO2,
также изучен ряд катализаторов синтеза метанола, в
соответственно (мас%): 43, 42.3, 21.5. Однако прямых
которых вместо оксида алюминия использован оксид
данных по поведению оксидов циркония и лантана в
Zr, модифицированный La или другими редкоземель-
сравнении с оксидом алюминия в синтезе ДМЭ нет.
ными элементами.
В то же время оксид вольфрама, нанесенный на
Влияние содержания оксида лантана (до 10 мас%)
диоксид циркония, активен в дегидратации спиртов
на активность катализатора Cu/ZrO2 рассмотрено в
С3-С4 [22] и метанола [23].
[12]. Тестирование образцов в гидрировании СО2 при
Ранее нами изучен синтез ДМЭ на бифункцио-
220°С, 3 МПа, объемной скорости 3600 ч-1 показало,
нальных катализаторах, метанольным компонентом
что повышение содержания лантана ведет к росту
в которых служил промышленный метанольный ка-
селективности образования метанола.
тализатор Мегамакс 507 [14-16]. Тестирование ката-
Различные способы введения оксидов Zr и La в
лизаторов проводили, варьируя объемную скорость.
метанольный компонент катализатора синтеза ДМЭ
Бифункциональный катализатор синтезировали та-
(соотношение Cu/La/Zr равно 1/0.08/1, дегидратиру-
блетированием механической смеси тонких фракций
ющий компонент — оксид алюминия) рассмотрены
порошков метанольного катализатора и дегидратиру-
в [13]. Но при этом отсутствуют сравнительные дан-
ющего компонента. Этот подход применен и в данной
ные по катализатору с традиционным метанольным
работе для оценки катализаторов, модифицирован-
компонентом.
ных Zr или La. При синтезе ДМЭ в качестве мета-
Таким образом, хотя имеющиеся данные и сви-
нольного компонента использован Мегамакс 507, а
детельствуют о влиянии оксидов Zr, La на селек-
дегидратирующим компонентом служили оксид цир-
тивность синтеза метанола, однако их явно недоста-
кония, модифированный оксидами алюминия, крем-
точно.
ния, вольфрама, и оксид лантана, поведение которых
Известен одноступенчатый (прямой) способ полу-
сопоставлено с поведением гамма-оксида алюминия.
чения ДМЭ из синтез-газа, в котором синтез метанола
Кроме того, проведен синтез и оценка катали-
совмещен с его дегидратацией на бифункциональном
тических характеристик метанольного оксидного
гибридном катализаторе [2]. Для прямой конверсии
катализатора Cu/Zn/La.
синтез-газа в ДМЭ в катализаторе необходимо иметь
Разработка новых катализаторов синтеза метано-
два типа центров: металлические центры, на которых
ла/ДМЭ не только важна для углубления понимания
идет синтез метанола (метанольный компонент), и
реакционного механизма, но и имеет прикладное
кислотные (дегидратирующий компонент), на кото-
значение для повышения эффективности как техно-
рых протекает дегидратация метанола в ДМЭ. При
логии приготовления катализаторов, так и синтеза
этом метанольный и дегидратирующий компоненты
метанола/ДМЭ.
могут быть синтезированы независимо, а бифункцио-
нальный катализатор синтезирован их механическим
Экспериментальная часть
смешением [14-16].
Эффективным катализатором дегидратации мета-
Катализаторы синтеза метанола на основе ок-
нола является гамма-оксид алюминия [17], который
сида La. Синтез La-образцов осуществляли с исполь-
может быть модифицирован рядом оксидов, в част-
зованием разбавленных растворов солей нитратов
ности Si, Zr.
меди, цинка, лантана и карбоната натрия. Величина
1002
Кипнис М. А. и др.
рН общего раствора нитратов после их смешения
ной HNO3, затем 3.5 г соли алюминия, после рас-
составляла 4.47. Карбонат натрия брали с избытком
творения которой постепенно добавляли 50 г соли
относительно стехиометрии осаждения (~1.5), чтобы
циркония. Осаждение проводили концентрирован-
избежать образования нитратсодержащих соедине-
ным раствором аммиака до pH 9 при непрерывном
ний, отрицательно влияющих, как показали допол-
перемешивании при 65°С. Образовавшийся осадок
нительные исследования, на качество катализатора.
выдерживали в покое при температуре 90°С в течение
Осаждение проводили при комнатной температуре
20 ч. Затем осадок отфильтровывали, высушивали
при постоянном перемешивании. Значения рН кон-
при 120°С и прокаливали при 500°С 2 ч. Далее обра-
тролировали рН-метром Аквилон 40.
зец обозначен как Zr-Al.
Поскольку при синтезе метанольных катализато-
Оксид циркония с добавкой вольфрама приго-
ров может использоваться как прямое осаждение из
товлен в две стадии по методике, описанной в [26].
нитратных солей [8, 9], так и обратное [24, 25], нами
На первой стадии проведено осаждение Zr(ОН)4 из
рассмотрены два варианта синтеза.
раствора ZrOCl2·8H2O концентрацией 1.3 моль·л-1
В первом случае к раствору нитратов постепенно
раствором аммиака при pH 9.9 с последующей вы-
добавляли раствор карбоната натрия, во втором —
держкой при 90°С в течение 20 ч, фильтрацией, про-
порядок добавления растворов обратный. В прямом
мывкой, сушкой при 120°С в течение 8 ч. На второй
прикапывании после добавления первых капель рас-
стадии сухой образец пропитывали по влагоемкости
твора карбоната натрия отмечено выпадение осадка.
раствором паравольфрамата аммония с концентраци-
После окончания осаждения величина рН достигла
ей 0.76 моль·л-1 (по WO3). Затем образец сушили при
значения 9.68, после чего перемешивание продолжа-
120°С и прокаливали при 800°С 2 ч. Далее образец
ли еще в течение 1 ч. При обратном прикапывании
обозначен как Zr-W.
после ввода раствора нитратов величина рН достигла
Оксид циркония с добавкой оксида кремния при-
8.25, после чего перемешивание продолжали еще 1 ч.
готовлен в две стадии по методике [27]. Сначала про-
После старения осадка в течение 1 сут осадок промы-
ведено осаждение Zr(ОН)4 из раствора ZrOCl2·8H2O
вали несколько раз дистиллированной водой, сушили
с концентрацией 0.77 моль·л-1 аммиаком в присут-
при 80°С, затем прокаливали при 300°С 6 ч.
ствии цетилтриметиламмония бромида до pH 10 с
Поведение La-модифицированного катализатора
последующей выдержкой при 95°С 48 ч, отмывкой
в синтезе метанола сравнивали с поведением про-
и сушкой. На второй стадии полученный порошок
мышленного метанольного катализатора Мегамакс
смешивали с аэросилом, обработанным ТЭАОН (те-
507 (артикул 26842627815, Clariant AG) по методике,
траэтиламмония гидроксид). Смесь выдерживали при
описанной ниже.
90°С 8 ч, затем отфильтровывали, высушивали при
Синтез бифункциональных катализаторов по-
комнатной температуре, прокаливали при 550°С 6 ч.
лучения ДМЭ. В качестве метанольного компонента
Далее образец обозначен как Zr-Si.
катализатора синтеза ДМЭ использовали, как отме-
Синтез La-содержащего образца. Осаждением
чено выше, промышленный катализатор Мегамакс
нитрата лантана карбонатом натрия с последующими
507. В качестве дегидратирующего компонента —
операциями промывки, осаждения, сушки, прокалки
синтезированные образцы на основе диоксида цирко-
при 500°С получен La-содержащий образец, использо-
ния, оксида лантана и для сравнения промышленный
ванный как дегидратирующий компонент катализато-
гамма-оксид алюминия (ТУ 2163-015-44912618-2003,
ра получения ДМЭ. Далее образец обозначен как LaO.
ЗАО «Промышленные катализаторы», Рязань).
Элементный анализ выполняли на усовершенство-
Синтез Zr-содержащих образцов. Оксид цирко-
ванном волновом рентгенофлуоресцентном спектро-
ния, промотированный небольшим количеством окси-
метре ARL Perform′x.
да алюминия, приготовлен совместным осаждением
Рентгенофазовый анализ (РФА) проводили с ис-
гидроксидов циркония и алюминия из растворов со-
пользованием дифрактометра Rigaku Rotaflex RU-
лей ZrO(NO3)2·9H2O и Al(NO3)3·9H2O.
200, излучение CuKα. Оценку размеров кристаллитов
Концентрацию растворов солей и условия осаж-
Zr-образцов выполняли методом Вильямсона-Холла
дения подбирали с учетом максимальной раствори-
[28], CuO — по формуле Шеррера.
мости ZrO(NO3)2·9H2O, исходя из атомного соотно-
Характеристики пористой структуры оксидов
шения Al/Zr = 0.05. Для предотвращения гидролиза
получены при изучении изотерм низкотемператур-
ZrO(NO3)2·9H2O использовали подкисление раствора
ной адсорбции азота на автоматическом сорбтометре
азотной кислотой. К 300 мл дистиллированной воды,
ASAP2000 (Micromeritics, США) с предварительным
нагретой до 65°С, добавили 8.0 мл концентрирован-
вакуумированием при 350°С до 10-3 Па.
Zr- и La-содержащие катализаторы в синтезе метанола и диметилового эфира
1003
Термопрограммированную десорбцию (ТПД) амми-
при 450°С проводилась в течение 30 мин с регистра-
ака изучали на сорбционном анализаторе УСГА-101
цией спектров через каждые 10 мин.
(Унисит, Россия). Фракцию образца размером 0.2-
Каталитические исследования. Для эксперимен-
0.5 мм прокаливали в токе осушенного гелия при
тов использовали проточную каталитическую уста-
550°С, затем охлаждали до 60°С. Адсорбцию амми-
новку, схема которой представлена в [15]. Реактор
ака проводили в течение 30 мин при 60°C из потока,
выполнен из нержавеющей стали и имел внутренний
содержащего 10 об% аммиака в азоте. Физически
диаметр 12 мм. По оси реактора расположен термо-
сорбированный образцом аммиак отдували в токе осу-
парный канал (внешний диаметр 6 мм), на котором
шенного гелия при 100°С в течение 1 ч. ТПД аммиака
помещался столик с металлической сеткой для раз-
проводили в интервале температур 60-700°С в токе
мещения навески катализатора. Обогрев реактора
осушенного гелия (расход 30 мл·мин-1) со скоростью
проводили с помощью электропечи. Температуру на
нагрева 8 град·мин-1. Адсорбционные и десорбци-
входе и выходе из слоя контролировали двумя тер-
онные измерения выполнены на Химическом фа-
мопарами, размещенными в термопарном канале на
культете МГУ в лаборатории кинетики и катализа.
соответствующих уровнях.
Адсорбцию метанола изучали с использованием
Поток горячего конвертированного газа на выходе
установки, описанной в [29]. Навеску образца (0.4 г)
из реактора набором вентилей разделялся на две ча-
помещали в кварцевый реактор. Температура на вы-
сти. Анализируемый поток направлялся на обогрева-
ходе из слоя образца контролировалась термопарой.
емую линию хроматографа Хроматэк-Кристалл 5000,
При этом на линии входа в реактор устанавливали
а основной поток — на холодильник-сепаратор и
6-ходовой кран, позволяющий подавать азот либо
через регулятор давления «до себя» на сброс. Выход
непосредственно в реактор, либо через сатуратор
из реактора и соответствующие газовые линии, нахо-
метанола, поддерживаемый при 0°С смесью воды со
дящиеся под давлением, поддерживались при темпе-
льдом. Расход газа через реактор поддерживали на
ратуре не ниже 120°С нагревом от дополнительной
уровне 1.2 Нл·ч-1 с помощью регуляторов расхода и
электропечи.
давления и измеряли датчиком расхода ИРГ-100 (ОАО
Хроматографический анализ проводили с исполь-
«Цвет»). Предварительно образец выдерживали в то-
зованием трех независимых линий. На линии ДТП-1 с
ке азота при 260°С 30 мин, затем охлаждали до 46°С.
насадочной колонкой с порапаком Т, газ-носитель —
При 46°С реактор перекрывался, мимо реактора про-
гелий, проводили определение содержания СО2,
пускали смесь азота c парами метанола, контролируя
ДМЭ, воды, метанола; на линии ДТП-2 с насадочной
хроматографически стабильность его подачи. Анализ
колонкой с цеолитом NaX, газ-носитель — гелий, —
содержания метанола проводили с использованием
определение содержания N2, СО; на линии ДТП-3
хроматографа Хром 5 («Лабораторные приборы»,
с насадочной колонкой с цеолитом NaX, газ-носи-
Чехия), оснащенного 1.5 м пустой металлической ко-
тель — аргон, — определение содержания Н2.
лонкой, детектор ПИД. Время выхода пика метанола
Показания датчиков расходов, температур, дав-
не превышало в этом случае 1.5 мин. Далее метанол
ления выводились на дисплей и сохранялись в виде
с помощью соответствующих поворотных вентилей
файла.
запускался в реактор и фиксировалось изменение
Активацию катализатора с целью восстановле-
температуры в слое образца и, по хроматографи-
ния оксида меди проводили в смеси ≈3 об% Н2/N2 с
ческим анализам, поглощение метанола. В оценку
расходом 2 Нл·ч-1, поднимая температуру до 220°С
поглощения вводили соответствующую поправку по
со скоростью примерно 0.5 град·мин-1, контролируя
эксперименту с пустым реактором.
хроматографически поглощение Н2 и выделение Н2О.
ИК-спектроскопию диффузного отражения
Катализатор после активации с целью приработки и
(ИКДО) in situ (высокотемпературная ячейка PIKE
сокращения времени на подготовительные процедуры
Diffus IR, сопряженная с ИК-Фурье-спектрометром
оставлялся на ночь в той же смеси при температуре
VERTEX-70, Bruker) использовали для исследования
260°С, давлении 0.2-0.3 МПа. На следующий день
состояния поверхности образцов. Образец (25 мг)
в реактор подавали синтез-газ до давления 3 МПа и
помещали в цилиндрическую кювету. Спектры по-
проводили соответствующие эксперименты.
верхности регистрировали в непрерывном режиме
Стандартную процедуру оценки активности про-
при температурах: комнатной, 100, 200, 300, 400,
водили на навеске катализатора 0.8 г при 260°С, дав-
450°С — в режиме нагрева и охлаждения в токе сухо-
лении 3 МПа с использованием нескольких значений
го аргона (194 сканирования/спектр) с разрешением
расхода (расход изменяли в пределах 5-25 л·ч-1).
2 см-1 в диапазоне 600-4000 см-1. Прокалка образца
При каждой величине расхода выполняли не менее
1004
Кипнис М. А. и др.
трех хроматографических анализов с интервалом
где свх, свых — концентрации азота на входе и выхо-
30-40 мин, используя средние значения для постро-
де из реактора, V0 — расход газа на входе в реактор
ения зависимостей и расчетов. В конце эксперимен-
(Нл·ч-1).
та, по возможности, повторяли измерения при на-
Конверсию СО (ХCO, %) рассчитывали, используя
чальном расходе, обычно при объемной скорости
значения расхода газа на входе и выходе из реактора,
12 000 л·кг-1 кат·ч-1. Повторные данные, как правило,
по формуле
незначительно отличались в меньшую сторону, что
ХCO = (с0V0 - сCOVвых)·100/с0V0,
(2)
связано, видимо, с приработкой катализатора, и также
представлены на графиках.
где с0, сCO — концентрации СО в исходном и конвер-
Погрешность определения содержания компо-
тированном газе.
нентов не более 5-7 отн%, определения расхода —
1-3 отн%. Баланс по углероду сходился с погрешно-
стью не более 5 отн%. В проведенных экспериментах
Обсуждение результатов
градиент температуры по слою не превышал одного
Элементный состав цирконийоксидных образцов
градуса. Температура в реакторе поддерживалась с
приведен в табл. 1.
погрешностью не более 1°. Давление поддерживалось
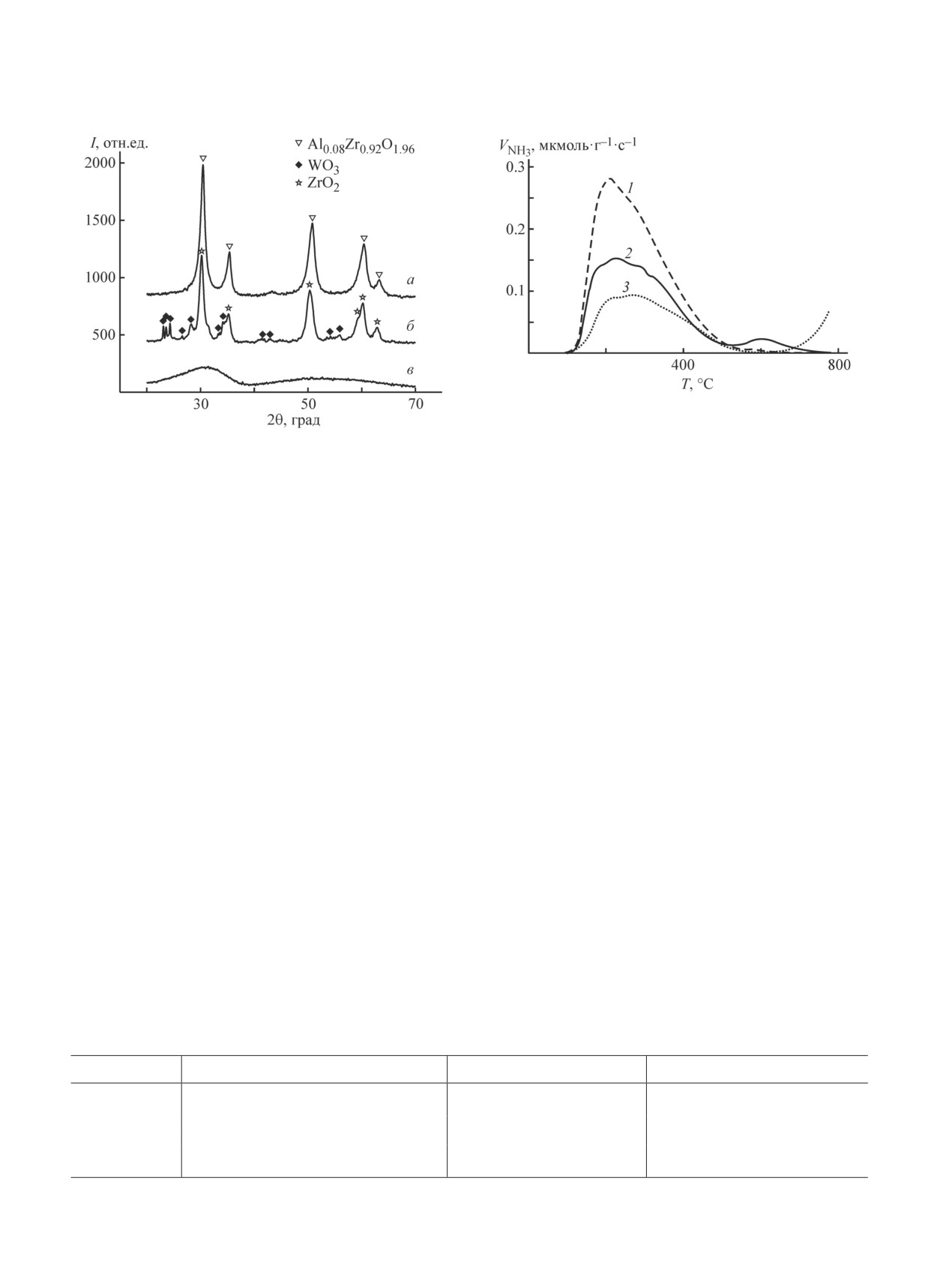
По данным РФА в образце Zr-Al наблюдается
с погрешностью не более 0.02 МПа.
хорошо окристаллизованное соединение состава
Синтез-газ готовили, контролируя давление по
Al0.08Zr0.92O1.96 тетрагональной структуры (файл
показаниям цифрового датчика, поверяемого образ-
JCPDS-ICDD PDF #53-0549) с размером кристалли-
цовым манометром из индивидуальных газов, в бал-
тов 7.5 нм (рис. 1, кривая а). В случае образца Zr-W
лоне, прошедшем предварительное вакуумирование.
(рис. 1, кривая б) помимо пиков тетрагонального
В состав синтез-газа вводили азот, исходя из сохра-
ZrO2 (файл JCPDS-ICDD PDF #79-1767) с размером
нения материального баланса которого на входе и
кристаллитов 10 нм на дифрактограмме в области
выходе из реактора рассчитывали расход конверти-
углов 2θ, равных 23-25, 33-35°, наблюдается ряд
рованного газа на выходе из реактора.
пиков, которые можно отнести к кристаллическому
Образцы бифункциональных катализаторов син-
оксиду вольфрама (файл JCPDS-ICDD PDF #83-0950).
теза ДМЭ готовили смешением порошков (фракция
Введение оксидов алюминия и вольфрама, таким об-
размером менее 0.1 мм) катализатора Мегамакс 507
разом, стабилизировало кристаллическую структуру
и соответствующих оксидов в соотношении (по весу)
диоксида циркония. Образец Zr-Si характеризуется
1/1 с последующим прессованием на ручном прессе
на дифрактограмме двумя широкими гало (рис. 1,
РП-12 (Биолент). Для обеспечения хорошей прес-
кривая в), которые можно отнести к аэросилу (в обла-
суемости образцов вводили в смесь добавку колло-
сти углов 2θ, равных 25-35°) и аморфному диоксиду
идного графита (≈1 мас%). Полученные таблетки
циркония.
толщиной ≈1 мм дробили до фракции 0.4-0.63 мм.
Содержания оксидов меди и цинка в синтезиро-
Бифункциональные катализаторы синтеза ДМЭ в
ванных образцах метанольных катализаторов практи-
зависимости от выбранного дегидратирующего ком-
чески равны содержаниям этих оксидов в метаноль-
понента, смешанного с Мегамакс 507, далее по тексту
ном промышленном катализаторе Мегамакс 507 [15],
обозначены как: МОа — смесь с гамма-Al2O3; МZrW,
выбранном для сравнения. Рентгенофазовый анализ
MZrSi, MZrAl — смеси с образцами модифициро-
ванного оксида Zr; МLaO — смесь с образцом La-
содержащего оксида.
Таблица 1
Образцы метанольных La-катализаторов (для син-
Состав цирконийоксидных образцов
теза метанола) готовили прессованием порошка с по-
следующим дроблением таблеток, как описано выше.
Содержание, мас%, в образце
Оксид
Фракцию катализатора Мегамакс 507 (0.4-0.63 мм)
Zr-Al
Zr-Si
Zr-W
для сравнительных испытаний в синтезе метанола
готовили дроблением исходных гранул.
ZrO2
96.7
86
87.8
Расход конвертированного газа после реактора
Al2O3
1.9
—
—
(Vвых, Нл·ч-1) рассчитывали из материального балан-
са по азоту по формуле
SiO2
—
12.8
—
WO3
—
—
11.5
Vвых = V0свх/свых,
(1)
Zr- и La-содержащие катализаторы в синтезе метанола и диметилового эфира
1005
Рис. 2. Спектры термопрограммированной десорбции
аммиака для промотированных цирконийсодержа-
Рис. 1. Дифрактограммы цирконийсодержащих образ-
щих образцов и оксида алюминия: Zr-Si (1), Al2O3 (2),
цов Zr-Al (а), Zr-W (б), Zr-Si (в).
Zr-W (3).
показал присутствие в прокаленных образцах мел-
фрамсодержащего образца при нагреве выше 600°С
кодисперсных фаз оксидов меди (файл JCPDS-ICDD
связан, на наш взгляд, с частичным деоксилировани-
PDF #48-1548) и цинка (файл JCPDS-ICDD PDF #75-
ем WO3 и поэтому не учитывался при количествен-
0576). Размер кристаллитов оксида меди составил для
ной обработке спектра.
образца, синтезированного прямым прикапыванием,
Рассмотрим поведение в синтезе метанола катали-
3 нм, обратным прикапыванием — 2 нм.
затора с носителем на основе оксида лантана в срав-
Осадок, полученный после осаждения нитрата
нении с промышленным катализатором, в котором в
лантана карбонатом натрия и подвергнутый после-
качестве носителя присутствует оксид алюминия. Как
довательно промывке, сушке, прокалке при 500°С,
указано выше, использовали два варианта синтеза La-
содержал, по данным РФА, фазу кристаллического
катализатора: прямым и обратным прикапыванием.
оксикарбоната лантана — 2La2O3·La2(CO3) (файл
Образец, синтезированный обратным прикапыва-
JCPDS-ICDD PDF #48-1113).
нием, оказался активнее образца, синтезированного
Для образцов Zr-Si, Zr-W, Al2O3 были оценены
прямым прикапыванием, и близок по активности к
характеристики пористой структуры и кислотности
промышленному катализатору (рис. 3). При этом в
по ТПД аммиака (табл. 2).
отличие от [10], где отмечено положительное влияние
Спектры ТПД аммиака (рис. 2) характеризуются
введения лантана в метанольный катализатор, мы та-
широким максимумом десорбции аммиака в обла-
кого эффекта не наблюдали. Оценки показывают, что
сти 100-550°С, располагаясь по интенсивности в
синтезированный лантансодержащий образец по кон-
порядке Zr-Si > Al2O3 > Zr-W. Количество десорби-
версии СО и выходу метанола примерно на 10 отн%
рованного аммиака максимально для образца Zr-Si —
уступает промышленному катализатору.
416 мкмоль·г-1 и минимально для образца с W —
В то же время, учитывая, что на качество ката-
173 мкмоль·г-1. Подъем кривой десорбции для воль- лизатора при фиксированном химическом составе
Таблица 2
Характеристики пористой структуры оксида алюминия и образцов на основе диоксида циркония
Образец
Удельная поверхность, БЭТ, м2·г-1
Средний диаметр пор, нм
Удельный объем пор, см3·г-1
Zr-Si
65.2
9.9
0.21
Zr-W
63.3
10
0.20
Al2O3
160
13.5
0.63
1006
Кипнис М. А. и др.
Рис. 3. Влияние объемной скорости и типа носителя на конверсию СО (а) и содержание метанола (б) в конверти-
рованном газе при синтезе метанола.
1 — Мегамакс 507, 2 — синтезированный обратным прикапыванием метанольный La-содержащий катализатор.
Синтез-газ (об%): СО — 21.9, СО2 — 5.9, N2 - 5.4, Н2 — баланс.
существенно влияют условия синтеза [8, 9, 30], мож-
оксидом алюминия. Поскольку содержание оксида
но считать полученный результат удовлетворитель-
вольфрама в образце МZrW примерно на порядок
ным.
ниже, чем оксида алюминия в образце МОа, можно
Сравнительные данные по активности образцов
говорить о высокой дегидратирующей активности
МОа и МZrW, MZrSi, MZrAl, МLaO в синтезе ДМЭ
WO3 и перспективности использования его в ката-
представлены на рис. 4. Как видно из рис. 4, моди-
лизаторах синтеза ДМЭ. Это согласуется с данными
фикация диоксида циркония оксидом вольфрама
[31], где показано, что введение пропиткой 5 мас%
привела к появлению заметной дегидратирующей
WO3 в гамма-оксид алюминия повышает его деги-
активности, близкой к активности катализатора с
дратирующую активность, и данными [32], где рас-
смотрено поведение гетерополикислоты на основе
оксида вольфрама в дегидратации метанола.
Образцы с диоксидом циркония, модифициро-
ванным оксидами алюминия и кремния, и оксикар-
бонатом лантана, полученным прокалкой при 500°С,
неактивны в дегидратации метанола: наблюдающиеся
содержания ДМЭ невелики (рис. 4) и сравнимы с
содержанием, наблюдаемым в случае использования
в бифункциональном катализаторе такого инертного
в дегидратации материала, как кварц [16].
Для выяснения различий в поведении катализато-
ров с дегидратирующими компонентами Zr-W, Zr-Si
использовали адсорбцию метанола и ИК-спектро-
скопию диффузного отражения in situ.
По количеству адсорбированного метанола об-
разцы расположились в следующем порядке:
Zr-Si > Al2O3 > Zr-W. Соответственно по количеству
Рис. 4. Влияние объемной скорости и типа дегидратиру-
адсорбированного метанола (ммоль·г-1): 1.67, 1.34,
ющего компонента на содержание ДМЭ в конвертиро-
0.41, что коррелирует с данными по ТПД аммиака.
ванном газе при синтезе ДМЭ из синтез-газа.
Адсорбция метанола характеризовалась заметными
Дегидратирующий компонент: 1 — оксид алюминия, 2 —
экзотермическими эффектами (рис. 5). При этом экзо-
Zr-W, 3 — Zr-Al, 4 — Zr-Si, 5 — LaO.
Синтез-газ (об%): СО — 19.1, СО2 — 5.9, N2 — 5.5, Н2 —
термические эффекты для образцов Zr-Si и Al2O3 при-
баланс.
мерно равны и существенно меньше для образца Zr-W.
Zr- и La-содержащие катализаторы в синтезе метанола и диметилового эфира
1007
Рис. 5. Температурные отклики при адсорбции метанола
на промотированных Zr-образцах и оксиде алюминия:
Zr-Si (1), Al2O3 (2), Zr-W (3).
Таким образом, данные по адсорбции метанола и
термодесорбции аммиака не коррелируют с данными
по дегидратирующей активности, свидетельствующи-
ми об инертности образца Zr-Si.
При комнатной температуре в спектре ИКДО об-
разца Zr-Si наблюдается широкая полоса с максиму-
мом 3545 см-1 от ассоциированных на поверхности
молекул воды (рис. 6, а). По мере повышения тем-
пературы эта полоса снижается по интенсивности
Рис. 6. ИК-спектры, зарегистрированные при разных
и смещается в сторону длинных волн, сохраняясь
температурах в токе аргона.
вплоть до 400°С. После прокалки при 200°С на плече
Образец: а — Zr-Si, б — Z-W.
широкой полосы от воды появляется полоса 3725 см-1
Т (°С): 1 — 25, 2 — 100, 3 — 200, 4 — 300, 5 — 400, 6 —
от изолированных связей Zr-ОН (изолированные
450.
силанольные гидроксильные группы имеют полосы
поглощения выше 3800 см-1). С ростом температуры
зей ОН (3732 и 3850 см-1), которые, согласно [33-35],
эта полоса растет по интенсивности и при 450°С
относятся к слабым БКЦ.
становится самой интенсивной полосой в спектре.
Таким образом, анализ ИКДО спектров позволяет
Положение максимума этой полосы — 3725 см-1 —
сделать вывод, что распределение кислотных центров
позволяет относить ее к колебаниям -ОН-связей в
на поверхности прокаленных образцов Zr-Si и Zr-W
составе слабого бренстедовского кислотного центра
существенно различается.
(БКЦ).
На поверхности образца Zr-Si наблюдается вы-
В спектрах образца Zr-W полоса 3545 см-1 от
сокое содержание слабых БКЦ. Сильные кислотные
адсорбированной на поверхности катализатора во-
центры если и существуют, своими ОН-группами
ды, присутствующая при комнатной температуре,
они ассоциированы с молекулами воды, поскольку
практически исчезает уже при 200°С (рис. 6, б). Но
вода с поверхности этого образца не удаляется даже
вместо нее появляются полосы 3553, 3624 см-1, кото-
при 450°С.
рые, согласно литературным данным [33-35], обычно
Иное распределение кислотных центров наблю-
связывают с ОН-группами в составе БКЦ сильной и
дается на поверхности образца Zr-W. Вода с поверх-
средней силы соответственно. Кроме того, появляют-
ности этого образца полностью удаляется при тем-
ся малоинтенсивные полосы от изолированных свя-
пературе 300°С. При этом на поверхности возникают
1008
Кипнис М. А. и др.
сильные БКЦ, которым отвечает полоса 3553 см-1, и
БКЦ, участвующие в реакции дегидратации метанола.
гидроксониевые катионы.
Таким образом, для реализации бифункционального
Соответственно состав кислотных центров на
катализатора синтеза диметилового эфира дегидра-
поверхности образца Zr-Si способствует прочному
тирующий компонент должен иметь сильные БКЦ.
связыванию метанола с поверхностью с образовани-
Соосаждением из растворов нитратных солей Cu,
ем метоксигрупп, тогда как на поверхности образца
Zn, La карбонатом Na обратным прикапыванием с
Zr-W с участием метоксигрупп успешно протека-
последующими операциями фильтрации, промывки,
ет процесс дегидратации метанола до ДМЭ, схема
термообработки приготовлен метанольный катализа-
механизма которого представлена в [23]. С такой
тор, близкий по активности в синтезе метанола к про-
трактовкой разницы в поведении образцов Zr-Si и
мышленному катализатору. Поскольку La-оксидный
Zr-W согласуются и приведенные выше данные по
компонент не проявил дегидратирующую активность
адсорбции метанола.
в бифункциональном катализаторе синтеза диметило-
Следует отметить, что инертность диоксида цир-
вого эфира, метанольный La-содержащий катализатор
кония и оксида лантана относительно дегидратации
может быть рекомендован для синтеза метанола, в
метанола является, однако, достоинством для ме-
котором диметиловый эфир является побочным про-
танольного катализатора, поскольку ДМЭ является
дуктом.
побочным продуктом в синтезе метанола [36].
Благодарности
Выводы
Работа выполнена в рамках государственного за-
Проведен синтез модифицированных Zr-оксидных
дания ИНХС РАН.
образцов (модификация оксидами Al, Si, W), исполь-
зованных как дегидратирующие компоненты бифунк-
Конфликт интересов
циональных катализаторов получения диметилового
эфира (в качестве метанольного компонента взят про-
Авторы заявляют об отсутствии конфликта инте-
мышленный метанольный катализатор). Кроме того,
ресов, требующего раскрытия в данной статье.
осаждением нитрата лантана карбонатом натрия с
последующими операциями промывки, осаждения,
Информация об авторах
сушки, прокалки при 500°С получен оксикарбонат La.
По данным испытаний на проточной каталитиче-
Кипнис Михаил Аронович, к.х.н., ORCID: https://
ской установке (давление 3 МПа, температура 260°С)
orcid.org/0000-0003-4192-8473
установлено, что диоксид циркония, модифицирован-
Косолапова Антонина Павловна, к.т.н., ORCID:
ный оксидами Al и Si, а также оксикарбонат лантана
инертны в дегидратации метанола. Введение в диок-
Белостоцкий Игорь Андреевич, ORCID: https://
сид циркония 11.5 мас% WO3 привело к появлению
orcid.org/0000-0001-7324-8996
дегидратирующей активности, сопоставимой с ак-
Волнина Эльвира Александровна, к.х.н., ORCID:
тивностью оксида алюминия, что свидетельствует о
перспективности использования его в катализаторах
Бондаренко Галина Николаевна, д.х.н., проф.,
синтеза диметилового эфира.
Для выяснения причин различия в поведе-
Левин Иван Сергеевич, к.ф.-м.н., ORCID: https://
нии Zr-образцов использовали данные по адсорб-
orcid.org/0000-0002-0800-575X
ции метанола при 46°С и высокотемпературную
Пономарев Андрей Борисович, к.х.н., ORCID:
ИК-спектроскопию диффузного отражения in situ.
Адсорбционная емкость ZrO2, модифицированного
оксидом Si, сравнима с емкостью оксида алюминия и
снижается в 4 раза при нанесении оксида W. Разница
Список литературы
в каталитическом и адсорбционном поведении об-
[1] Transformation and Utilization of Carbon Dioxide / Eds
разцов объясняется тем, что, по данным ИКДО, на
B. M. Bhanage, M. Arai. Springer, Berlin, Heidelberg,
поверхности оксида Zr присутствуют слабые БКЦ,
2014. 388 р.
при взаимодействии которых с метанолом происходит
[2] Saravanan K., Ham H., Tsubaki N., Bae J. W. // Appl.
метоксилирование поверхности катализатора. При на-
Catal. B: Environmental. 2017. V. 217. Р. 494-522.
личии оксида W на поверхности появляются сильные
[3] Waugh K. C. // Catal. Lett. 2012. V. 142. P. 1153-1166.
Zr- и La-содержащие катализаторы в синтезе метанола и диметилового эфира
1009
[4] Oh-Shim Joo, Kwang-Deog Jung, Il Moon, Rozov-
[21] Angelo L., Girleanu M., Ersen O., Serra C., Parkho-
skii A. Ya., Lin G.I., Sung-Hwan Han, Sung-Jin Uhm
menko K., Roger A.-C. // Catal. Today. 2016. V. 270.
// Ind. Eng. Chem. Res. 1999. V. 38. P. 1808-1812.
Р. 59-67.
[5] Vibhatavata P., Borgard J.-M., Tabarant M., Bian-
[22] Eunpyo Hong, Hye-In Sim, Chae-Ho Shin // Chem.
chi D., Mansilla C. // Int. J. Hydrogen Energy. 2013.
Eng. J. 2016. V. 292. P. 156-162.
V. 38. P. 6397-6405.
[23] Zhou W., Soultanidis N., Xu H., Wong M.S., Neu-
[6] Kunkes E., Behrens M. // Chemical Energy Storage /
rock M., Kiely C.J., Wachs I.E. // ACS Catal. 2017.
Ed. by R. Schlögl. De Gruyter Textbook, 2013. P. 413.
V. 7. P. 2181-2198.
[7] Busca G. Heterogeneous catalytic materials. Solid
[24] Jeong C., Ham H., Bae J. W., Kang D.-C., Shin C.-H.,
state chemistry, surface chemistry and catalytic
Baik J.H., Suh Y.-W. // ChemCatChem. 2017. V. 9.
behavior. Ch. 9. Elsevier B.V., 2014. P. 302.
P. 4484-4489.
[8] Baltes C., Vukojević S., Schüth F. // J. Catal. 2008.
[25] Arena F., Barbera K., Italiano G., Bonura G., Spa-
V. 258. P. 334-344.
daro L., Frusteri F. // J. Catal. 2007. V. 249. P. 185-
[9] Behrens M., Schlögl R. // Z. Anorg. Allgem. Chem.
194.
2013. V. 639. Р. 2683-2695.
[26] Лысенко С. В., Баранова С. В., Сунгуров А. В., Ко-
[10]
Ban H., Li C., Asami K., Fujimoto K. // Catal. Com-
валева Н. Ф., Караханов Э. А. // Нефтехимия. 2005.
mun. 2014. V. 54. P. 50-54.
Т. 45. № 5. С. 331-335 [Lysenko S. V., Baranova S. V.,
[11]
Madej-Lachowska M., Kasprzyk-Mrzyk A., Moroz H.,
Sungurov A. V., Kovaleva N. F., Karakhanov E. A. //
Lachowski A.I., Wyżgoł H. // Chemik. 2014. V. 68.
Petrol. Chem. 2005. V. 45. N 5. P. 305-308].
P. 65-68.
[27] Лысенко С. В., Баранова С. В., Зангелов Т. Н.,
[12]
Xiaoming Guo, Dongsen Mao, Guanzhong Lu, Song
Ковалева Н. Ф., Сунгуров А. В., Караханов Э. А.
Wang, Guisheng Wu // J. Mol. Catal. A: Chemical.
// Нефтехимия. 2005. Т. 45. № 4. С. 290-295
2011. V. 345. P. 60-68.
[Lysenko S. V., Baranova S. V., Zangelov T. N.,
[13]
Zhuo Li, Jianqing Li, Meng Dai, Yongqiang Liu, Dezhi
Kovaleva N. F., Sungurov A. V., Karakhanov E. A. //
Han, Jinhu Wu // Fuel. 2014. V. 121. P. 173-177.
Petrol. Chem. 2005. V. 45. N 4. P. 264-267].
[14]
Кипнис М. А., Самохин П. В., Белостоцкий И. А.,
[28] Dinnebier R. E., Billinge S. J. L. Powder Diffraction:
Туркова Т. В. // Катализ в пром-сти. 2017. Т. 17.
Theory and Practice. RSC Publishing (UK). 2008.
№ 6. С. 442-449 [Kipnis M. A., Samokhin P. V.,
605 p.
Belostotskii I. A., Turkova T. V. // Catal. Ind. 2018.
[29] Кипнис М. А., Самохин П. В., Яшина О. В., Су-
V. 10. N 2. P. 97-104].
хореброва О. А. // ЖФХ. 2013. Т. 87. С. 868-873
[15]
Кипнис М. А., Белостоцкий И. А., Волнина Э. А.,
[Kipnis M. A., Samokhin P. V., Yashina O. V.,
Лин Г. И., Маршев И. И. // Кинетика и ката-
Sukhorebrova O. A. // Russ. J. Phys. Chem. A. 2013.
лиз. 2018. Т. 59. № 6. С. 715-727 [Kipnis M. A.,
V. 87. N 5. P. 851-855].
Belostotskii I. A., Volnina E. A., Lin G. I., Marshev I. I.
[30] Schumann J., Tarasov A., Thomas N., Schlögl R.,
// Kinet. Catal. 2018. V. 59. N 6. P. 754-765].
Behrens M. //Appl. Catal. A: General. 2016. V. 516.
[16]
Кипнис М. A., Белостоцкий И. А., Волнина Э. А., Лин
P. 117-126.
Г. И. // Катализ в пром-сти. 2018. Т. 18. № 5. С. 12-
[31] Said A. E.-A. A., Abd El-Wahab M. M. M., Abd El-
18 [Kipnis M. A., Belostotskii I. A., Volnina E. A.,
Aal M. // Monatsh. Chem. 2016. V. 147. P. 1507-1516.
Lin G. I. // Catal. Ind. 2019. V. 11. N 1. P. 53-58].
[32] Ivanova S., Nitsch X., Romero-Sarria F., Louis B.,
[17]
Bateni H., Able C. // Катализ в пром-сти. 2018. Т. 18.
Centeno M. A., Roger A. C., Odriozola J. A. // Catal.
С. 6-30 [Bateni H., Able C. // Catal. Ind. 2019. V. 11.
Today. 2011. V. 171. P. 236-241.
N 1. P. 7-33].
[33] Jacobs P. A., Leuven K. U. // Catal. Rev. Sci. Eng.
[18]
Vishwanathan V., Hyun-Seog Roh, Jae-Woo Kim, Ki-
1982. V. 24. P. 415-440.
Won Jun // Catal. Lett. 2004. V. 96. Р. 23-28.
[34] Peuker Ch. // J. Mol. Struct. 1995. V. 349. P. 317-320.
[19]
Arena F., Italiano G., Barbera K., Bordiga S., Bo-
[35] Jacobs P.A., Mortier W.J., Uytterhoeven J.B. // J.
nura G., Spadaro L., Frusteri F. // Appl. Catal. A:
Inorg. Nucl. Chem. 1978. V. 40. P. 1919-1923.
General. 2008. V. 350. Р. 16-23.
[36] Караваев М. М., Леонов В. Е., Попов И. Г., Шепе-
[20]
Arena F., Mezzatesta G., Zafarana G., Trunfio G.,
лев Е. Т. Технология синтетического метанола /
Frusteri F., Spadaro L. // Catal. Today. 2013. V. 210.
Под ред. М. М. Караваева. М.: Химия, 1984. С. 97.
Р. 39-46.