Журнал прикладной химии. 2019. Т. 92. Вып. 8
НЕОРГАНИЧЕСКАЯ ХИМИЯ
УДК 546.97/66.046.8
ОСОБЕННОСТИ РАСТВОРЕНИЯ МЕТАЛЛИЧЕСКОГО РОДИЯ
В КИСЛЫХ ОКИСЛИТЕЛЬНЫХ СРЕДАХ В ГИДРОТЕРМАЛЬНЫХ УСЛОВИЯХ
© Н. В. Белоусова1, О. В. Белоусов1,2, Р. В. Борисов1,2*, Н. В. Гризан1,2
1 Сибирский федеральный университет, 660041, г. Красноярск, пр. Свободный, д. 79
2 Институт химии и химической технологии СО РАН — обособленное подразделение
ФИЦ КНЦ СО РАН, 660036, г. Красноярск, Академгородок, 50/24
* E-mail: roma_boris@list.ru; ov_bel@icct.ru
Поступила в Редакцию 1 октября 2018 г.
После доработки 11 июня 2019 г.
Принята к публикации 26 июня 2019 г.
Исследовано растворение металлического родия в растворах хлороводородной кислоты в гидротер-
мальных автоклавных условиях. Изучено влияние различных факторов на глубину перевода родия(0) в
раствор. Установлено, что количественное растворение родия(0) достигается в смеси хлороводород-
ной и бромоводородной кислот в присутствии диоксида марганца при 200°С в автоклавах. Полученные
результаты могут быть использованы как для аналитического определения родия, так и в технологии
переработки родийсодержащего сырья и синтезе комплексных соединений родия.
Ключевые слова: родий; растворение; гидротермальные условия
DOI: 10.1134/S0044461819080073
Хорошо известно, что металлы платиновой груп-
[3, 4]. На аффинажных предприятиях применяют
пы, в особенности родий и иридий, в обычных ус-
методы хлорирования платиновых металлов в различ-
ловиях химически весьма устойчивы к действию
ных модификациях, например, в присутствии галоге-
различных минеральных кислот и щелочей. При этом
нидов щелочных металлов. Для приготовления особо
следует отметить, что смеси кислот способны частич-
чистых растворов платиновых металлов применяют
но растворять благородные металлы в дисперсном
электролитические методы их растворения под дей-
состоянии [1, 2]. Разработка эффективных методов
ствием постоянного или переменного тока в раство-
перевода объектов, содержащих родий, в удобные
рах минеральных кислот [4-6]. Так, специалистами
для дальнейших операций комплексные формы чрез-
АО «Екатеринбургский завод по обработке цветных
вычайно актуальна в химическом анализе, аффи-
металлов» разработана и внедрена эффективная тех-
нажном производстве для получения прекурсоров с
нология получения родиевой хлористоводородной
целью последующего использования, например, при
кислоты, которая предусматривает электрохлориро-
создании различных каталитических систем или в
вание порошка родия в растворе HCl [5, 6].
ювелирной промышленности. Наиболее широко для
На наш взгляд, для растворения металлов пла-
растворения металлического родия используют ме-
тиновой группы перспективно применение гидро-
тоды его сплавления с пероксидными соединениями,
металлургических технологий. Так, показано [7],
пиросульфатами щелочных металлов с дальнейшим
что в открытой системе при 65°С наилучший ре-
растворением сульфатов родия в воде или кислотах
зультат (85.6%) по растворению родия из отрабо-
1010
Особенности растворения металлического родия в кислых окислительных средах в гидротермальных условиях
1011
танных катализаторов достигнут при использовании
ный родий, полученный отжигом в атмосфере аргона
хлороводородной кислоты с добавками пероксида
родиевой черни по методике, описанной в работе
водорода. Однако здесь необходимо учитывать ве-
[15]; аффинированный родий (ГОСТ 12342-2015;
роятность нахождения родия в состоянии, отличном
коммерческий продукт ОАО «Красцветмет»); пла-
от компактного, с чем как раз и может быть связана
стинку родиевую толщиной 0.15 мм (доля родия не
легкость его перевода в раствор. В нашей преды-
менее 99.9 мас%).
дущей работе [8] отмечено, что в мелкодисперсном
Концентрацию родия в растворах определя-
состоянии растворяется даже иридий, но, правда, в
ли атомно-абсорбционным методом (спектрометр
автоклавных условиях, при температурах, близких
AAnalyst-400, Perkin Elmer, США). Размеры частиц и
к 200°С. При этом, несмотря на жесткие окисли-
морфологию определяли методом сканирующей элек-
тельные условия, данный процесс протекает крайне
тронной микроскопии на приборе ТМ-3000 (Hitachi,
медленно.
Япония). Для компактного порошка родия, кото-
Достаточно часто процессы с участием металлов
рый был использован в настоящей работе, согласно
платиновой группы отличаются кинетической затор-
электронно-микроскопическим данным, характерна
моженностью. Повышение температуры является
сферическая форма частиц диаметром 0.9-1.2 мкм.
одним из наиболее распространенных приемов ин-
Усредненный размер частиц аффинированного родия
тенсификации химических реакций, а использование
составляет 100 мкм. Рассчитанная удельная площадь
закрытых реакторов (автоклавов) приводит к суще-
родиевой пластинки (0.001 м2·г-1) примерно в 5 и
ственному улучшению показателей как с экологиче-
500 раз меньше удельной поверхности аффиниро-
ской, так и с экономической точки зрения. В связи с
ванного (0.005 м2·г-1) и компактного (отожженного)
этим интерес к гидрометаллургическим автоклавным
(0.5 м2·г-1) родия соответственно.
процессам чрезвычайно высок; в качестве примера
Эксперименты по растворению родия осуществля-
выделим лишь некоторые работы, посвященные дан-
ли в кварцевых автоклавах объемом от 20 до 30 см3,
ной проблематике [8-11].
конструкция которых описана в работах [8, 10].
Большое влияние на процессы растворения оказы-
В кварцевый автоклав помещали металлический ро-
вает выбор окислительной среды. В работах [12, 13]
дий (в виде порошка или пластинки) в количестве от
показана эффективность автоклавного разложения
10 до 100 мг, загружали окислитель, заливали 10 мл
образцов хлорированием в смесях хлороводородной
кислоты (хлороводородная или смесь хлороводород-
кислоты и перманганата калия. В [14] авторами де-
ной и бромоводородной кислот). Кварцевый реактор
тально исследованы процессы растворения платино-
закрывали фторопластовой крышкой, фиксировали в
вых концентратов и показано, что трехкомпонентная
титановом кожухе [8]. Автоклав нагревали в термо-
реакционная смесь, состоящая из HCl, H2O2 и MnO2,
стате до заданной температуры при постоянном пере-
существенно улучшает показатели вскрытия упорных
мешивании в вертикальной плоскости. Конструкция
концентратов сложного состава.
автоклавов позволяет проводить эксперименты с раз-
Таким образом, определение оптимальных усло-
делением фаз, когда твердые реагенты помещаются в
вий (температура, выбор окислителя, продолжитель-
стаканчик, закрепленный в верхней части автоклава,
ность) количественного растворения металлического
а в кварцевый реактор заливаются жидкие реагенты.
родия в гидротермальных условиях представляет
В данном случае смешение фаз осуществляли путем
практический интерес как для разработки аналити-
включения перемешивания после прогрева системы
ческих методов его определения, так и для совер-
до требуемой температуры.
шенствования процессов выщелачивания родия из
Отметим важную специфическую особенность
промпродуктов аффинажного производства.
используемых реакторов, а именно возможность
Цель настоящего исследования заключалась в
визуального контроля за протекающим процессом.
установлении возможности количественного раство-
В ходе растворения наблюдали изменение окраски
рения металлического родия в автоклавных условиях
раствора от бесцветной (бледно-желтой) до тем-
при повышенных температурах.
но-красной (красно-коричневой). После истечения
заданного времени автоклав доставали, охлаждали.
Осадок отделяли от раствора, многократно промы-
Экспериментальная часть
вали дистиллированной водой до отрицательной ре-
В данной работе использовали: воду дистилли-
акции на хлорид-ион, высушивали до постоянной
рованную; HCl — ос.ч. 20-4; H2O2 (ГОСТ 177-88);
массы и взвешивали. Определяли химический состав
MnO2 — ч.д.а.; HBr — х.ч.; NaClO3 — х.ч.; компакт-
раствора.
1012
Белоусова Н. В. и др.
Обсуждение результатов
Ввод хлора в автоклав можно осуществлять непо-
средственно в молекулярном (газообразном) состоя-
нии, однако удобнее его вводить опосредованно, ког-
да он выделяется в результате химической реакции,
например, при взаимодействии диоксида марганца с
хлороводородной кислотой:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O.
(1)
В солянокислых растворах процесс окисления
металлического родия хлором термодинамически раз-
решен, однако вследствие кинетических затруднений
в области умеренных температур он практически не
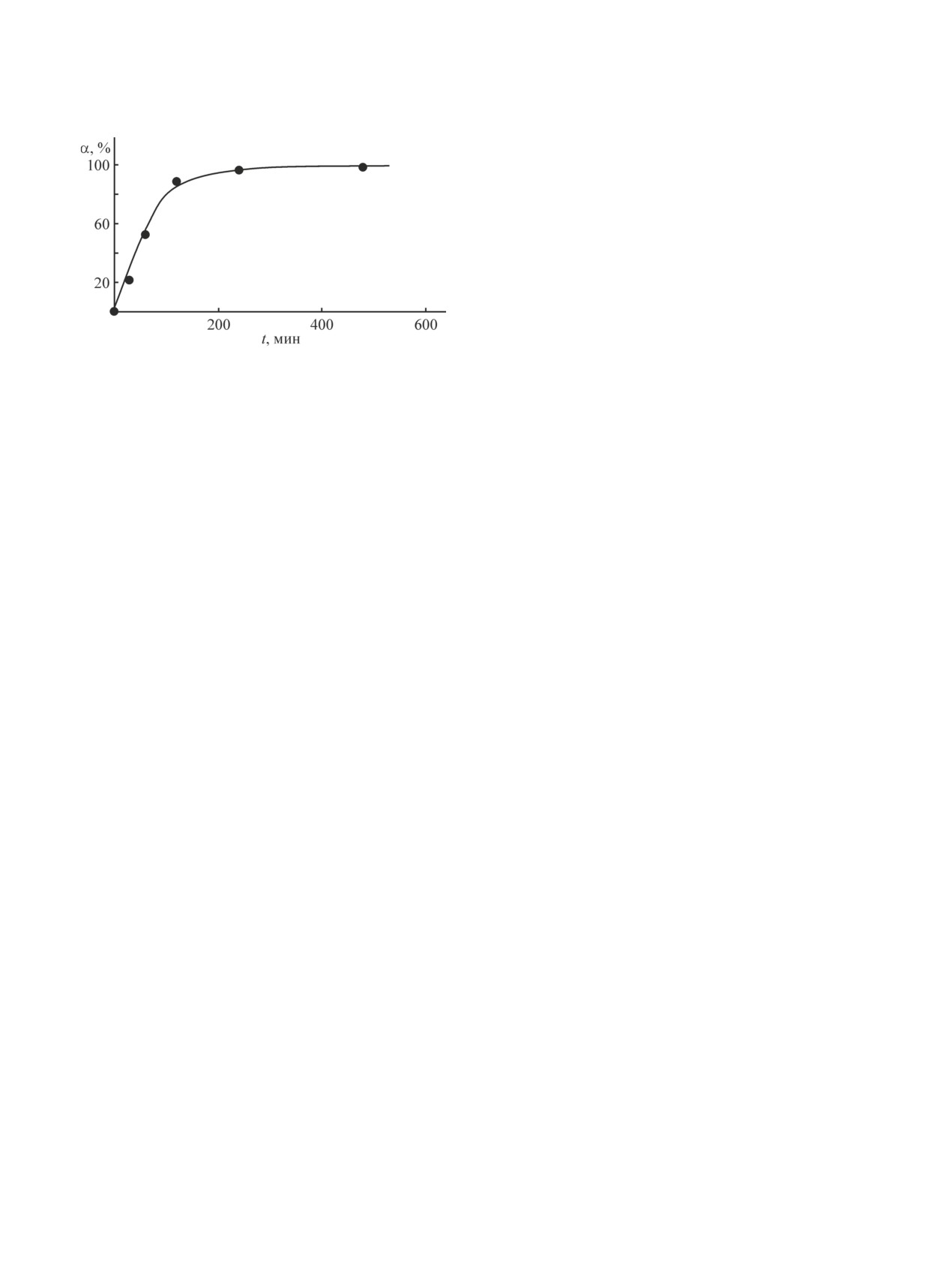
Рис. 1. Зависимость степени вскрытия отожженного
протекает даже в случае родиевой черни. Авторы ра-
Rh-порошка в 6 М HCl + MnO2 от времени при темпе-
боты [14], детально изучая процесс пробоподготовки
ратуре 200°С.
платиновых концентратов, в том числе и содержащих
родий, показали возможность их вскрытия при темпе-
ратуре 180°С. Однако следует отметить, что эти кон-
через 2 ч, а близкие к количественному растворению
центраты обладают большой удельной поверхностью
результаты получены через 4 ч (рис. 1). Растворение
(не менее 10 м2·г-1), существенно более высокой, чем
(близкое к количественному) аффинированного родия
у порошка отожженного родия (0.5 м2·г-1) — самого
при данной температуре происходит за время более
дисперсного из образцов, используемых в настоящей
10 ч.
работе. При этом концентраты являются материалами
В случае с родиевой пластинкой следует ожидать
сложного химического состава (твердые растворы
ухудшения степени растворения. Действительно, при
металлов платиновой группы друг с другом и цвет-
температуре 200°С через 8 ч в раствор перешло всего
ными металлами), обладающими существенными
лишь 4% родия.
неоднородностями как структурного, так и химиче-
В работе [14] авторы показали, что добавление к
ского характера, что в свою очередь может приводить
смеси диоксида марганца и хлороводородной кисло-
к эффектам внутреннего электролиза, благоприятно
ты пероксида водорода (~10% от общего количества
влияющего на показатели растворения.
реакционной смеси) приводит к более эффективно-
Хорошо известно, что скорость растворения зави-
му вскрытию концентратов благородных металлов.
сит от величины площади поверхности твердой фазы.
По мнению авторов, это связано с образованием в
В нашем случае даже для материала с относительно
этом случае в качестве промежуточного продукта
высокой поверхностью (0.5 м2·г-1) при температуре
атомарного хлора, более реакционноспособного, чем
180°С не наблюдали растворения в растворах, содер-
молекулярный хлор. Введение в систему пероксида
жащих хлороводородную кислоту и диоксид мар-
водорода (5 об%) не привело к заметному увеличе-
ганца. Повышение температуры до 190°С приводит
нию степени растворения пластинки.
к заметному вскрытию отожженного порошка родия.
Использование альтернативных диоксиду марган-
Схематично этот процесс можно описать уравнением
ца окислителей может привести к улучшению показа-
телей растворения металлического родия. В качестве
Rh + 1.5Cl2 + 3HCl = H3RhCl6.
(2)
такого окислителя был рассмотрен хлорат натрия,
имеющий в кислых средах более высокий окисли-
В этих условиях растворяется 80-85% отожжен-
тельно-восстановительный потенциал, чем диоксид
ного родиевого порошка в течение 5 ч.
марганца. Процесс вскрытия родия можно предста-
Дальнейшее увеличение температуры до 200°С
вить следующим образом:
превышает достигнутые показатели вскрытия уже
2Rh + NaClO3 + 12HСl = 2H3RhCl6 + NaCl + 3H2O.
(3)
Однако и в этом случае, несмотря на высокое зна-
бряного электрода), повысить степень растворения
чение окислительно-восстановительного потенциала
родиевой пластинки не удалось.
после опыта (+1050 мВ относительно хлоридсере-
Особенности растворения металлического родия в кислых окислительных средах в гидротермальных условиях
1013
окислительно-восстановительного потенциала после
проведения эксперимента на 100 мВ, что составило
+650 мВ относительно хлоридсеребряного электрода.
Кроме того, зафиксировано снижение скорости рас-
творения родиевой пластинки: за 4 ч растворилось
около 90% образца, в то время как при соотношении
9:1 за такое же время растворилось >98%. При этом
количества родия и диоксида марганца оставляли
прежними.
Выводы
Рис. 2. Зависимость степени растворения родиевой пла-
В настоящей работе показана возможность и опре-
от вре-
стинки в смеси 5.4 М НCl + 0.6 М HBr + MnO2
делены параметры (температура, время, влияние до-
мени при температуре 200°С.
бавок окислителей) количественного растворения ме-
таллического родия как в виде компактных порошков,
В работе [16] отмечено, что бромид-ионы ускоря-
так и в виде пластинки в гидротермальных автоклав-
ют растворение благородных металлов в водных рас-
ных условиях. Установлено, что аффинированный
творах. И действительно, ситуация изменяется при
родий и родиевую пластинку можно растворить (бо-
использовании в качестве реакционной среды смеси
лее чем на 98%) в смеси 6 М хлороводородной и бро-
6 М НCl + 6 М HBr в соотношении 9:1 с добавлением
моводородной кислот (9:1) с добавлением диоксида
диоксида марганца в полуторакратном избытке от
марганца при 200°С в течение 2 и 4 ч соответственно.
стехиометрии. Уже через 1 ч при 200°С растворяет-
Отожженная родиевая чернь растворяется при 200°С
ся 60% родиевой пластинки после приведения их в
в растворе 6 М хлороводородной кислоты с добавле-
контакт. При этом значение окислительно-восстано-
нием диоксида марганца в течение 4 ч.
вительного потенциала после опытов относительно
хлоридсеребряного электрода составляет +750 мВ.
Благодарности
Однако следует ожидать, что при термостатировании
в автоклавных условиях при высокой температуре
Работа частично выполнена с использованием
(200°С) реализуются более высокие значения окисли-
оборудования Красноярского регионального цен-
тельно-восстановительного потенциала, чем измеряе-
тра коллективного пользования ФИЦ КНЦ СО РАН.
мые при комнатной температуре. Родиевая пластинка
Выражаем благодарность заведующему лабораторией
эффективно растворяется в смеси хлороводородной
рентгеновских и спектральных методов анализа к.т.н.
и бромоводородной кислот с использованием в каче-
А. М. Жижаеву за проведение инструментальных
стве окислителя диоксида марганца, и через 2 ч около
исследований.
90% родиевой пластинки переходит в жидкую фазу
(рис. 2). В рассматриваемых условиях аффинирован-
Конфликт интересов
ный родий количественно растворяется за 2 ч.
Авторы заявляют об отсутствии конфликта инте-
По сравнению с хлором элементарный бром имеет
ресов, требующего раскрытия в данной статье.
более высокую растворимость в хлороводородной
кислоте, и как следствие реализуется возможность
создания более высокой концентрации галогенидов в
Информация об авторах
реакционной среде [17]. Бромид-ион взаимодействует
Белоусова Наталья Викторовна, зав. кафедрой
с молекулярным хлором по реакции
металлургии цветных металлов СФУ, проф., д.х.н.,
2Br- + Cl2 = Br2 + 2Cl-.
(4)
Белоусов Олег Владиславович, старший научный
Летучесть брома существенно ниже летучести
хлора, что в свою очередь приводит к меньшему дав-
7778-5393
лению насыщенных паров в автоклаве.
Борисов Роман Владимирович, научный сотрудник,
Увеличение содержания HBr в 3 раза за счет из-
менения соотношения хлороводородной и бромово-
Гризан Наталья Васильевна, инженер, ORCID:
дородной кислот привело к уменьшению значения
1014
Белоусова Н. В. и др.
Список литературы
platinum by the leaching of spent catalysts: A review//
Hydrometallurgy. 2013. V. 133. P. 23-32. DOI: https://
[1] Hodgson A. P. J., Jarvis K. E., Grimes R. W., Mars-
doi.org/10.1016/j.hydromet.2012.11.012
den O. J. Development of an iridium dissolution
[10] Белоусов О. В., Белоусова Н. В., Рюмин А. И.,
method for the evaluation of potential radiological
Борисов Р. В. Обогащение платино-палладиево-
device materials // J. Radioanal. Nucl. Chem. 2016.
го концентрата в гидротермальных условиях //
ЖПХ. 2015. Т. 88. № 6. С. 984-987 [Belousov O. V.,
s10967-015-4381-1
Belousova N. V., Ryumin A. I., Borisov R. V. Russ. J.
[2] Park J. C. Purification and recovery of rhodium metal
Appl. Chem. 2015. V. 88. N 6. P. 1078-1081. DOI:
by the formation of intermetallic compounds // Bull.
Korean Chem. Soc. 2008. V. 29. N 9. P. 1787-1789.
[11] Mahmoud M. H. H. Leaching platinum-group metals
in a sulfuric acid/chloride solution// J. Miner. Met.
[3] Saguru C., Ndlovu S., Moropeng D. A review of
Mater. Soc. 2003. V. 55 N 4. P. 37-40. DOI: https://
recent studies into hydrometallurgical methods for
doi.org/10.1007/s11837-003-0086-y
recovering PGMs from used catalytic converters //
[12] Белоусов О. В., Дорохова Л. И., Чмышкова Т. И.,
Hydrometallurgy. 2018. V. 182. P. 44-56. DOI: https://
Жижаев А. М. Автоклавное вскрытие геологиче-
doi.org/10.1016/j.hydromet.2018.10.012
ских проб золотосодержащих руд // Цвет. мет. 2005.
[4] Upadhyay A., Lee J.-C., Kim E., Kim M. S., Kim B. Su.,
№ 3. С. 13-15.
Kumar V. Leaching of platinum group metals (PGMs)
[13] Беляев В. Н., Владимирская И. Н., Колонина Л. Н.,
from spent automotive catalyst using electro-gene-
Ковалев Г. Г., Кузнецов Л. Б., Ширяева О. А.
rated chlorine in HCl solution // J. Chem. Technol.
Вскрытие платиносодержащих материалов хло-
Biotechnol. 2013. V. 88. P. 1991-1999. DOI: https://
рированием в замкнутых системах // ЖАХ. 1985.
doi.org/10.1002/jctb.4057
Т. 40. № 1. С. 135-140.
[5] Воинов В. Н., Коник К. П., Кузас Е. А., Лобко С. В.
[14] Гильберт Э. Н., Шабанова Л. Н., Коваленко Н. Л.,
Показатели технологии электрохлорирования по-
Бухбиндер Г. Н., Солдатенко Г. Г., Кабаева В. А. //
рошка родия // Цвет. мет. 2016. № 9. С. 57-62. DOI:
Унифицированный химико-атомно-эмиссионный
метод определелия благородных и цветных метал-
[6] Лобко С. В., Кузас Е. А., Набойченко С. С., Вои-
лов в промышленных материалах // ЖАХ. 1991.
нов В. Н. Электрохлорирование вторичного сырья,
Т. 46. № 7. С. 1391-1402.
содержащего благородные металлы, с использова-
[15] Борисов Р. В., Белоусов О. В., Иртюго Л. А.
нием объемного токоподвода // Цвет. мет. 2017. № 3.
Термостимулированные превращения высоко-
дисперсных порошков металлов платиновой
[7] Harjanto S., Cao Y., Shibayama A., Shibayama A.,
группы в атмосфере аргона // ЖФХ. 2014. Т. 88.
Naitoh I., Nanami T., Kasahara K., Fujita T. Leaching
of Pt, Pd and Rh from automotive catalyst residue in
S0044453714100082 [Borisov R. V., Belousov O. V.,
various chloride based solutions //Materials Trans-
Irtyugo L. A. // Russ. J. Phys. Chem. A. 2014. V. 88.
org/10.2320/matertrans.47.129
S0036024414100069].
[8] Борисов Р. В., Белоусов О. В., Дорохова Л. И., Жи-
[16] Pesic B., Sergent R. H. Reaction mechanism of
жаев А. М. Особенности растворения высокодис-
gold dissolution with bromine // Metallurgical and
персных порошков иридия в кислых средах. //
Materials Transactions B. 1993. V. 24. N 3. P. 419-
Журн. Сиб. федерал. ун-та. Химия. 2017. Т. 10. № 3.
[17] Lee J., Ilyas S. Gold Metallurgy and the Environment.
0029
2018. Boca Raton: CRC Press. Ch. 6. P. 147. DOI:
[9] Jha M. K., Lee J. C., Kim M. S., Jeong J., Kim B. S.,
Kumar V. Hydrometallurgical recovery/recycling of