Экстракция железа(III) из хлоридных никелевых растворов алифатическими кетонами
1015
Журнал прикладной химии. 2019. Т. 92. Вып. 8
УДК 66.061:546.723
ЭКСТРАКЦИЯ ЖЕЛЕЗА(III) ИЗ ХЛОРИДНЫХ НИКЕЛЕВЫХ РАСТВОРОВ
АЛИФАТИЧЕСКИМИ КЕТОНАМИ
© А. Г. Касиков, А. Ю. Соколов, Е. А. Щелокова, И. В. Глуховская
Институт химии и технологии редких элементов и минерального сырья им. И. В. Тананаева —
обособленное подразделение ФИЦ КНЦ РАН,
184209, г. Апатиты, Академгородок, д. 29а
E-mail: cobaltag@yandex.ru
Поступила в Редакцию 4 февраля 2019 г.
После доработки 22 апреля 2019 г.
Принята к публикации 26 июня 2019 г.
Изучено экстракционное извлечение железа(III) из хлоридных никелевых растворов высокомолеку-
лярными алифатическими кетонами. Установлено, что с повышением концентрации хлорид-иона
в растворе возрастает экстракция Fe(III). Для раствора соляной кислоты максимальная степень
извлечения наблюдается при концентрации HCl ≥6 моль·дм-3 и составляет 99%, для раствора хло-
рида никеля наибольшее извлечение достигается при концентрации Cl- ≥8 моль·дм-3 и составляет
95%. Показана высокая селективность кетонов по отношению к железу(III) — они практически не
экстрагируют такие микропримеси, как Cu2+ и Co2+, а также макрокомпонент Ni2+. Установлено
оптимальное соотношение органической и водной фаз для промывки экстракта от унесенного ни-
келя. Проведены укрупненные лабораторные испытания по глубокому разделению железа и никеля,
в результате которых получен раствор хлорного железа концентрацией Fe(III) 76.8 г·дм-3 с общим
содержанием примесей никеля(II), кобальта(II) и меди(II) <0.022 г·дм-3.
Ключевые слова: алифатические кетоны; экстракция; железо(III); никелевый раствор
DOI: 10.1134/S0044461819080085
Удаление железа из никелевых растворов обычно
дующим получением товарной железосодержащей
проводят путем нейтрализации карбонатом никеля
продукции.
или известью [1, 2] с получением некондиционных
В качестве экстрагентов для извлечения желе-
продуктов. При малой концентрации железа в рас-
за(III) из хлоридных растворов ранее использова-
творе данный способ очистки растворов достаточно
ли различные классы экстрагентов [1, 2, 4-15], но
эффективен. При высоком содержании железа много-
наибольшее распространение на практике получи-
кратно возрастают расходы на нейтрализующие реа-
ли нейтральные экстрагенты [15]. В частности, экс-
генты и увеличивается выход гидратного железистого
тракционное извлечение железа(III) из никелевых
кека, содержащего цветные металлы. Вследствие того
растворов три-н-бутилфосфатом (ТБФ) в настоящее
что железистые кеки являются отвальными продук-
время применяют во Франции [2]. Данный экстрагент
тами, их складирование приводит к потере ценных
является доступным и имеет высокую экстракцион-
металлов и способствует загрязнению окружающей
ную способность по отношению к хлорокомплексам
среды.
железа(III). Однако он не лишен ряда недостатков:
Предотвратить вывоз кеков в отвал и уменьшить
высокая плотность, относительно высокая раство-
потери цветных металлов можно путем организации
римость, способность к гидролизу. Кроме того, ТБФ
их переработки [3, 4]. Однако это не исключает высо-
способен извлекать из растворов кислоты и большое
ких затрат на получение кеков и требует организации
количество элементов, что не позволяет отнести его
дополнительного производства по их переработке.
к селективным экстрагентам.
Альтернативным способом очистки никелевых
В ряде работ для извлечения железа(III) из рас-
растворов от железа является его экстракция с после- творов хлороводородной кислоты использовали вы-
1016
Касиков А. Г. и др.
сокомолекулярные алифатические спирты [16, 17].
отделяли водную фазу от органической и проводи-
Они производятся в больших масштабах и также
ли реэкстракцию дистиллированной водой в тече-
являются доступными и достаточно дешевыми реа-
ние 5 мин при различных соотношениях о:в. После
гентами. Несмотря на то что спирты обладают менее
расслоения фаз отделяли водную фазу от органи-
высокой экстракционной способностью, чем ТБФ, и
ческой.
также экстрагируют кислоты, они превосходят его по
Концентрацию железа(III), никеля(II), а также
селективности при извлечении железа из многоком-
примесных металлов определяли методом атомно-
понентных растворов [17].
абсорбционной спектрометрии на приборе AAnalyst
Помимо ТБФ и спиртов высокую экстракционную
400 (США), концентрацию кислоты в растворе — ти-
способность к железу(III) проявляют и алифатиче-
триметрически с использованием смешанного инди-
ские кетоны. Наиболее полно изучен процесс экс-
катора метиленового голубого и метилового красного.
тракции Fe(III) метилизобутилкетоном (МИБК) [14].
Концентрацию металла и кислоты в органической
Однако его применение в гидрометаллургических
фазе рассчитывали по разности между его содержа-
процессах крайне ограничено в связи с низкой тем-
нием в водной фазе до и после экстракции.
пературой вспышки (17°C) и значительной раство-
римостью (19 г·дм-3). Для экстракции железа(III) из
Обсуждение результатов
растворов хлороводородной кислоты также исполь-
зовали ацетофенон [14] и октанон-2. Алифатические
В ходе работы исследована экстракция железа(III)
кетоны для извлечения железа из растворов никеле-
октаноном-2 из хлоридного никелевого раствора при
вого производства ранее не были опробованы.
постоянной концентрации железа в зависимости от
Цель настоящей работы состояла в изучении экс-
концентрации никеля в интервале сNi = 59-235 г·дм-3
тракции железа(III) из хлоридных никелевых раство-
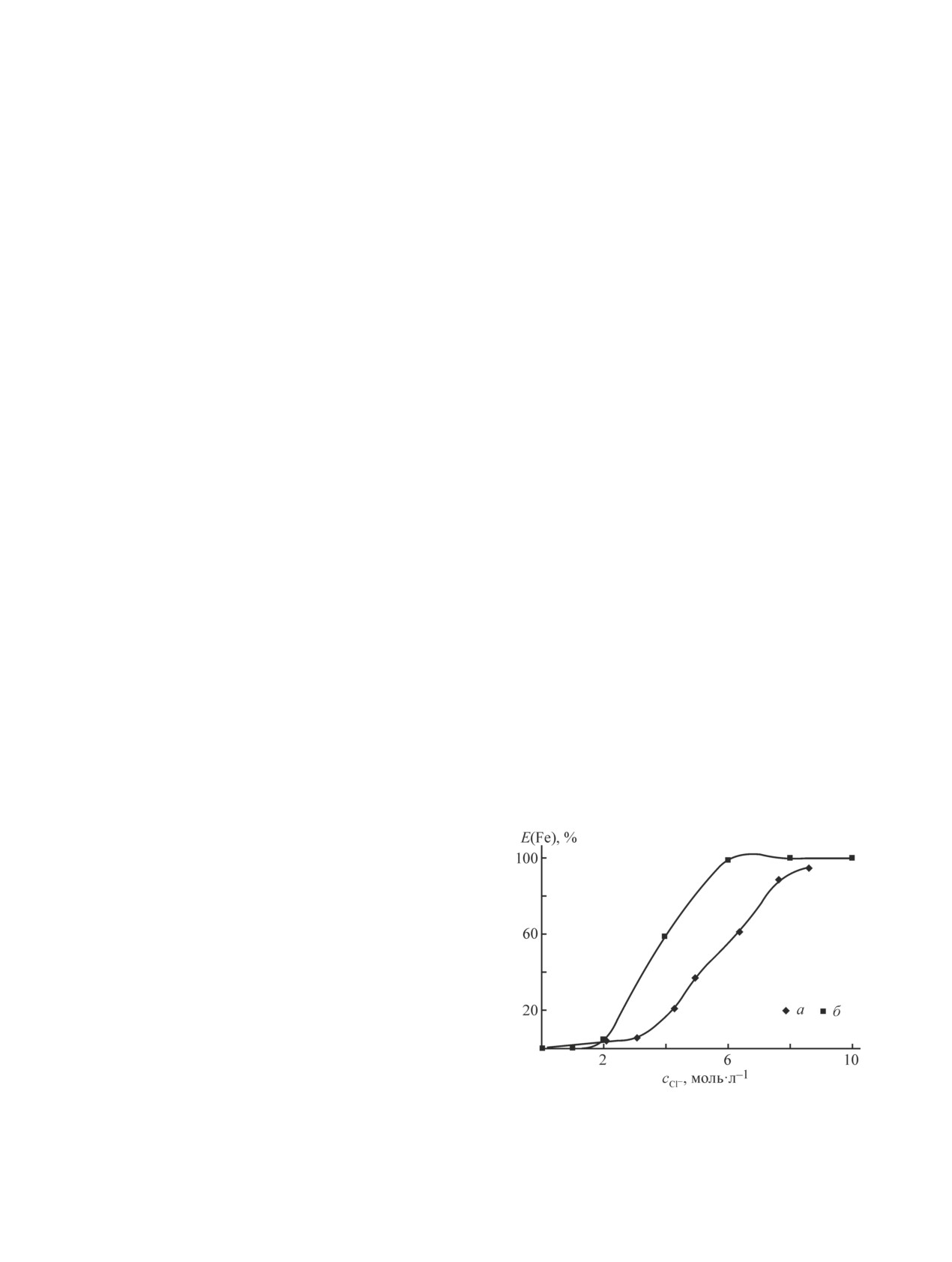
(рис. 1). Железо(III) из хлоридных никелевых рас-
ров высокомолекулярными кетонами нормального
творов экстрагируется октаноном-2 хуже, чем из
строения и получении чистого раствора хлорного
растворов хлороводородной кислоты. Это связано с
железа.
тем, что H+ при одинаковом содержании в растворе
хлорид-ионов обладает более высокой высаливающей
способностью, чем двухзарядный катион никеля.
Экспериментальная часть
Однако при концентрации хлоридных ионов в нике-
В качестве экстрагентов использовали техниче-
левом растворе более 8 моль·дм-3 экстракция желе-
скую смесь спиртов С8 + С10 [октанол-1 (51.9%) и
за(III) октаноном-2 превышает 95% за одну ступень
деканол-1 (47.5%), Crestmont Sdn Bhd, Малайзия],
экстракции при о:в = 1:1 (рис. 1).
алифатические кетоны: октанон-2 («чистый», ЗАО
Важным качеством любого экстрагента является
Вектон, Россия), нонанон-2 (марки ≥99%, Haihang,
селективность извлечения элемента в органическую
Китай), деканон-2 (марки ≥99%, Haihang, Китай) и
ундеканон-2 (марки ≥98%, Treatt, Англия).
Хлоридные никелевые растворы, близкие по со-
ставу к растворам, образующимся при гидрохло-
рировании магнитной фракции медно-никелевого
файнштейна [18], готовили разбавлением концентри-
рованных растворов соответствующих солей — хло-
рида железа(III) и хлорида никеля — с добавлением
расчетных количеств концентрированной хлорово-
дородной кислоты и хлоридных солей меди(II) и ко-
бальта(II). Все неорганические реагенты, использо-
ванные в работе, соответствовали квалификации х.ч.,
ЛенРеактив, Россия.
Жидкостная экстракция проводилась интенсив-
ным встряхиванием смеси органической (о) и водной
(в) фаз при соотношении о:в = 1:1 в течение 5 мин
Рис. 1. Зависимость степени извлечения Fe(III) от кон-
при 20°С. Предварительные исследования показа-
центрации хлорид-иона.
ли, что время контакта является достаточным для
а — NiCl2 (данные настоящей работы) б — HCl (данные
установления равновесия [19]. После разделения фаз
[19]); сFe(III)
= 10.0 г·дм-3.
исх
Экстракция железа(III) из хлоридных никелевых растворов алифатическими кетонами
1017
Таблица 1
Значения коэффициентов распределения DFe(III) и коэффициентов разделения βFe/M при экстракции
Fe(III) из модельного хлоридного никелевого раствора, содержащего, г·дм-3: 192.0 Ni, 12.0 Fe(III),
2.8 Cu(II), 2.3 Сo(II), изученными экстрагентами (о:в = 1:1)
Коэффициент разделения β
Экстрагент
СFe(III) в рафинате, г⋅дм-3
DFe(III)
Fe/Ni, ×103
Fe/Cu, ×103
Fe/Co, ×103
Октанон-2
0.99
11.1
47.4
3.10
51.1
Нонанон-2
1.40
7.6
26.4
4.20
34.8
Деканон-2
2.00
5.0
12.0
4.70
11.5
Ундеканон-2
2.70
3.4
10.2
4.80
7.9
Спирты С8 + С10
2.70
3.4
0.4
0.08
0.3
фазу. Для изучения соэкстракции элементов, присут-
по отношению к железу(III). Они практически не
ствующих обычно в растворах никелевого производ-
экстрагируют примесные металлы Cu и Co. Кобальт
ства, экстракцию проводили из многокомпонентного
слабо экстрагируется всеми представленными орга-
хлоридного раствора (табл. 1).
ническими соединениями, но извлечение кобальта
Из данных табл. 1 следует, что с ростом числа
спиртами более чем в 20 раз превышает извлечение
атомов углерода в углеводородной цепи экстракцион-
кетонами. Значение экстракции Ni для всех экстра-
ная способность кетонов падает и для ундеканона-2
гентов примерно одинаково, кроме смеси спиртов,
становится сравнимой со смесью спиртов C8 + C10.
которая извлекает никель на порядок выше. Кроме
Однако сопоставление значений коэффициентов
того, спирты в значительной степени соэкстрагируют
разделения показывает, что все представленные ке-
хлороводородную кислоту, что ведет к получению
тоны являются более селективными экстрагентами
кислых реэкстрактов хлорного железа:
Зависимость коэффициента распределения соляной кислоты от экстрагента, сHClисх = 219 г·дм-3
Экстрагент
Октанон-2
Нонанон-2
Деканон-2
Ундеканон-2
Спирты C8 + C10
D
0.01
0.005
0.003
0.003
0.22
Высокая селективность извлечения железа(III)
таты промывки насыщенного экстракта от основной
кетонами связана с тем, что из концентрирован-
примеси Ni раствором соляной кислоты, содержащим
ных хлоридных растворов оно экстрагируется по
284 г·дм-3 хлорид-иона, при различных о:в за одну
гидратно-сольватному механизму в виде соедине-
ступень. Введение дополнительной операции про-
ния HFeCl4·nH2O·mS, где S — молекула кетона [20].
мывки экстракта при о:в = (15-20):1 за одну ступень
Медь(II) и кобальт(II) образуют малоустойчивые и
позволяет уменьшить содержание примеси Ni более
менее экстракционноспособные хлоридные комплек-
чем на 99%.
сы [21, 22], которые в присутствии железа(III) практи-
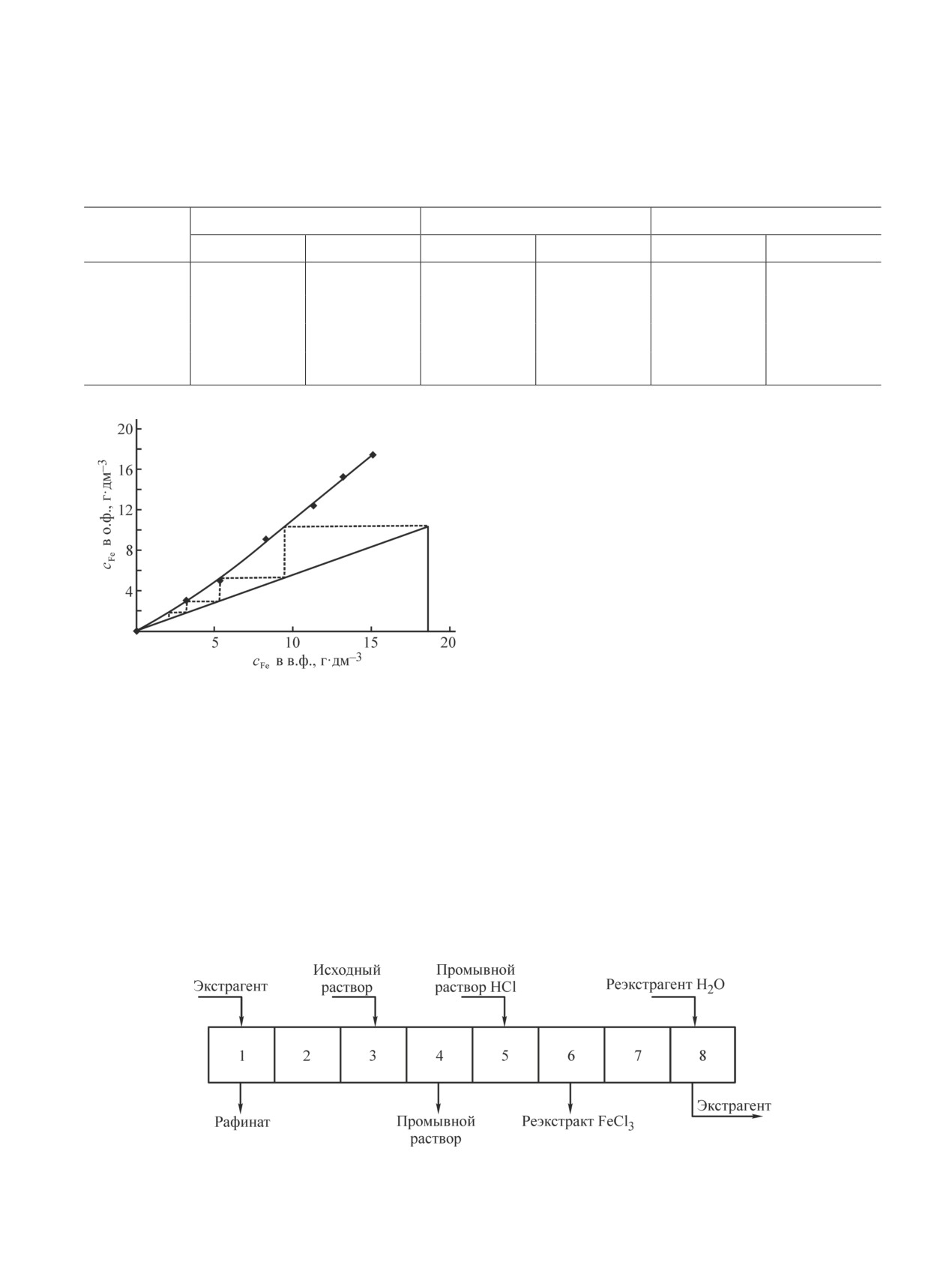
Для определения числа ступеней экстракции же-
чески не извлекаются. Никель из хлоридных раство-
леза(III) из никелевого раствора ундеканоном-2 по-
ров не экстрагируется, так как присутствует только в
лучена изотерма экстракции путем варьирования
двух катионных формах — Ni2+ и NiCl+ [23]. Наличие
соотношений органической и водной фаз (рис. 2). Из
некоторого количества никеля в органической фазе
представленной зависимости видно, что для глубоко-
при извлечении из концентрированных растворов
го извлечения Fe(III) в органическую фазу достаточно
может быть связано с уносом водной фазы в экстракт.
четырех ступеней экстракции.
Для снижения содержания примесей в экстракте с
На основании полученных результатов проведены
целью получения более чистого конечного продукта
лабораторные испытания в непрерывном режиме по
(реэкстракта) может быть введена дополнительная
экстракции железа из модельного хлоридного ни-
операция промывки экстракта. В табл. 2 на примере
келевого раствора на каскаде экстракторов смеси-
экстракции Fe(III) из модельного хлоридного никеле-
тельно-отстойного типа конструкции и производства
вого раствора ундеканоном-2 представлены резуль-
ИХТРЭМС КНЦ РАН, описание которого представ-
1018
Касиков А. Г. и др.
Таблица 2
Промывка экстракта раствором соляной кислоты, содержащим 284 г·дм-3 хлорид-иона
Состав исходного экстракта, г·дм-3: 18.96 Fe, 1.41 Ni
сM в промывном растворе, г∙дм-3
EM в промывной раствор, %
сM в промывном экстракте, мг∙дм-3
о:в
Fe
Ni
Fe
Ni
Fe
Ni
20:1
0.51
7.2
0.1
99.3
18.95
10.0
15:1
0.49
6.15
0.1
99.5
18.94
7.6
10:1
0.12
3.15
0.1
99.6
18.93
5.1
5:1
0.125
3.00
0.1
99.6
18.93
5.1
вали наименее растворимый в водной фазе ундека-
нон-2. В качестве промывного раствора использовали
раствор HCl, содержащий 284 г·дм-3 хлорид-иона;
в качестве реэкстрагента — дистиллированную воду.
Лабораторный экстракционный каскад непре-
рывного действия в наших испытаниях состоял из
8 камер: 3 камеры экстракции, 2 камеры промывки
и 3 камеры реэкстракции. Соотношение органиче-
ской и водной фаз на экстракции поддерживалось на
уровне о:в ~ 2:1, на стадии промывки — о:в ~ 15:1,
реэкстракции — о:в ~ 7:1. Принципиальная схема
экстракционного каскада изображена на рис. 3.
Составы исходного хлоридного никелевого рас-
твора и некоторых растворов, полученных на экстрак-
Рис. 2. Изотерма экстракции Fe(III) ундеканоном-2 при
ционном каскаде в процессе непрерывной работы,
различном соотношении о:в.
приведены в табл. 3.
сFe(III)
= 18.6 г·дм-3, сNi(II)
= 190.0 г·дм-3.
исх
исх
Из представленных в табл. 3 данных видно, что
экстракционным способом удается снизить содер-
лено в работе [24]. Целью испытаний являлось удале-
жание железа(III) в исходном хлоридном никелевом
ние из никелевого раствора основной части железа с
растворе до 0.2 г·дм-3, что соответствует извлечению
получением чистого и концентрированного раствора
в реэкстракт более 97% железа(III), и получить доста-
хлорида железа(III).
точно концентрированный раствор хлорного железа.
На экстракцию подавали хлоридный никелевый
После упарки реэкстракта был получен 40%-ный
раствор состава (г·дм-3): 196.0 Ni, 20.6 Fe(III), 3.8 Сo,
раствор хлорного железа, соответствующий ГОСТ
0.05 Сu, 247.0 Сl. В качестве экстрагента использо-
857-95 марка Б высший сорт. После удаления основ-
Рис. 3. Принципиальная схема 8-ступенчатого экстракционного каскада для извлечения и концентрирования Fe(III).
Экстракция железа(III) из хлоридных никелевых растворов алифатическими кетонами
1019
Таблица 3
Состав некоторых растворов лабораторного экстракционного каскада непрерывного действия
Концентрация металлов, г⋅дм-3
Раствор
Fe
Ni
Co
Cu
Исходный раствор
20.60
196.0
3.8
0.05
Рафинат
0.20
193.20
4.0
0.05
Промраствор
0.42
9.60
0.064
0.066
Реэкстракт
76.80
0.02
<0.001
<0.001
ной части железа рафинат поступает на дальнейшую
переработку в никелевое производство, а промывной
org/0000-0002-0281-5284
раствор может быть использован на операции гидро-
Щелокова Елена Анатольевна, к.т.н., ORCID:
хлоридного выщелачивания магнитной фракции файн-
штейна взамен чистой хлороводородной кислоты.
Глуховская Ирина Владимировна, ORCID: https://
Таким образом, проведение жидкостной экстрак-
orcid.org/0000-0002-9754-0251
ции железа(III) из растворов никелевого производства
позволит избежать получения больших объемов от-
вального железистого кека и обеспечит производство
Список литературы
дополнительной кондиционной продукции.
[1] Ритчи Г. М., Эшбрук А. В. Экстракция. Принципы
и применение в металлургии / Пер. с англ. под ред.
Б. Н. Ласкорина. М: Металлургия, 1983. С. 150
Выводы
[Ritcey G. M., Ashbrook A. W. Solvent extraction.
Показано, что экстракция железа(III) октаноном-2
Principles and applications to process metallurgy.
начинается при концентрации хлоридного фона свы-
Amsterdam; Oxford; New York: Elsevier Sci. Publ.
ше 2 моль·дм-3 и достигает 99% при концентрации
Co., 1979].
хлороводородной кислоты >6 моль·дм-3, а для рас-
[2] Резник И. Д., Соболь С. И., Худяков В. М. Кобальт.
М.: Машиностроение, 1995. Т. 2. C. 369-371.
творов NiCl2 при концентрации хлоридных ионов
[3] Мотов Д. Л., Васёха М. В. // Металлы. 2005. № 1.
>8 моль·дм-3.
С. 42-47.
Установлена возможность селективного извлече-
[4] Касиков А. Г. // Цв. металлы. 2012. № 7. С. 29-35.
ния железа(III) из хлоридных растворов кетонами на
[5] Mao X. H., Liu D. J. // Asian J. Chem. 2013. V. 6. N 9.
фоне макроколичеств хлорида никеля и хлороводо-
P. 4753-4756.
родной кислоты, а также в присутствии Co и Cu.
[6] Agrawal A., Kumari S., Sahu K. K. // J. Environmental
В ходе укрупненных лабораторных испытаний на
Management. 2011. V. 92. P. 3105-3111.
каскаде лабораторных экстракторов показана возмож-
[7] El-Dessouky S. I., El-Nadi Y. A., Anmed I. M.,
ность глубокого извлечения железа(III) ундекано-
Saad E. A., Daoud J. A. // Chem. Eng. Processing.
ном-2 из хлоридного никелевого раствора с получе-
2008. V. 47. P. 177-183.
нием чистого реэкстракта, пригодного для получения
[8] Mahmoud M. E., Soliman E. M. // Talanta. 1997. V. 44.
товарного раствора хлорного железа.
P. 1063-1071.
[9] Lee M. S., Lee K. J., Oh Y. J. // Mater. Transactions.
2004. V. 45. N 7. P. 2364-2368.
Конфликт интересов
[10] Cai X., We B., Han J., Li Y., Cui Y., Sun G. //
Hydrometallurgy. 2016. V. 164. P. 1-6.
Авторы заявляют об отсутствии конфликта инте-
[11] Sun X., Sun Y., Yu J. // Separation Purification Technol.
ресов, требующего раскрытия в данной статье.
2016. V. 159. P. 18-22.
[12] Mishra R. K., Rout P. C., Sarangi K., Nathsarma K. C.
// Hydrometallurgy. 2011. V. 108. P. 93-99.
Информация об авторах
[13] Воропанова Л. А., Величко Л. А. // ЖПХ. 1999. Т. 72.
Касиков Александр Георгиевич, к.х.н., ORCID:
№ 6. С. 1858-1863 [Voropanova L. A.,Velichko L. N. //
Russ. J. Appl. Chem. 1999. V. 72. N 11. P. 1970-1975].
1020
Касиков А. Г. и др.
[14] Farouq R., Selim Y. // Chill. Chem. Soc. 2017. V. 62.
[20] Золотов Ю. А., Серякова И. В., Карякин А. В., Гри-
N 2. P. 3427-3429.
бов Л. А., Зубрилина М. Е. // ДАН СССР. 1962.
[15] Zhang G., Chen D., Wei G., Zhao H., Wang L., Qi T.,
Т. 145. № 1. С. 100-103.
Meng F., Meng L. // Separation Purification Technol.
[21] Lee M. S., Nicol M. J. // J. Korean Institute of Metals
2015. V. 150. P. 132-138.
and Materials. 2008. V. 46 (1). P. 20-25.
[16] Mao X. // 3rd Int. Conf. on Material, Mechanical and
[22] Lakshmanan V. I., Sridhar R., Tait D., Halim M. A.
Manufacturing Engineering. 2015. P. 126-132.
// Applications of Process Engineering Principles in
[17] Wang X., Liu W., Liang B., Lü L., Li C. // Separation
Materials Processing, Energy and Environmental
Purification Technol. 2016. V 158. P. 96-102.
Technologies. The Minerals, Metals & Materials Ser.
[18] Хомченко О. А., Садовская Г. И., Дубровский В. Л.,
2017. P. 169-178.
Смирнов П. В., Цапах С. Л. // Цв. металлы. 2014.
[23] Lee M. S., Lee K.-J. // Hydrometallurgy. 2005.
№ 9. С. 81-88.
V. 80 (3). P. 163-169.
[19] Соколов А. Ю., Касиков А. Г. // Тр. Кольского науч.
[24] Gromov P. B., Kasikov A. G., Shchelokova E. A.,
центра РАН. 2018. Т. 6. № 9. С. 60-66.
Petrova A. M. // Hydrometallurgy. 2018. V 175.
P. 187-192.