1070
Мамедбейли Э. Г. и др.
Журнал прикладной химии. 2019. Т. 92. Вып. 8
УДК 547.56.563.364
СИНТЕЗ И ИССЛЕДОВАНИЕ АНТИМИКРОБНОЙ АКТИВНОСТИ
НОРБОРНЕНСОДЕРЖАЩИХ ОСНОВАНИЙ МАННИХА
© Э. Г. Мамедбейли1, Г. Э. Гаджиева1, С. И. Ибрагимли2, Н. А. Джафарова3
1 Институт нефтехимических процессов им. Ю. Г. Мамедалиева НАН Азербайджана,
Азербайджан, AZ1025, г. Баку, пр. Ходжалы, д. 30
2 Гянджинский государственный университет
Азербайджан, AZ1017, г. Гянджа, пр. Алиева, д. 187
3 Азербайджанский государственный университет нефти и промышленности,
Азербайджан, AZ1021, г. Баку, ул. Низами, д. 117
Е-mail: eldar_mamedbeyli@mail.ru
Поступила в Редакцию 8 ноября 2018 г.
После доработки 23 мая 2019 г.
Принята к публикации 26 июня 2019 г.
На основе конденсации по Манниху норборненилметанола, формальдегида и вторичных аминов
синтезированы представители нового поколения аминометоксипроизводных норборнена. Строение
синтезированных соединений подтверждено методами элементного анализа, масс-спектрометрии,
ИК-, ЯМР 1Н и 13С спектроскопии. Полученные соединения исследованы в качестве антимикробных
веществ против бактерий и грибов. Показано, что они являются более эффективными антими-
кробными веществами, чем применяемые в настоящее время медицинские препараты. Определены
минимальная ингибирующая концентрация и минимальная бактерицидная концентрация.
Ключевые слова: основания Манниха; аминопроизводные норборнена; антимикробная активность; ми-
кроорганизмы; минимальная ингибирующая концентрация; минимальная бактерицидная концентрация
DOI: 10.1134/S0044461819080164
Основания Манниха применяют в качестве син-
двух фармакофорных фрагментов — азотсодержащей
тонов в органическом синтезе, в том числе в синтезе
группы [6] и углеродного каркаса, родственного при-
биологически активных соединений [1, 2]. Так, ами-
родным терпенам. Структура бицикло[2.2.1]-гептана
нометоксипроизводные различных классов органи-
(норборнан) лежит в основе многих важных при-
ческих соединений проявляют противоопухолевую
родных соединений, таких как борнеол, камфора и
активность, влияют на сердечнососудистую систе-
др. Для аминов с каркасами норборнана характерна
му, вызывая снижение кровяного давления, исполь-
антивирусная активность [7].
зуются в качестве препаратов для лечения болезни
Поскольку биологически активные соединения,
Паркинсона, входят в состав противомалярийных
в составе которых сочетаются несколько фармако-
препаратов, проявляют антидепрессантные свойства
форных фрагментов, обладают более эффективными
[3]. Реакция Манниха является одним из удобных,
действиями, исследователи стараются расширить
простых и экологически чистых методов получения
ассортимент таких соединений и изучать их физио-
такого рода соединений, находящих применение в
логически активные свойства [8].
различных сферах медицины в качестве фармаколо-
Мы предположили, что введение норборненового
гических препаратов [4].
фрагмента в состав оснований Манниха повысит
Амины соединений ряда норборнена также обла-
их биологическую активность и другие полезные
дают высокой биологической активностью и встре-
свойства. Норборненилметанол имеет подвижный
чаются в составе лекарственных препаратов [5].
атом водорода и в связи с этим с легкостью вступает
Ценность их связывают с присутствием в молекулах
в реакцию Манниха как СН-кислотный компонент.
Синтез и исследование антимикробной активности норборненсодержащих оснований Манниха
1071
В литературе имеются малочисленные сообщения об
серийных разведений в отношении различных микро-
использовании спиртов (сведений о норборненилме-
организмов. В качестве питательной среды использо-
таноле отсутствуют) в реакции аминометилирова-
вали мясо-пептонный агар рН 7.2-7.4 для бактерий и
ния [9], поэтому использование спиртов, в частности
среду Сабуро для грибов. Длительность инкубации в
норборненилметанола, в реакции Манниха позволит
термостате для бактерий была 18-24 ч при 37°C, для
расширить ассортимент аминометоксипроизводных
грибов — 1-10 дней при 28°C. Степень разведения сое-
с различными областями применения. Таким обра-
динений составила 1:100, 1:200, 1:400 и 1:800 соответ-
зом, синтез и исследование свойств аминометокси-
ственно. Высевы делались через 5, 15, 30, 45, 60 мин
производных норборненилметанола является весьма
(время экспозиции). Для сравнения в качестве этало-
актуальной задачей и представляет как научный, так
нов были исследованы в тех же разведениях этанол,
и практический интерес.
риванол, фурацилин, карболовая кислота, хлорамин.
В данной работе описаны результаты синтеза и
Изучены минимальная бактерицидная (МБК) и
исследования антимикробных свойств ранее неиз-
минимальная ингибирующая (МИК) концентрации
вестных аминометоксипроизводных норборнена,
синтезированных аминометоксипроизводных норбор-
полученных однореакторной реакцией Манниха
нена по отношению к бактериям и грибам (S. aureus,
норборненилметанола с вторичными аминами в при-
E. coli, C. albicans). В качестве питательной среды
сутствии формальдегида.
для бактерий использовали мясо-пептонный бульон,
для грибов — сахарный бульон. Был применен метод
разведений, время инкубации составило 24 ч.
Экспериментальная часть
В получении исходного норборненилметанола
ИК-спектры синтезированных соединений были
используется дициклопентадиен, выделенный из
получены на аппаратах Spektrum BX и Bruker фирмы
побочной фракции С5 жидких продуктов пироли-
ALPHA IR FURYE в области 4000-400 см-1. Спектры 1Н
за, и реактивный аллиловый спирт, который перед
и 13С ЯМР записаны на спектрометре Bruker AМ-300,
использованием сушили над MgSO4 и перегоняли.
при частоте 300 МГц в растворителе С6D6, внутрен-
Вторичные амины (II)-(IX) использовали реактив-
ний стандарт — гексаметилдисилоксан. Масс-спектры
ные, перед использованием перегоняли и определяли
получены на масс-спектрометре VG-7070Е (ионизи-
их физико-химические константы, которые совпада-
рующее напряжение — 70 эВ). Чистоту продуктов
ют с литературными данными. Аммиачная вода, яв-
реакции определяли по температуре кипения, дан-
ляющаяся медицинским препаратом, использовалась
ным элементного анализа и газожидкостной хрома-
в виде 10%-ного раствора. В качестве растворителя
тографии (ГЖХ). Элементный анализ осуществлен
был использован бензол. Параформальдегид — про-
на приборе фирмы CARLO ERBA модель ЕА 1108.
дукт полимеризации формальдегида, при нагревании
ГЖХ-анализ осуществляли на хроматографе ЛХМ-8
деполимеризуется до формальдегида. Использовался
МД, стальная колонка (300 × 3 мм) с 5%-ным ПЭГС
в виде реактивного порошка.
на динохроме П, газ-носитель — гелий (40 см3·мин-1),
Норборненсодержащие основания Манниха (X)-
детектор катарометр, температура колонки 150°C,
(XVII) получены реакцией норборненилметанола (I)
испарителя — 230°C. Показатель преломления
с вторичными аминами [диэтиламин (II), дипропил-
(nD20) определяли на рефрактометре марки ABBEMAT
амин (III), дибутиламин (IV), дипентиламин (V), ди-
350/500, плотность (ρ420) — на приборе ДМА 4500 М.
гексиламин (VI), пиперидин (VII), морфолин (VIII),
Антимикробную активность полученных соедине-
гексаметиленимин (IX)] в присутствии формальде-
ний (X)-(XVII) изучали в Азербайджанском медицин-
гида. Выход целевых продуктов составил 43-71%.
ском университете. Исследование проводили методом
Реакции протекают по следующей схеме:
где R = N(C2H5)2 (II), (X); N(C3H7)2 (III), (XI);
(VI), (XIV); пиперидино- (VII), (XV); морфолино-
N(C4H9)2 (IV), (XII); N(C5H11)2 (V), (XIII); N(C6H13)2
(VIII), (XVI); гексаметиленимино- (IX), (XVII).
1072
Мамедбейли Э. Г. и др.
Аминометоксипроизводные норборн-2-ена (X)-
5-(N,N-Дибутиламинометоксиметил)бицикло-
(XVII). Общая методика синтеза. К 0.2 моль па-
[2.2.1]-гепт-2-ен (XII). Спектр ЯМР 1Н, δ, м. д.: 0.92 т
раформа, разбавленного в 20 мл бензола, при
(6H, 2CH3, J 7.1 Гц), 1.34-1.50 м (7H, C5H, C6H2,
перемешивании по каплям добавили 0.1 моль нор-
2CH2CH3), 1.79 д. д. д (2H, C7H2, J 2.3, 2.1, 1.2 Гц),
борненилметанола (I), разбавленного в 20 мл бен-
2.47 д. д (1H, C1H, J 0.1, 1.2 Гц), 2.63 д. д (1H, C4H,
зола. Затем, продолжая перемешивание, по каплям
J 0.1, 1.2 Гц), 2.77-2.93 м (4H, 2CH2C2H5), 3.00-3.11 м
добавили раствор 0.1 моль вторичного амина (II)-(IX)
(6H, 2СН2N, С8Н2О), 4.07 с (1H, OC10H2N), 4.09 с
в 20 мл бензола. Перемешивание продолжали при
(1H, OC10H2N), 5.93-5.94 м (1H, =C2H), 6.10-6.11 м
температуре 78-80°С в течение 4-5 ч. После охлажде-
(1H, =C3H). Спектр ЯМР 13С, δ, м. д.: 13.56 (CH3),
ния смесь обработали аммиачным раствором (10%).
13.57 (CH3), 20.31 (CH2CH3), 20.33 (CH2CH3), 29.0
Промывали дистиллированной водой до нейтральной
(C6), 30.27 (CH2C2H5), 30.28 (CH2C2H5), 38.8 (C5),
реакции и сушили над МgSO4. Отогнали бензол, оста-
42.0 (C1), 43.8 (C4), 49.0 (C7), 51.41 (СН2N), 51.42
ток перегоняли в вакууме.
(СН2N), 71.1 (C8), 85.1 (C10), 132.3 (C2), 136.6 (C3).
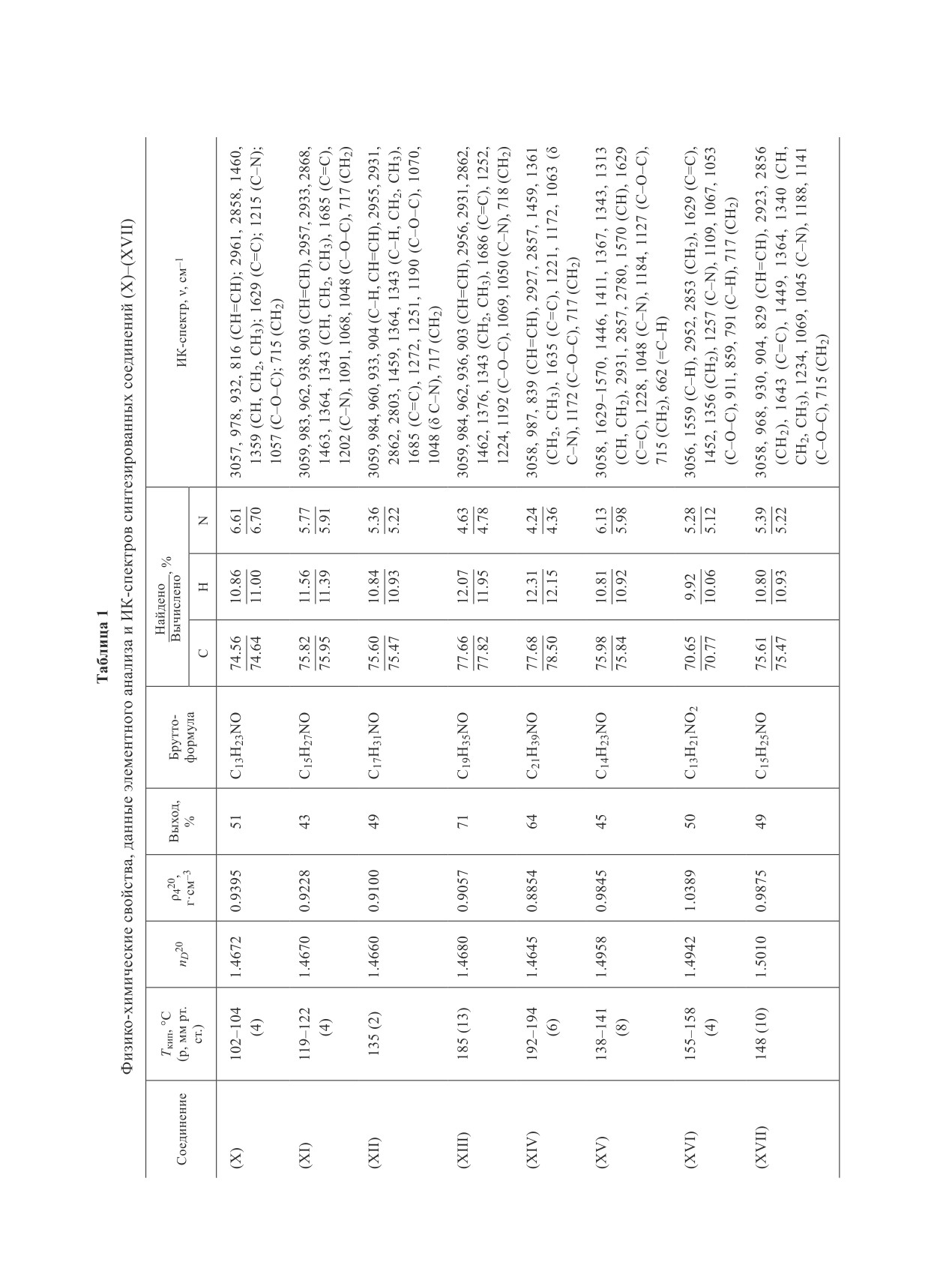
Данные физико-химических свойств, элементного
Масс-спектр, m/z (Iотн, %): 266 (8) [М + Н]+, 265 (10)
анализа и ИК-спектров синтезированных соединений
[М]+, 247 (8) [М - Н2О]+, 207 (15) [М - С2Н2O2]+, 196
(X)-(XVII) показаны в табл. 1.
(5), 142 (100) [С8Н16NO]+, 100 (70) [С4Н8N2O]+, 91 (7)
Ниже представлены данные ЯМР 1Н, 13С спек-
[С7Н7]+, 79 (13), 58 (60).
троскопии и масс-спектрометрии соединений (X)-
Найдено (%): С 75.60, Н 10.84, N 5.36.
(XVII).
C17H31NO. Вычислено (%): С 75.47, H 10.93, N 5.22.
5-(N,N-Диэтиламинометоксиметил)бицикло-
5-(N,N-Дипентиламинометоксиметил)бицикло-
[2.2.1]-гепт-2-ен (X). Спектр ЯМР 1Н, δ, м. д.: 1.04 т
[2.2.1]-гепт-2-ен (XIII). Спектр ЯМР 1Н, δ, м. д.:
(6H, 2CH3, J 7.5 Гц), 1.26-1.37 м (2H, C6H2), 1.78 д.
0.81-0.95 т (6H, 2CH3, J 7.3 Гц), 1.00-1.60 м [12H,
д. д (2H, C7H2, J 2.2, 2.1, 1.2 Гц), 2.68-2.92 м (3H,
2(CH2)3CH3], 1.33-1.52 м (5H, C1H, C4H, C5H, C6H2),
C1H, C4H, C5H), 3.29-3.42 м (4H, 2СН2N), 3.42 д (2H,
1.79 д. д. д (2H, C7H2, J 2.2, 2.1, 1.2 Гц), 3.0-3.34 м
C8H2O, J 6.8 Гц), 4.17 с (2H, OC10H2N), 5.93-5.95 м
(6H, 2СН2N, С8Н2О), 4.08 с (1H, OC10H2N), 4.09 с
(1H, =C2H), 6.10-6.11 м (1H, =C3H). Спектр ЯМР
(1H, OC10H2N), 5.94-5.95 м (1H, =C2H), 6.11-6.12 м
13С, δ, м. д.: 12.85 (CH3), 12.86 (CH3), 29.0 (C6), 38.8
(1H, =C3H). Спектр ЯМР 13С, δ, м. д.: 10.8 (CH3), 13.6
(C5), 42.0 (C1), 43.8 (C4), 45.1 (C7), 49.03 (CH2N),
(CH3), 17.1 (CH2CH3), 22.4 (CH2CH3), 27.2 (CH2C2H5),
49.04 (CH2N), 71.0 (C8), 84.1 (C10), 132.3 (C2), 136.6
27.7 (CH2C2H5), 33.1 (CH2C3H7), 38.8 (CH2C3H7),
(C3). Масс-спектр, m/z (Iотн, %): 210 (5) [М + Н]+, 209
42.0 (C6), 43.8 (C5), 49.0 (C1), 51.6 (C4), 52.2 (C7),
(7) [М]+, 191 (13) [М - Н2О]+, 176 (7), 167 (10) [М -
58.6 (СН2N), 59.5 (СН2N), 71.2 (C8), 85.5 (C10), 132.3
С2Н2O]+, 159 (10), 132 (13), 124 (10), 107 (8) [С8H11]+,
(C2), 136.6 (C3). Масс-спектр, m/z (Iотн, %): 294 (13)
86 (100) [С5H12N]+, 79 (15), 58 (30), 44 (5).
[М + Н]+, 293 (11) [М]+, 276 (100) [М - ОН]+, 275 (8)
Найдено (%): С 74.56, Н 10.86, N 6.61.
[М - Н2O]+, 262 (4) [М - ОН - СН2]+, 209 (17) [M -
C13H23NO. Вычислено (%): С 74.64, H 11.00, N 6.70.
С5Н10N]+, 170 (50) [С11Н24N]+, 114 (100), 58 (60), 43
5-(N,N-Дипропиламинометоксиметил)бицикло-
(20) [С3Н7]+.
[2.2.1]-гепт-2-ен (XI). Спектр ЯМР 1Н, δ, м. д.: 0.88-
Найдено (%): С 77.66, Н 12.07, N 4.63.
0.91 т (6H, 2CH3, J 7.1 Гц), 1.26-1.46 м (7H, C5H,
C19H35NO. Вычислено (%): С 77.82, H 11.95, N 4.78.
C6H2, 2CH2CH3), 1.79-1.83 м (2H, C7H2), 2.57 д. д
5-(N,N-Дигексиламинометоксиметил)бицикло-
(1H, C1H, J 0.1, 1.2 Гц), 2.77 д. д (1H, C4H, J 0.1,
[2.2.1]-гепт-2-ен (XIV). Спектр ЯМР 1Н, δ, м. д.: 0.91 т
1.2 Гц), 2.93-3.11 м (6H, 2СН2N, С8Н2О), 4.07 с (2H,
(6H, 2CH3, J 7.1 Гц), 1.32-1.48 м [16H, 2(CH2)4CH3],
OC10H2N), 5.94-6.11 м (2H, =C2H, =C3H). Спектр
1.79 д. д. д (2H, C7H2, J 2.2, 2.1, 1.2 Гц), 2.47 д. д (1H,
ЯМР 13С, δ, м. д.: 11.30 (CH3), 11.31 (CH3), 21.15
C1H, J 0.1, 1.2 Гц), 2.63 д. д (1H, C4H, J 0.1, 1.2 Гц),
(CH2CH3), 21.16 (CH2CH3), 29.0 (C6), 38.8 (C5), 42.0
3.0-3.12 м (6H, 2СН2N, С8Н2О), 4.08 с (1H, OC10H2N),
(C1), 43.8 (C4), 49.0 (C7), 53.73 (СН2N), 53.74 (СН2N),
4.09 с (1H, OC10H2N), 5.94-6.11 м (2H, =C2H, =C3H).
71.1 (C8), 85.2 (C10), 132.3 (C2), 136.6 (C3). Масс-
Спектр ЯМР 13С, δ, м. д.: 13.57 (CH3), 13.58 (CH3),
спектр, m/z (Iотн, %): 238 (11) [М + Н]+, 237 (9) [М]+,
22.56 (CH2CH3), 22.58 (CH2CH3), 26.97 (CH2C2H5),
219 (7) [М - Н2О]+, 179 (15) [М - С2Н2O2]+, 168
26.98 (CH2C2H5), 27.21 (CH2C3H7), 27.23 (CH2C3H7),
(5), 114 (100) [С7Н16N]+, 86 (41) [С4Н6O2]+, 58 (21)
28.03 (CH2C4H9), 28.04 (CH2C4H9), 31.7 (C6), 38.8
[С2Н2O2]+, 44 (11).
(C5), 42.0 (C1), 43.8 (C4), 49.0 (C7), 51.7 (СН2N), 51.8
Найдено (%): С 75.82, Н 11.56, N 5.77.
(СН2N), 71.1 (C8), 85.1 (C10), 132.3 (C2), 136.6 (C3).
C15H27NO. Вычислено (%): С 75.95, H 11.39, N 5.91.
Масс-спектр, m/z (Iотн, %): 322 (18) [М + Н]+, 321 (20)
Синтез и исследование антимикробной активности норборненсодержащих оснований Манниха
1073
1074
Мамедбейли Э. Г. и др.
[М]+, 303 (9) [М - Н2О]+, 290 (13) [М - OH - СН2]+,
[М + Н]+, 235 (5) [М]+, 166 (7), 142 (10), 128 (9), 112
223 (6) [M - С6Н12N]+, 198 (80) [С13Н28N]+, 154 (30),
(100) [С7Н13N + H]+, 106 (5) [M - С7Н15NO]+, 100 (25)
128 (100), 84 (15), 58 (60), 44 (12).
[С6Н13N + H]+, 79 (15), 58 (50), 44 (16).
Найдено (%): С 77.68, Н 12.31, N 4.24.
Найдено (%): С 75.61, Н 10.80, N 5.39.
C21H39NO. Вычислено (%): С 78.50, H 12.15, N 4.36.
C15H25NO. Вычислено (%): С 75.47, H 10.93, N 5.22.
5-Пиперидинометоксиметилбицикло[2.2.1]-
гепт-2-ен (XV). Спектр ЯМР 1Н, δ, м. д.: 1.26-1.54
Обсуждение результатов
м (4Н, С6Н2, С7Н2), 1.55-1.75 м (4Н, 2NСН2СН2),
2.01-2.08 м [2Н, N(СН2)2СН2], 2.35-2.58 м (3Н, С1Н,
Нами получены аминометоксипроизводные нор-
С4Н, С5Н), 2.99-3.02 м (6Н, 2СН2Nцикл, С8Н2О), 3.94
борн-5-ена (X)-(XVII), представляющие собой жид-
д (1Н, ОС10Н2N, J 16.1 Гц), 4.00 д (1Н, ОС10Н2N, J
кости с характерным запахом, нерастворимые в воде,
16.1 Гц), 5.94 д. д (1Н, =С2Н, J 0.6, 2.1 Гц), 6.10 д. д
но хорошо растворимые в органических раствори-
(1Н, =С3Н, J 0.6, 2.1 Гц). Спектр ЯМР 13С, δ, м. д.:
телях (этанол, ацетон, бензол, CCl4, CHCl3 и др.).
24.2 [N(СН2)2СН2], 25.8 (NСН2СН2), 26.0 (NСН2СН2),
Реакции проведены в растворе бензола при 78-80°С
29.0 (С6), 38.9 (С7), 42.2 (С1), 43.9 (С4), 49.3 (С5),
в течение 4-5 ч при мольном соотношении реагентов:
50.7 (СН2N), 50.8 (СН2N), 72.5 (С8), 89.4 (С10), 132.5
норборненилметанола (I), формальдегида и амина
(С3), 137.9 (С2). Масс-спектр, m/z (Iотн, %): 222 (8)
(II)-(IX) 1:2:1 соответственно.
[М + Н]+, 221 (7) [М]+, 177 (12) [М - C2Н4О]+, 124
Состав и строение полученных соединений (X)-
(5), 114 (7), 107 (10) [С8H11]+, 98 (100) [С6Н12N]+, 91
(XVII) подтверждены с помощью данных элемент-
(15), 86 (10), 79 (5), 70 (15) [С4Н8N]+, 68 (5), 66 (5),
ного анализа, ИК-, ЯМР 1Н, 13С спектроскопии и
56 (3), 42 (4).
масс-спектрометрии.
Найдено (%): С 75.98, Н 10.81, N 6.13.
В ИК-спектре 5-(норборн-2-енил)метанола (I) на-
C14H23NO. Вычислено (%): С 75.84, H 10.92, N 5.98.
блюдается широкая полоса поглощения в области
5-Морфолинометоксиметилбицикло[2.2.1]-гепт-
3500 см-1, характерная для гидроксильной группы,
2-ен (XVI). Спектр ЯМР 1Н, δ, м. д.: 0.37-0.41 м (2Н,
а в ИК-спектрах аминометоксипроизводных нор-
С6Н2), 1.11-1.67 м (2Н, С7Н2), 2.56-2.74 м (3Н, С1Н,
борн-5-ена (X)-(XVII) эта полоса поглощения отсут-
С4Н, С5Н), 3.53-3.55 м (6Н, 2СН2Nцикл, С8Н2О), 3.78-
ствует. Полосы поглощения в области 1288-1100 см-1
3.79 м (4Н, 2СН2Oцикл), 3.80 д. д (1Н, ОС10Н2N, J 1.2,
характерны для валентных колебаний связи С-N со-
2.2 Гц), 3.84 д. д (1Н, ОС10Н2N, J 1.2, 2.2 Гц), 5.94 д. д
единений (X)-(XVII). Наряду с этим обнаружены
(1Н, =С2Н, J 1.1, 2.1 Гц), 6.01 д. д (1Н, =С3Н, J 1.1, 2.1
полосы поглощения в областях 2952-2931, 2857-
Гц). Спектр ЯМР 13С, δ, м. д.: 28.9 (С6), 38.9 (С7), 42.2
2853 см-1, характерные для связи С-Н (νС-Н) групп
(С1), 44.9 (С4), 49.2 (С5), 49.86 (СН2N), 49.87 (СН2N),
СН3 и СН2 соответственно. Валентные колебания свя-
66.72 (СН2O), 66.73 (СН2O), 72.1 (С8), 88.6 (С10),
зи С-О (νС-О) проявляются в области 1100-1048 см-1
132.5 (С2), 137.7 (С3). Масс-спектр, m/z (Iотн, %): 224
в виде интенсивной полосы поглощения.
(9) [М + Н]+, 223 (20) [М]+, 205 (15) [М - Н2О]+, 179
Данные спектров ЯМР 1Н и 13С синтезированных
(13) [М - С2Н4O]+, 114 (5), 107 (7) [С8H11]+, 100 (100)
соединений (X)-(XVII) также подтверждают указан-
[С5Н10NO]+, 91 (20), 86 (12) [С4Н8NO]+, 79 (22), 72 (5),
ное строение.
70 (25) [С4Н8N]+, 66 (5), 56 (8) [С3Н6N]+, 51 (5), 42 (10).
Была изучена антимикробная активность соеди-
Найдено (%): С 70.65, Н 9.92, N 5.28.
нений (X)-(XVII) в сравнении с известными бакте-
C13H21NO2. Вычислено (%): С 70.77, H 10.06, N 5.12.
рицидными препаратами, широко применяемыми в
5-Гексаметилениминометоксиметилбицикло-
медицинской практике: этанол, риванол, фурацилин,
[2.2.1]-гепт-2-ен (XVII). Спектр ЯМР 1Н, δ, м. д.:
карболовая кислота, хлорамин. Исследование было
1.26-2.06 м (12Н, С6Н2, С7Н2, 4СН2цикл), 1.51-1.54 м
проведено методом серийных разведений. Для этого
(3Н, С1Н, С4Н, С5Н), 2.26-3.87 м (6Н, С8Н2O,
1%-ный спиртовой раствор исследуемого вещества
2СН2Nцикл), 4.04 д. д (1Н, OС10Н2N, J 1.2, 2.2 Гц),
разводили в физиологическом растворе до различных
4.08 д. д (1Н, OС10Н2N, J 1.2, 2.2 Гц), 5.94 д. д (1Н,
концентраций. Затем в каждую пробирку с испы-
=С2Н, J 1.1, 2.1 Гц), 6.01 д. д (1Н, =С3Н, J 1.1, 2.1 Гц).
туемым веществом высеивали 0.1 мл тест-культу-
Спектр ЯМР 13С, δ, м. д.: 27.20 [N(СН2)2СН2], 27.21
ры, содержащей 900 тысяч микробных тел в 1 мл.
[N(СН2)2СН2], 28.58 (NСН2СН2), 28.59 (NСН2СН2),
В качестве тест-культур использовали: грамполо-
29.2 (С6), 38.9 (С7), 42.1 (С1), 43.9 (С4), 49.3 (С5),
жительные (S. aureus), грамотрицательные (E. coli,
52.4 (СН2N), 53.2 (СН2N), 72.5 (С8), 89.6 (С10), 132.4
K. pneumoniae) бактерии, а также дрожжеподобные
(С3), 136.9 (С2). Масс-спектр, m/z (Iотн, %): 236 (10)
грибы рода C. albicans. Результаты испытаний анти-
Синтез и исследование антимикробной активности норборненсодержащих оснований Манниха
1075
1076
Мамедбейли Э. Г. и др.
Таблица 3
Антимикробная активность контрольных препаратов*
Контрольный препарат:физиологический раствор
Время
карболовая
Микроорганизм
экспозиции,
этанол
хлорамин
риванол
фурацилин
кислота
мин
t
1:1
1:2
1:4
t
1:1
1:2
1:4
t
1:1
1:2
1:4
t
1:1
1:2
1:4
t
1:1
1:2
1:4
S. aureus
5
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
+
+
+
+
+
15
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
+
+
+
+
+
30
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
+
+
+
+
+
45
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
+
+
+
+
+
60
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
-
-
-
-
-
E. coli
5
+
+
+
+
+
+
+
+
-
-
-
+
-
-
+
+
+
+
+
+
15
+
+
+
+
+
+
+
+
-
-
-
+
-
-
+
+
+
+
+
+
30
+
+
+
+
+
+
+
+
-
-
-
±
-
-
-
+
+
+
+
+
45
+
+
+
+
+
+
+
+
-
-
-
-
-
-
-
+
+
+
+
+
60
+
+
+
+
+
+
+
+
-
-
-
-
-
-
-
+
-
-
-
+
K. pneumoniae
5
+
+
+
+
+
+
+
+
-
-
-
+
+
+
+
+
+
+
+
+
15
+
+
+
+
+
+
+
+
-
-
-
+
+
+
+
+
+
+
+
+
30
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
+
+
+
+
+
45
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
+
+
+
+
+
60
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
+
+
+
+
+
C. albicans
5
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
+
+
+
+
+
15
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
+
+
+
+
+
30
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
+
+
+
+
+
45
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
+
+
+
+
+
60
+
+
+
+
+
+
+
+
-
-
-
-
+
+
+
+
+
+
+
+
* (+) — рост, (-) — отсутствие роста, (±) — слабый рост; t — 1%-ный раствор исследуемого соединения в этиловом
спирте.
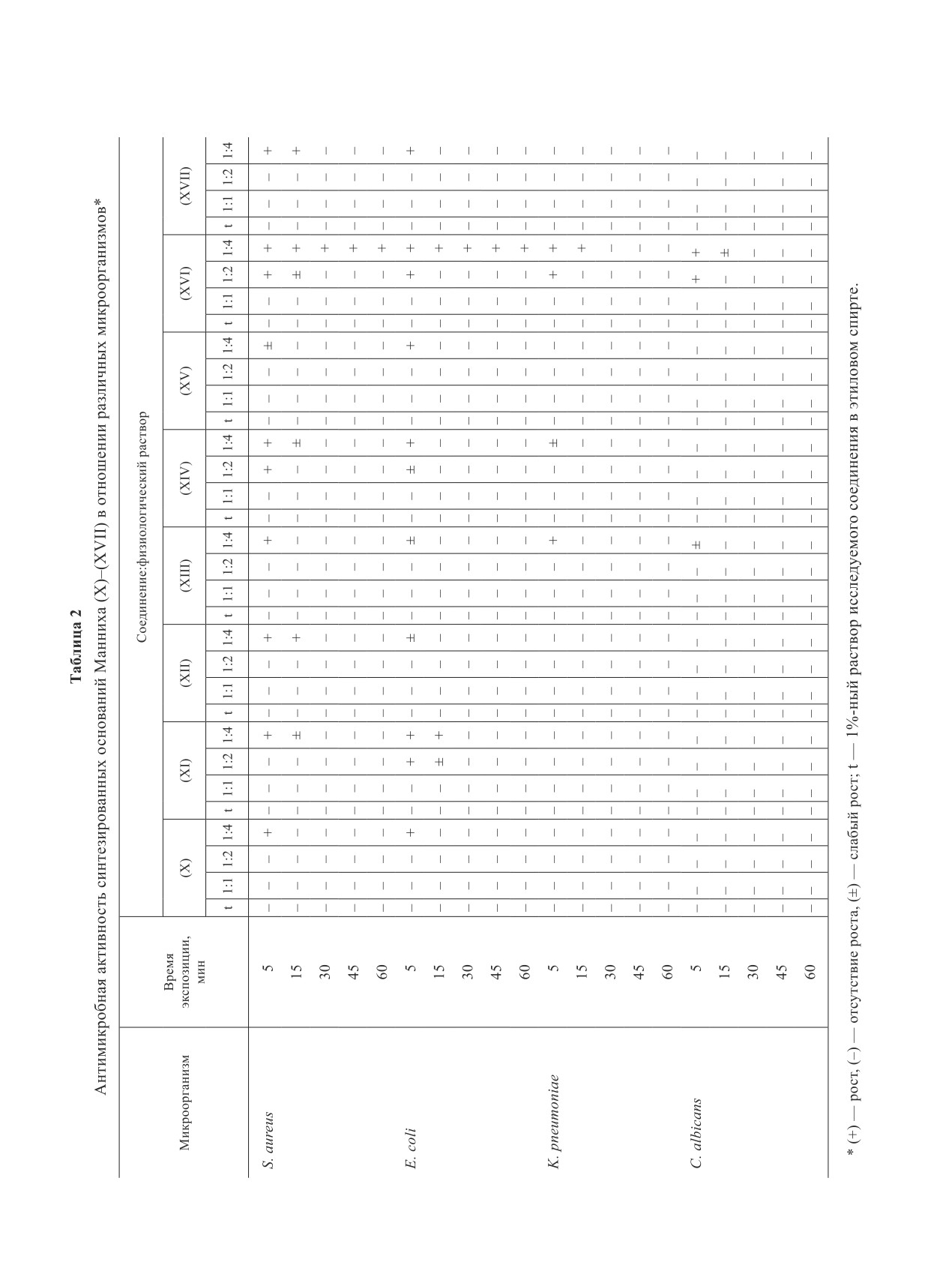
микробной активности синтезированных соединений
нений (XI) и (XIV) по сравнению с предыдущими
(X)-(XVII) и контрольных препаратов представлены
соединениями, а самый низкий результат — у соеди-
в табл. 2 и 3.
нения (XVI). Таким образом, исследование показало,
Как видно из данных табл. 2, кроме соедине-
что антимикробная активность синтезированных сое-
ния (XVI), все синтезированные соединения об-
динений (X)-(XVII) изменяется в зависимости от их
ладают близкими антимикробными свойствами.
структуры и природы заместителей.
Сравнительные исследования антимикробной актив-
Сравнительные исследования показали (табл. 2,
ности испытуемых соединений (X)-(XVII) показали,
3), что синтезированные соединения (X)-(XVII) об-
что лучший результат выявлен у соединений (X) и
ладают более высокой антимикробной активностью
(XV), ниже — у соединений (XII), (XIII) и (XVII).
в отличие от контрольных препаратов, причем их
Относительно низкий результат обнаружен у соеди-
губительное воздействие на микроорганизмы прояв-
Синтез и исследование антимикробной активности норборненсодержащих оснований Манниха
1077
Таблица 4
МИК и МБК соединений (X)-(XVII)*
Соединение
Микроорганизм
Концентрация, %
(X)
(XI)
(XII)
(XIII)
(XIV)
(XV)
(XVI)
(XVII)
S.aureus
0.005
-
-
-
-
-
-
-
-
0.0025
-
-
-
-
-
-
-
-
0.00125
-
-
-
-
-
-
±
-
0.000625
±
±
+
+
+
+
+
+
0.0003125
+
+
+
+
+
+
+
+
E.coli
0.005
-
-
-
-
-
-
-
-
0.0025
-
-
-
-
-
-
-
-
0.00125
-
-
±
-
±
±
-
-
0.000625
+
±
+
+
+
+
+
+
0.0003125
+
+
+
+
+
+
+
+
C.albicans
0.005
-
-
-
-
-
-
-
-
0.0025
-
-
-
-
-
-
±
-
0.00125
+
-
+
±
-
+
+
+
0.000625
+
+
+
+
+
+
+
+
0.0003125
+
+
+
+
+
+
+
+
* (+) — рост, (-) — отсутствие роста, (±) — слабый рост.
ляется гораздо быстрее, чем у широко используемых
отношении микроорганизмов, таких как золотистый
в медицинской практике контрольных препаратов.
стафилококк, синегнойная палочка, кишечная па-
Также были определены минимальная ингибирую-
лочка, и дрожжеподобных грибов рода C. albicans по
щая и минимальная бактерицидная концентрации для
сравнению с широко используемыми в медицинской
синтезированных соединений (X)-(XVII) по отно-
практике контрольными препаратами (этанол, ри-
шению к некоторым вышеуказанным микроорганиз-
ванол, фурацилин, карболовая кислота, хлорамин).
мам (табл. 4). Показано, что полученные соединения
Определены минимальная ингибирующая концен-
(X)-(XVII) реагируют на микроорганизмы при очень
трация и минимальная бактерицидная концентрация
низких концентрациях.
синтезированных соединений и установлено, что по-
Результаты исследований позволяют рекомендо-
лученные нами соединения реагируют на бактерии и
вать синтезированные соединения к применению в
грибы (S. aureus, E. coli, C. albicans) при очень низких
качестве антимикробных веществ.
концентрациях.
Выводы
Благодарности
Синтезированы новые представители норборнен-
Авторы благодарят К. М. Эфендиеву и Г. М. Талы-
содержащих оснований Манниха взаимодействи-
бова за помощь в проведении экспериментов, со-
ем норборненилметанола с вторичными аминами
трудников аналитической лаборатории Б. А. Али-
в присутствии формальдегида с выходом 43-71%.
ева, Ю. Г. Юсифова и Ч. Г. Салманову за помощь
Синтезированные соединения обладают высокой
в исследовании физико-химических свойств син-
антимикробной и антифунгальной активностью в
тезированных соединений, сотрудников кафедры
1078
Мамедбейли Э. Г. и др.
«Микробиологии и иммунологии» Азербайджанского
Гаджиева Гюльсум Энвер кызы, ORCID: https://
медицинского университета А. И. Курбанова и
orcid.org/0000-0002-9445-186X
С. А. Мурадову за изучение антимикробных свойств
Ибрагимли Сахиль Иса оглы, к.х.н., доцент,
полученных соединений, а также особо благодарят
рецензентов и редакцию за внимательное отношение
Джафарова Нахида Али кызы, к.х.н., доцент,
при подготовке статьи в печать.
Финансирование работы
Список литературы
Синтез соединений проводили в Институте нефте-
[1] Богданов А. В., Вазыхова А. М., Хасиятуллина Н. Р.,
химических процессов им. Ю. Г. Мамедалиева На-
Криволапов Д. Б., Добрынин А. Б., Волошина А. Д.,
Миронов В. Ф. // Химия гетероцикл. соединений.
циональной Академии Наук Азербайджана, антими-
2016. Т. 52. № 1. С. 25-30 [Bogdanov A. V., Vazy-
кробную активность исследовали в Азербайджанском
khova A. M., Khasiyatullina N.R., Krivolapov D. B.,
медицинском университете, работа финансировалась
Dobrynin A. B., Voloshina A. D., Mironov V. F. // Chem.
государственным бюджетом.
Heterocyclic Compounds. 2016. V. 52. N 1. P. 25-30].
[2] Ayeni A., Oyerinde M., Ajayeoba T. // J. Chem. Pharm.
Res. 2016. V. 8. N 7. P. 171-175.
Конфликт интересов
[3] Roman G. // Eur. J. Med. Chem. 2015. V. 89. P. 743-
Авторы заявляют об отсутствии конфликта инте-
816.
ресов, требующего раскрытия в данной статье.
[4] Allochio Filho J. F., Lemos B. C., de Souza A. S.,
Penheiro S., Greco S. J. // Tetrahedron. 2017. V. 73.
P. 6977-7004.
Информация о вкладе авторов
[5] Bunch L., Liljefors T., Greenwood J. R. // J. Org. Chem.
2003. V. 68. N 4. P. 1489-1495.
Э. Г. Мамедбейли принадлежит идея данной
[6] Касьян Л. И., Касьян А. О., Оковитый С. И., Тара-
работы, Г. Э. Гаджиева синтезировала образцы и
бара И. Н. Амины с каркасными фрагментами и их
подготовила их для анализа, Э. Г. Мамедбейли и
производные. Днепропетровск: Изд-во Днепропетр.
С. И. Ибрагимли участвовали в обработке данных и
ун-та, 2009. С. 74-91.
провели теоретические расчеты, Э. Г. Мамедбейли,
[7] Тандура С. Н., Шумский А. Н., Литвин Е. Ф., Козло-
Г. Э. Гаджиева и Н. А. Джафарова участвовали в на-
ва Л. М., Шувалова Е. В., Шарф В. З., Колесни-
писании текста статьи. Все авторы участвовали в
ков С. П. // Изв. РАН. Сер. хим. 2006. Т. 50. № 6.
обсуждении результатов.
С. 971-978 [Tandura S. N., Shumsky A. N., Litvin E. F.,
Kozlova L. M., Shuvalova E. V., Sharf V. Z., Kolesni-
kov S. P. // Russ. Chem. Bull. 2001. V. 50. N 6. P. 1014-
1022].
Дополнительные материалы
[8] Гулюкина Н. С., Макухин Н. Н., Белецкая И. П.
По данным антимикробной активности имеется
// Успехи химии. 2016. Т. 85. № 7. C. 667-683
акт, утвержденный Азербайджанским медицинским
[Goulioukina N. S., Makukhin N. N., Beletskaya I. P. //
университетом.
Russ. Chem. Rev. 2016. V. 85. N 7. P. 667-683].
[9] Мамедбейли Э. Г., Джафаров И. А., Рагимова С. К.,
Гаджиева Г. Э. // Процессы нефтехим. и нефтепе-
рераб. 2015. Т. 17. № 2 (62). С. 139-165 [Mammad-
Информация об авторах
bayli E. H., Jafarov İ. A., Rahimova S. K., Hajieva G. E.
Мамедбейли Эльдар Гусейнгулу оглы, д.х.н., проф.,
// Processes Petrochem. Oil Refining. 2015. V. 17. N 2
(62). P. 131-157].