Синтез фоточувствительных циклопропансодержащих полимеров
1131
Журнал прикладной химии. 2019. Т. 92. Вып. 9
УДК 541.64:547:512
СИНТЕЗ ФОТОЧУВСТВИТЕЛЬНЫХ ЦИКЛОПРОПАНСОДЕРЖАЩИХ
ПОЛИМЕРОВ
© К. Г. Гулиев, А. Э. Рзаева, А. М. Гулиев
Институт полимерных материалов НАН Азербайджана
Az5004, г. Сумгайыт, ул. С. Вургуна, д. 124, Азербайджан
E-mail: ipoma@science.az
Поступила в Редакцию 20 ноября 2018 г.
После доработки 15 апреля 2019 г.
Принята к публикации 5 июля 2019 г.
Осуществлен синтез новых мономеров циклопропилметакрилатов, проведена их радикальная полиме-
ризация, установлены состав и структура этих полимеров, содержащие в макромолекуле чувстви-
тельные к УФ-облучению реакционноспособные фрагменты. Исследовано фотохимическое струк-
турирование и установлено, что синтезированные полимеры обладают фоточувствительностью,
а также оптической прозрачностью материалов и могут быть использованы в микроэлектронике
и в оптике.
Ключевые слова: циклопропан; фоточувствительность; оптическая прозрачность; фенилзамещенный
циклопропилметакрилат
DOI: 10.1134/S0044461819090056
Макромолекулы, содержащие различные фоторе-
закономерностей их радикальной полимеризации и
акционноспособные фрагменты в макроцепях, обла-
изучение свойств полученного полимера.
дают ценным комплексом свойств и возможностью
В работе предложена новая стратегия синтеза
сшивания таких полимеров под действием излуче-
получения функционально замещенного полимета-
ния, что позволяет получать на их основе резисты,
крилата с боковыми функциональными циклопропа-
используемые в микроэлектронике. С учетом этого
новыми фрагментами, способного образовывать фо-
проявляется большой интерес исследователей к полу-
точувствительные эластичные пленки. Также изучена
чению новых типов фоточувствительных полимеров
структура и свойства полимеров с целью разработки
для микроэлектроники [1-5].
новых фоточувствительных и прозрачных полимеров.
Полимеры, содержащие в макромолекулах ци-
клопропановые звенья с различными функциональ-
Экспериментальная часть
ными заместителями, представляют большой инте-
рес, поскольку характеризуются сбалансированным
ИК-спектры пленок полимера записаны на при-
комплексом свойств, в том числе фоточувствитель-
боре AgilentCary 630 FTIR, спектры ЯМР 1Н — на
ностью, оптической прозрачностью, и могут исполь-
спектрометре Bruker AFR-300 в CDCl3, химические
зоваться в полимерных резистных и оптических про-
сдвиги определены относительно тетраметилсилана.
зрачных материалах, в микроэлектронике и оптике.
Чистоту синтезированных соединений контролирова-
Одним из путей получения полимеров, содержащих
ли методами газожидкостной (ГЖХ) и тонкослойной
циклопропановые звенья с реакционноспособными
(ТСХ) хроматографии. ГЖХ-анализ проведен на хро-
функциональными группами, включая фрагменты,
матографах марки ЛХМ-8 МД модель-3 и Цвет-100.
является полимеризация синтезированных новых
В качестве жидких фаз были использованы Apiezon-L
мономеров [6-9].
(15%), XE-60 (5%) и ПЭГА (5%). Носителями служи-
Цель работы — синтез новых циклопропансо-
ли хроматон и целит-547, газ-носитель - гелий. Для
держащих метакрилатных мономеров, исследование ТСХ-анализа использовали стеклянные пластинки
1132
Гулиев К. Г. и др.
размерами 60 × 130, 130 × 180, 230 × 300 мм с не-
Найдено (%): С 64.28, Н 5.32, Сl 15.75.
закрепленным слоем SiO2 толщиной 1-2 мм и пла-
С12H13O2Cl. Вычислено (%): С 64.14, Н 5.79, Cl 15.81.
стинки Silufol UV размерами 30 × 60 и 160 × 160 мм
2-п-Нитрофенил-1-этоксикарбонилциклопро-
с закрепленным слоем адсорбента.
пан (3). Выход 65%, т. кип. 140-142°С (3 мм рт. ст.),
Чистота всех исходных соединений составляет
nD20 1.5610, d420 1.30. Спектр ЯМР 1Н, δ, м. д.: 7.50
98-99.9%. Исходные соединения имели следующие
м (4Наром), 2.09 м (1Н, СHциклопропан), 2.68 м (1Н,
характеристики: стирол (фирма-производитель Acros
СHциклопропан), 1.67 м (1Н, СН2циклопропан), 1.63 м (1Н,
Organics), т. кип. 145°С, nD20 1.5462, d420 0.9090;
СН2циклопропан),4.13 к (2Н, СН2), 1.12 т (3Н, СН3).
п-хлорстирол (фирма-производитель Alfa Aesar),
Найдено (%): С 61.11, Н 5.63, N 5.80.
т. кип. 191-192°С, nD20 1.5650, d420 1.0868; п-нитро-
С12H13O4N. Вычислено (%): С 61.28, Н 5.53, N 5.95.
стирол (фирма-производитель Alfa Aesar), т. кип.
Синтез 2-п-фенилзамещенных-1-гидроксиме-
93-96°С, nD20 1.5753, d420 1.1632; этилдиазоацетат
тилциклопропанов. В трехгорлую колбу емкостью
(синтезирован нами), т. кип. 140-141°C, nD20 1.4610,
500 мл, снабженную механической мешалкой, капель-
d420 1.085; хлорангидрид метакрилата (синтезирован
ной воронкой и обратным холодильником, помещали
нами), т. кип. 95-96°C, nD20 1.4420, d420 1.070.
9.1 г (0.25 г·моль) LiAlH4 в 200 мл абсолютного ди-
Реакция карбоэтоксикарбена с фенилзамещенны-
этилового эфира, прибавляли 0.25 моль (85 г·моль)
ми стиролами. Смесь 0.6 г·моль стирола или п-фе-
этилового эфира 2-фенилциклопропанкарбоновой
нилзамещеннего стирола и 0.2 г безводного сульфата
кислоты в течение 2.0-2.5 ч. При этом температуру
меди в качестве катализатора нагревали до 40-50°С и
реакционной среды поддерживали 25-35°С. После
при перемешивании по каплям прибавляли 0.5 моль
прибавления всего исходного эфира перемешивание
этилдиазоацетата (скорость прибавления 10-12 г·ч-1).
продолжали еще 30 мин. Затем в колбу по каплям
После прибавления всего этилдиазоацетата и пре-
приливали дистиллированную воду, а потом 5%-ный
кращения выделения азота реакционную смесь ох-
раствор соляной кислоты. Эфирный слой отделя-
лаждали до комнатной температуры. Катализатор
ли, водный слой экстрагировали эфиром (дважды
(СuSO4) отфильтровывали, фильтрат экстрагировали
по 20 мл). Эфирные вытяжки объединяли с эфир-
несколько раз с диэтиловым эфиром и объединяли
ным слоем и высушивали над прокаленным Na2SO4.
полученную реакционную массу. Далее перегоняли
После отгонки диэтилового эфира продукты реакции
диэтиловый эфир и разгоняли в вакууме. Вначале
разгоняли в вакууме. Аналогично синтезировали со-
был получен избыток стирола или фенилзамещенного
единения (5), (6).
стирола, а затем основная фракция (1)-(3).
В ИК-спектрах соединений (4)-(6) содержатся
В ИК-спектрах соединений (1)-(3) содержатся
полосы поглощения в области 3095-3100 (υС-Н цикла);
полосы поглощения в области 3095-3100, 1030-
2980, 2940, 2880 (υС-Н алиф); 2900-3100 см-1 (ОН).
1035 (υС-H цикла); 2980, 2940, 2880 (υC-H алиф), 750-760
2-Фенил-1-гидроксиметилциклопропан (4). Выход
(υCl); 1690, 1720 (υC=O); 1450-1500 см-1; 1570-1620,
92%, т. кип. 125-130°С (9 мм рт. ст.), nD20 1.5110, d420
1335 и 1525 см-1 (NO2) у соединения (3); полосы
1.335, МRD = 43.235. Спектр ЯМР 1Н, δ, м. д.: 6.92
690-750 см-1 внеплоскостных деформационных ко-
м (5Наром), 1.93 м (1Н, СHциклопропан), 2.61 м (1Н,
лебаний С-Н в монозамещенном бензоле соедине-
СHциклопропан), 1.63 м (1Н, СН2циклопропан), 1.65 м (1Н,
ния (1).
СН2циклопропан), 3.86 д (2Н, СН2О), 3.64 с (1Н, ОН).
2-Фенил-1-этоксикарбонилциклопропан (1). Выход
Найдено (%): С 81.25, Н 8.05.
90%, т. кип. 68-70°С (3 мм рт. ст.), nD20 1.5125, d420
С10H12O. Вычислено (%): С 81.08, Н 8.10.
1.08. Спектр ЯМР 1Н, δ, м. д.: 6.95 м (5Наром), 1.92 м
2-п-Хлорфенил-1-гидроксиметилциклопропан (5).
(1Н, СHциклопропан), 2.56 м (1Н, СHциклопропан), 1.65 м
Выход 94%, т. кип. 135-142°С (9 мм рт. ст.), nD20
(1Н, СН2циклопропан), 1.62 м (1Н, СН2циклопропан), 3.85 к
1.5225, d420 1.478, МRD = 48.998. Спектр ЯМР 1Н,
(2Н, СН2), 0.96 т (3Н, СН3).
δ, м. д.: 7.14 м (4Наром), 2.05 м (1Н, СHциклопропан),
Найдено (%): С 75.20, Н 7.91.
2.57 м (1Н, СHциклопропан), 1.66 м (1Н, СН2циклопропан),
С12H14O2. Вычислено (%): С 75.79, Н 7.37.
1.72 м (1Н, СН2циклопропан), 3.91 д (2Н, СН2О), 3.68 с
2-п-Хлорфенил-1-этоксикарбонилциклопропан (2).
(1Н, ОН).
Выход 82%, т. кип. 85-87°С (3 мм рт. ст.), nD20 1.5640,
Найдено (%): С 65.20, Н 6.75, Сl 19.94.
d420 1.32. Спектр ЯМР 1Н, δ, м. д.: 7.10 м (4Наром),
С10H11OСl. Вычислено (%): С 65.75, Н 6.03, Сl 19.45.
2.08 м (1Н, СHциклопропан), 2.55 м (1Н, СHциклопропан),
2-п-Нитрофенил-1-гидроксиметилциклопропан
1.71 м (1Н, СН2циклопропан), 1.65 м (1Н, СН2циклопропан),
(6). Выход 93%, т. кип. 131-149°С (2 мм рт. ст.), nD20
4.0 к (2Н, СН2), 1.0 т (3Н, СН3).
1.5190, d420 1.524, МRD = 49.998.Спектр ЯМР 1Н,
Синтез фоточувствительных циклопропансодержащих полимеров
1133
δ, м. д.: 7.55 м (4Наром), 2.17 м (1Н, СHциклопропан),
полимеров, которые наносили на стеклянную под-
2.60 м (1Н, СHциклопропан), 1.65 м (1Н, СН2циклопропан),
ложку размером 60 × 90 мм. Нанесение осуществля-
1.69 м (1Н, СН2циклопропан), 3.98 д (2Н, СН2О), 3.71 с
ли методом центрифугирования при 2500 об·мин-1.
(1Н, ОН).
После нанесения заготовки фоторезист выдерживали
Найдено (%): С 62.22, Н 5.40, N 7.80.
в течение не менее 20 мин для увеличения адгезии
С10H11O3N. Вычислено (%): С 62.18, Н 5.69, N 7.25.
фоторезиста к подложке. Затем фоторезист обре-
Синтез 2-п-фенилзамещенных 1-оксиметилцикло-
зали по контуру заготовки, не допуская отслоения
пропилметакрилатов. В колбу с обратным холодиль-
пленки. Толщину получаемых пленочных фоторе-
ником помещали 0.5 моль (74 г) 2-фенил-1-гидрок-
зистов замеряли микроинтерферометром Линника
симетилциклопропана в среде пиридина при 40°С на
МИИ-4. Толщина слоя резиста после его высушива-
2 ч, затем при перемешивании по каплям добавляли
ния в течение 10 мин при комнатной температуре и
0.6 моль хлорангидрида метакрилата в 30 мл абсо-
в течение 20 мин при 25°C/10 мм рт. ст. составляла
лютного бензола, после завершения реакции экстра-
0.2-0.3 мкм.
гировали, затем сушили, перегоняли легкие фракции,
Экспонирование заготовок с нанесенным фото-
а потом основную фракцию в вакууме. Аналогично
резистом осуществляли на установке с точечным
синтезировали соединения (8), (9).
источником света через фотошаблон.
В ИК-спектрах соединений (7)-(9) содержатся
Проявление вели в струйной установке. В качестве
полосы поглощения в области 1435-1440, 3095-3100
проявителя использовали диоксан:изопропиловый
(υС-Н цикла), 2880, 2940, 2980 (υС-Н алиф), 750-760 (υCl),
спирт = 1:2 при температуре 18-25°С. Критерием
1365 и 1335 см-1 (NO2).
фоточувствительности негативных фоторезистов
2-Фенил-1-оксиметилциклопропилметакрилат
при УФ-облучении является полнота прохождения
(7). Выход 95%, т. кип. 95-110°С (3 мм рт. ст.), nD20
фотохимической реакции полимеризации (сшивки)
1.4040, d420 0.878, МRD = 60.027. Спектр ЯМР 1Н,
молекул основы фоторезиста.
δ, м. д.: 7.25 м (5Наром), 1.91 м (1Н, СHциклопропан),
В качестве источника УФ-облучения использовали
2.58 м (1Н, СHциклопропан), 1.58 м (1Н, СН2циклопропан),
ртутную лампу ДРТ-220 (сила тока 2.2 А, расстояние
1.60 м (1Н, СН2циклопропан), 4.08 д (2Н, СН2О), 5.48 с
от источника излучения 15 см, скорость передвижной
(1Н, СН2винил. г), 5.89 с (1Н, СН2винил. г), 1.57 с (3Н,
заслонки экспонометра 720 мм·ч-1) время экспозиции
СН3-С=).
5-20 с. Содержание нерастворимого полимера рас-
Найдено (%): С 77.45, Н 7.83.
считывали по массе остатка.
С14H16O2. Вычислено (%): С 77.78, Н 7.40.
Фоточувствительность — величина, обратная дозе
2-п-Хлорфенил-1-оксиметилциклопропилметакри-
УФ-света, поглощенной фоторезистом, иначе говоря,
лат (8). Выход 96%, т. кип. 110-115°С (3 мм рт. ст.),
дозе, необходимой для перевода фоторезиста в нерас-
nD20 1.4105, d420 0.970, МRD = 63.787. Спектр ЯМР
творимое состояние. Она измеряется в см2·Вт-1·с-1 =
1Н, δ, м. д.: 7.36 м (4Наром), 1.88 м (1Н, СHциклопропан),
= см2·Дж-1:
2.63 м (1Н, СHциклопропан), 1.58 м (1Н, СН2циклопропан),
1.64 м (1Н, СН2циклопропан), 4.11 д (2Н, СН2О), 5.49 с
(1Н, СН2винил. г), 5.92 с (1Н, СН2винил. г), 1.66 с (3Н,
СН3-С=).
Найдено (%): С 67.24, Н 5.57, Сl 14.81.
где H — экспозиция (или доза облучения УФ светом)
С14H15O2Сl. Вычислено (%): С 67.07, Н 5.98, Сl 14.17.
(Дж·см), E — интенсивность (Вт·см-2), τ — длитель-
2-п-Нитрофенил-1-оксиметилциклопропил-
ность облучения (с).
метакрилат (9). Выход 94%, т. кип. 117-125°С
(3 мм рт. ст.), nD20 1.4080, d420 0.950, МRD = 67.585.
Обсуждение результатов
Спектр ЯМР 1Н, δ, м. д.: 7.60 м (4Наром), 2.18 м (1Н,
СHциклопропан), 2.70 м (1Н, СHциклопропан), 1.66 м (1Н,
Вначале было изучено образующееся соединение
СН2циклопропан), 1.72 м (1Н, СН2циклопропан), 4.22 д (2Н,
при взаимодействии карбоэтоксикарбена со стиролом
СН2О), 5.66 с (1Н, СН2винил. г), 6.01 с (1Н, СН2винил. г),
и п-замещенными стиролами в условиях термока-
1.89 с (3Н, СН3-С=).
талитического разложения этилдиазоацетата в при-
Найдено (%): С 64.73, Н 5.18, N 5.66.
сутствии безводного CuSO4 по следующей реакции,
С14H15O4N. Вычислено (%): С 64.36, Н 5.75, N 5.36.
в результате которой по восстановлению получен-
Для структурирования синтезированных сопо-
ных соединений (1)-(3) были получены соединения
лимеров были приготовлены 2-10%-ные растворы
(4)-(6):
1134
Гулиев К. Г. и др.
CuSO4
R-C6H4-CH=CH2 + N2CHCO2C2H5
R-C6H4-CH-CH-CO2C2H5
CH2
(1)-(3)
LiAlH4
R-C6H4-CH-CH-CH2OH,
CH2
(4)-(6)
где R = H (1), (4); Cl (2), (5); NO2 (3), (6).
транс:цис = 70:30. Чистота синтезированного соеди-
На основании спектральных данных и ГЖХ-
нения контролировалась методом ГЖХ-анализа и во
анализа было установлено, что все синтезированные
всех случаях составляла свыше 99.2%.
соединения являются смесью двух геометрических
Фенил- и п-фенилзамещенные циклопропилмета-
транс- и цис-изомеров (относительно трехчленного
крилата (7)-(9) были получены по реакции
цикла); соотношение этих изомеров соответствует
где X = H (7), (10); Cl (8), (11); NO2 (9), (12).
Валентно-деформационным колебаниям бензо-
Радикальную полимеризацию проводили в блоке
льного кольца принадлежат полосы поглощения при
и в растворе бензола в запаянных ампулах при 70ºС в
1608, 1580, 1496 и 1456 см-1 в спектрах полимеров,
присутствии динитрила азобисизомасляной кислоты
полученных из мономеров (7)-(9). Полосы погло-
(ДАК) (0.3 от массы мономера). Полученные полиме-
щения в области 1035-1040 см-1 можно отнести к
ры представляют собой белые порошки, растворимые
циклопропановым группам, наблюдающимся в ИК-
в ароматических и хлорсодержащих углеводородах
спектрах как мономеров, так и полимеров. Изменения
и нерастворимые в алифатических углеводородах и
в ИК-спектрах полимеров, а именно отсутствие поло-
низших спиртах.
сы поглощения в областях 900-1000, 1640-1645 см-1,
С целью установления структуры полученных по-
относятся к деформационным и валентным коле-
лимеров были проведены спектральные (ИК и ЯМР)
баниям двойной связи винильной группы. В ЯМР-
и элементные анализы образцов. Путем сопоставле-
спектре (рис. 1) полимеров отчетливо проявляют-
ния ИК-спектров полученных полимеров со спек-
ся резонансные сигналы, относящиеся к протонам
трами исходных мономеров, которым принадлежат
бензольного ядра (δ = 6.80-7.60 м. д.) и циклопро-
полосы поглощения 1720 см-1, были обнаружены
панового кольца (δ = 0.25-2.60 м. д.), а протонные
полосы поглощения, характеризующие валентные
сигналы, относящиеся к протонам винильной группы
колебания карбонильной группы у образующихся по-
(δ = 4.50-5.05 м. д.), отсутствуют в полимерном об-
лимеров при 1730 см-1. Смещение максимума полосы
разце.
поглощения, характеризующего группу С=О, связано
Результаты спектральных анализов показали, что
с раскрытием двойной связи, что приводит к наруше-
полимеризация протекает только по двойной связи
нию сопряжения и перераспределению электронной
винильной группы, а реакционноспособные фраг-
плотности в системе.
Синтез фоточувствительных циклопропансодержащих полимеров
1135
Рис. 1. ЯМР-спектры синтезированных соединений.
1 — 2-фенил-1-этоксикарбонилциклопропан, 2 — 2-фенил-1-гидроксиметилциклопропан, 3 — 2-фенил-1-оксиметилцикло-
пропилметакрилат, 4 — поли-2-фенил-1-оксиметилциклопропилметакрилат.
скорости полимеризации п-фенилзамещенных цикло-
пропилметакрилатов в основном зависит от поли-
менты (
) в боковой цепи
меризующего влияния заместителя, находящегося в
пара-положении фенильного кольца. Выявлено, что
оставались без изменений.
полимеризация хлорфенильного эфира метакриловой
Для оценки способности мономеров (7)-(9) к по-
кислоты проводилась в блоке при температуре 70°С
лимеризации была исследована зависимость выхода
в аналогичных условиях.
полимеров от продолжительности полимеризации
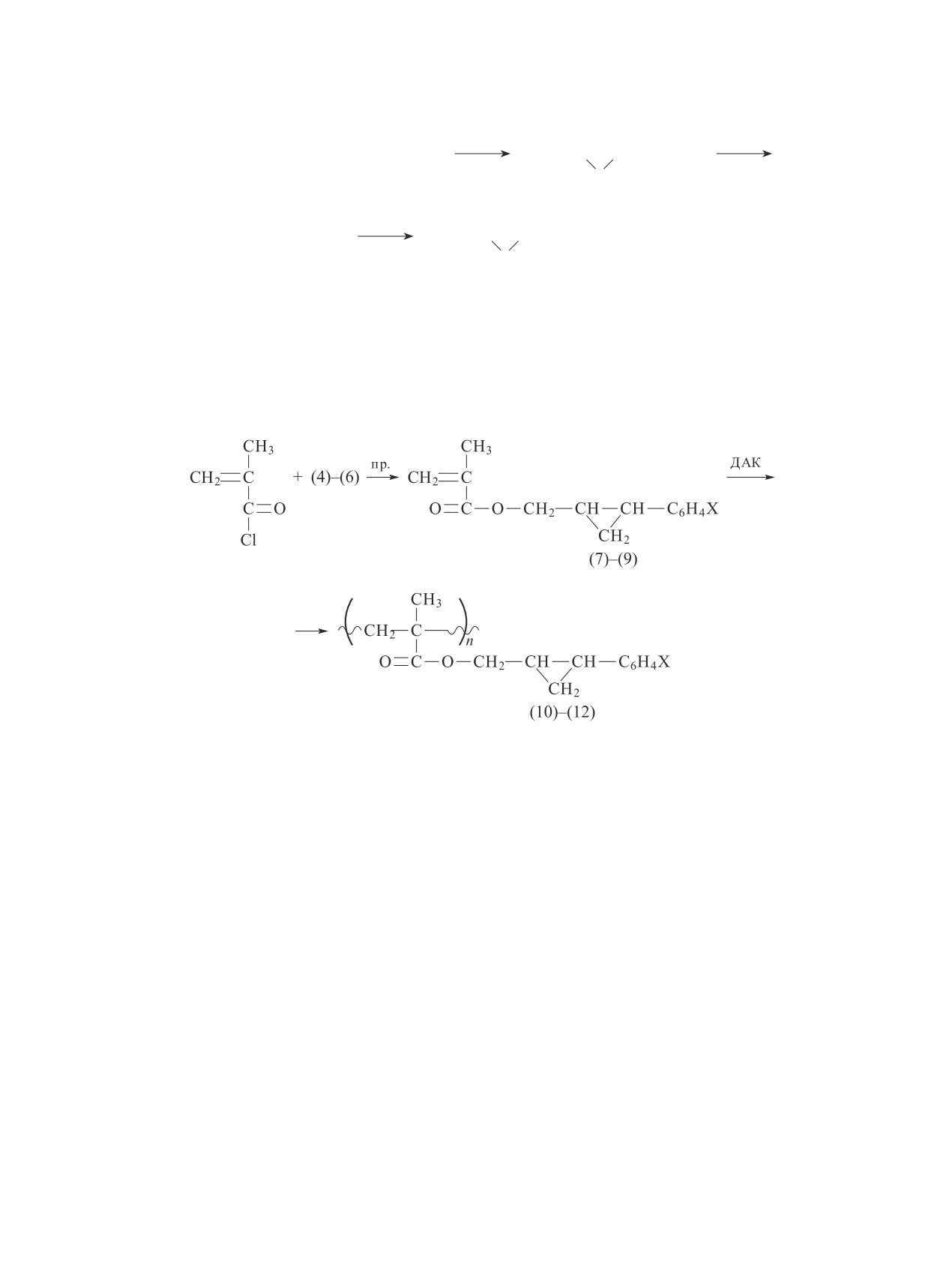
Из рис. 2 следует, что полимеризация хлорфениль-
при выбранных стандартных условиях. На рис. 2
ного эфира метакриловой кислоты (А) протекает с
представлены полученные кинетические кривые
большой скоростью, превосходящей скорость поли-
полимеризации мономеров (7)-(9) и п-хлорфенил-
меризации мономеров (7)-(9). Такой факт, вероят-
метакрилата (А). При сопоставлении кинетических
но, связан с влиянием заместителя хлорфенильной
кривых видно, что по скорости полимеризации син-
группы через -О- с карбонильной группой, которая
тезированные мономеры (7)-(9) и п-хлорфенилмета-
сопряжена с винильным фрагментом.
крилат заметно различаются между собой и в зависи-
Наблюдаемый порядок активности мономеров
мости от фенильного заместителя в пара-положении
в радикальной полимеризации не связан непосред-
образуют ряд А > (9) > (8) > (7). Такая закономерность
ственно с эффектом сопряжения. Хотя УФ-спектры
1136
Гулиев К. Г. и др.
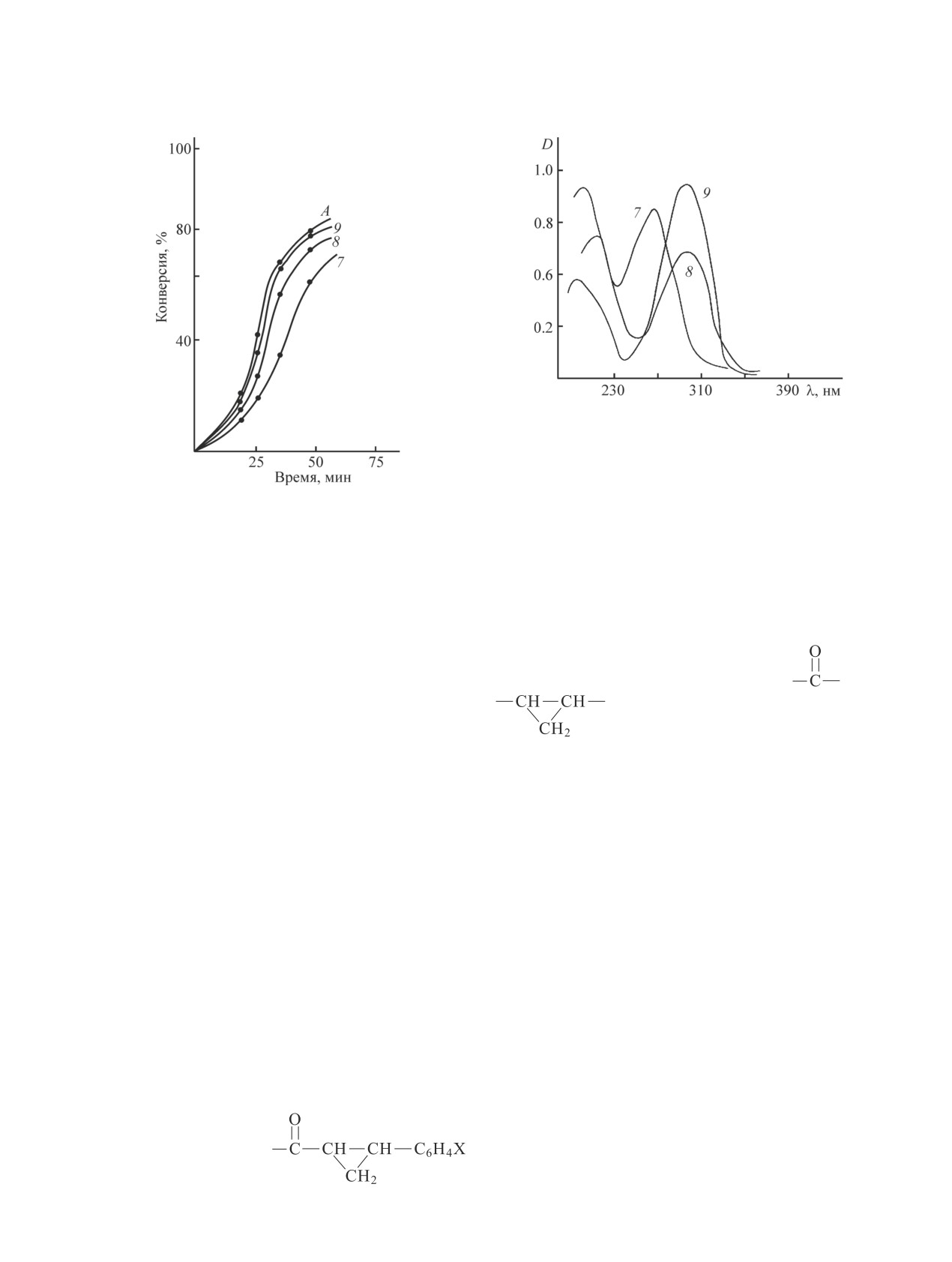
Рис. 3. УФ-спектры синтезированных соединений.
7 — 2-фенил-1-оксиметилциклопропилметакрилат, 8 —
2-п-хлорфенил-1-оксиметилциклопропилметакрилат, 9 —
2-п-нитрофенил-1-оксиметилциклопропилметакрилат.
Рис. 2. Зависимость конверсии от продолжительности
реакции полимеризации.
которые увеличивают чувствительность полимеров
7 — 2-фенил-1-оксиметилциклопропилметакрилат, 8 —
к УФ-свету и склонны к фотохимическим реакциям,
2-п-хлорфенил-1-оксиметилциклопропилметакрилат, 9 —
приводящим к сшиванию полимерных цепей. В ис-
2-п-нитрофенил-1-оксиметилциклопропилметакрилат, А —
следуемом полимере основную функциональную
п-хлорфенилметакрилат.
нагрузку несет карбонильная группа. Выявлено, что
полимер обладает в основном различными погло-
(рис. 3) этих мономеров свидетельствуют об изме-
нении полосы поглошения. По-видимому, важную
роль на стадии роста цепи играют пространственные
щающими группировками, такими как
, Cl и
факторы. Другим важным фактором, влияющим на
. С учетом вышеперечисленных осо-
характер полимеризации, может быть относительная
стабильность радикала, ответственного за рост цепи.
бенностей и строения используемых высокомоле-
Выявлено, что полимеризация всех мономеров
кулярных систем эти полимеры должны обладать
при радикальной полимеризации мономеров в массе
светочувствительностью. При УФ-облучении пленки
сопровождается автоускорением. Начало автоуско-
полимера в результате раскрытия циклопропановых
рения начинается при превращении мономеров в
колец и при их рекомбинации, вероятно, образуется
процессе полимеризации ~25%, что согласуется с
циклогексановый цикл, играющий роль сшивок, и
данными [10].
полимер становится нерастворимым. Предполагаем,
Синтезированные полимеры, содержащие чув-
что механизм протекает по схеме [1, 11].
ствительные к УФ-облучению реакционноспособные
Было установлено, что процессы сшивания ма-
группы, представляют собой ценный объект фотохи-
кромолекулярных цепей под действием актиничного
мических исследований и могут служить основой для
облучения протекают значительно быстрее процес-
создания фоточувствительных материалов. Наличие
сов окисления. Фотореакционноспособные фраг-
в звеньях макромолекулы полученного полимера ре-
менты были рассмотрены с разной концентрацией
акционноспособных группировок разной химической
полимера в тонких пленках. В УФ-спектрах полу-
природы вызывает интерес к исследованию фотохи-
ченных полимерных пленок наблюдаются полосы
мического структурования указанного полимера, т. е.
поглощения в интервале ~275 и ~285 нм. Для выяс-
к сшивке под действием УФ-облучения. Интенсивное
нения путей и механизмов протекания фотореакции
протекание фотохимических процессов в полимере
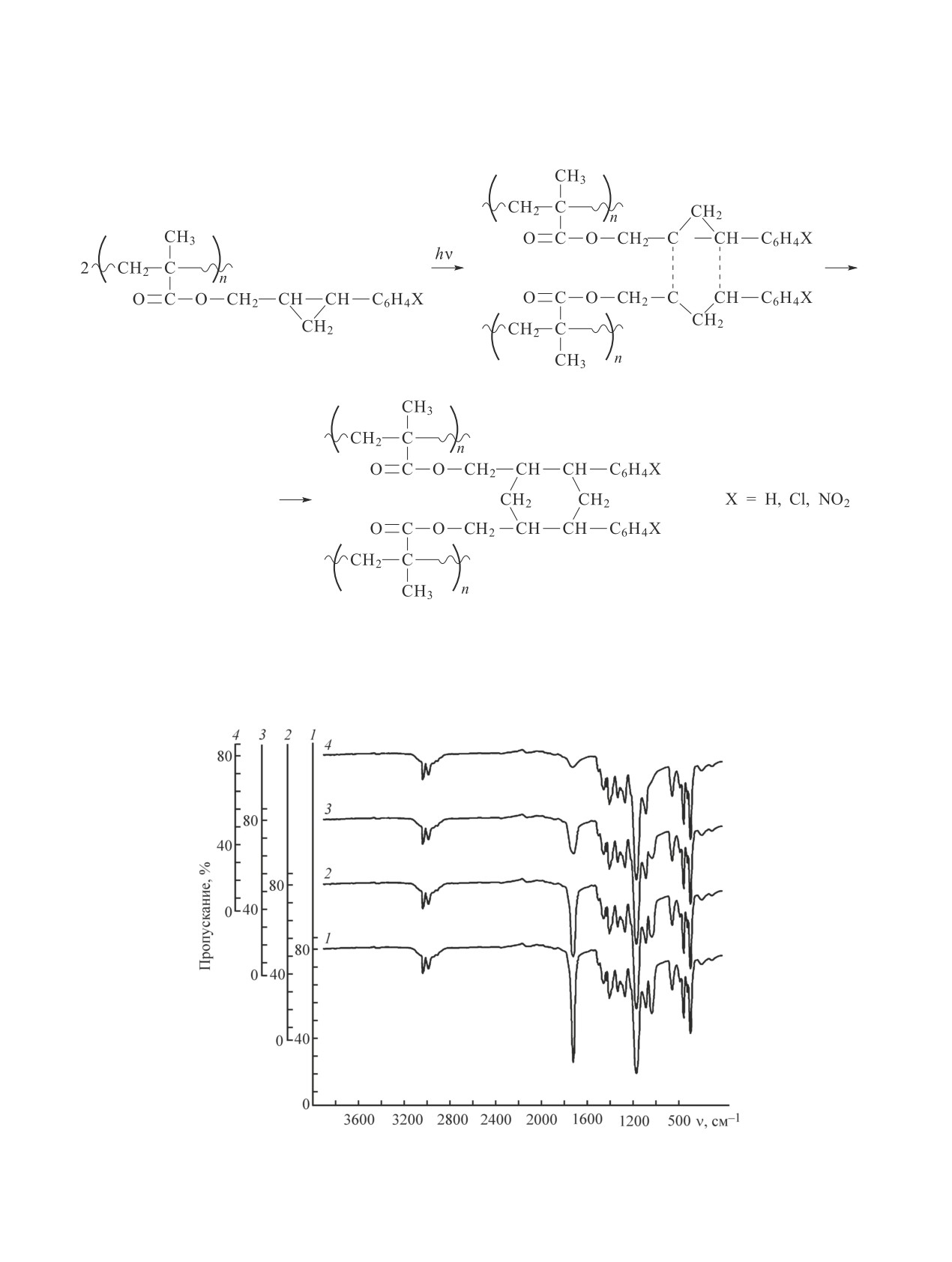
изучали ИК-спектры (рис. 4) на различных стадиях
вызывается присутствием в нем таких сильнопогло-
УФ-облучения. В процессе фотореакции при УФ-
облучении происходит уменьшение интенсивности,
щающих группировок, как
,
затем исчезновение полос поглощения при 1720 и
1035 см-1, соответствующих карбонильным и ци-
Синтез фоточувствительных циклопропансодержащих полимеров
1137
Схема
•
•
•
•
клопропановым фрагментам, находящимся в боко-
счет раскрытия циклопропанового кольца с участием
вой цепи макромолекулы. Это, вероятно, показывает,
карбонильной группы в фотохимических реакциях.
что процесс фотоструктурирования происходит за
Результаты проведенных исследований показали воз-
Рис. 4. ИК-спектр пленки полимера поли-2-фенил-1-оксиметилциклопропилметакрилата: необлученной (1) и об-
лученной в течение 5 (2), 10 (3) и 25 с (4).
1138
Гулиев К. Г. и др.
можность синтеза нового ценного негативного фото-
Гулиев Абасгулу Мамедоглы, д.х.н., проф., член-
чувствительного полимера (35-40 см2·Дж-1) с целью
создания основы фоточувствительного материала.
org/0000-0002-8736-2383
Выявлено, что толщина пленок играет большую роль
при облучении. Хорошие результаты были получены
при работе с пленками толщиной 0.2-0.3 мкм. После
Список литературы
30-80 с облучения (преобразование 40-75%) поли-
[1] Моро У. Микролитография: принципы, методы,
мерные пленки становятся нерастворимыми в орга-
материалы / Пер. с англ. под ред. Д. Х. Тимеровой.
нических растворителях, в которых они растворялись
М.: Мир, 1990. Ч. 1. 606 с. [Moreau Wayne M.
при комнатной температуре до облучения.
Semiconductor Lithography: Principles, Practices, and
Синтезированные полимеры обладают также хо-
Materials. NewYork: Plenum Press, 1988].
рошими оптическими показателями (nD20 1.5130-
[2] Reichmanis E., Nalamasu O., Houhihan F. M., No-
1.5215), сохраняют прозрачность вплоть до 100°С
vembre A. E. Radiation chemistry of polymeric
при выдержке в течение 1-1.5 ч. Показано, что
materials: novel chemistry and applications for
светопропускание в видимой части спектра состав-
microlithography // Polym. Int. 1999. V. 48. N 10.
ляет 85-90% и мало зависит от толщины образца до
0126(199910)48:10<1053::AID-PI268>3.0.CO;2-T
6-8 мм, при относительно высокой толщине проис-
[3] Булгакова С. А., Мазанова Л. М., Лопатин А. Я.,
ходит частичное ухудшение оптических свойств, что
Корсаков В. С., Новожилов А. В. Резисты с химиче-
характерно для всех известных прозрачных матери-
ским усилением на основе полимера трет-буток-
алов.
сикарбонилоксистирола и его сополимеров с ме-
Синтезированные полимеры могут использоваться
тилметакрилатом // Высокомолекуляр. соединения.
как фоточувствительные полимерные материалы, а
2004. Т. 46А. № 6. С. 1052-1060 [Bulgakova S. A.,
также в оптике в качестве оптически прозрачного
Mazanova L. M., Lopatin A. Ya., Korsakov V. S.,
материала.
Novozhilov A. V. Chemical amplification resists based
on a tert-butoxycarbonyloxystyrene homopolymer and
its copolymers with methyl methacrylate // Polym. Sci.
Выводы
Ser. A. 2004. V. 46. N 6. P. 657-663].
[4] Вайнер А. Я., Дюмаев К. М., Лихачев И. А.,
1. Синтезированы новые полифункциональные
Шалатонова А. Д., Ярцев Ю. А. Метакрилатные
мономеры — циклопропилметакрилаты, осущест-
производные карбоксилсодержащих полиими-
влена их радикальная гомополимеризация, установ-
дов: синтез и фотохимические превращения //
лены состав и структура синтезированных поли-
ДАН. 2004. Т. 396. № 3. С. 362-365 [Vainer A. Ya.,
меров, полученных на основе соответствующих
Dyumaev K. M., Likhachev I. A., Shalatonova A. D.,
мономеров.
Yartsev Yu. A. Methacrylate derivatives of carboxyl-
2. Изучены процессы УФ-структурирования по-
containing polyimides: synthesis and photochemical
лимеров и установлено, что синтезированные по-
transformations // Doklady Phys. Chem. 2004. V. 396.
лимеры обладают относительно высокой фоточув-
N 1-3. P. 115-118. DOI: 10.1023/B:DOPC.000002916
ствительностью (35-40 см2·Дж-1), а также являются
7.69210.4c].
хорошими оптически прозрачными материалами.
[5] Hou H., Jiang J., Ding M. Ester-type precursor of
polyimide and photosensitivity // Eur. Polym. J. 1999.
S0014-3057(98)00290-0
Конфликт интересов
[6] Гулиев К. Г., Пономарева Г. З., Гулиев А. М.
Авторы заявляют об отсутствии конфликта инте-
Фоточувствительность полимеров на базе эпокси-
ресов, требующего раскрытия в данной статье.
замещенных винилфенилциклопропанов // ЖПХ.
2006. Т. 79. № 3. С. 497-500 [Guliev K. G., Ponoma-
reva G. Z., Guliev A. M. Photosensitivity of polymers
Информация об авторах
based on epoxy-substituted vinylphenylcyclopropanes
// Russ. J. Appl. Chem. 2006. V. 79. N 3. P. 488-491.
Гулиев Казым Гафароглы, д.х.н., ORCID: https://
DOI: 10.1134/S1070427206030323].
orcid.org/0000-0002-5063-4410
[7] Гулиев К. Г., Пономарева Г. З., Гулиев А. М.
Рзаева Айсель Эльшадгызы, м.н.с., аспирант
Синтез и свойства эпоксисодержащих полицикло-
Института полимерных материалов НАН Азербай-
пропилстиролов // Высокомолекуляр. соединения.
2007. Т. 49Б. № 8. С. 1577-1581 [Guliev K. G., Pono-
Синтез фоточувствительных циклопропансодержащих полимеров
1139
mareva G. Z., Guliev A. M. Synthesis and properties of
cinnamate // Russ. J. Appl. Chem. 2013. V. 86. N 1.
epoxy-containing poly(cyclopropylstyrenes) // Polym.
P. 92-95. DOI: 10.1134/S1070427213010165].
Sci. Ser. B. 2007. V. 49. N 8. P. 196-199. DOI: 10.1134/
[10] Лачинов М. Б., Королев Б. А., Древаль В. Е., Че-
S1560090407070068].
рен Е. И., Зубов В. П., Виноградов Г. В., Каба-
[8] Гулиев К. Г., Пономарева Г. З., Мамедли С. Б.
нов В. А. Связь автоускорения при радикальной
Сополимеризация некоторых 2-алкоксиметил-1-(ви-
полимеризации метилметакрилата в массе со
нилфенил)циклопропанов со стиролом // Процессы
структурными изменениями полимеризующейся
нефтехимии и нефтеперераб. 2009. 10. № 2. С. 183-
системы // Высокомолекуляр. соединения. 1982.
186.
Т. 24А. № 10. С. 2220-2226.
[9] Гулиев К. Г., Алиева А. М., Гулиев А. М. Синтез и
[11] Egerton P., Trigg J., Hyde E., Reiser A. Ester-type
полимеризация (п-винилфенил)циклопропилметил-
precursor of polyimide and photosensitivity //
циннамата // ЖПХ. 2013. Т. 86. № 1. С. 101-104
Macromolecules. 1981. V. 14. N 1. P. 100-104. DOI:
[Guliev K. G., Alieva A. M., Guliev A. M. Synthesis and
polymerization of (p-Vinylphenyl)cyclopropylmethyl