Выделение хлористого натрия из концентрированных сточных вод химических производств
1157
Журнал прикладной химии. 2019. Т. 92. Вып. 9
УДК 661.833.321:661.727.4:544.351.3-16:628.31
ВЫДЕЛЕНИЕ ХЛОРИСТОГО НАТРИЯ
ИЗ КОНЦЕНТРИРОВАННЫХ СТОЧНЫХ ВОД ХИМИЧЕСКИХ ПРОИЗВОДСТВ
© Г. С. Дмитриев1, Л. Н. Занавескин1, Т. Е. Шорина1,2, М. Н. Махин1
1 Институт нефтехимического синтеза им. А. В. Топчиева РАН,
119991, г. Москва, Ленинский пр., д. 29
2 Российский химико-технологический университет им. Д. И. Менделеева,
125047, г. Москва, Миусская пл., д. 9
E-mail: dmitriev.gs@mail.ru
Поступила в Редакцию 23 апреля 2019 г.
После доработки 17 июня 2019 г.
Принята к публикации 4 июля 2019 г.
Исследован процесс выделения хлористого натрия из его водных растворов с концентрациями более
14.65 мас% путем добавления в систему ацетона. Получено уравнение растворимости NaCl в си-
стеме вода-ацетон-NaCl при концентрациях ацетона более 84.5 мас%. Показано, что оптимальное
соотношение масс ацетона и исходного раствора соли составляет (8-9):1. При этом выпадает в
осадок более 94% NaCl. Приведена блок-схема процесса очистки сточных вод химических производств
с высоким содержанием NaCl.
Ключевые слова: хлористый натрий; вода; ацетон; растворимость; сточная вода
DOI: 10.1134/S0044461819090081
Существует ряд химических производств хлорной
350 мг·л-1 хлорид-ионов. Так, например, 1 м3 сточ-
промышленности, отходами которых являются сточ-
ной воды, содержащей 15 мас% хлористого натрия,
ные воды с высоким содержанием хлористого натрия
требует для его разбавления 330 м3 воды, не содер-
(15-22 мас%). К таким производствам, например,
жащей хлоридов. Такую степень разбавления могут
относятся процессы получения эпоксидно-диановых
обеспечить БОС только очень крупных городов. Для
смол [1] и эпихлоргидрина [2]. Утилизация сточ-
большинства же отечественных предприятий такой
ных вод с большой концентрацией NaCl вызывает
метод утилизации сточной воды недоступен.
определенные трудности. До недавнего времени этот
В то же время сточные воды с высокой концен-
вопрос решался достаточно просто: солесодержащие
трацией NaCl являются потенциальным источником
сточные воды закачивались обратно в выработанные
этой соли. Если реализовать способ выделения вы-
скважины по добыче хлористого натрия или слива-
сокочистого хлористого натрия из этих сточных вод
лись в море. Сегодня в условиях повышенного внима-
или полное удаление из них органических примесей,
ния к экологии такие методы неприемлемы, и вопрос
то полученный рассол мог бы быть использован для
очистки сточных вод, обогащенных солью, составля-
электролитического получения Cl2 и NaOH.
ет большую проблему. Наиболее простым решением
Наиболее часто встречающимся в литературе спо-
является смешение производственных сточных вод с
собом выделения хлористого натрия из концентриро-
бытовыми и их совместная очистка на биологических
ванных сточных вод является упаривание раствора,
очистных сооружениях (БОС). С учетом того что
сопровождающееся кристаллизацией солей [3-5].
хлористый натрий не удаляется из воды на станциях
В ряде случаев в упаренный до насыщения раствор
БОС, требуется разбавление солесодержащих сточ-
вводят электролит, уменьшающий растворимость
ных вод до норм сброса в водные объекты, которые
NaCl, например едкий натр [6] или хлористый водо-
в соответствии с СанПиН 2.1.4.1175-02 составляют
род [7]. Однако этот метод требует высоких энергети-
1158
Дмитриев Г. С. и др.
ческих затрат на выпарку воды и не может обеспечить
с детектором по теплопроводности. Параметры ана-
чистоту образующейся твердой соли, но в то же время
лиза: колонка набивная длиной 2 м и диаметром 3 мм,
приводит к образованию сточной воды, насыщенной
фаза — полисобр-1, температура детектора 200°С,
другим минеральным соединением. Методы, осно-
температура испарителя 220°С, температурный ре-
ванные на мембранных технологиях (осмос, диализ)
жим колонок: 70-180°С с программируемым нагре-
[8, 9] и ионном обмене, позволяют очистить сточные
вом.
воды от минеральных солей, в том числе NaCl, но при
этом не позволяют выделить из сточной воды NaCl с
Обсуждение результатов
целью использования для электролиза.
Настоящее исследование посвящено разработке
Хлористый натрий ограниченно растворим в воде:
способа выделения NaCl из сточных вод, доступного
26.41 мас% при 20°С — и практически нерастворим
практически для любого химического предприятия и
в ацетоне (3.2·10-5 мас% при 18°С). В водно-ацето-
основанного на уменьшении растворимости NaCl при
новых смесях по мере увеличения концентрации аце-
смешении рассола с органическими растворителями,
тона растворимость NаCl снижается. Особенностью
в частности с ацетоном.
системы вода-ацетон-NaCl является образование
одновременно двух жидких водно-ацетоновых рас-
творов, имеющих разный состав и насыщенных хло-
Экспериментальная часть
ристым натрием, при использовании в качестве рас-
Исследования проводили с растворами NaCl, при-
творителя смеси ацетон-вода с содержанием первого
готовленными из химически чистой соли, а также со
компонента 25-82 мас% [10]. Снижение или увеличе-
сточной водой, содержащей 16.87 мас% NaCl, процес-
ние концентрации ацетона приводит к образованию
са синтеза эпоксидно-диановых смол [1].
одного гомогенного раствора.
Эксперименты проводили в стеклянном реакторе
Применительно к поставленной цели интерес
объемом 100 мл, снабженном рубашкой, обратным
представляют гомогенные растворы с минимальной
холодильником и пробоотборником. Перемешивание
растворимостью NaCl, которые существуют при кон-
осуществляли с помощью магнитной мешалки.
центрациях ацетона в растворе более 82%.
В реактор загружали рассчитанные количества рас-
Проведенные эксперименты позволили опреде-
твора NaCl (или сточной воды процесса получения
лить растворимость хлористого натрия в этих рас-
эпоксидно-диановых смол) и ацетона (Ац), при пе-
творах (рис. 1).
ремешивании содержимое реактора термостатиро-
Образование одного водно-ацетонового раствора,
вали, по достижении заданной температуры пере-
насыщенного хлористым натрием, возможно при кон-
мешивание осуществляли в течение 15 мин, затем
центрациях ацетона в этом растворе более 84.5 мас%.
мешалку выключали и после отстаивания отбира-
Уменьшение концентрации ацетона ниже этой вели-
ли пробу водно-ацетонового раствора для анализа.
чины, как было упомянуто выше, приводит к обра-
Эксперименты проводили при температурах 23 и
зованию двух жидких фаз и твердой соли, причем
40°С.
в меньшей по объему жидкой фазе аккумулируется
Содержание NaCl определяли потенциометриче-
выпавший в осадок хлористый натрий, что выглядит
ским титрованием раствором AgNO3. Определение
как кашеобразная суспензия белого цвета. В изучен-
концентрации воды и ацетона осуществляли методом
ной области концентраций (рис. 1) растворимость
газожидкостной хроматографии на приборе Цвет-800
NaCl описывается уравнением
WNaCl = -1.6·10-4WАц3 + 4.73·10-2WАц2 - 4.67WАц + 1.54·102 [мас%],
(1)
где WАц — массовая доля ацетона в насыщенном
4.7-кратный массовый избыток. При этом из раство-
хлористым натрием водно-ацетоновом растворе
ра концентрацией 14.65 мас% выпадет в осадок 83%
(WАц ≥ 84.5 мас%).
NaCl от его исходного количества. А при добавлении
На рис. 2 представлены результаты эксперимен-
такого же количества ацетона к 24.58 мас%-ному
тальных данных по зависимости степени выделения
раствору соли в осадок выпадает 92% NaCl.
NaCl от массового избытка ацетона.
Необходимо отметить, что при mАц/mрассол <10 по-
Для исследованных концентраций растворов
сле прекращения перемешивания осадок хлористого
(14.65-24.58 мас% NaCl) минимальное количество
натрия полностью оседает за 5-10 с. При более вы-
ацетона, которое необходимо добавить, составляет
сокой концентрации ацетона основная часть осадка
Выделение хлористого натрия из концентрированных сточных вод химических производств
1159
ство ацетона, по полученным нами эксперименталь-
ным данным можно рассчитать количество NaCl в
осадке и в растворе.
Данные рис. 1 могут быть представлены в виде
зависимости соотношения массовых долей компо-
нентов раствора:
ц
(2)
ц
Тогда масса растворенного NaCl в образовавшемся
водно-ацетоновом растворе [m(NaCl)р] и его массовая
доля [W(NaCl)р], а также масса выпавшей в осадок
соли [m(NaCl)осадок] могут быть вычислены по урав-
нениям
Рис. 1. Зависимость растворимости NaCl в водно-
ацетоновом растворе от массовой доли ацетона в нем,
температура 23°С.
(3)
где
— массовая доля NaCl в исходном рассоле,
хлористого натрия (97-98%) оседает также быстро,
выраженная в долях; mрассол — масса исходного рас-
но при этом образуются мелкодисперсные части-
сола; mАц — масса ацетона, добавляемая к исходному
цы (2-3% от массы всего осадка), которые придают
рассолу;
мутность раствору, и их полное осаждение длится
около 3 ч.
(4)
Незначительное увеличение доли выделенного
NaCl при увеличении mАц/mрассол > 9 и сопутствую-
(5)
щее этому существенное увеличение времени осаж-
дения осадка позволяют выбрать оптимальный мас-
совый избыток ацетона, равный (8-9):1.
Применимость полученных уравнений (3)-(5)
На практике обычно известны количество и состав
была проверена в эксперименте со сточной водой
исходного раствора соли. Задав то или иное количе-
процесса получения эпоксидно-диановых смол.
Для эксперимента был взят образец сточной воды
(16.87 мас% NaCl) в количестве 5.98 г и смешан с
48.09 г ацетона. Отношение масс mАц/mH2O составило
8.04. Экспериментально была определена массовая
доля хлористого натрия в образовавшемся водно-
ацетоновом слое: 0.083 мас%.
Расчет по уравнениям (3)-(5) позволил рассчи-
тать массу хлористого натрия в растворенном ви-
де 0.0441 г, массу NaCl в осадке 0.9647 г и массо-
вую долю растворенного в водно-ацетоновом слое
NaCl 0.083 мас%. Результаты расчета и эксперимен-
та совпали. При этом в осадок выделилось 95.63%
хлористого натрия от его исходного количества в
рассоле.
В исходной сточной воде процесса получения
эпоксидно-диановых смол присутствуют примеси
толуола (0.2 мас%), эпоксидных смол (0.07 мас%)
Рис. 2. Степень выделения NaCl от соотношения масс
и глицерина (0.7 мас%). Наличие этих примесей не
ацетона и рассола, к которому он был добавлен, темпе-
ратура 23°С.
повлияло на результат проведенных расчетов. Все
эти примеси растворяются в ацетоне и переходят
Концентрация NaCl в исходном рассоле (мас%): 1 — 24.58,
2 — 19.65, 3 — 14.65.
в образовавшийся водно-ацетоновый раствор. При
1160
Дмитриев Г. С. и др.
воды процесса получения эпоксидно-диановых смол,
был отфильтрован, промыт чистым ацетоном и высу-
шен на воздухе; концентрация основного вещества
составила 100 мас%.
На рис. 3 представлены данные по концентрации
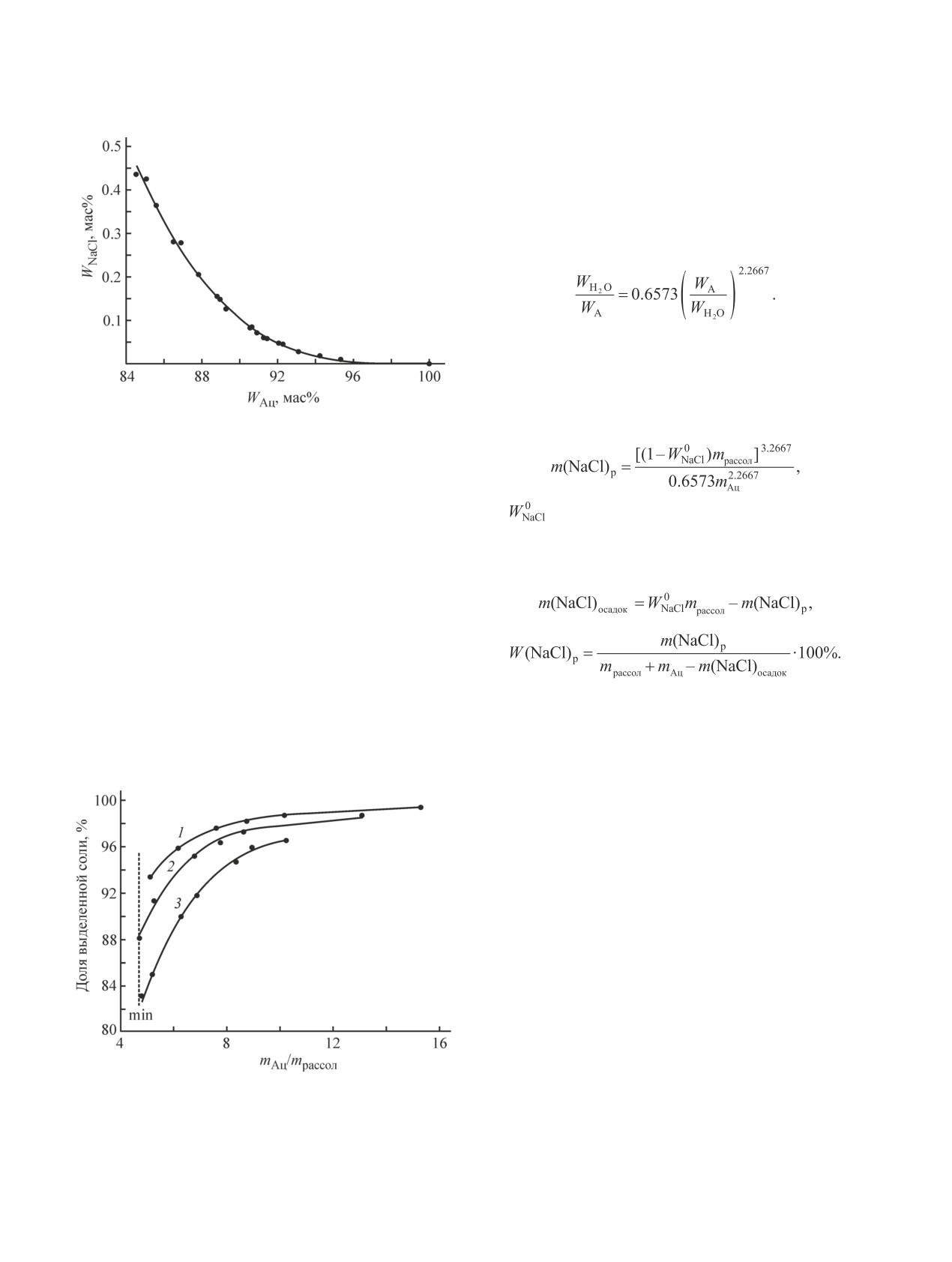
NaCl в воде после отгонки ацетона.
При оптимальном соотношении масс ацетона и
исходного рассола, равном (8-9):1, предлагаемый
процесс позволяет снизить концентрацию хлористого
натрия в сточной воде с 15-25 до 0.5-1.0 мас%.
Температурная зависимость растворимости хлори-
стого натрия в воде и ацетоне низка, поэтому вполне
естественно, что в эксперименте c 14.65 мас%-ным
рассолом при mАц/mH2O = 8.076 растворимость NaCl
в водно-ацетоновом растворе в интервале температур
Рис. 3. Зависимость массовой доли NaCl в водном рас-
23-40°C не изменилась и составила 0.089 мас%.
творе после отгонки ацетона из водно-ацетонового рас-
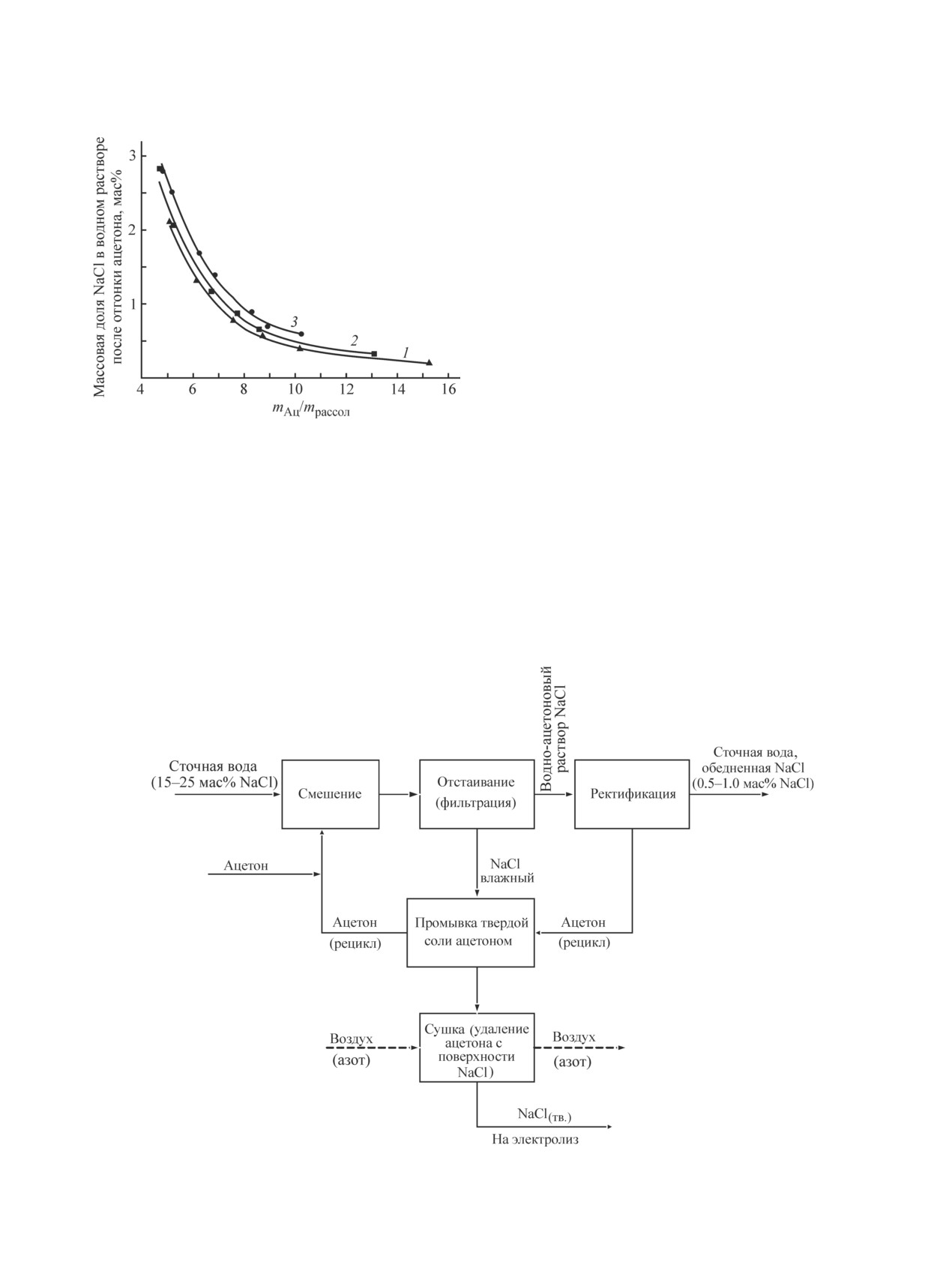
На рис. 4 представлена блок-схема предлагаемого
, температура 23°С.
твора от mАц/mрассол
процесса выделения NaCl из сточных вод.
Концентрация NaCl в исходном рассоле (мас%): 1 — 24.58,
Сточная вода химического производства, содержа-
2 — 19.65, 3 — 14.65.
щая более 15 мас% хлористого натрия, подвергается
смешению с ацетоном. После разделения образовав-
фильтрации NaCl часть примесей может адсорбиро-
шейся суспензии образуются водно-ацетоновый рас-
ваться на поверхности соли, поэтому целесообразно
твор с примесью растворенного в нем NаCl и осадок
осуществление промывки осадка чистым ацетоном.
NaCl. Из водно-ацетонового раствора отгоняется весь
Хлористый натрий, осажденный ацетоном из сточной
ацетон, и сточная вода, содержащая 0.5-1.0 мас%
Рис. 4. Блок-схема процесса выделения NaCl из сточных вод химических производств.
Выделение хлористого натрия из концентрированных сточных вод химических производств
1161
NaCl, передается на утилизацию, например, на БОС.
Занавескин Леонид Николаевич, к.х.н., ORCID:
Влажный осадок хлористого натрия промывается
чистым ацетоном и подвергается сушке для удаления
следов ацетона с поверхности осадка. Потери ацетона
org/0000-0003-2029-5152
на стадии сушки составляют около 0.15 кг на 1.0 кг
Махин Максим Николаевич, к.х.н., ORCID: https://
полученного NaCl(тв.). Образовавшийся твердый хло-
orcid.org/0000-0001-6154-3189
ристый натрий передается на электролиз. Операции
фильтрования, промывки осадка и его сушка могут
Список литературы
осуществляться в одном аппарате.
[1] Воробьев А. Эпоксидные смолы // Компоненты и
технологии. 2003. № 8. С. 170-173.
Выводы
[2] Krzyzanowska A., Milchert E., Bartkowiak M.
Проведенные исследования показали, что опти-
Dehydrochlorination of 1,3-dichloropropan-2-ol by
мальное количество ацетона, которое необходимо
calcium and sodium hydroxide solutions // Polish J.
добавить к сточной воде с концентрацией NaCl бо-
Chem. Technol. 2014. V. 16. N 3. P. 86-90. DOI:
лее 15 мас%, составляет 8-9-кратный массовый из-
10.2478/pjct-2014-0056
быток. При этом в осадок выделяется более 94%
[3] Pat. CN 207158994 U (publ. 2018). A two-way
NaCl, а водный раствор после отгонки из него ацето-
concentrated separator of high salt waste water that is
used for sulfur acid sodium and sodium chloride.
на содержит всего 0.5-1.0 мас% соли. Выделенный
[4] Pat. CN 205099371 U (publ. 2016). High concent-
хлористый натрий может быть использован в каче-
ration contains sodium chloride waste water evapo-
стве сырья для электролиза. Предложена блок-схема
ration crystallization process device.
выделения NaCl из сточных вод химических про-
[5] Pat. CN 104276724 A (publ. 2015). Device for
изводств с высоким содержанием NaCl, например,
recovering sodium chloride and glycerin from high-
процессов получения эпоксидно-диановых смол или
salinity glycerin-containing organic waste water.
эпихлоргидрина.
[6] Pat. SU 706331 (publ. 1979). Method of waste water
purification from sodium chloride.
Финансирование работы
[7] Pat. CN 102847337 A (publ. 2013). Method for
extracting sodium chloride from waste water by using
Работа выполнена в рамках государственного за-
hydrogen chloride gas.
дания Института нефтехимического синтеза РАН.
[8] Pat. CN 208054983 U (publ. 2018). Retrieve sodium
chloride solution’s in high salt preserved szechuan
Конфликт интересов
pickle waste water device.
[9] Pat. CN 205222913 U (publ. 2016). Recovery system
Авторы заявляют об отсутствии конфликта инте-
of zero release of high salt waste water and high
ресов, требующего раскрытия в данной работе.
-purity sodium chloride.
[10] Матвиенко В. Г., Ярым-Агаев Н. Л. Фазовая ди-
аграмма конденсированной системы хлорид нат-
Информация об авторах
рия-диэтиленгликоль-ацетон-вода при 25°С //
Дмитриев Георгий Сергеевич, к.х.н., ORCID:
Вестн. Новгород. гос. ун-та. 2017. Т. 103. № 5.
C. 31-35.