132
Бельская О. Б. и др.
Журнал прикладной химии. 2020. Т. 93. Вып. 1
УДК 544.478.02:54.057:546.92:544.723:542.97
КАТАЛИЗАТОРЫ PT/(GA)Al2O3, ПОЛУЧЕННЫЕ С ИСПОЛЬЗОВАНИЕМ
МЕТАЛЛИЧЕСКОГО АЛЮМИНИЯ, АКТИВИРОВАННОГО ГАЛЛИЕМ
© О. Б. Бельская1,3, А. И. Низовский2,3, Т. И. Гуляева1,
Н. Н. Леонтьева1, В. И. Бухтияров2
1 Центр новых химических технологий Института катализа им. Г. К. Борескова
Сибирского отделения РАН (Омский филиал),
644040, г. Омск, ул. Нефтезаводская, д. 54
2 Институт катализа им. Г. К. Борескова Сибирского отделения РАН,
630090, г. Новосибирск, пр. Академика Лаврентьева, д. 5
3 Омский государственный технический университет,
644050, г. Омск, пр. Мира, д. 11
E-mail: obelska@ihcp.ru
Поступила в Редакцию 2 декабря 2019 г.
После доработки 2 декабря 2019 г.
Принята к публикации 2 декабря 2019 г.
Продукты взаимодействия активированного алюминия с водой были использованы в качестве пред-
шественника оксидного носителя катализаторов. Показана возможность изменять состав оксидной
фазы посредством варьирования природы активатора (галлий и Ga-In-эвтектика). Установлено, что
в процессе синтеза катионы галлия входят в структуру оксида алюминия посредством вытеснения
алюминия из тетраэдрического положения. Продемонстрировано влияние содержания галлия в со-
ставе носителя на его текстурные и кислотно-основные свойства. Присутствие галлия в составе
катализатора приводит к модифицированию каталитических свойств платины, которое заключается
в подавлении реакций гидрогенолиза С-С-связей в реакции превращения пропана.
Ключевые слова: активированный алюминий; оксид алюминия; галлий; платиновый катализатор;
дегидрирование пропана
DOI: 10.31857/S0044461820010132
Галлийсодержащие системы являются объектом
форминге метанола. Было показано, что в результате
интенсивных исследований как оксидные катализа-
добавления галлия в алюмоплатиновый катализатор
торы дегидрирования легких алканов [1-4] и селек-
возрастает дисперсность нанесенного металла и ста-
тивного восстановления NOx углеводородами [5-7].
бильность каталитической системы в дегидроцикли-
В отличие от массивных Ga2O3 нанесенные преиму-
зации н-гексана [11]. В то же время при введении
щественно на оксид алюминия оксиды галлия про-
галлия наблюдали уменьшение удельной поверхности
являют повышенную активность и стабильность в
оксида алюминия, а также дисперсности нанесенной
результате формирования твердого раствора между
платины и ее гидрирующей активности [9]. Замена
Ga2O3 и Al2O3 [1, 8]. Не менее важным направлением
части атомов алюминия на галлий в составе смешан-
является использование галлийсодержащих оксидов в
ного оксида привела к росту активности платиновых
качестве носителей катализаторов. Известна способ-
катализаторов в превращении пропана при сохране-
ность галлия модифицировать свойства платины в со-
нии высокой селективности образования пропилена и
ставе катализаторов Pt/Ga2O3, Pt/Ga2O3-Al2O3 [9, 10],
подавлении реакции гидрогенолиза С-С-связей [12].
GaPt/A12О3 [11] в реакциях алкилирования и гидри-
Для реализации модифицирующего эффекта
рования бензола, превращения алканов, паровом ри- галлия необходимо обеспечение высокой степени
Катализаторы Pt/(Ga)Al2O3, полученные с использованием металлического алюминия, активированного галлием
133
его взаимодействия с другими компонентами ката-
Экспериментальная часть
лизатора, которая обеспечивается выбором метода
синтеза. Так, для формирования твердого раство-
В качестве исходного материала для получения
ра Ga2O3-Al2O3 эффективными являются методы
носителя использовался литой коммерческий алю-
соосаждения [1, 12, 13], пиролиза аэрозоля [14],
миниевый сплав А0 (ГОСТ 11069-74), из которого
сольвотермический [15], золь-гель синтез [16, 17], в
были механически вырезаны образцы для активации.
отдельных работах — пропиточный метод [18, 19].
Для активации использовались либо эвтектический
В качестве принципиально другого подхода к синтезу
Ga-In-сплав, содержащий 75 мас% Ga и 25 мас% In,
алюмогаллиевых композиций можно рассматривать
либо жидкий галлий марки Гл-0. Обработка прово-
их получение из продуктов реакции алюминия, ак-
дилась в соответствии с методикой, описанной ранее
тивированного галлием или галлиевой эвтектикой,
[21], посредством смачивания галламой поверхности
с водой. Активирующую обработку алюминия для
среза при Т = 150°C в сухой атмосфере в течение 100
повышения его реакционной способности по отноше-
и 300 ч для указанных активаторов соответственно.
нию к воде используют с целью получения водорода
Реакцию активированного продукта с водой прово-
в компактных водородных картриджах [20-22]. Для
дили при атмосферном давлении в 100 см3 реакторе
активации используется как чистый галлий, так и
из нержавеющей стали, внешняя поверхность кото-
галламы различного состава. При этом актуальной
рого была покрыта теплоизоляционным материалом.
задачей является рациональное использование побоч-
Количество дистиллированной воды для проведения
ных продуктов данной реакции — гидроксидов алю-
реакции было взято с пятикратным избытком отно-
миния и галлия. Наряду с направлением, связанным с
сительно стехиометрии реакции. Процесс гидролиза
возвращением в качестве сырья в электрохимический
алюминия, активированного эвтектическим Ga-In-
цикл получения алюминия [23, 24], рассматривается
сплавом, проходил с интенсивным выделением водо-
возможность синтеза адсорбентов и катализаторов
рода, повышением температуры реакционной среды
на их основе.
от 25 до 90°С и скоростью, существенно превышаю-
В отличие от традиционного механоактивирова-
щей скорость гидролиза алюминия, активированного
ния алюминия в присутствии галлам или чистого
галлием. После удаления индия центрифугированием
галлия авторами [20-22, 25] была показана возмож-
(Centrifuge 5702 R, Eppendorf) из одного из продуктов
ность активирования массивного алюминия или ком-
реакции полученные гидроксиды прокаливали при
мерческих сплавов на его основе Ga-In-эвтектикой
температуре 550°С в течение 3 ч. Согласно данным
без дополнительной механохимической обработки.
химического анализа полученные оксиды содержали
В дальнейшем продукты реакции активированного
2.2 мас% Ga и 0.17 мас% In [образец Al2O3(Ga-2)] и
таким образом алюминия с водой были использованы
25.4 мас% Ga [образец Al2O3(Ga-25)].
для получения носителя платинового катализатора
Для приготовления катализаторов в качестве со-
[25]. Данный подход к синтезу алюмогаллиевых ком-
единения предшественника платины использовали
позиций является перспективным, поскольку позво-
платинохлористоводородную кислоту (ОАО АУРАТ,
ляет в зависимости от состава эвтектического сплава,
ТУ 6-09-2026-87). Ее сорбцию на Al2O3(Ga-2),
условий активации и реакции варьировать состав
Al2O3(Ga-25) и образце сравнения γ-Al2O3
продуктов гидролиза и свойства соответствующих
(CONDEA) выполняли из избытка водных растворов
оксидных материалов.
(5.0·10-3 моль·л-1) при соотношении объемов раство-
В настоящей работе в качестве предшественников
ра и носителя, равном 10:1. В течение 1 ч происходи-
оксидных носителей были использованы продукты
ло полное извлечение металлокомплекса из пропиточ-
взаимодействия с водой массивного коммерческо-
ного раствора. После стадий сушки при 25 и 120°С
го алюминия, предварительно активированного как
и прокалки при 550°С проводилось восстановление
Ga-In-эвтектикой, так и галлием. Полученные на их
платины в токе водорода при 550°С.
основе Ga2O3-Al2O3 носители существенно различа-
Концентрацию платины в растворах, а также со-
лись содержанием галлия и были использованы для
держание платины, галлия и индия в образцах по-
приготовления платиновых катализаторов.
сле их растворения в кислотах определяли методом
Целью работы было показать возможность ва-
атомно-эмиссионной спектрометрии с индуктивно
рьирования адсорбционных и кислотно-основных
связанной плазмой на приборе Varian 710-ES, Agilent
свойств алюмогаллиевых носителей в зависимости
Technologies.
от состава, а также исследовать свойства платиновых
Фазовый состав оксидных образцов с различ-
катализаторов, полученных на их основе.
ным содержанием галлия был исследован методом
134
Бельская О. Б. и др.
рентгенофазового анализа (РФА) в интервале углов
ной ветви, в расчетах использовали цилиндрическую
дифракции 2θ = 5-80° (дифрактометр D8 Advance
модель несвязанных пор.
Bruker с монохроматизированным CuKα-излучением)
Исследование процессов десорбции аммиака
с шагом сканирования 0.05° и временем интегрирова-
(ТПД-NH3) и поглощения водорода при темпера-
ния сигнала 2 с на точку. Для уточнения параметров
турно-программируемом восстановлении платины
решетки были зарегистрированы дифрактограммы с
(ТПВ-Н2) проводили на прецизионном хемосорб-
добавлением внутреннего стандарта Si (SRM640b)
ционном анализаторе AutoChem-2920 Micromeritics
в диапазоне углов дифракции 2θ = 40-70° с шагом
с детектором по теплопроводности. При ТПД-NH3
сканирования 0.02° и временем интегрирования 4 с
образцы, прокаленные при 550°С, дополнительно
на точку. Для расшифровки дифрактограмм исполь-
нагревали в токе 10% О2-Не до 550°С и охлажда-
зовалась база данных по порошковой дифракции
ли в токе Не до 100°С. Адсорбцию аммиака про-
ICDD PDF-2. Для уточнения параметров решетки
водили при температуре 100°С в течение 30 мин,
применялась программа TOPAS 4.2. Средний размер
используя калиброванную смесь 10 об% NH3 в гелии.
областей когерентного рассеяния (ОКР) рассчитыва-
Слабосвязанный аммиак убирали продувкой гелием
ли с использованием формулы Селякова-Шеррера по
при температуре 100°С в течение 60 мин. ТПД амми-
пику (440) для γ-Al2O3. Погрешность определения
ака проводили в температурной области 100-550°С со
составляла ±0.3 нм.
скоростью нагрева измерительной ячейки с образцом
Морфологию прокаленного продукта взаимо-
10 град·мин-1. Скорость потока гелия через реактор с
действия активированного алюминия с водой ис-
образцом составляла 30 см3·мин-1. В экспериментах
следовали методом сканирующей электронной ми-
по ТПВ Н2 платины использовали смесь 10% Н2-Ar.
кроскопии (JSM-6610LV, JEOL). Для проведения
Для последующего определения дисперсности на-
локального химического анализа применяли метод
несенного металла c помощью монооксида углеро-
рентгеновской энергодисперсионной спектроско-
да D(CO) хемосорбцию молекул-тестов проводили
пии с использованием приставки INCAx-act, Oxford
после ТПВ и охлаждения катализатора в инертном
Instruments.
газе до комнатной температуры. Дисперсность ме-
Спектры ЯМР 27Al образцов γ-Al2O3, Al2O3(Ga-2)
талла рассчитывали с учетом стехиометрии сорбции
и Al2O3(Ga-25) были получены на ЯМР-спектрометре
СО:Ме = 1:1.
(Аvance-400, Bruker) c многоядерным датчиком SB4
Реакцию дегидрирования пропана проводили в
в условиях простого одноимпульсного эксперимента
проточном реакторе с неподвижным слоем катали-
при вращении образцов под магическим углом в ро-
затора (загрузка 0.5 г) при 550°C, атмосферном дав-
торах из диоксида циркония. Были использованы сле-
лении, мольном отношении Н2:С3Н8 = 0.25 и мас-
дующие параметры эксперимента: резонансная часто-
совой скорости подачи сырья 8 г·ч-1. Длительность
та — 104 МГц, длительность импульсов — 2.5 мкс,
каждого эксперимента составляла 5 ч. Перед испы-
интервал повторения импульсов — 0.5 с, ширина
танием катализаторы были прокалены при 550°C
окна — 20 800 Гц, число точек на спектр — 4096,
и восстановлены в токе водорода непосредствен-
внешний стандарт — раствор AlCl3.
но в каталитической установке при 550°C. Состав
Изотермы адсорбции-десорбции азота при
продуктов анализировали хроматографически (Цвет
77.4 K получали на объемной вакуумной статиче-
500, колонка Rt-Alumina PLOT, 50 м, пламенно-ио-
ской установке ASAP-2020M Micromeritics в интер-
низационный детектор) в режиме on-line. Параметр
вале равновесных относительных давлений p/p0 от
дезактивации катализаторов (ДП) [12] вычисляли
10-3 до 0.996. Образцы, прокаленные при 550°С,
по формуле ДП = (Xнач - Xкон)Хнач-1·100%, где Хнач и
вакуумировали при 300°С в течение 6 ч. Расчеты
Хкон — степени превращения пропана после прове-
удельной поверхности (SБЭТ) выполняли в интервале
дения реакции в течение 1 и 5 ч.
равновесных относительных значений паров азота
p/p0 = 0.05-0.25 по изотерме адсорбции с учетом
Обсуждение результатов
значения молекулярной площадки азота в заполнен-
ном монослое 0.162 нм2. Значения адсорбционного
Исследование оксидных носителей. Использование
объема пор (Vадс) определяли по величине адсорбции
при обработке алюминия различных активирующих
азота при p/p0 = 0.990, принимая плотность адсорбата
агентов — эвтектического Ga-In-сплава и жидкого
равной плотности нормальной жидкости 0.808 г·см-3.
галлия — позволило после взаимодействия данных
Для получения кривых распределения пор по разме-
образцов активированного алюминия с водой полу-
рам (КРПР) применяли метод BJН для адсорбцион-
чить продукты, различающиеся химическим соста-
Катализаторы Pt/(Ga)Al2O3, полученные с использованием металлического алюминия, активированного галлием
135
вом. Их дальнейшая термоокислительная обработка
привела к формированию оксидной фазы, исследова-
ние которой было выполнено с точки зрения контроля
параметров, важных для носителей катализаторов.
Исследование структурных характеристик, текстур-
ных параметров и кислотно-основных свойств алю-
могаллиевых оксидных носителей с содержанием
галлия 2.2 и 25.4 мас% было выполнено в сравнении с
одним из наиболее химически чистых коммерческих
гамма-оксидов алюминия (Condea).
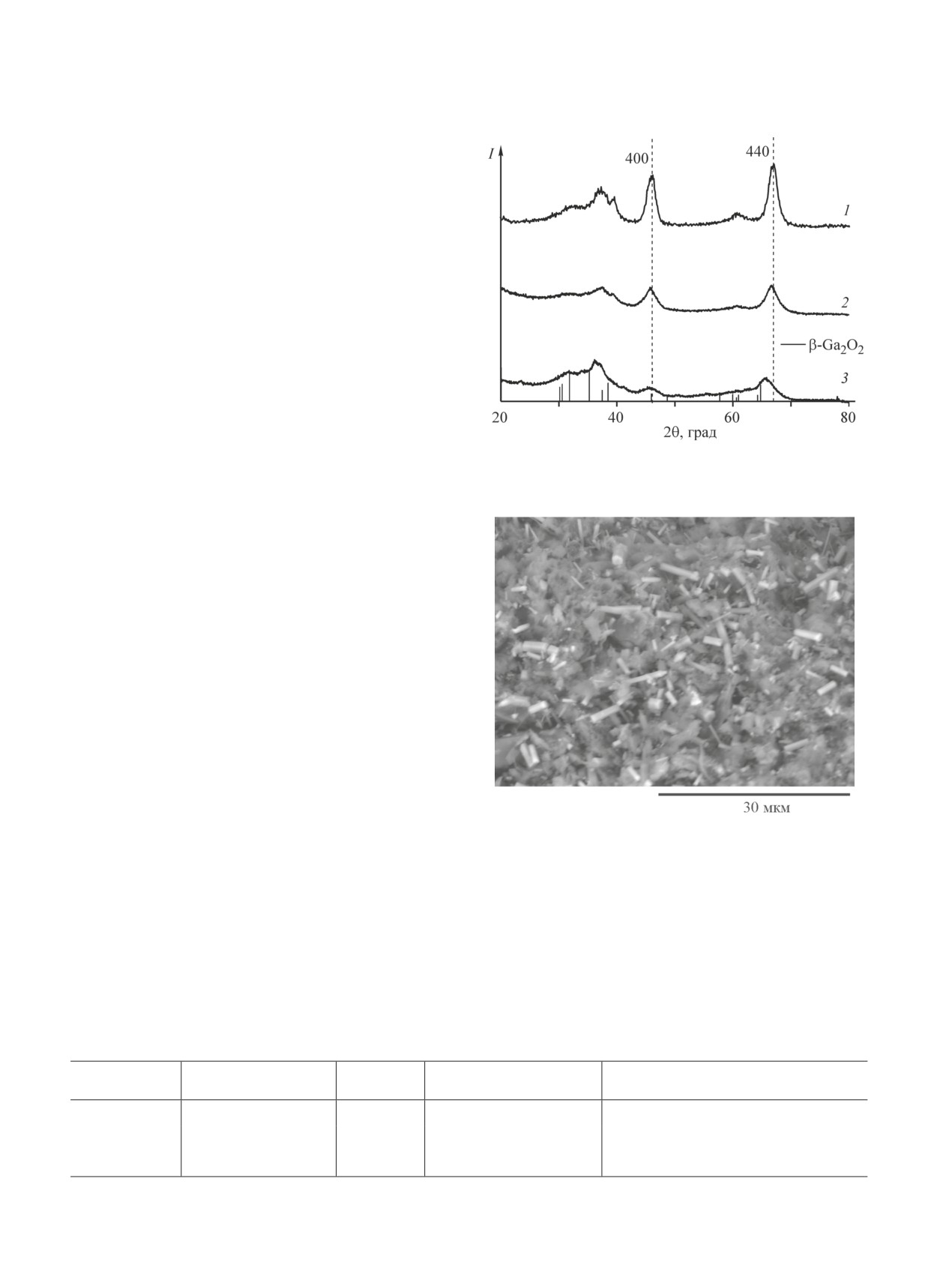
Рентгенофазовый анализ оксидов (рис. 1) показал,
что во всех образцах присутствует фаза γ-Al2O3, име-
ющая кубическую гранецентрированную решетку
(пространственная группа Fd3m). На дифрактограм-
мах присутствуют основные рефлексы этой фазы: 400
и 440. Однако для образца Al2O3(Ga-25) с высоким
содержанием галлия наблюдаются дополнительные
Рис. 1. Рентгенофазовый анализ оксидов Al2O3 (1),
Al2O3(Ga-2) (2), Al2O3(Ga-25) (3).
рефлексы, которые можно отвести к фазе чистого
оксида галлия, вероятно, модификации β-Ga2O3,
имеющей моноклинную кристаллическую решетку.
Неоднородность фазового состава данного образца
подтверждается данными сканирующей микроскопии.
Представленное электронно-микроскопическое изо-
бражение (рис. 2) демонстрирует присутствие второй
фазы, отличающейся морфологией (частицы в форме
вытянутых шестигранников) и обогащенной галлием.
Следует отметить, что введение галлия приводит
не только к уширению пиков, связанному с умень-
шением размеров кристаллитов (табл. 1), но и сме-
щению основных пиков γ-Al2O3 400 и 440 в сторону
меньших углов. Данный эффект связывают с увели-
чением параметра решетки гамма-оксида алюми-
ния за счет вхождения в его структуру ионов галлия,
имеющих большее значение ионного радиуса Ga3+
(0.062 нм) по сравнению с радиусом Al3+ (0.051 нм).
В результате происходит образование твердого рас-
Рис. 2. Электронно-микроскопическое изображение
твора шпинельного типа GaxAl10-xO15 (0 < x < 10) [1,
поверхности образца Al2O3(Ga-25).
17, 19, 26]. С использованием рассчитанных значений
параметра решетки а для образцов Al2O3, Al2O3(Ga-2)
жания галлия был рассчитан состав формирующихся
и Al2O3(Ga-25), а также установленной ранее [19]
смешанных оксидов (табл. 1).
линейной зависимости параметра решетки от содер-
Данные 27Al ЯМР-спектроскопии для исследо-
ванных образцов, представленные на рис. 3, также
Таблица 1
Фазовый состав и микроструктурные характеристики исследованных образцов
Область когерентного
Рассчитанный состав смешанного оксида
Образец
Фазовый состав
a, Å
рассеяния, Å
GaxAl10-xO15
γ-Al2O3
γ-Al2O3
7.903
53
—
Al2O3(Ga-2)
γ-Al2O3
7.925
42
Ga0.5Al9.5O15
Al2O3(Ga-25)
γ-Al2O3, β-Ga2O3
8.005
34
Ga2.5Al7.5O15
136
Бельская О. Б. и др.
Al. Данный эффект является подтверждением взаи-
модействия оксидов, в результате которого галлий
входит в структуру Al2O3 посредством вытеснения
алюминия из тетраэдрического положения [19].
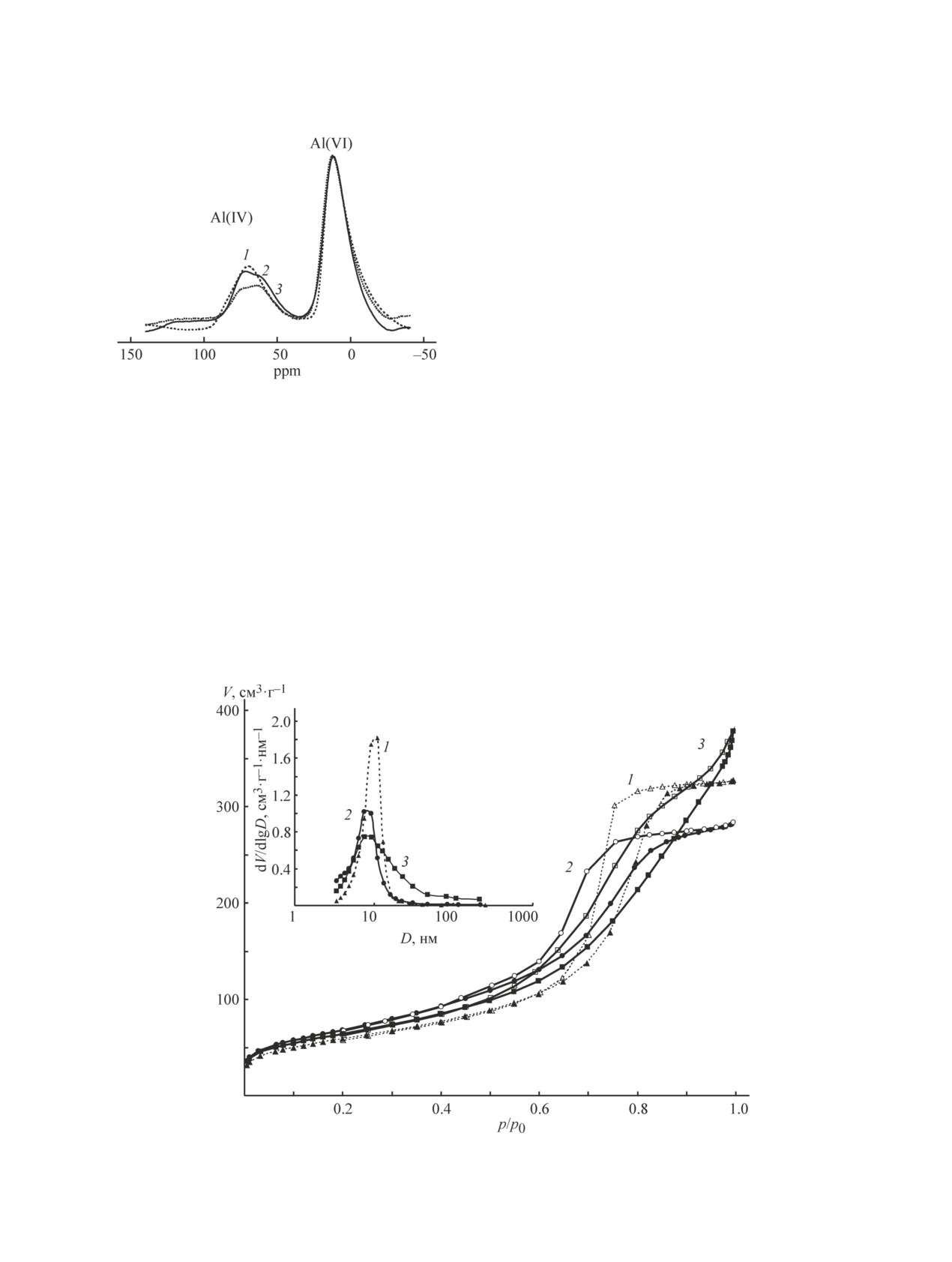
Изотермы низкотемпературной адсорбции-де-
сорбции азота для исследуемых образцов приведе-
ны на рис. 4. Форма изотерм для образцов γ-Al2O3
и Al2O3(Ga-2) одинакова и соответствует IV типу
с петлей гистерезиса, подобной Н2а по номенкла-
туре IUPAC [29]. Данный вид петли характеризует
материалы, содержащие как взаимосвязанные по-
ры, так и мезопоры, различающиеся размерами по-
лостей и горл, например бутылкообразной формы
(1),
Рис. 3. Спектры 27Al ЯМР образцов Al2O3
[30]. Изотерма адсорбции-десорбции для образца
(Ga-25) (3).
Al2O3(Ga-2) (2) и Al2O3
Al2O3(Ga-25) имеет другой вид, без области насыще-
ния при высоких p/p0 и с формой петли гистерези-
подтверждают факт взаимодействия оксидов галлия
са, позволяющей отнести ее к типу H3. Отсутствие
и алюминия в процессе получения оксидного носите-
насыщения при p/p0, стремящемся к 1, может сви-
ля. В спектре γ-Al2O3 присутствуют два характерных
детельствовать о наличии макропор, не полностью
асимметричных пика с химическими сдвигами 10 и
заполненных конденсатом. Наблюдаемые особен-
75 ppm, которые, согласно [27, 28], можно отнести к
ности пористого пространства Al2O3(Ga-25) могут
атомам алюминия, находящимся в октаэдрическом
быть следствием неоднородности фазового состава,
Al(VI) и в тетраэдрическом Al(IV) окружении ато-
установленной для данного образца.
мов кислорода соответственно. По мере увеличения
Анализ основных текстурных характеристик ис-
в составе образцов содержания галлия наблюдается
следуемых образцов (табл. 2) показал, что присут-
уменьшение интенсивности пика тетраэдрического
ствие галлия не приводит к ухудшению параметров
Рис. 4. Изотермы адсорбции-десорбции и кривые распределения объема пор по размерам (вставка) для образцов
γ-Al2O3 (1), Al2O3(Ga-2) (2), Al2O3(Ga-25) (3).
Катализаторы Pt/(Ga)Al2O3, полученные с использованием металлического алюминия, активированного галлием
137
Таблица 2
Основные текстурные характеристики оксидов Al2O3(Ga) по данным адсорбции азота (при 77 K) и результаты
температурно-программируемой десорбции аммиака
Объем пор,* см3·г-1 (%)
Количество
Удельная
Адсорбционный
Средний
десорбированного
Образец
поверхность,
объем пор,
диаметр
NH3, мкмоль·м-2
м2·г-1
см3·г-1
пор,** нм
3-10 нм
10-20 нм
>20 нм
(мкмоль·г-1)
Al2O3
213
0.504
10.1
0.330 (64)
0.178 (34)
0.008 (2)
1.9 (413)
Al2O3(Ga-2)
249
0.435
8.2
0.321 (77)
0.074 (18)
0.022 (5)
2.0 (487)
Al2O3(Ga-25)
232
0.560
8.2
0.258 (47)
0.147 (26)
0.148 (27)
2.3 (532)
* Оценен из данных расчета кривых распределения пор по размерам (методом BJH).
** Соответствует максимуму на BJH-кривой распределения пор по размерам.
пористой структуры оксидного носителя. Все образ-
от 1.9 до 2.3 мкмоль·м-2 (табл. 2). Рост концентрации
цы имеют развитую 200-250 м2·г-1 удельную поверх-
слабых кислотных центров в алюмогаллиевых окси-
ность и адсорбционный объем пор 0.4-0.6 см3·г-1.
дах, как правило, связывают с присутствием катионов
Наблюдаемые различия связаны с изменениями в
Ga3+ в тетраэдрической координации [1, 31, 32].
соотношении пор различного размера. Согласно кри-
Свойства платинового катализатора на основе
вым распределения пор по размерам (рис. 4, встав-
алюмогаллиевых оксидов. Согласно данным элемент-
ка), образцы γ-Al2O3 и Al2O3(Ga-2) имеют мономо-
ного анализа содержание платины в образцах соот-
дальное распределение мезопор в области до 20 нм.
ветствует расчетному и составляет 1.0 мас%. Процесс
Некоторое перераспределение мезопор в сторону
формирования частиц платины при восстановлении
увеличения вклада более мелких пор диаметром ≤10
ее оксидных форм, полученных при окислительной
практически до 80% для Al2O3(Ga-2) приводит к сме-
обработке (550°С) адсорбированных хлоридных ком-
щению максимума кривой с 10 до 8.2 нм. В [19] ана-
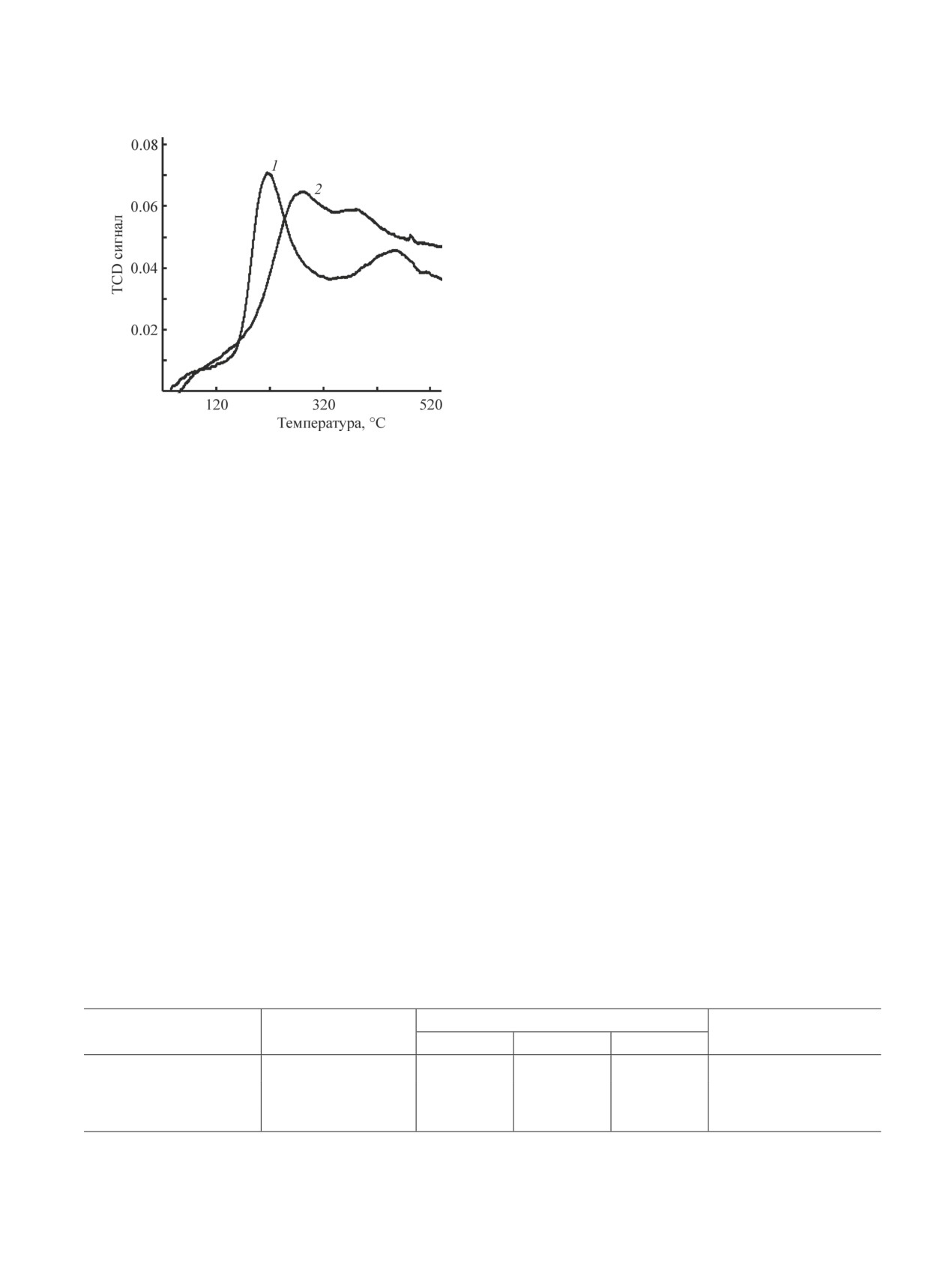
плексов, был исследован методом температурно-про-
логичное образование пор, более узких, чем у исход-
граммируемого восстановления. Анализ полученных
ного оксида алюминия, связывали с формированием
профилей (рис. 6) показал, что введение Ga в состав
агломератов частиц твердого раствора Ga2O3-Al2O3.
катализатора приводит к появлению дополнительной
В образце Al2O3(Ga-25) в результате формирования
высокотемпературной области поглощения водорода,
крупных мезопор и макропор (доля пор диаметром
связанной с восстановлением галлия [12]. При этом,
>20 нм увеличилась от 2-5 до 27%) наблюдается
широкое распределение пор по размерам в области
4-100 нм с сохранением максимума 8.2 нм, характер-
ного для Al2O3(Ga-2). Вероятно, увеличение доли пор
большего размера обусловлено вкладом фазы оксида
галлия, присутствующей в данном образце.
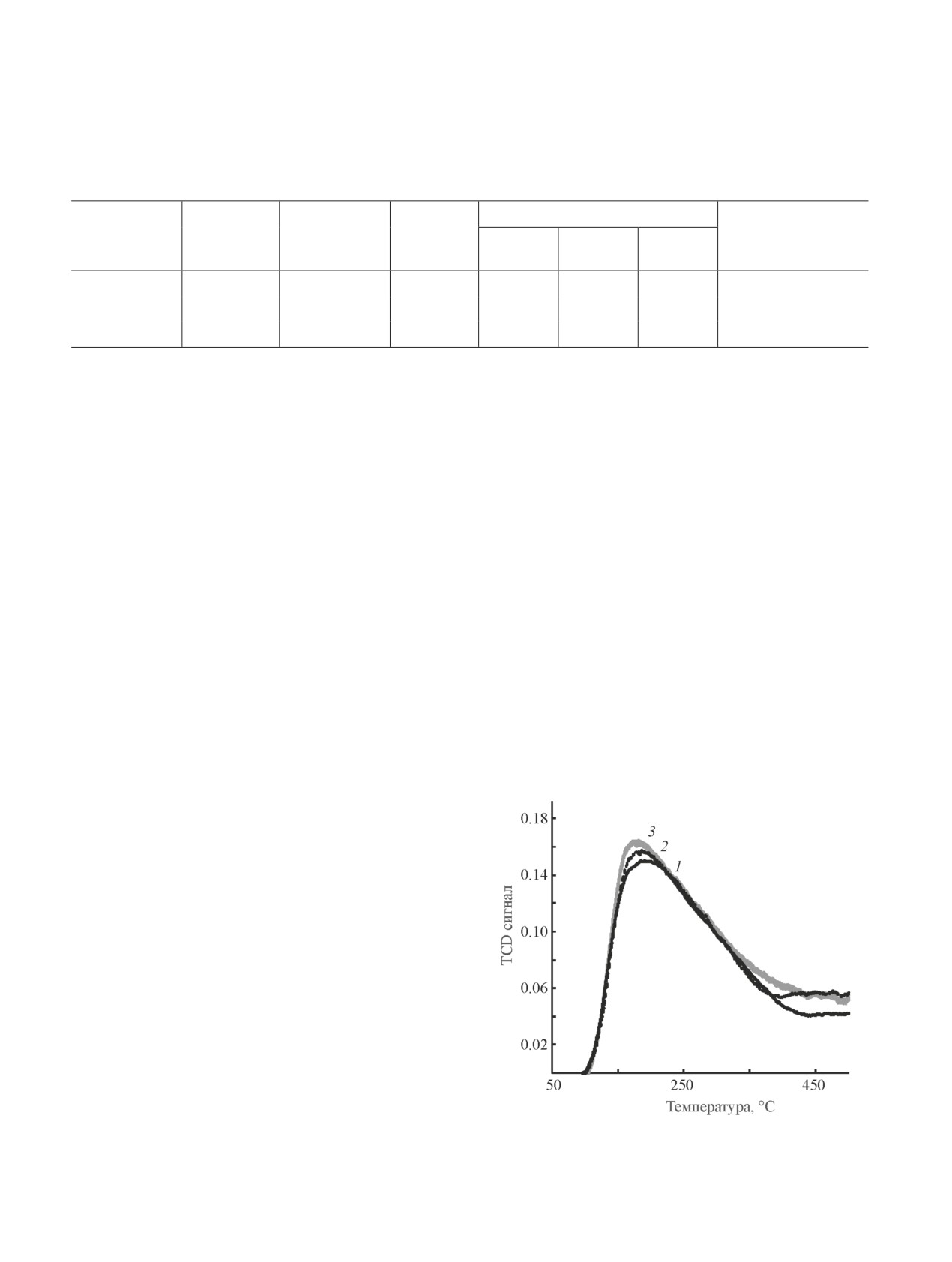
Для сопоставления кислотных свойств исследо-
ванных образцов был использован метод температур-
но-программируемой десорбции аммиака, который
позволяет по размеру десорбционных пиков и их
положению получить информацию о количестве и
силе кислотных центров на поверхности носителя.
Из анализа полученных профилей (рис. 5) следует,
что все образцы обладают близкой кислотностью:
ТПД-профили имеют одинаковую форму, а основ-
ной десорбционный пик имеет широкий максимум
в интервале температур 180-190°С. Данную область
связывают с присутствием слабых кислотных цен-
тров [1]. Введение галлия приводит к некоторому уве-
Рис. 5. Профили температурно-программируемой де-
личению кислотности, выраженному в монотонном
сорбции аммиака для образцов Al2O3 (1), Al2O3(Ga-2)
увеличении количества десорбированного аммиака
(2) и Al2O3(Ga-25) (3).
138
Бельская О. Б. и др.
личение температуры восстановления платины при
увеличении содержания галлия в носителе. Данный
эффект, как правило, связывают с более прочным
взаимодействием предшественника активного ком-
понента с носителем. Можно полагать, что в данном
случае также правомерно подобное объяснение, по-
скольку происходит заметный рост дисперсности
нанесенной платины (измеренной по хемосорбции
СО) от 47 до 74% для образцов 1% Pt/Al2O3(Ga-2) и
1% Pt/Al2O3(Ga-25) соответственно.
Результаты каталитических испытаний образцов
1% Pt/Al2O3(Ga-2) и 1% Pt/Al2O3(Ga-25) в сравнении
с 1% Pt/Al2O3 в реакции дегидрирования пропана
приведены в табл. 3. В начале эксперимента катализа-
тор 1% Pt/Al2O3 демонстрирует наиболее высокую ак-
тивность, однако достигаемую в результате большого
Рис. 6. Профили ТПВ образцов PtОх/Al2O3(Ga-2) (1) и
вклада реакций гидрогенолиза С-С-связей, происхо-
PtОх/Al2O3(Ga-25) (2).
дящих на высокодисперсных (дисперсность, близкая
Содержание платины в образцах 1.0 мас%, перед вос-
становлением образцы [PtCl6]/Al2O3(Ga) прокалены при
к 100%) частицах нанесенной платины. После 5 ч
550°С.
реакции конверсия пропана уменьшается с 22 до 17%,
вследствие чего катализатор характеризуется относи-
несмотря на существенные различия в содержании
тельно высоким значением параметра дезактивации
галлия, наблюдаемое избыточное количество погло-
(табл. 3). При этом уменьшается выход продуктов
щенного водорода примерно одинаково (поглощается
С1-С2 (с 9 до 3 мас%), в результате чего наблюдается
в 1.4-1.5 раза больше по сравнению со стехиометри-
рост селективности образования целевого пропилена
ческим, необходимым для восстановления платины).
с 70 до 80%. Галлийсодержащие образцы изначально
Вероятно, в результате активации водорода на плати-
обладают более высокой селективностью в образо-
не, которая восстанавливается при более низкой тем-
вании пропилена при значениях конверсии в стацио-
пературе, происходит восстановление части галлия,
нарных условиях (после 5 ч эксперимента), близких к
расположенной вблизи платины [12, 33]. При этом
алюмоплатиновой системе, и более низких значениях
присутствие восстановленного галлия, способного
показателя дезактивации. Выход продуктов гидро-
к образованию сплавов с платиной, может оказывать
генолиза даже в начале эксперимента не превышает
существенное влияние на свойства получающегося
1 мас% и далее снижается до 0.3 мас%. И хотя взгля-
катализатора. Следует отметить, что при большем
ды на природу модифицирующего действия галлия
содержании галлия температурный максимум его
различны и являются предметом обсуждения [34-36],
восстановления смещается в область более низких
установлено, что действие как геометрического, так
температур (от 450 до 380°С), что, вероятно, связано
и электронного факторов способно влиять на адсорб-
с ослаблением его взаимодействия с оксидом алюми-
ционные свойства металлической фазы и приводить к
ния. В то же время наблюдается существенное уве-
уменьшению вклада реакций гидрогенолиза. Следует
Таблица 3
Каталитические характеристики образцов 1% Pt/Al2O3(Ga) в реакции дегидрирования пропана
Селективность образования,* %
Параметр
Образец
Конверсия С3Н8,* %
С1-С3
С3Н6
С5+
дезактивации,** %
1% Pt/Al2O3
22.3
20.8
73.0
6.3
20.5
1% Pt/Al2O3(Ga-2)
19.2
2.2
89.3
8.5
12.5
1% Pt/Al2O3(Ga-25)
20.3
2.7
79.4
17.9
15.0
* После 1 часа эксперимента.
** Изменение активности в течение 5 ч работы катализатора.
Катализаторы Pt/(Ga)Al2O3, полученные с использованием металлического алюминия, активированного галлием
139
отметить, что обнаруженное увеличение кислотности
Финансирование работы
носителя по мере увеличения содержания галлия
Работа выполнена в рамках государственно-
(рис. 5) отражается в росте вклада реакций обра-
го задания Института катализа СО РАН, проект
зования продуктов с более высокой молекулярной
№ АААА-А17-117041110045-9.
массой, идущих на кислотных центрах. Вследствие
заметной доли соединений С5+ в продуктах реакции
селективность образования целевого продукта пропи-
Конфликт интересов
лена имеет более низкие значения при использовании
Авторы заявляют об отсутствии конфликта инте-
катализатора 1% Pt/Al2O3(Ga-25).
ресов, требующего раскрытия в данной статье.
Выводы
Информация об авторах
Продукты взаимодействия активированного алю-
Бельская Ольга Борисовна, к.х.н., ORCID: https://
миния с водой были использованы в качестве пред-
orcid.org/ 0000-0002-7650-880X
шественника оксидного носителя катализаторов.
Низовский Александр Иванович, к.х.н., доцент,
Использование различных активаторов — галлия и
Ga-In-эвтектики позволило существенно изменить
содержание галлия в составе оксидной фазы и как
org/0000-0002-2319-499
следствие повлиять на текстурные и кислотно-основ-
Леонтьева Наталья Николаевна, к.х.н., ORCID:
ные свойства носителя. Было показано, что в процес-
се синтеза катионы галлия входят в структуру оксида
Бухтияров Валерий Иванович, д.х.н., проф., акад.
алюминия посредством вытеснения алюминия из
тетраэдрического положения. В присутствии значи-
тельного количества галлия (25 мас%) часть галлия
Список литературы
содержится в составе отдельной фазы Ga2O3, что
приводит к изменению пористого пространства ок-
[1] Chen M., Xu J., Su F.-Z., Liu Y.-M., Cao Y., He He-Y.,
сидного носителя в сторону увеличения пор большего
Fan K.-N. Dehydrogenation of propane over spinel-type
диаметра, а также росту концентрации кислотных
gallia-alumina solid solution catalysts // J. Catal. 2008.
центров слабой силы. Присутствие галлия в составе
V. 256. P. 293-300.
катализатора приводит к модифицированию ката-
[2] Saito M., Watanabe S., Takahara I., Inaba M., Murata K.
литических свойств платины, которое заключается
Dehydrogenation of propane over a silica-supported
в подавлении реакций гидрогенолиза С-С-связей в
gallium oxide catalyst // Catal. Lett. 2003. V. 89. P. 213-
реакции превращения пропана.
Таким образом, побочный продукт, образующийся
[3] Michorczyk P., Gora-Marek K., Ogonowski J.
при взаимодействии активированного алюминия с
Dehydrogenation of propane in the presence and
водой в реакции получения водорода, может быть
absence of CO2 over β-Ga2O3 supported chromium
использован в качестве предшественника носите-
oxide catalysts // Catal. Lett. 2006. V. 109. P. 195-198.
ля катализаторов, поскольку обеспечивает форми-
рование необходимых структурных и текстурных
[4] Nakagawa K., Kajita C., Okumura K., Ikenaga N.-О.,
свойств оксидной фазы. Галлий, присутствующий в
Nishitani-Gamo M., Ando T., Kobayashi T., Suzuki T.
составе данного продукта, способен модифицировать
Role of carbon dioxide in the dehydrogenation of ethane
свойства как носителя, так и нанесенной платины,
over gallium-loaded catalysts // J. Catal. 2001. V. 203.
и необходимы дополнительные исследования для
[5] Haneda M., Kintaichi Y., Hamada H. Effect of SO2 on
оптимизации количества данного модификатора и
the catalytic activity of Ga2O3-Al2O3 for the selective
регулирования свойств алюмогаллиевого носителя.
reduction of NO with propene in the presence of oxygen
// Appl. Catal. B. 2001. V. 31. P. 251-261. https://
Благодарности
doi.org/10.1016/S0926-3373(00)00286-1
[6] Takahashi M., Nakatani T., Iwamoto S., Watanabe T.,
Авторы выражают благодарность Л. Н. Степа-
Inoue M. Performance of solvothermally prepared
новой, В. П. Талзи, О. В. Маевской, И. В. Муромцеву,
Ga2O3-Al2O3 catalysts for SCR of NO with methane
А. В. Шиловой, Р. Р. Измайлову за участие в исследо-
// Appl. Catal. B. 2007. V. 70. P. 73-79. https://
вании образцов.
doi.org/10.1016/j.apcatb.2006.01.018
140
Бельская О. Б. и др.
[7] Shimizu K., Takamatsu M., Nishi K., Yoshida H.,
Appl. Catal. B. 2006. V. 65. P. 142-149. https://
Satsuma A., Tanaka T., Yoshida S., Hattori T. Alumina-
doi.org/10.1016/j.apcatb.2006.01.007
supported gallium oxide catalysts for NO selective
[16]
Maunula T., Kintaichi Y., Inaba M. Enhanced activity
reduction: Influence of the local structure of surface
of in and Ga-supported sol-gel alumina catalysts for
gallium oxide species on the catalytic activity // J.
NO reduction by hydrocarbons in lean conditions
Phys. Chem. B. 1999. V. 103. P. 1542-1549. https://
// Appl. Catal. B. 1998. V. 15. P. 291-304. https://
doi.org/10.1021/jp983790w
doi.org/10.1016/S0926-3373(97)00056-8
[8] Xu B. J., Zheng B., Hua W. M., Yue Y. H., Gao Z.
[17]
Haneda M., Kintaichi Y., Mizushima T. Kakuta N.,
Support effect in dehydrogenation of propane in
Hamada H. Structure of Ga2O3-Al2O3 prepared by
the presence of CO2 over supported gallium oxide
sol-gel method and its catalytic performance for
catalysts // J. Catal. 2006. V. 239. P. 470-477.
NO reduction by propene in the presence of oxygen
// Appl. Catal. B. 2001. V. 31. P. 81-92. https://
[9] Domínguez F., Sánchez J., Arteaga G., Choren E. Gallia
doi.org/10.1016/S0926-3373(00)00271-X
as support of Pt in benzene hydrogenation reaction //
[18]
Haneda M., Kintaichi Y., Hamada H. Effect of SO2 on
J. Mol. Catal. A: Chemical. 2005. V. 228. P. 319-
the catalytic activity of Ga2O3-Al2O3 for the selective
reduction of NO with propene in the presence of
[10] Iwasa N., Mayanagi T., Ogawa N., Sakata K.,
oxygen // Appl. Catal. B. 2001.V. 31. P. 251-261.
Takezawa N. New catalytic functions of Pd-Zn, Pd-
Ga, Pd-In, Pt-Zn and Pt-In alloys in the conversion
[19]
Афонасенко Т. Н., Леонтьева Н. Н., Талзи В. П.,
of methanol // Catal. Lett. 1998. V. 54. P. 119-123.
Смирнова Н. С., Савельева Г. Г., Шилова А. В.,
Цырульников П. Г. Синтез и свойства твердого
[11] Ryndin Yu. A., Gobo1os S., Zaikovskii V. I.,
раствора γ-Ga2O3-Al2O3 // ЖФХ. 2017. Т. 91. № 10.
Margitfalvi J., Yermakov Yu. I. Conversion of
С. 1712-1718.
hydrocarbons on supported catalysts prepared via
decomposition of surface complexes. Preparation and
[Afonasenko T. N., Leont′eva N. N., Talzi V. P.,
properties of (Ga + Pt)/SiO2 and (Ga + Pt)/Al2O3
Savel′eva G. G., Shilova A. V., Tsyrul′nikov P. G.,
catalysts // React. Kinet. Catal. Lett. 1982. V. 21.
Smirnova N. S. Synthesis and properties of γ-Ga2O3-
Al2O3 solid solution // Russ. J. Phys. Chem. A. 2017.
[12] Бельская О. Б., Степанова Л. Н., Гуляева Т. И.,
V. 91. N 10. P. 1939-1945.
Леонтьева Н. Н., Зайковский В. И., Саланов А. Н.,
Лихолобов В. А. Синтез слоистых гидроксидов, со-
[20]
Тренихин М. В., Бубнов А. В., Козлов А. Г.,
держащих катионы Mg2+, Al3+, Ga3+, и платиновых
Низовский А. И., Дуплякин В. К. Проникновение
катализаторов на их основе // Кинетика и катализ.
компонентов индий-галлиевого сплава в алю-
2016. Т. 57. № 4. С. 554-565.
миний // ЖФХ. 2006. Т. 80. № 7. С. 1262-1267
[Trenikhin M. V., Bubnov A. V., Kozlov A. G., Nizovskii
[Belskaya O. B., Stepanova L. N., Gulyaeva T. I.,
A. I., Duplyakin V. K. The penetration of indium-
Leont′eva N. N., Likholobov V. A., Zaikovskii V. I.,
gallium melt components into aluminum // Russ.
Salanov A. N. Synthesis of Mg2+-, Al3+-, and Ga3+-
J. Phys. Chem. A. 2006. V. 80. N 7. P. 1110-1114.
containing layered hydroxides and supported platinum
catalysts based thereon // Kinet. Catal. 2016. V. 57.
[21]
Тренихин М. В., Бубнов А. В., Низовский А. И.,
N 4. P. 546-556.
Дуплякин В. К. Взаимодействие эвтектики си-
стемы In-Ga c алюминием и его сплавами //
[13] Masuda T., Watanabe T., Miyahara Y., Kanai H.,
Неорган. материалы. 2006. Т. 42. № 3. С. 298-
Inoue M. Synthesis of Ga2O3-Al2O3 catalysts by a
303 [Trenikhin M. V., Bubnov A. V., Nizovskii A. I.,
coprecipitation method for CH4-SCR of NO // Top.
Duplyakin V. K. Chemical interaction of the In-Ga
Catal. 2009. V. 52. P. 699.
eutectic with Al and Al-base alloys // Inorg. Mater.
V. 42. N 3. P. 256-260.
[14] Watanabe T., Miki Y., Masuda T., Kanai H.,
Hosokawa S., Wada K., Inoue M. Pore structure of
[22]
Nizovskii A. I., Kulikov A. V., Trenikhin M. V.,
γ-Ga2O3-Al2O3 particles prepared by spray pyrolysis
Bukhtiyarov V. I. Material for compact hydrogen
// Micropor. Mesopor. Mater. 2011. V. 145. P. 131-
cartridges based on commercial aluminium alloys
activated by Ga-In eutectics // Catal. Sustain. Energy.
[15] Takahashi M., Inoue N., Nakatani T., Takeguchi T.,
2017. V. 4. P. 62-66.
Iwamoto S., Watanabe T., Inoue M. Selective catalytic
reduction of NO with methane on γ-Ga2O3-Al2O3
[23]
Шейндлин А. Е., Жук А. З. Концепция алюмоводо-
solid solutions prepared by the glycothermal method //
родной энергетики // Рос. хим. журн. 2006. Т. L.
Катализаторы pt/(ga)al2o3, полученные с использованием металлического алюминия, активированного галлием
141
№ 6. С. 105-108 [Sheindlin A. E., Zhuk A. Z. Concept
Physisorption of gases, with special reference to the
of aluminiun hydrogen energy industry // Russ. J.
evaluation of surface area and pore size distribution
Gen. Chem. 2007. V. 77. N 4. Р. 778-782. https://
(IUPAC Technical Report) // Pure Appl. Chem. 2015.
doi.org/10.1134/S107036320704038X].
V. 87. N 9-10. P. 1051-1069.
[24]
Шейндлин А. Е., Жук А. З. Алюмоводородная
энергетика: принципы и технологии // Вестн.
[30] Hakim S. H., Shanks B. H. Manipulation of mesoporous
РАН. 2010. T. 80. № 2. C. 143-148 [Sheindlin A. E.,
structure and crystallinity in spontaneously self-
Zhuk A. Z. Alumino-hydrogen energy: principles and
assembled hierarchical metal oxides // Micropor.
technologies // Herald of the Russian Academy of
Mesopor. Mater. 2010. V. 135. P. 105-115. https://
Sciences. 2010. V. 80. N 2. Р. 143-148].
doi.org/10.1016/j.micromeso.2010.06.017
[25]
Бельская О. Б., Низовский А. И., Гуляева Т. И.,
[31] Vimont A., Lavalley J. C., Sahibed-Dine A.,
Бухтияров В. И. Оксид алюминия, полученный с
Arean C. O., Delgado M. R., Daturi M. Infrared
использованием активированного алюминия, как
spectroscopic study on the surface properties of
носитель платиновых катализаторов // ЖПХ. 2018.
γ-gallium oxide as compared to those of γ-alumina //
Т. 91. № 11. С. 1602-1609.
J. Phys. Chem. B. 2005. V. 109. P. 9656-9664. https://
doi.org/10.1021/jp050103+.
[Belskaya O. B., Nizovskii A. I., Gulyaeva T. I.,
[32] Gonzalez E. A., Jasen P. V., Juan A., Collins S. E.,
Bukhtiyarov V. I. Aluminum oxide produced with the
Baltanas M. A., Bonivardi A. L. Hydrogen adsorption
use of activated aluminum as support for platinum
on β-Ga2O3 surface containing oxygen vacancies //
catalysts // Russ. J. Appl. Chem. 2018. V. 91. N 11.
Surf. Sci. 2005. V. 575. P. 171-180.
P. 1814-1820.
[33] Todorova S., Su B.-L. Effects of acidity and
[26]
Arean C. O., Delgado M. R., Montouillout V.,
combination of Ga and Pt on catalytic behavior of
Massiot D. Synthesis and characterization of spinel-
Ga-Pt modified ZSM-5 catalysts in benzene alkylation
type gallia-alumina solid solutions // Z. anorg.
with pure propane // Catal. Today. 2004. V. 93-95.
allgem. Chem. 2005. V. 631. P. 2121-2126. https://
P. 417-424.
doi.org/10.1002/zaac.200570027
[27]
Kwak J. H., Hu J. Z., Kim D. H. Szanyi J.,
[34] Sun P., Siddiqi G., Chi M., Bell A. T. Synthesis and
Peden C. H. F. Penta-coordinated Al3+ ions as
characterization of a new catalyst Pt/Mg(Ga)(Al)O
preferential nucleation sites for BaO on γ-Al2O3:
for alkane dehydrogenation // J. Catal. 2010. V. 274.
An ultra-high-magnetic field 27Al MAS NMR
study // J. Catal. 2007. V. 251. P. 189-194. https://
[35] Redekop E., Galvita V., Poelman H., Bliznuk V.,
doi.org/10.1016/j.jcat.2007.06.029
Detavernier C., Marin G. Delivering a modifying
[28]
Paglia G., Buckley C. E., Rohl A. L., Hart R. D.,
element to metal nanoparticles via support: Pt-Ga
Winter K., Studer A. J., Hunter B. A., Hanna J. V.
alloying during the reduction of Pt/Mg(Al,Ga)Ox
Boehmite derived γ-alumina system. 1. Structural
catalysts and its effects on propane dehydrogenation //
evolution with temperature, with the identification
ACS Catal. 2014. V. 4(6). P. 1812-1824.
and structural determination of a new transition phase,
γ-alumina // Chem. Mater. 2004. V. 16. N 2. P. 220-
[36] Bednarova L., Lyman C.E., Rytter E., Holmen A.
Effect of support on the size and composition of highly
[29]
Thommes M., Kaneko K., Neimark A. V., Olivier J. P.,
dispersed Pt-Sn particles // J. Catal. 2002. V. 211.
Rodriguez-Reinoso F., Rouquerol J., Sing K. S. W.