Журнал прикладной химии. 2020. Т. 93. Вып. 1
ФИЗИКО-ХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ СИСТЕМ И ПРОЦЕССОВ
УДК 678.048:547.565:544.421:544.43:544.18
ФАКТОРНЫЙ АНАЛИЗ СВЯЗИ ХИМИЧЕСКОЙ СТРУКТУРЫ
И АНТИРАДИКАЛЬНОЙ АКТИВНОСТИ ПРИРОДНЫХ ФЕНОЛОВ
© Н. И. Белая
Донецкий национальный университет,
83001, г. Донецк, ул. Университетская, д. 24
Е-mail: nat.iv.belaya@gmail.com
Поступила в Редакцию 21 июня 2019 г.
После доработки 5 сентября 2019 г.
Принята к публикации 27 сентября 2019 г.
Методами линейного многофакторного регрессионного анализа установлена связь между антиради-
кальной активностью различных классов растительных фенолов и дескрипторами их электронного
строения в виде полуэмпирических линейных одно- и двухфакторных уравнений. Проведена оценка
предсказательной способности полученной модели на контрольной выборке, средняя ошибка аппрок-
симации составила не более 6.5%. Полученная взаимосвязь дескриптор-активность является основой
для прогнозирования антирадикальных свойств природных фенолов различной структуры в полярных
средах.
Ключевые слова: антирадикальная активность; природные фенолы; антиоксидант
DOI: 10.31857/S0044461820010144
Изучение антиоксидантов природного и синте-
Activity Relationships) [1] и количественной взаимос-
тического происхождения проводится по двум на-
вязи структура-реакционная способность вещества
правлениям: 1) расширение ассортимента (синтез)
QSAR/QSPR (Quantitative Structure-Activity/Property
соединений, обладающих выраженными антиок-
Relationships) [2, 3] в виде линейных регрессионных
сидантными свойствами; 2) поиск и исследование
уравнений. В случае QSAR/QSPR при выборе ан-
кинетических моделей для оценки эффективности
тиоксиданта используют как квантово-химические
антиоксидантов и изучения механизмов их действия.
расчеты, так и эксперимент, что способствует сни-
Для физикохимиков принципиально важно второе
жению времени проведения скрининга по сравнению
направление, развитие которого позволит надежно
с полностью эмпирическим методом и повышению
определять эффективные ингибиторы радикальных
надежности результатов в отличие от неэмпириче-
процессов среди постоянно возрастающего количе-
ских расчетов.
ства новых антиоксидантов.
Получение экспериментатором линейных регрес-
Особое место среди методов оценки реакционной
сионных зависимостей параметров активности ан-
способности веществ и изучения механизма их дей-
тиоксиданта от показателя его структуры есть слож-
ствия занимают полуэмпирические модели прогнози-
ная комплексная задача, которая требует учета ряда
рования различных видов биологической активности
факторов: выбора модельной реакции (или реакций),
на основе качественной взаимосвязи структура-ре-
экспериментального определения показателя реак-
акционная способность вещества SAR (Structure-
ционной способности антиоксиданта, установления
142
Факторный анализ связи химической структуры и антирадикальной активности природных фенолов
143
возможного антирадикального механизма действия
с участием кислорода воздуха. Спектральные иссле-
вещества, выбора дескриптора структуры, который
дования проводили при Т = 293±2 K и концентра-
определяется тем, в какой форме антиоксидант уча-
ции реагирующих веществ 10-4-10-5 моль∙л-1 при
ствует в лимитирующей стадии реакции. Очевидно,
λmax = 520 нм на спектрофотометре Specord S300
что все перечисленные факторы взаимосвязаны меж-
UV-VIS (производство Analytik Jena AG, Германия).
ду собой и требуют обязательного учета при состав-
Константы скоростей реакции ArOH c DPPH• опреде-
лении полуэмпирической модели скрининга, осно-
ляли из зависимости изменения концентрации ради-
ванной на одно- или многофакторных зависимостях
кала во времени. Для этого реагенты смешивали 1:1,
реакционной способности вещества от его структуры.
затем измеряли оптическую плотность смеси (1:1)
Цель данной работы — проведение факторного
и с помощью молярного коэффициента светопогло-
анализа связи дескрипторов электронного строения
щения (ε = 1.2·103 л∙моль-1·мм-1) по закону Бугера-
природных фенолов (ArOH) и их антирадикальной
Ламберта-Бера рассчитывали концентрацию радика-
активности (АРА) в реакции со стабильным ради-
ла DPPH•. Для поддержания постоянного рН водных
калом 2,2′-дифенил-1-пикрилгидразилом (DPPH•), а
растворов использовали солянокислую (с рН 1.5) и
также оценка прогностической способности получен-
борно-щелочную (с рН 9) буферные системы. рН
ной линейной многофакторной модели.
приготовленных буферных растворов контролиро-
вали с помощью иономера И-160МИ (производства
ООО Измерительная техника, Россия).
Экспериментальная часть
В качестве объектов исследования использовались
Обсуждение результатов
соединения № 9-43, 8 без предварительной очистки
(производства Fluka, Швейцария; Merck, Германия;
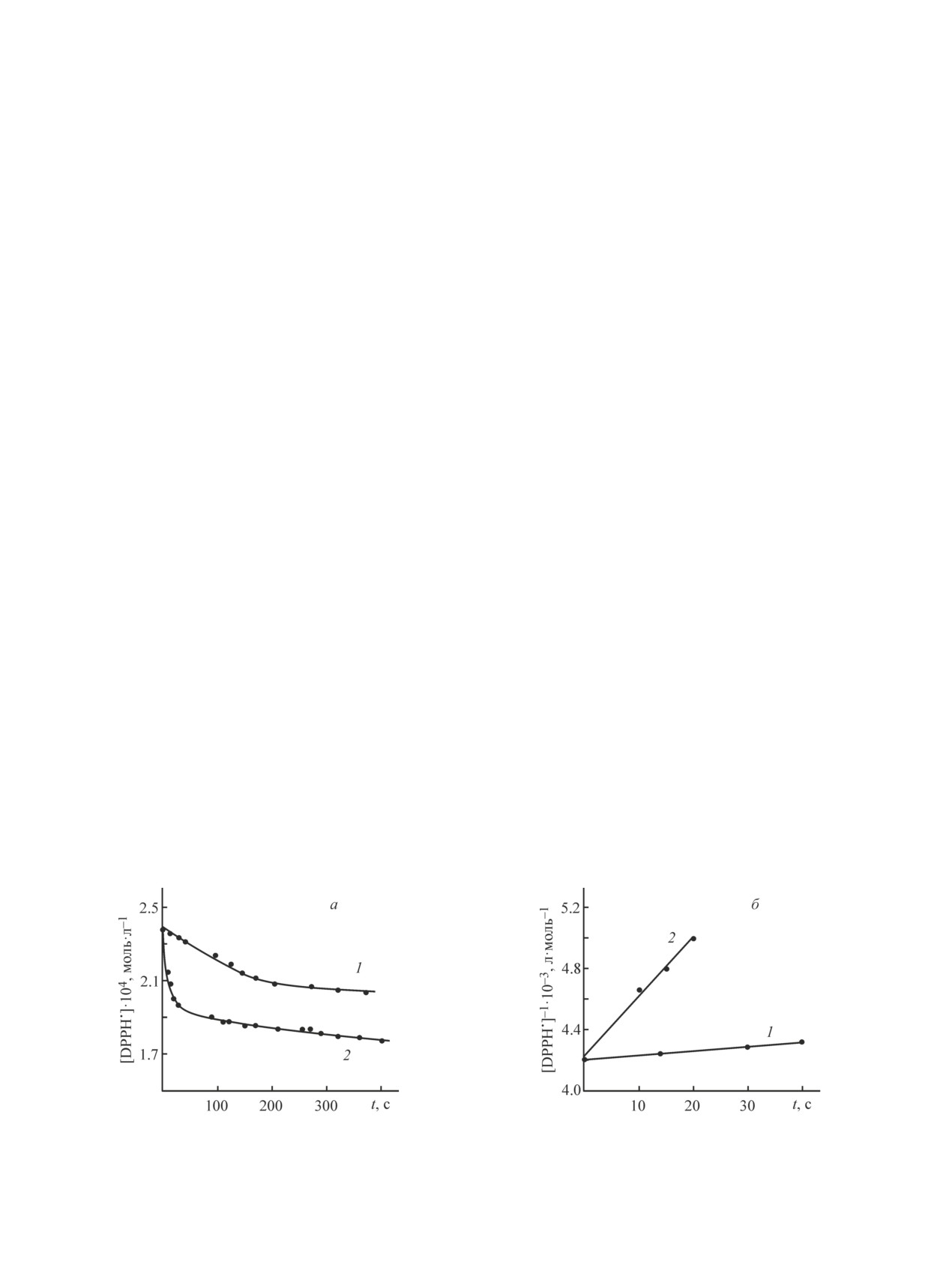
Нами изучались только начальные участки (до
Panreac, Испания), гидроксибензолы № 1-7 марки
15-60 с) кинетических кривых расходования кон-
х.ч. (производство Merck, Германия), которые под-
центрации DPPH• (рис. 1, а), позволяющие оценить
вергались многократной перекристаллизации из эти-
активность ArOH в элементарной реакции с ради-
лового спирта и сушились при 40°С в атмосфере азо-
калом. Установлен первый псевдопорядок по ArOH
та, после чего сублимировались в вакууме. Подбор
при условии, что его концентрация в реакционной
природных антиоксидантов осуществлялся таким
смеси была в 20 раз меньше по сравнению с DPPH•.
образом, чтобы вещества каждого предыдущего клас-
Аналогично определен первый псевдопорядок по
са были структурными элементами более сложных
радикалу. Общий порядок реакции (при эквивалент-
последующих групп фенолов. Модельным радика-
ном соотношении реагентов) подтверждался путем
лом являлся свободный стабильный радикал DPPH•
спрямления данных в координатах реакции 2-го по-
(производство Sigma-Aldrich, США). Растворитель
рядка (рис. 1, б). АРА фенолов характеризовалась
— 96%-ный этанол — предварительно деоксигени-
величиной константы скорости исследуемой реакции
ровался путем барботирования аргоном в течение
k, рассчитанной по угловому параметру полученных
15-20 мин для предотвращения побочных реакций
анаморфоз.
Рис. 1. Кинетические кривые расходования DPPH• в реакции с природными фенолами (а) и их анаморфозы в коор-
динатах реакции второго порядка (б).
1 — резорцин (с = 2.38·10-4 моль∙л-1), 2 — кемпферол (с = 2.38·10-4 моль∙л-1).
Факторный анализ связи химической структуры и антирадикальной активности природных фенолов
145
146
Белая Н. И.
В этаноле при 293 K все изученные соединения
в той или иной мере проявляют антирадикальную
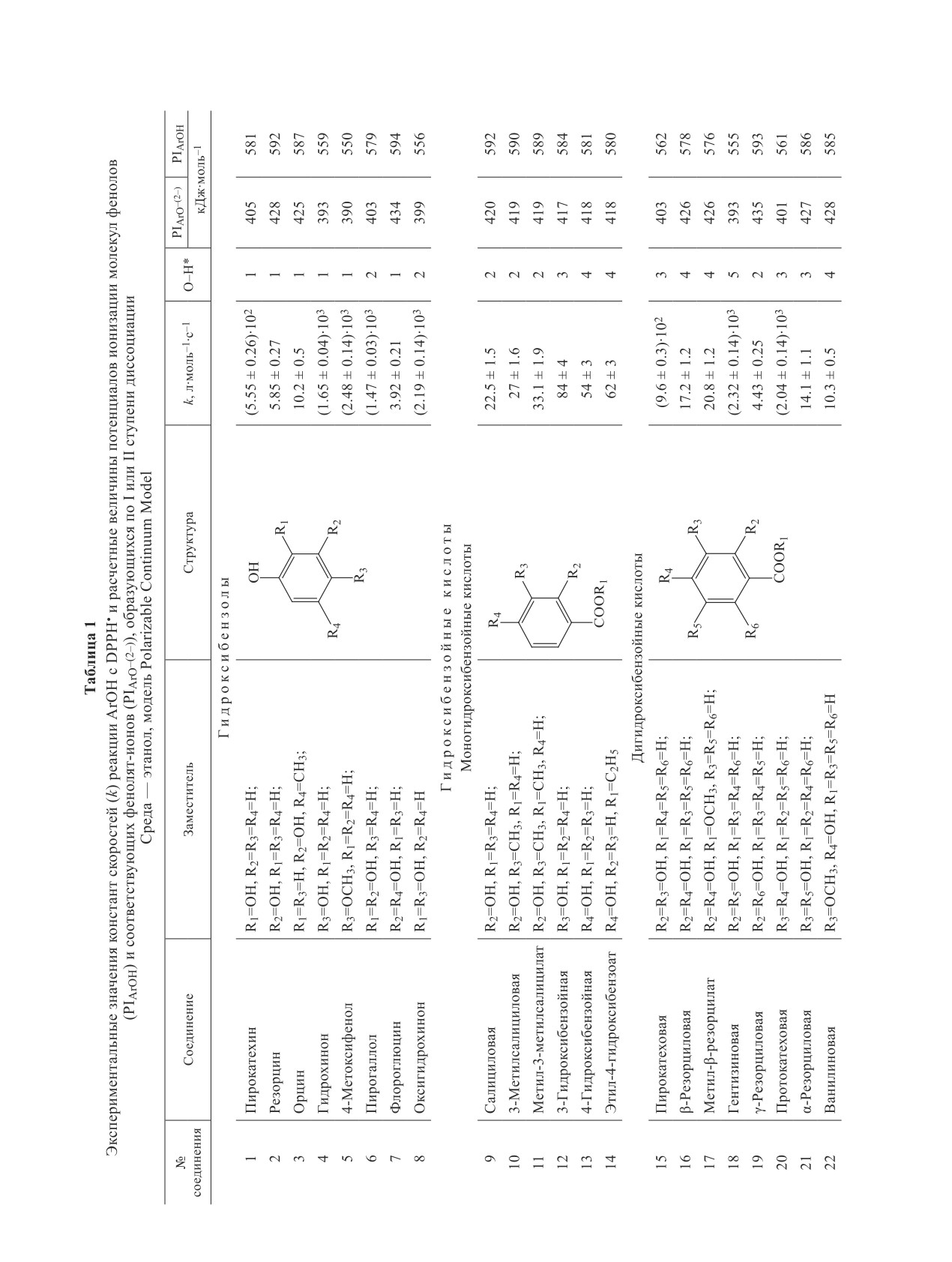
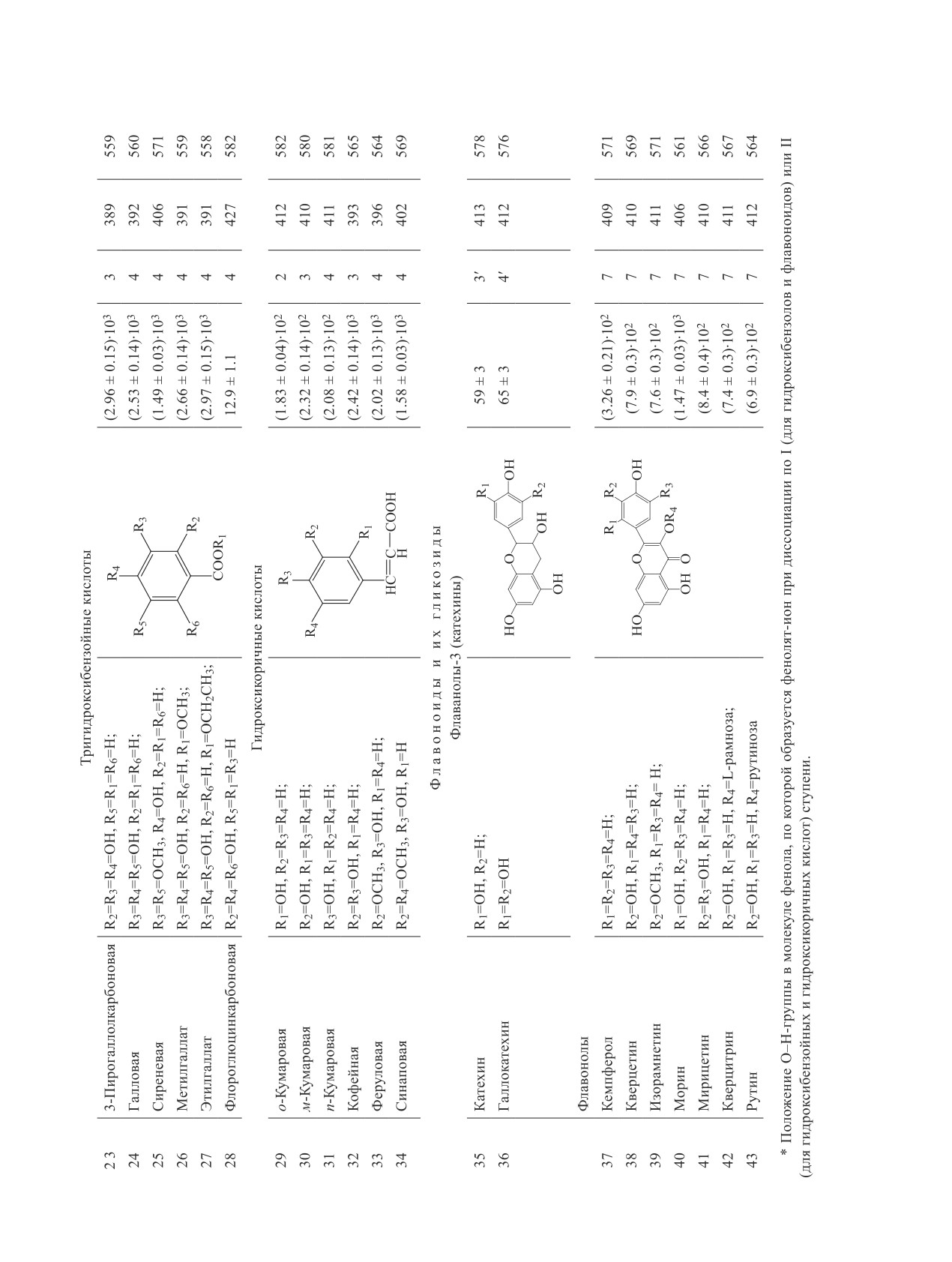
активность (табл. 1). Наибольшее количество соеди-
нений, активных в реакции с DPPH•, принадлежит
к группе фенольных кислот с двумя и тремя ОН-
группами: № 18, 20, 23-27, 32-34. Слабо реагируют
с радикалом все моногидроксибензойные кислоты
№ 9-14, м-гидроксибензолы № 2, 3, 7, а также фла-
ваны № 35, 36.
В этаноле (Solv) представленные фенольные со-
единения частично диссоциируют с последующей
лимитирующей (slow) стадией переноса электрона
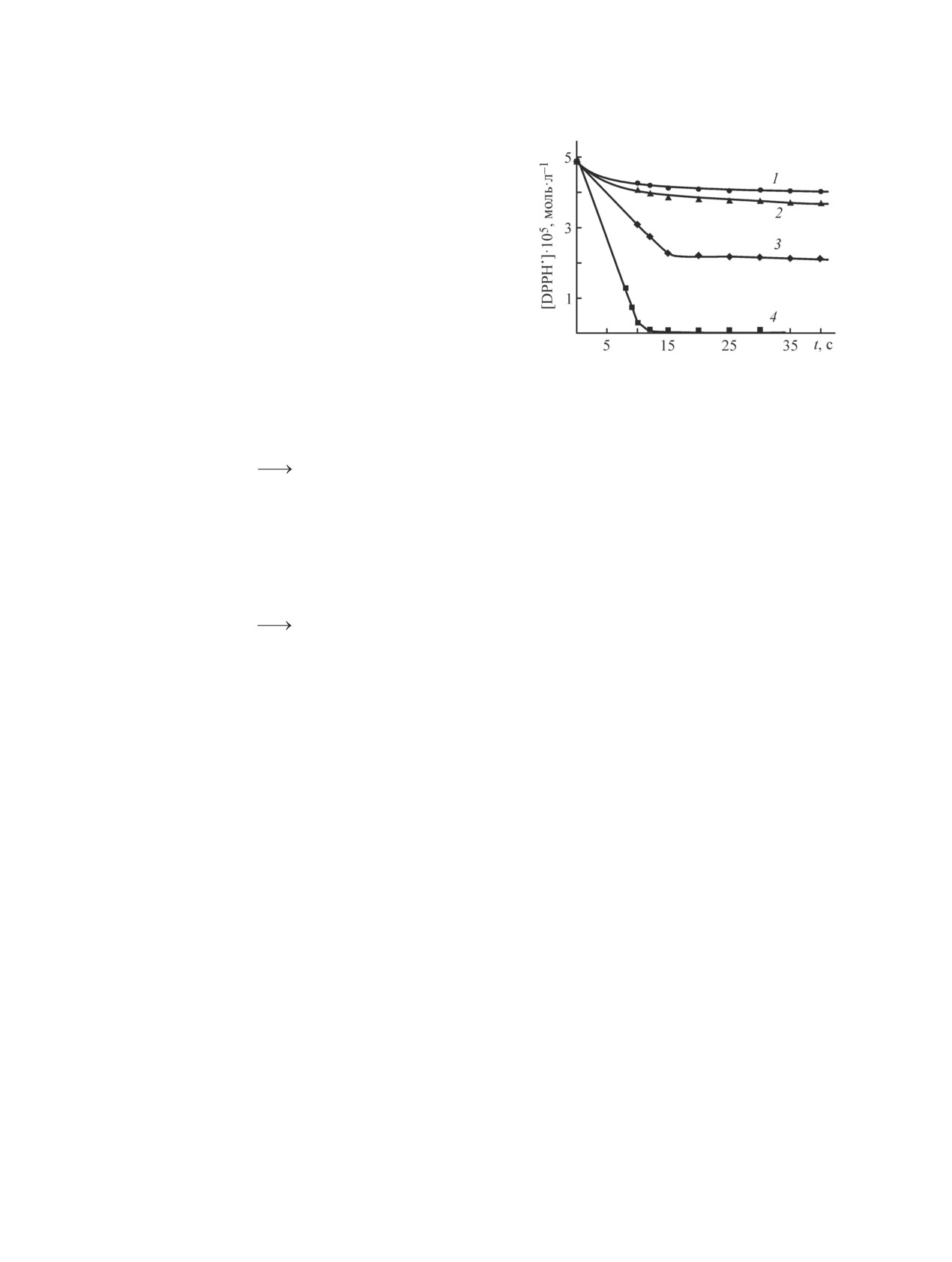
Рис. 2. Влияние добавок солянокислого буферного
от образующегося фенолят-иона (ArO-) (Sequential
раствора с рН 1.5 на кинетику расходования DPPH• в
Proton Loss Electron Transfer, SPLET) [4, 5]:
реакции с галловой кислотой (с = 4.9∙10-5 моль∙л-1)
в этаноле.
ArOH + Solv ArO- + SolvH+,
Содержание этанола (об%): 1 — 60, 2 — 50, 3 — 20, 4 — 0.
ArO- + DPPH• slow ArO• + DPPH-,
(1)
Таким образом, зависимость скорости исследуе-
DPPH- + SolvH+ DPPH - H + Solv.
мой реакции ArOH с DPPH• от рН среды подтвержда-
Непродиссоциировавшие молекулы ArOН могут
ет, что в этаноле преобладает механизм SPLET (1).
дезактивировать DPPH• по механизму последова-
Квантово-химическим дескриптором, связанным
тельного переноса электрона с последующей потерей
с реализацией механизма SPLET, является потен-
протона (Electron Transfer-Proton Transfer, ЕТ-РТ) [6]:
циал ионизации фенолят-иона, который непосред-
ственно участвует в лимитирующей стадии реакции
ArOH + DPPH• slow ArO•+ + DPPH-,
(2). Концентрация такого фенолята в реакционной
ArOH•+ + Solv ArO• + SovH+,
(2)
смеси должна быть максимальна по сравнению с
другими ионными формами, а значит, он образует-
DPPH- + SolvH+ DPPH - H + Solv.
ся либо по I ступени (ArO- для собственно феноль-
Механизм переноса атома Н (Hydrogen Atom
ных соединений — гидроксибензолы, гидрокси-
Transfer, НАТ) с участием ArOH
ацетофеноны, флавоноиды), либо по II ступени
диссоциации (ArO2- для карбоксилсодержащих фе-
ArOH + DPPH• → ArO• + DPPH - H
нолов — гидроксибензойные и гидроксикоричные
не рассматривался, поскольку вероятность его ре-
кислоты).
ализации велика только в неполярных средах, что
Нередко при исследовании механизма SPLET рас-
подтверждается как литературными данными [5, 7],
считывается энтальпия ионизации аниона антиок-
так и проведенными ранее исследованиями [8].
сиданта без учета его доли в системе [10] либо для
Определить, какой из двух параллельных механиз-
прогнозирования АРА вещества используется только
мов — SPLET или ЕТ-РТ является доминирующим и
его константа диссоциации [11], что не позволяет
определяет скорость реакции в целом, можно путем
полностью учесть все факторы, влияющие на реак-
добавки к реакционной смеси в этаноле буферного
ционную способность соединения.
раствора с низким рН.
В данной работе поиск и расчет структуры фе-
На примере галловой кислоты показано (рис. 2),
нолята, участвующего в лимитирующей стадии
что при проведении реакции в этаноле с добавкой
реакции, осуществлялся следующим образом: вна-
солянокислого буферного раствора (рН 1.5) скорость
чале методом QSPR в программном пакете Marvin
исследуемой реакции резко уменьшается вследствие
16.1.11 рассчитывали отрицательные десятичные ло-
подавления процесса диссоциации ArOH и сниже-
гарифмы констант диссоциации изученных веществ
ния концентрации ионных форм, более активных в
рKа = -lgKа (водная среда, Т = 298 K), по величинам
реакции с гидразильным радикалом, чем нейтраль-
которых определяли группы O-H, диссоциирующие
ные молекулы [9]. Напротив, замена кислого на бор-
по I или II ступени, а затем квантово-химическим
но-щелочной (с рН 9) буферный раствор приводит к
методом рассчитывали значения адиабатических по-
резкому увеличению скорости расходования радикала
тенциалов ионизации образующихся ионов в среде
в присутствии ArOH.
этанола:
Факторный анализ связи химической структуры и антирадикальной активности природных фенолов
147
PIArO-(et) = HArO• - HArO,
электронной энергией использовались в качестве
начального приближения для расчета на уровне
где HArO•, HArO — полные энтальпии феноксильного
B3LYP/6-311++G(d,p). Геометрия всех структур была
радикала и соответствующего фенолят-иона;
оптимизирована по всем независимым переменным
без ограничений по симметрии. Все полученные ре-
PIArO2-(et) = HArO•- - HArO2-,
зультаты относятся к основному состоянию и стан-
где HArO•-, HArO2- — полные энтальпии анион-
дартным условиям (T = 298 K, Р = 1 атм). Первичные
радикала и соответствующего бииона фенольной
расчеты проводились в газовой фазе, а затем исполь-
кислоты.
зовались в качестве основы для полной оптимизации
Скорость реакции молекул ArOH с радикалом,
геометрии реагентов и продуктов реакции с учетом
протекающей по механизму ЕТ-РТ (2), будет зави-
влияния растворителя (этанола) с применением под-
сеть от их потенциала ионизации, рассчитанного по
хода поляризуемого континуума РСМ [13]. Для всех
формуле
равновесных структур был проведен гармонический
колебательный анализ с целью тестирования на соот-
PIArOH = HArOH•+ - HArOH,
ветствие минимуму.
где HArOH•+, HArOH — полные энтальпии катион-ра-
В этаноле как амфипротонном растворителе,
дикала и молекулы фенола.
склонном к ионизации веществ, а также при низких
Термохимические характеристики реагентов и
рабочих концентрациях антиоксидантов фенолят-ио-
продуктов реакции DPPH• с ArOH рассчитывали
ны будут образовываться в количестве, достаточном
в рамках теории функционала плотности (DFT) с
для участия в лимитирующей стадии по механизму
использованием гибридного функционала B3LYP
SPLET (1). Об этом свидетельствует как зависимость
в программе Gaussian 09. Выбор B3LYP обуслов-
скорости исследуемой реакции от рН среды (рис.
лен опубликованными данными [8, 12] об успеш-
2), так и более высокая корреляция (рис. 3) антира-
ном применении этого функционала для соедине-
дикальной активности (lnk) изученных фенолов с
ний фенольного типа. Поиск основных конформеров
расчетными значениями PIArO-(2-) [уравнение (3)] по
предварительно осуществлялся в рамках полуэмпи-
сравнению с PIArOH [уравнение (4)]:
рического метода PM6. Структуры с самой низкой
lnk = (71 ± 3) - (15.9 ± 0.8)∙10-2 PIArO-(2-),
n = 43, r = 0.946, r2 = 0.895, F = 349, p < 0.0000, Sest = 0.7,
(3)
где n — число опытов; r — коэффициент корреляции;
го углового коэффициента уравнения регрессии);
r2 — коэффициент детерминации; F — критерий
Sest — стандартная ошибка оценки (или стандартное
Фишера проверки значимости линейной регрессии;
отклонение ошибок предсказания), является мерой
p — уровень значимости, при котором может быть
точности величин, предсказанных по предложенной
принята нуль-гипотеза (о равенстве нулю истинно-
модели:
Рис. 3. Однофакторная линейная регрессионная зависимость логарифма экспериментальной константы скорости
реакции DPPH• с ArOH от потенциала ионизации молекулы PIArOH (а) и бииона PIArO-(2-) (б) фенола.
148
Белая Н. И.
lnk = (97 ± 7) - (16.0 ± 1.3)∙10-2 PIArOH,
n = 43, r = 0.888, r2 = 0.789, F = 153, p < 0.0000, Sest = 1.
(4)
С ростом потенциалов ионизации фенолят-ионов
регрессионный анализ в программе Statistica Demo
реакционная способность антиоксидантов законо-
6.0, позволяющий установить корреляцию между
мерно падает (рис. 3, б), что обусловлено, с точки
двумя квантово-химическими дескрипторами и ан-
зрения доминирования механизма SPLET, замедлени-
тирадикальной активностью фенолов.
ем переноса электрона с иона на радикал. При этом
Как видно [уравнение (5)] из значений множе-
по величине коэффициента корреляции r видно, что
ственного коэффициента корреляции (r = 0.960) и де-
в этаноле влияние потенциала ионизации молекулы
терминации (r2 = 0.922), выбранная линейная модель
ArOH как дескриптора электронной структуры, опре-
с двумя факторами PIArOH и PIArO-(2-) (независимыми
деляющего механизм реакции, явно ниже, а значит,
переменными) адекватно описывает эксперименталь-
ЕТ-РТ можно считать параллельным конкурирую-
ные данные (рис. 4), и вариация зависимой перемен-
щим, но не доминирующим механизмом.
ной (lnk) на 96% может быть обусловлена вариацией
Поскольку взаимосвязь между величинами потен-
независимых переменных. F-критерий Фишера про-
циалов ионизации молекул и фенолят-ионов не пре-
верки значимости линейной модели регрессии имеет
вышает 0.8, был проведен множественный линейный
высокое значение F = 211.
lnk = (83 ± 5) - (4.9 ± 1.1)∙10-2 PIArOH - (11.9 ± 1.5)∙10-2 PIArO-(2-),
(5)
n = 43; r = 0.960; r2 = 0.922; F = 211; p < 0.0000;
Далее проводили анализ частных коэффициентов
Sest = 0.6; бета-коэффициенты: PIArOH-beta = 0.273,
корреляции, отражающих степень линейной взаи-
PIArO-(2-)-beta = 0.709; полные парные коэффици-
мосвязи между двумя переменными, рассчитанную
енты: rlnk-PIArOH = 0.888, rlnk-PIArO-(2-) = 0.946;
после устранения влияния всех других переменных.
частные коэффициенты: r(partical)lnk-PIArOH = 0.419,
При этом следует учитывать, что если между двумя
r(partical)lnk-PIArO-(2-) = 0.768.
величинами частный коэффициент корреляции равен
При этом значения бета-коэффициентов, по-
нулю или уменьшается по сравнению с полным пар-
зволяющих сравнить относительный вклад каждой
ным коэффициентом корреляции, то взаимосвязь этих
независимой переменной в предсказание зависи-
величин в значительной степени обусловлена други-
мой переменной, являются статистически значимы-
ми факторами. Если же при фиксировании других
ми и соответственно равны PIArOH-beta = 0.273 и
факторов степень взаимосвязи двух величин растет
PIArO-(2-)-beta = 0.709 [уравнение (5)]. Видно, что
(частный коэффициент корреляции увеличивается),
переменная PIArO-(2-) вносит больший вклад в изме-
то это означает, что факторы маскировали истинную
нение lnk.
взаимосвязь двух величин. Как видно [уравнение (5)],
при исключении переменной PIArO-(2-) коэффициент
корреляции между зависимой переменной lnk и не-
зависимой PIArOH уменьшается: полный и частный
коэффициенты корреляции соответственно равны
rlnk-PIArOH = 0.888 и rlnk-PIArO-(2-) = = 0.419. Такая
же закономерность наблюдается и при исключении
влияния переменной PIArOH на зависимую перемен-
ную lnk: полный и частный коэффициенты корре-
ляции соответственно равны rlnk-PIArO-(2-) = 0.946 и
r(partical)lnk-PIArO-(2-) = 0.768. Таким образом, мож-
но утверждать о наличии выраженной связи между
PIArOH, PIArO-(2-) и lnk, об отсутствии маскирующего
влияния независимых переменных одной на другую,
а также о статистической значимости параметров
уравнения регрессии. Высокий частный коэффициент
Рис. 4. Линейная регрессионная зависимость логарифма
корреляции между зависимой переменной lnk и не-
экспериментальной константы скорости реакции DP
PH• с ArOH от рассчитанного lnk(calc.) по уравнению (5)
зависимой PIArO-(2-) подтверждает вывод о большем
при доверительной вероятности 95%.
влиянии этой переменной по сравнению с PIArOH,
Факторный анализ связи химической структуры и антирадикальной активности природных фенолов
149
дразильный радикал, что, по-видимому, связано с
участием в реакции активных фенолят-ионов. При
этом карбоксилсодержащие фенольные соединения
с более выраженными кислотными свойствами про-
являют наиболее высокую реакционную способность
по отношению к DPPH•. Это обусловлено не только
низкими потенциалами ионизации их молекул и фе-
нолят-ионов (рис. 5), но и лучшей способностью к
диссоциации. В зависимости от структуры феноло-
кислот их потенциалы ионизации изменяются сле-
дующим образом:
— величина k гидроксикоричных кислот выше,
а PIArO2- ниже, чем у соответствующих фенолкар-
боновых кислот, за счет большей удаленности элек-
троноакцепторной карбоксильной группы -СООН
от бензольного кольца посредством винильного мо-
стика;
— кислоты с одной О-Н-группой характеризуются
Рис. 5. Трехмерный график зависимости логарифма
экспериментальной константы скорости реакции DPPH•
высокими потенциалами ионизации фенолят-ионов и,
с ArOH от потенциала ионизации молекулы PIArOH и би-
следовательно, менее склонны к процессам переноса
иона PIArO-(2-) фенола, построенный в системе Statistica
электрона, что подтверждается их низкой антиради-
Demo 6.0.
кальной активностью;
— наибольшую реакционную способность про-
сделанный на основе анализа бета-коэффициентов
являют тригидроксибензойные кислоты и их эфиры,
[уравнение (5)].
фенолят-ионы которых имеют низкие значения по-
Величина толерантности для независимых пере-
тенциалов ионизации (№ 24, 23, 26, 27). Исключение
менных (1 - R2, где R2 — квадрат коэффициента кор-
составляет флороглюцинкарбоновая кислота (№ 28)
реляции между PIArO-(2-) и PIArOH), характеризующая
с высоким PIPhO2-.
их избыточный вклад в уравнение регрессии, равна
Большинство флавоноидов менее эффективны,
0.302, что отлично от нуля, а значит, указанные неза-
чем тригидроксибензойные кислоты. Особенно низ-
висимые переменные нельзя исключить из уравнения
кой АРА обладают флаваны, потенциалы ионизации
как лишние величины. Анализ остатков показал, что
их фенолят-ионов выше, чем у флавонолов, а зна-
остатки имеют нормальное распределение, не наблю-
чит, ионы соединений № 35 и 36 будут медленнее
дается их упорядоченной зависимости от величин
отдавать электрон в реакции с радикалом DPPH• по
зависимой или независимых переменных, среднее
механизму SPLET.
остатков приближается к нулю (≈1.3∙10-8).
При использовании методологии QSAR важно
Для выбранной и статистически аргументирован-
контролировать прогностическую способность по-
ной модели можно построить трехмерный график
строенных моделей. Один из наиболее надежных
зависимости между параметром антирадикальной
подходов к решению этой задачи состоит в использо-
активности фенолов (lnk) и их структурными кванто-
вании контрольной выборки. Последняя необходима
во-химическими дескрипторами (PIArOH и PIArO-(2-))
для независимого контроля предсказательной способ-
(рис. 5).
ности моделей. Такой подход позволяет в большин-
С учетом того что PIArOH является дескриптором
стве случаев избежать случайных корреляций.
для механизма ЕТ-РТ, а PIArO-(2-) — для SPLET, по-
В качестве такой группы были использованы ги-
лученную многофакторную зависимость можно ин-
дроксиацетофеноны № 44-50 (табл. 2) как соедине-
терпретировать как дополнительное подтверждение
ния, относящиеся к природным растительным фе-
протекания реакции ArOН с DPPH• в этаноле по двум
нолам [14] и имеющие близкую с ними химическую
параллельным механизмам ЕТ-РТ и SPLET с доми-
структуру и одинаковый антирадикальный механизм
нированием последнего.
действия. Гидроксиацетофеноны редко встречаются
Анализ взаимосвязи дескриптор-активность
в растительных тканях, но при этом используются
растительных фенолов показал, что в этаноле все
при исследовании окислительно-восстановительных
изученные вещества способны дезактивировать ги-
свойств флавоноидов [15], поскольку моделируют
150
Белая Н. И.
Таблица 2
Расчетные значения потенциалов ионизации молекул (PIArOH) гидроксиацетофенонов и их фенолят-ионов
(PIArO-), диссоциирующих по I ступени, а также экспериментальные (k) и прогнозируемые константы (kcalc)
скорости их реакции с радикалом DPPH•
H3C
C O
R1
R4
R2
R3
№
PIArOH
PIArO*
kcalc**
k
Δk
Δk
Соединение
соединения
кДж∙моль-1
л∙моль-1∙с-1
%
44
2-Гидроксиацетофенон
587
417
1∙102
(1.13 ± 0.03)∙102
10.3
(R1=OH, R2=R3=R4=H)
45
3-Гидроксиацетофенон
580
411
2.9∙102
(3.05 ± 0.15)∙102
4.8
(R2=OH, R1=R3=R4=H)
46
4-Гидроксиацетофенон
583
413
2∙102
(2.19 ± 0.13)∙102
10.1
(R3=OH, R1=R2=R4=H)
47
2,4-Дигидроксиацетофенон
574
414a
2.7∙102
(2.91 ± 0.13)∙102
6.2
6.5
(R1=R3=OH, R2=R4=H)
48
2,5-Дигидроксиацетофенон
554
394b
7.8∙103
(8.0 ± 0.3)∙103
1.8
(R1=R4=OH, R2=R3=H)
49
3,4-Дигидроксиацетофенон
558
398c
4∙103
(4.08 ± 0.15)∙103
1.7
(R2=R3=OH, R1=R4=H)
50
3-Метокси-4-Гидроксиацетофенон
581
420
95
(1.06 ± 0.03)∙102
10.6
(R2=ОСН3, R3=OH, R1=R4=H)
* a, b, c — величины потенциалов ионизации фенолят-ионов, образующихся по I ступени диссоциации в положении
4, 5 и 4 ароматического цикла молекулы гидроксиацетофенона соответственно.
** Значения рассчитаны по уравнению (5).
фрагменты молекулы флавонолов, которые формиру-
Установленная линейная зависимость [уравне-
ют кольца А и С (табл. 1).
ние (6)] между прогнозируемыми и эмпирическими
По расчетным дескрипторам (PIArOH и PIArO-)
константами имеет высокие значения коэффициен-
электронного строения молекул и ионов гидрокси-
та корреляции (r = 0.996) и критерия Фишера, что
ацетофенонов были спрогнозированы константы ско-
подтверждает адекватность предложенного двух-
рости (kcalc) их реакции с DPPH• по уравнению (5).
факторного уравнения (5) для прогнозирования
Для проверки адекватности прогнозируемых kcalc эти
АРА природных фенолов в этаноле по отношению
же величины были определены экспериментально (k)
к DPPH•:
в этаноле при Т = 293 ± 2 K.
kcalc = -(11.4 ± 2.4) + (98.3 ± 0.1)∙10-2 k,
n = 7, r = 0.999, r2 = 0.998, F = 1998, p < 0.00000, Sest = 5.22.
(6)
Чтобы иметь более наглядное суждение о качестве
определяли среднюю ошибку аппроксимации (Δk =
предложенной модели из относительных отклонений
= 1/n∑Δk), которая не должна превышать 8-10%.
Установлено (табл. 2), что единичные относитель-
(k - kcalc)
для каждой константы Δk =
·100%
,
ные отклонения предсказанных констант не превыша-
k
Факторный анализ связи химической структуры и антирадикальной активности природных фенолов
151
ют 11%, а средняя ошибка аппроксимации составляет
the heuristic method and a support vector machine //
6.5%, что свидетельствует о хорошем подборе модели
J. Chem. Inf. Comput. Sci. 2004. V. 44. N 5. P. 1693-
[уравнение (5)].
[3] Lagunin A., Zakharov A., Filimonov D., Poroikov V.
QSAR modelling of rat acute toxicity on the basis of
Выводы
PASS prediction // Mol. Inform. 2011. V. 30. N 2-3.
Применение факторного анализа позволяет полу-
Р. 241-250.
чить модельную линейную функцию с минимальным
[4] Galano A., Mazzone G., Alvarez-Diduk R., Marino
набором дескрипторов электронного строения веще-
T., Alvarez-Idaboy J. R., Russo N. Food antioxidants:
ства, достаточным для описания антирадикальной
chemical insights at the molecular level // Annu. Rev.
активности растительных фенольных соединений
Food Sci. Technol. 2016. V. 7. P. 335-352. https://
разных классов. Адекватный подбор дескрипто-
doi.org/10.1146/annurev-food-041715-033206
ров зависит от полярности и ионизирующей спо-
[5] Mazzone G., Russo N., Toscano M. Antioxidant
собности среды, а также механизма окислительных
properties comparative study of natural
превращений антиоксиданта в реакции с радика-
hydroxycinnamic acids and structurally modified
лом. Полученная количественная взаимосвязь дес-
derivatives: Computational insights // Comput.
криптор-активность не только представляет собой
Theoret. Chem. 2016. V. 1077. P. 39-47.
готовое полуэмпирическое двухфакторное уравнение
для подбора эффективных антиоксидантов, но и явля-
[6] Litwinienko G., Ingold K. U. Solvent effects on the
ется основой скрининга антирадикальной активности
rates and mechanisms of reaction of phenols with
природных фенольных соединений.
free radicals // Acc. Chem. Res. 2007. V. 40. N 3.
[7] Volkov V. A., Misin V. M. Kinetics of reactions of
Благодарности
antioxidants from some food and medicinal plants
with the stable radical 2,2-diphenyl-1-picrylhydrazyl //
Расчеты в рамках теории функционала плотно-
Kinet. Catal. 2015. V. 56. N 1. P. 43-48.
сти выполнены в Центре коллективного пользования
«Высокопроизводительные вычисления» Южного
[Волков В. А., Мисин В. М. Кинетика взаимодей-
Федерального университета. Автор выражает призна-
ствия антиоксидантов ряда пищевых и лекарствен-
тельность заведующему кафедрой физической и кол-
ных растений со стабильным радикалом 2,2-дифе-
лоидной химии Южного Федерального университета
нил-1-пикрилгидразилом // Кинетика и катализ.
профессору И. Н. Щербакову за оказанную помощь
2015. Т. 56. № 1. С. 48-54].
при квантово-химических расчетах.
[8] Белая Н. И., Белый А. В., Заречная О. М., Щерба-
ков И. Н., Дорошкевич В. С. Структура переходного
состояния и механизм реакции гидроксибензолов
Конфликт интересов
с N-центрированным радикалом в неионизиру-
ющих средах // ЖОХ. 2018 Т. 88 № 7 С. 1057-
Автор заявляет об отсутствии конфликта интере-
1069 [Belaya N. I., Belyi A. V., Zarechnaya O. M.,
сов, требующего раскрытия в данной статье.
Scherbakov I. N., Doroshkevich V. S. Transition
state structure and mechanism of the reaction of
Информация об авторах
hydroxybenzenes with N-centered radical in non-
ionizing media // Russ. J. Gen. Chem. 2018. V. 88.
Белая Наталья Ивановна, к.х.н., доцент, ORCID:
N 7. P. 1351-1362.
[9] Musialik M., Litwinienko G. Scavenging of dpph•
radicals by vitamin E is accelerated by its partial
Список литературы
ionization: the role of sequential proton loss electron
[1] Javan A. J., Javan M. J. Electronic structure of
transfer // Org. Lett. 2005. V. 7. N 22. P. 4951-4954.
some thymol derivatives correlated with the radical
scavenging activity: Theoretical study // Food Chem.
[10] Marković Z., Đorović J., Petrović Z. D., Petrović V. P.,
2014. V. 165. P. 451-459.
Simijonović D. Investigation of the antioxidant and
radical scavenging activities of some phenolic Schiff
[2] Xue C. X., Zhang R. S., Liu H. X., Yao X. J., Liu M. C.,
bases with different free radicals // J. Mol. Model.
Hu Z. D., Fan B. T. QSAR models for the prediction
2015. V. 21. P. 293-1003.
of binding affinities to human serum albumin using
152
Белая Н. И.
[11] Pérez-González A., Galano A., Alvarez-Idaboy J. R.
[13] Tomasi J., Mennucci B., Cammi R. Quantum
Dihydroxybenzoic acids as free radical scavengers:
mechanical continuum solvation models // Chem.
mechanisms, kinetics, and trends in activity // New J.
Chem. 2014. V. 38. P. 2639-2652.
org/10.1021/cr9904009
[14] Барабой В. А. / Растительные фенолы и здоровье
[12] Weinberg D. R., Gagliardi C. J., Hull J. F.,
человека. М.: Наука, 1984. C. 25-38.
Murphy C. F., Kent C. A., Westlake B., Paul A.,
[15] Черников Д. А., Пальшин В. А., Баженов Б. Н.,
Ess D. H., McCafferty G. D., Meyer T. J. Proton-
Сафронов А. В. Гидроксиацетофеноны — новые
coupled electron transfer // Chem Rev. 2007. V. 107.
модели при изучении электроокисления кверце-
тина // Изв. вузов. Химия и хим. технология. 2012.
Т. 55. № 8. С. 43-47.