Экстракционное извлечение железа(III) трибутилфосфатом из бромидных растворов
243
Журнал прикладной химии. 2020. Т. 93. Вып. 2
УДК 661.462:66.061
ЭКСТРАКЦИОННОЕ ИЗВЛЕЧЕНИЕ ЖЕЛЕЗА(III) ТРИБУТИЛФОСФАТОМ
ИЗ БРОМИДНЫХ РАСТВОРОВ
© Д. В. Кузьмин, В. И. Кузьмин, Н. В. Гудкова, М. Н. Лескив
Институт химии и химической технологии СО РАН,
660036, г. Красноярск, ул. Академгородок, д. 50/24
E-mail: kuzmin-dv@mail.ru
Поступила в Редакцию 31 января 2019 г.
После доработки 24 сентября 2019 г.
Принята к публикации 14 декабря 2019 г.
Исследовано экстракционное извлечение железа(III) трибутилфосфатом из бромидных водных
растворов в процессе электрохимической переработки природных вод и рассолов. Установлено, что
железо(III) извлекается из растворов бромидов щелочных металлов в виде комплексной соли MFeBr4
при концентрации солей более 4 моль·л-1. Извлечение возрастает в ряду KFeBr4 < NaFeBr4 < LiFeBr4.
Продукты экстракции в значительной степени подвержены электролитической диссоциации в орга-
нической фазе. Определены оптимальные условия извлечения бромида железа(III) и возвращения его
в технологический процесс.
Ключевые слова: бромиды; железо(III); экстракция; трибутилфосфат; переработка природных вод
и рассолов
DOI: 10.31857/S0044461820020127
Основными промышленными источниками брома
бромидного солевого концентрата. Этот способ ос-
являются морская вода, озерные и подземные рассо-
нован на анодном окислении бромид-иона в элек-
лы. Традиционные методы его выделения из этого
тролизере, переносе элементного брома из анодного
сырья основаны на окислении бромид-иона до мо-
в катодное пространство, которые разделены между
лекулярного брома, обычно хлором и выделении по-
собой катионообменной мембранной, и последую-
лученного брома из основной водной массы. Первые
щем катодном восстановлении брома с получением
промышленные способы выделения брома, которые
солевого бромидного концентрата. Бром транспорти-
широко применяются и до настоящего времени, были
руют из анодного в катодное пространство, используя
основаны на отгонке брома из рассола при продувке
жидкостную экстракцию. Для повышения эффек-
через раствор воздуха или пара [1]. Эти процессы
тивности процесса в католит добавляют небольшие
совершенствуются в основном для снижения энерго-
количества бромида железа (0.05-0.1 моль·л-1) [8].
затрат при выделении окисленного брома [2]. С этой
В дальнейшем процесс был усовершенствован
целью предлагается использовать различные сорбци-
[9]. Вместо природного рассола в анодную камеру
онные и экстракционные методы извлечения [3-5],
подают раствор чистого хлорида металла (лития,
а также мембранные процессы [6]. Сравнительный
натрия, калия и др.), а образующийся молекулярный
анализ этих технологических процессов представлен
хлор смешивают с бромсодержащим рассолом. Это
в обзоре [7]. Следует отметить, что значительное чис-
позволяет получать в анодной камере электролизера
ло исследований в этом направлении выполняется в
вместо концентрата, содержащего смесь бромидов
Китае, который в настоящее время вышел на третье
различных металлов, востребованные бромиды ин-
место в мире после США и Израиля по получению
дивидуальных металлов (лития, натрия, калия и др.).
бромидной продукции.
Оба предложенных электрохимических процесса
Нами предложен несколько иной — электрохими-
[8, 9] позволяют получать достаточно концентриро-
ческий вариант извлечения брома [8] с получением ванные растворы бромидов (3-4.5 моль·л-1) с низким
244
Кузьмин Д. В. и др.
содержанием хлора. Основной примесью в получен-
ли титрованием растворами азотнокислого серебра в
ных продуктах является бромид железа(III), добавля-
присутствии хромата калия. Для устранения мешаю-
емый для улучшения технологических показателей
щего влияния железа(III) к анализируемому раствору
процесса. Железо(III) может быть удалено из полу-
добавляли 0.2-0.3 г фторида калия. При определении
ченных растворов различными гидрометаллургиче-
состава экстрактов аликвоту органической фазы объе-
скими способами. Перспективным процессом для
мом 1 мл разбавляли толуолом в 10 раз для снижения
этого является жидкостная экстракция, использо-
активности экстрагента, далее реэкстрагировали соли
вание которой может обеспечить не только очистку
10 мл воды и анализировали водную фазу. Полнота
продуктивного раствора от железа, но и возвращение
перехода солей в водный раствор установлена отсут-
этой добавки в технологический процесс.
ствием солей в реэктрактах при повторном контакте
Извлечение железа(III) из хлоридных растворов
органической фазы с водой и сохранением материаль-
органическими соединениями изучено достаточно
ного баланса в системе.
хорошо [10-12]. Для этого могут быть использова-
Электропроводность органической фазы опре-
ны нейтральные экстрагенты — диэтиловый эфир,
деляли с использованием кондуктометра Анион
метилизобутилкетон и трибутилфосфат. Установлено,
4100. Перед измерениями органические экстракты,
что железо(III) также достаточно эффективно экстра-
содержащие комплексные галогенидные соли желе-
гируется из растворов бромистоводородной кислоты.
за(III) с трибутилфосфатом, фильтровали через бу-
В этом случае катионы железа(III) извлекаются в виде
мажный фильтр для удаления микроэмульсий водной
сольватированной комплексной кислоты HFeBr4 [13].
фазы.
Целью настоящей работы являлась оценка возмож-
ности извлечения железа(III) из растворов бромидов
Обсуждение результатов
щелочных металлов доступным и дешевым промыш-
ленным экстрагентом — трибутилфосфатом.
При решении проблемы очистки бромидов ще-
лочных металлов от железа важно, чтобы сами соли
экстрагировались незначительно. В связи с этим была
Экспериментальная часть
исследована экстракция бромидов лития, натрия,
В работе использовали минеральные кислоты (со-
калия, а также бромистоводородной кислоты без до-
ляную и бромистоводородную), щелочи (гидроксид
бавок железа(III) (рис. 1). Бромиды извлекаются в
натрия), соли [бромиды железа(III), лития, натрия и
органическую фазу незначительно. Для 4 М раство-
калия], элементный бром квалификации х.ч. и ч.д.а.
ров солей величина их коэффициентов распреде-
и органические растворители — толуол и гептан ква-
ления не превышает 0.01-0.02 (извлечение 1-2%).
лификации х.ч., трибутилфосфат — «техн».
Трибутилфосфат и гептан предварительно обраба-
тывали молекулярным бромом с целью разрушения
возможных примесей органических восстановителей.
Для этого к органическим реагентам добавляли бром
до концентрации 0.1-0.2 моль·л-1. Растворы выдер-
живали 1-2 ч, затем обрабатывали раствором 1 М
гидроксида натрия. Далее трибутилфосфат и гептан
перегоняли (трибутилфосфат в вакууме при давлении
5-7 мм рт. ст.).
Экстракцию в статических условиях проводили
в делительных воронках при температуре 20-22°С и
времени перемешивания водной и органической фаз
3-5 мин. Предварительно показано, что этого време-
ни достаточно для установления межфазного равно-
весия. Извлечение проводили при равном отношении
объемов водной (в) и органической (о) фаз (о:в = 1:1).
Концентрацию катионов металлов в раство-
рах определяли атомно-абсорбционным методом с
Рис. 1. Изотермы экстракции бромидов щелочных ме-
использованием спектрометра Analist 400 (Perkin
таллов 80%-ным раствором трибутилфосфата в гептане.
Elmer). Бромид-ион в водных растворах анализирова-
1 — KBr, 2 — NaBr, 3 — LiBr, 4 — HBr.
Экстракционное извлечение железа(III) трибутилфосфатом из бромидных растворов
245
Экстрагируемость бромидов однозарядных катионов
возрастает в ряду KBr < NaBr < LiBr << HBr в соот-
ветствии с уменьшением радиуса катионов и ростом
их энергии пересольватации.
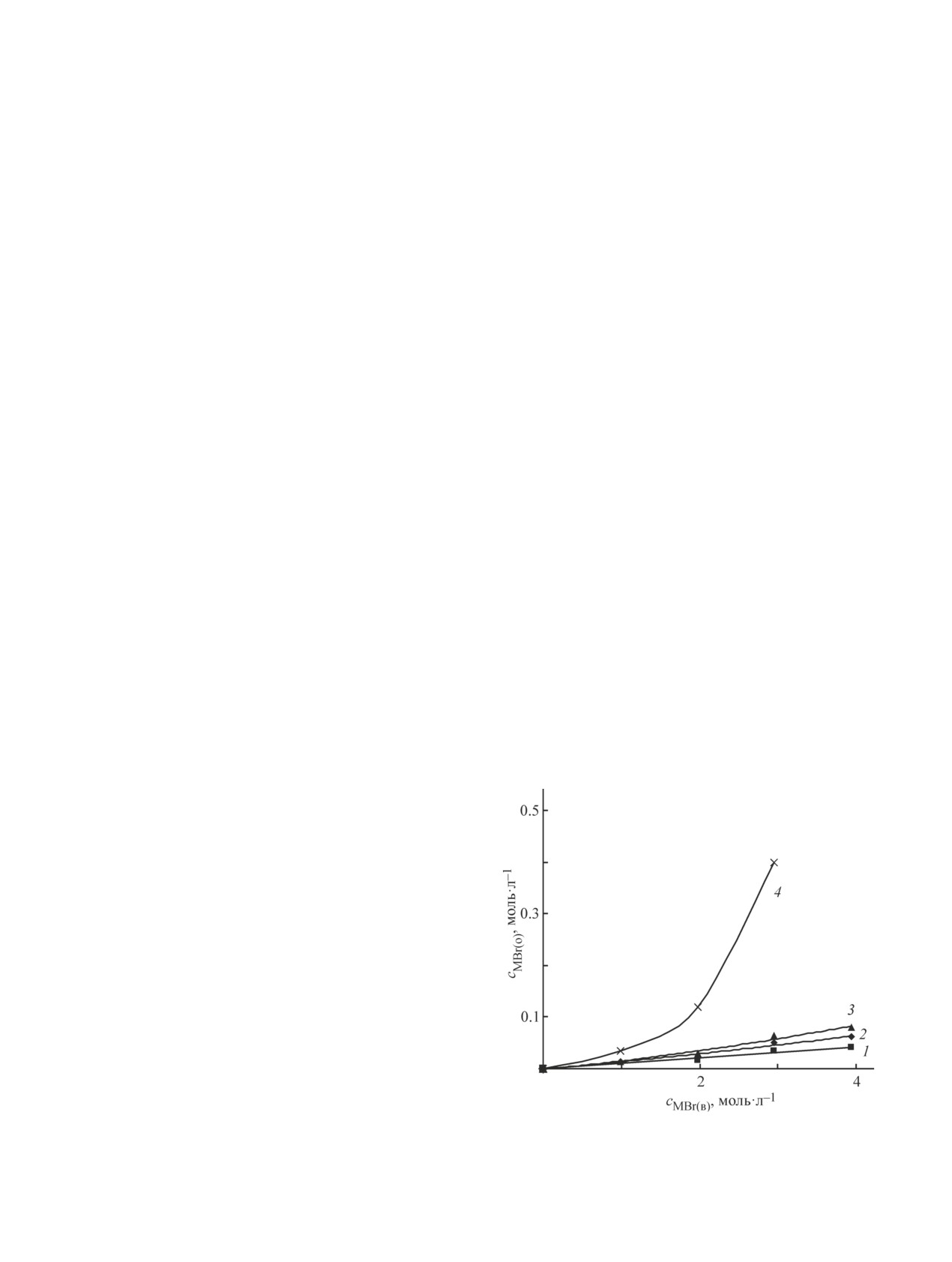
При контактировании разбавленных растворов
(<0.1 моль·л-1) бромида железа(III) с трибутилфос-
фатом экстракция соли не наблюдается в пределах
ошибки анализа (рис. 2). В области концентраций
бромидов менее 3 моль·л-1 коэффициенты распре-
деления железа также невелики, и процесс не пред-
ставляет интереса для извлечения железа. При даль-
нейшем повышении концентраций коэффициенты
распределения железа резко возрастают, достигая
150 для 4 М раствора бромида лития и 40 для 4 М
раствора бромида натрия. Извлечение железа из рас-
творов бромида калия остается относительно неболь-
Рис. 2. Зависимость коэффициентов распределения же-
шим, коэффициент распределения составляет около
леза от концентрации бромидов калия (1), натрия (2) и
2. Тем не менее для противоточного процесса это не
лития (3) при экстракции 80%-ным раствором трибу-
является большой проблемой, и хорошее извлечение
тилфосфата в гептане.
бромида железа может быть достигнуто за 5-7 сту-
Концентрация бромида железа(III) в исходных растворах
пеней экстракции. При равном отношении объемов
0.05 моль·л-1.
органической и водной фаз этот режим обеспечит из-
влечение бромида железа(III) в органическую фазу на
97-99%. В то же время последующая после экстрак-
ветствует образованию экстрагируемого комплекса
ции обработка органической фазы водой позволит
MFeBr4:
реэкстрагировать железо практически нацело за одну
М(в)+ + Fe(в)3+ + 4Br(в)- + pL(o)
МLpFeBr4(o), (1)
ступень и вернуть его обратно в производственный
цикл.
где М(в)+ — катионы Li+, Na+, К+; L(o) — молекулы
Экстракция в органическую фазу бромида же-
трибутилфосфата; МLpFeBr4 — образующееся при
леза(III) сопровождается повышением извлечения
экстракции комплексное соединение; символы (в) и
бромидов щелочных металлов по отношению к рас-
(o) обозначают принадлежность компонента к водной
творам этих солей без железа(III) (рис. 3). Оценка до-
или органической фазе соответственно.
полнительно соэкстрагируемых с железом количеств
Таким образом, извлечение в органическую фа-
катионов щелочных металлов и бромид-ионов соот-
зу наряду с железом(III) также катионов щелочных
Рис. 3. Изотермы экстракции бромида лития (а), бромида натрия (б) 80%-ным раствором трибутилфосфата в гептане.
1 — без FeBr3, 2 — в присутствии 0.1 М FeBr3.
246
Кузьмин Д. В. и др.
металлов в виде комплексных солей по реакции (1)
добавлении в органическую фазу молекулярного иода
объясняет значительные различия в экстрагируемости
электропроводность растворов резко возрастает из-за
бромида железа из растворов бромидов различных
замены галогенид-ионов в соединениях на крупные
щелочных металлов. Полученный ряд экстрагируе-
комплексные анионы типа [X(I2)]- или [X(I2)2]-, что
мости бромида железа KFeBr4 < NaFeBr4 < LiFeBr4
приводит к значительной электролитической диссо-
соответствует экстрагируемости исходных бромидов
циации соединений в органической фазе.
щелочных металлов, что также обусловлено ростом
Большое значение, с практической точки зрения,
энергии пересольватации катионов в этом ряду.
имеет подбор оптимальной концентрации трибутил-
По данным измерений электропроводности орга-
фосфата. Это обусловлено не только высокой вязко-
нической фазы было установлено, что соль MLpFeBr4
стью 100%-ного трибутилфосфата, но и его плотно-
практически нацело диссоциирована в экстрактах на
стью, близкой к плотности воды, что при извлечении
ионы по реакции
солей нередко приводит к затруднению разделения
фаз в экстракторах. Эти проблемы устраняются путем
MLpFeBr4(o)
MLp(o)+ + FeBr4(o)-.
(2)
разбавления экстрагента легкими углеводородами.
Однако любое снижение концентрации экстрагента
Об этом свидетельствует высокая величина удель-
ухудшает экстракцию солей. Это также имеет место
ной электропроводности органических растворов
для исследуемой системы. Для всех исследованных
и линейность ее зависимости в широком диапазоне
солей снижение концентрации трибутилфосфата с 80
концентрации солей в экстрактах (рис. 4). Лишь в
до 60% приводит к почти 5-кратному снижению коэф-
области концентраций солей выше 0.1 моль·л-1 на-
фициентов распределения железа (рис. 5). Степенной
блюдается небольшое снижение электропроводно-
характер зависимости влияния содержания трибутил-
сти, что связано с ростом доли недиссоциированных
фосфата свидетельствует о сольватации комплексов
комплексов. При этом степень диссоциации литиевой
несколькими молекулами трибутилфосфата.
соли несколько выше, чем калиевой, что может быть
Оценка среднего сольватного числа для экстра-
обусловлено ее более значительной сольватацией
гируемых солей осложнена необходимостью учета
молекулами трибутилфосфата.
степени диссоциации солей в органической фазе. Это
Аналогичные свойства обнаружены нами для си-
обусловлено изменением диэлектрической проница-
стем с трибутилфосфатом при экстракции комплекс-
емости растворов и возможным участием трибутил-
ных соединений галогенидов скандия и галогенводо-
фосфата в самой реакции диссоциации, например, по
родных кислот с молекулярным иодом [14], а также
уравнениям (3), (4), когда молекулы трибутилфосфата
систем с тетрафенилборатами щелочных и щелочно-
земельных металлов. Установлено, что галогениды
скандия и галогенводородные кислоты в растворах
трибутилфосфата диссоциированы слабо. Однако при
Рис. 5. Зависимость коэффициентов распределения
Fe(III) от концентрации трибутилфосфата в гептане
Рис. 4. Зависимость удельной электропроводности экс-
(сМBr(исх)= 4 моль·л-1).
трактов от концентрации LiFeBr4 и KFeBr4 в 80%-ном
растворе трибутилфосфата (разбавитель — гептан).
1 — LiBr, 2 — KBr, 3 — NaBr.
Экстракционное извлечение железа(III) трибутилфосфатом из бромидных растворов
247
вытесняют комплексный анион [FeBr4]- из внутрен-
Финансирование работы
ней координационной сферы во внешнюю с образо-
Работа выполнена по госбюджетному проекту
ванием сольваторазделенной пары, диссоциирующей
V.46.1.1 фундаментальных исследований Сибирского
далее на ионы:
отделения Российской академии наук «Физико-
химические исследования поверхности и межфазных
MLpFeBr4(o) + L(о)
[MLp+1]+[FeBr4](o)-,
(3)
процессов, развитие научных основ высокоэффектив-
[MLp+1]+[FeBr4](o)-
ML(p+1)(o)+ + [FeBr4](o)-. (4)
ных и экологически безопасных технологий перера-
ботки природного и техногенного сырья цветных,
Тем не менее из полученных данных ясно, что
редких и благородных металлов и получения высо-
концентрация трибутилфосфата в органической фазе
котехнологичных материалов».
должна находиться в пределах 75-85%, что обеспечит
высокие показатели извлечения железа(III) и хорошее
Конфликт интересов
расслаивание фаз.
Авторы заявляют об отсутствии конфликта инте-
ресов, требующего раскрытия в данной статье.
Выводы
Проведенные исследования показывают возмож-
Информация об авторах
ность эффективной очистки бромидных растворов от
Кузьмин Дмитрий Владимирович, к.х.н., ORCID:
железа(III) экстракцией трибутилфосфатом с глубо-
кой реэкстракцией бромида железа водой, что может
Кузьмин Владимир Иванович, д.х.н., проф.,
быть использовано в процессе электрохимического
мембранного способа извлечения брома из природ-
Гудкова Наталья Владимировна, к.х.н., ORCID:
ных вод и рассолов. Установлено, что железо(III)
извлекается в органическую фазу в виде комплексной
Лескив Марина Николаевна, к.х.н., ORCID: https://
соли MFeBr4, а величина его коэффициентов рас-
orcid.org/0000-0003-0782-2317
пределения зависит от природы соэкстрагируемого
бромида металла (лития, натрия или калия).
Список литературы
Принципиальная технологическая схема процесса
очистки бромидов лития и натрия может включать
[1] Ксензенко В. И., Стасиневич Д. С. Химия и техноло-
гия брома, йода и их соединений. М.: Химия, 1995.
двух-трехступенчатую противоточную экстракцию
C. 162-280.
бромида железа 80%-ным раствором трибутилфосфа-
[2] Pat. WO 2016054874 (publ. 2016). Method for
та из 4 М растворов бромидов лития или натрия при
extracting bromine from seawater by vacuum
равном соотношении потоков водной и органической
distillation.
фаз. На этой стадии содержание железа в бромидах
[3] Liu W., Cai R., Zhang H., Ma L., Wu D., Lu S., Zhang
снижается более чем в 1000 раз и не превышает тре-
Yu-shan. Extracting bromine from brine by using a new
буемый допустимый уровень (5 мг·л-1). Для очистки
type macro-porous resin // J. Salt Chem. Ind. 2012. N 5.
растворов бромида калия потребуется 5-7 ступеней
P. 20-24.
противоточной экстракции или повышение кон-
[4] Pat. CN 103754823 A (publ. 2014). Reaction-extraction
центрации бромида калия упаркой до 5-6 моль·л-1.
coupling method for extracting molecular bromine or
Водный бромидный раствор после очистки упарива-
iodine.
ют с целью получения кристаллических солей брома.
[5] Pat. CN 103613072 A (publ. 2014). Method for
Из органического раствора FeBr3 реэкстрагируют
recovering bromine from bromine-containing
водой также при равных соотношениях водной и
wastewater by solvent extraction.
[6] Hao F., Wu C., Lv X., Wang G., Zhang H. Novel
органической фаз. Степенной характер зависимости
membrane absorption process for extracting bromine
извлечения железа от концентрации бромидов обе-
from Seawater // J. Salt Chem. Ind. 2008. N 6. P. 1-4.
спечивает практически количественную реэкстрак-
[7] Fei G., Yuting L., Xiushen Y., Haining L. Progress on
цию и регенерацию экстрагента за 1 ступень. Далее
the extraction techniques of bromine // Int. Symp. on
водный реэкстракт, содержащий бромиды железа и
Energy Science and Chemical Engineering. 2010. P. 23-
некоторое количество соэкстрагирующихся щелоч-
ных солей, направляют в технологический процесс на
[8] Пат. РФ 2360039 (опубл. 2009). Способ извлечения
получение бромидов, а органический раствор — на
брома из природных хлоридных вод с получением
головную стадию экстракции железа.
бромидного концентрата.
248
Кузьмин Д. В. и др.
[9] Пат. РФ 2398734 (опубл. 2010). Способ извлечения
HInBr4- nitrobenzene systems // J. Am. Chem. Soc.
брома из природных вод с получением бромидов
1966. N 10. P. 2099-2104.
металлов.
[10] Meyers D. A., McDonald R. L. Solvation of extracted
[13] Gerald G. S., Herbert M. C. The extraction of ferric
complex metal acids III. The HFeCl4-diethyl ether
bromide by diethyl ether // J. Phys. Chem. 1961. V. 65.
system // J. Am. Chem. Soc. 1967. N 3. P. 486-489.
[14] Кузьмин В. И., Кузьмина А. А., Гудкова Н. В.
[11] Seung L., Gwang-Seop L., Keun Yong S. Solvent
Оценка возможности получения бромида калия
extraction equilibria of FeCl3 with TBP // Japan Inst.
при экстракции из хлоридно-кальциевых природ-
Metals. 2004. V. 45. N 6. P. 1859-1863.
ных рассолов смесью трибутилфосфата и моле-
кулярного иода // Хим. технология. 2018. № 10.
[12] Erickson R. L., McDonald R. L. Solvation of extracted
complex metal acids. I. The HFeCl4-, HFeBr4-, and
5811-2018-19-10-468-473