290
Батоева А. А. и др.
Журнал прикладной химии. 2020. Т. 93. Вып. 2
УДК 544.526.2
ФОТОКАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕ ТИОЦИАНАТОВ
В ВОДНЫХ РАСТВОРАХ
© А. А. Батоева, М. Р. Сизых, В. А. Мункоева
Байкальский институт природопользования CO РАН,
670047, г. Улан-Удэ, ул. Сахьяновой, д. 6
E-mail: abat@binm.ru
Поступила в Редакцию 23 апреля 2019 г.
После доработки 14 сентября 2019 г.
Принята к публикации 14 декабря 2019 г.
Исследованы кинетические закономерности фотокаталитического окисления тиоцианатов персуль-
фатом под воздействием квазисолнечного ультрафиолетового излучения (УФ). Изучено влияние основ-
ных факторов (рН, температуры реакционной среды, природы катализатора, времени экспозиции) на
эффективность окисления тиоцианатов в комбинированной системе {УФ/S2O82-/Fe3+}. Установлено,
что процесс фотокаталитического окисления тиоцианатов протекает по сопряженному ион-ради-
кальному механизму с участием генерируемых in situ активных форм кислорода, преимущественно
гидроксильных радикалов и сульфатных анион-радикалов.
Ключевые слова: тиоцианаты; персульфаты; симулированное солнечное излучение; окисление; ката-
лизатор; Фентон-подобные системы; обезвреживание
DOI: 10.31857/S0044461820020188
Тиоцианаты — неорганические соли тиоциановой
бохозяйственного назначения составляет 0.09 мг·л-1
кислоты, применяющиеся в производстве тиомоче-
(в пересчете на ион).** В связи с этим очистка тио-
вины, в процессах выделения и разделения редких
цианатсодержащих производственных сточных вод
металлов, являющиеся реагентами при крашении и
является актуальной задачей.
печатании тканей, использующиеся как инсектициды,
Для очистки сточных вод от тиоцианатов наиболее
фунгициды и стабилизаторы горения взрывчатых
часто используется обработка соединениями хлора
веществ. Источниками поступления тиоцианатов в
(гипохлоритом, хлорной известью, жидким хлором)
водные экосистемы являются недостаточно очищен-
в щелочной среде, но при этом образуются большие
ные воды указанных производств, а также горнопере-
объемы осадков, требующих специального размеще-
рабатывающих предприятий по добыче и переработке
ния, и возникает риск образования высокотоксичного
золота, использующих технологии цианирования
хлорциана при несоблюдении условий обработки, а
сульфидных руд [1]. Несмотря на то что тиоцианаты
также хлорорганических соединений при наличии в
не обладают высокой острой токсичностью (ЛД50
обрабатываемой воде сопутствующих органических
по белым мышам для KSCN 590 мг/кг*), при дли-
веществ [3]. Применение традиционных биологиче-
тельном воздействии они могут оказывать пагубное
ских методов возможно лишь при низких концентра-
влияние на кислородный обмен, ферментную и нерв-
циях тиоцианатов [4-6].
но-мышечную системы водных организмов [2]. На
Внимание исследователей сосредоточено на раз-
содержание тиоцианатов в объектах окружающей
работке комбинированных окислительных методов
среды установлены экологические ограничения. Так,
(Advance Oxidation Processes — AOP), основанных
предельно допустимая концентрация в водоемах ры-
** Нормативы предельно допустимых концентра-
ций вредных веществ в водах водных объектов рыбохо-
* Лазарев Н. В., Левина Э. Н. Вредные вещества в про-
зяйственного значения. Приказ Минсельхоза России от
мышленности. Т. 3. Л.: Химия, 1977. C. 275.
13.12.2016. № 552.
Фотокаталитическое окисление тиоцианатов в водных растворах
291
на деструкции загрязнителей генерированными in
Эксперименты проводили на лабораторной уста-
situ активными формами кислорода (АФК) — ги-
новке, детальное описание которой представлено в
дроксильными и супероксидными радикалами,
работе [13]. Объем обрабатываемого раствора состав-
сульфатными анион-радикалами и т. п. [7, 8]. В ка-
лял 400 мл, скорость потока 0.5 л·мин-1. Для имита-
честве прекурсоров АФК часто используются пере-
ции солнечного излучения использовали ксеноновую
кисные соединения, в том числе персульфаты. При
лампу HID 4300 KН (MaxLight, South Korea) —
термическом, ультразвуковом, фотохимическом воз-
источник оптического излучения с квазисолнечным
действии в результате гомолитического разрыва связи
спектром. Содержание тиоцианатов в растворе кон-
О-О происходит образование сульфатных анион-ра-
тролировали фотометрическим экспресс-методом с
дикалов, обладающих высокой реакционной способ-
азотнокислым железом [14]. Определение концен-
ностью (E0 = 2.6 B) [реакция (1)] [9]. Также известно,
трации железа проводили стандартным фотометри-
что они генерируются в присутствии металлов пере-
ческим методом с о-фенантролином. Эффективность
менной валентности (серебра, меди, цинка, кобаль-
окисления оценивали по изменению концентрации
та, марганца, железа) вследствие каталитического
тиоцианатов (степени конверсии) в обрабатываемом
диспропорционирования персульфата [реакция (2)]:
растворе по формуле
сτ
Э (%) = (1 -
)·100,
O3S-O-O-SO3 → 2SO4-•,
(1)
с0
S2O82- + Men+ → Me(n+1)+ + SO4-• + SO42-.
(2)
где с0 и сτ — исходная и в момент времени τ (мин)
концентрации соответственно.
Перспективными, на наш взгляд, являются комби-
Синергический индекс φ рассчитывали по фор-
нированные фотокаталитические системы с использо-
муле
k(УФ/S2O82-/Fe)
ванием экологически безопасных железосодержащих
φ =
,
k(УФ) + k(Fe/S2O82-)
катализаторов и ультрафиолетового излучения (УФ)
безртутных источников (эксиламп, светодиодных
где k — константа скорости реакции окисления тио-
ламп, естественного солнечного излучения). В ли-
цианатов (мин-1).
тературе имеются данные о высокой эффективности
Значение φ > 1 свидетельствует о возникнове-
использования подобных окислительных систем для
нии синергического эффекта, φ = 1 — аддитивного,
деструкции биорезистентных органических соеди-
φ < 1 — негативного.
нений [10-12], однако сведения по обезвреживанию
загрязнителей неорганической природы немного-
Обсуждение результатов
численны, хотя изучение данного вопроса имеет как
теоретическое, так и практическое значение.
Сравнительная оценка окислительных систем.
Целью данной работы являлось исследование ки-
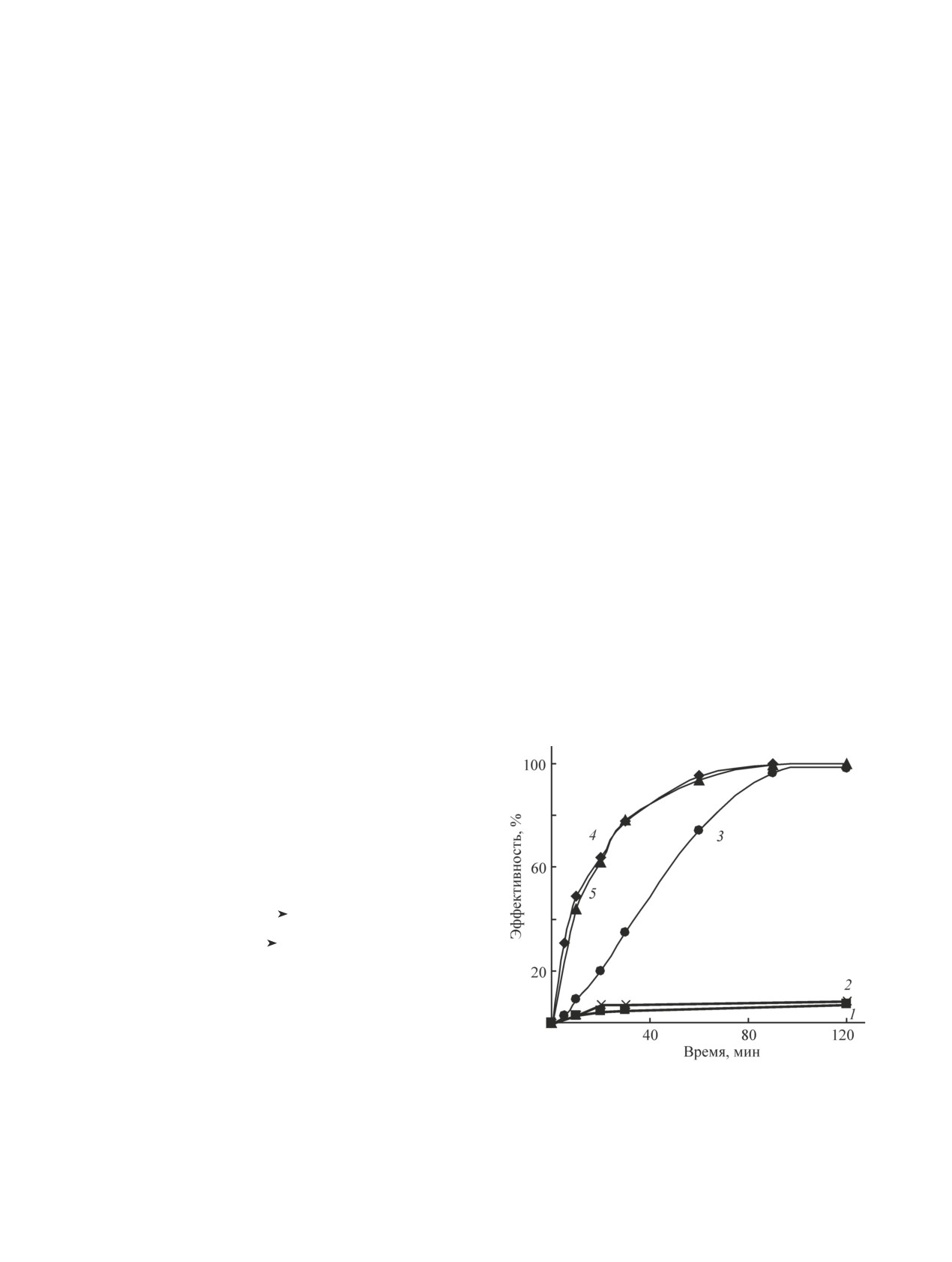
Тиоцианаты практически не взаимодействуют с пер-
нетических закономерностей фотокаталитического
сульфатом, устойчивы к излучению ксеноновой лам-
окисления тиоцианатов персульфатом под воздей-
пы и лишь незначительно (<8%) окисляются в систе-
ствием квазисолнечного ультрафиолетового излуче-
ме {УФ/S2O82-} (см. таблицу, рис. 1).
ния.
Процессы окисления тиоцианатов в системах
{S2O82-/Fe2+}, {S2O82-/Fe3+}, {S2O82-/Fe0} протека-
Экспериментальная часть
ли более эффективно вследствие участия вторичных
более сильных окислителей — сульфатных анион-ра-
Исследования проводили на растворах тиоциа-
дикалов, гидроксильных радикалов (см. таблицу).
натов концентрацией 100 мг·л-1 (1.72 ммоль·л-1),
Однако необходимо отметить, что полная конверсия
приготовленных на дистиллированной воде
тиоцианатов после 120 мин обработки достигалась
(рН 5.7 ± 0.2). В экспериментах использовали:
лишь в окислительной системе {S2O82-/Fe3+}. Из-за
железо металлическое Fe0 (PanReac Applichem,
схожести механизма данные окислительные системы
США, 0.5 мм), FeSO4·7H2O (≥99.5%, Scharlab S.L.,
называют Фентон-подобными [15]:
Испания), Fe2(SO4)3·9H2O и K2S2O8 (99%, АО
«Химреактивснаб», Россия).
Fe2++S2O82- → SO4-• + SO42- + Fe3+,
k = 17-49 моль-1·л·с-1;
(3)
Fe3+ + S2O82- → 2SO4-• + Fe2+,
k = 22.5-33.5 моль-1·л·с-1;
(4)
292
Батоева А. А. и др.
Fe2+ + SO4-•+ → SO42- + Fe3+,
k = 4.6·109 моль-1·л·с-1;
(5)
S2O82- + SO4-• → S2O8-• + SO42-,
k = 6.62·105 моль-1·л·с-1;
(6)
SO4-• + H2O → HO• + HSO4-,
k = 9.4·103 моль-1·л·с-1;
(7)
2SO4-• → S2O82-,
k = 8.1·108 моль-1·л·с-1;
(8)
S2O82- + HO• → HSO4- + SO4-• + 0.5O2,
k = 1.2·107 моль-1·л·с-1;
(9)
SO4-• + HO• → HSO4- + 0.5O2,
k = 1.1·1010 моль-1·л·с-1;
(10)
SO42- + HO• → SO4-• + ОН-,
k = 1.5·108 моль-1·л·с-1;
(11)
Fe2+ + HO• → Fe3+ + OH-,
k = (2.6-5.1)·108 моль-1·л·с-1.
(12)
При использовании Fe0 на первом этапе происхо-
вание активных форм кислорода [реакции (5), (12)],
дит его окисление до Fe2+:
что обусловливает высокую эффективность примене-
ния Fe0 (ZVI — zero-valent iron) для окисления био-
Fe0 - 2e- → Fe2+,
(13)
резистентных органических соединений в Фентон- и
Fe0 + S2O82- → Fe2+ + 2SO42-,
(14)
Фентон-подобных системах [16, 17]. При окислении
Fe0 + ½О2 + Н2О → Fe2+ + 2ОН-,
(15)
тиоцианатов в системе {S2O82-/Fe0} аналогичный
эффект не наблюдался (см. таблицу), так как процесс
Fe0 + 2Н2О → Fe2+ + 2ОН- + Н2,
(16)
образования сульфатных анион-радикалов протекает
Fe0 + 2Fe3+ → 3Fe2+.
(17)
через формирование промежуточных железосодержа-
щих комплексов [18]:
Медленное и непрерывное поступление ионов
Fe2+ в раствор позволяет снизить нецелевое расходо-
[Fe(SCN)n(H2O)6-n](3-n) + S2O82- → [Fe(SCN)n(H2O)6-n](2-n) + 2SO4-•,
(18)
[Fe(SCN)n(H2O)6-n](2-n) + S2O82- → [Fe(SCN)n(H2O)6-n](3-n) + SO4-• + SO42-.
(19)
В комбинированных системах {УФ/S2O82-/Fe2+},
деструкции тиоцианатов являются окислительные
{УФ/S2O82-/Fe3+}, {УФ/S2O82-/Fe0} наблюдалось зна-
системы {УФ/S2O82-/Fe3+} и {УФ/S2O82-/Fe2+}. При
чительное увеличение скорости реакций окисления
этом с практической точки зрения использование со-
тиоцианатов по сравнению с «темновыми» услови-
ями (см. таблицу). При этом во всех окислительных
системах достигается полная конверсия тиоцианатов
(рис. 1).
УФ-излучение обеспечивает дополнительное ге-
нерирование активных форм кислорода в результате
фотоиндуцированного распада персульфата и фото-
восстановления гидроксокомплексов железа:
S2O82- hν
2SO4-•,
(20)
hν
FeOH2+
Fe2+ + •OH.
(21)
Значения синергических индексов (φ > 1) (см.
таблицу), рассчитанных по соотношениям констант
скоростей реакции окисления тиоцианатов в комби-
нированных и индивидуальных системах, свидетель-
ствуют о возникновении синергических эффектов,
Рис.1. Деструкция тиоцианатов в разных окислительных
обусловленных реализацией сопряженного ион-ра-
системах.
дикального механизма с участием генерируемых in
[S2O82-] = 8.6 ммоль·л-1, [Fe2+] = [Fe3+] = 0.86 ммоль·л-1,
situ активных форм кислорода.
Fe0 = 200 мг·л-1, рН 5.8, 25°С.
Полученные результаты позволили сделать вы-
1 — УФ-фотолиз, 2 -- {УФ/S2O82-}, 3 — {УФ/S2O82-/Fe0},
вод, что наиболее эффективными для окислительной
4 — {УФ/S2O82-/Fe2+}, 5 — {УФ/S2O82-/Fe3+}.
Фотокаталитическое окисление тиоцианатов в водных растворах
293
Кинетические характеристики процессов окисления тиоцианатов в различных системах
[S2O82-] = 8.6 ммоль·л-1, [Fe2+] = [Fe3+] = 0.86 ммоль·л-1, Fe0 = 200 мг·л-1, рН 5.8, 25°C
Начальная
Коэффициент
Константа скорости
Время полу-
Окислительная
скорость реакции
аппроксимации
Эффективность,*
Синергический
реакции окисления,
превращения,
система
окисления,
линейной
%
индекс
×10-2 мин-1
мин
мкмоль·л-1·мин-1
зависимости
УФ-фотолиз
5.1
0.13
0.81
—
6
{УФ/S2O82-}
5.7
0.29
0.89
—
7
{S2O82-/Fe3+}
47.9
3.0
0.98
29.5
80
{S2O82-/Fe2+}
49.5
3.10
0.78
24.5
69
{S2O82-/Fe0}
14.3
1.8
0.93
59.0
51
{УФ/S2O82-/Fe3+}
71.3
5.6
0.97
12.5
94
1.8
{УФ/S2O82-/Fe2+}
74.9
5.1
0.97
10.6
95
1.6
{УФ/S2O82-/Fe0}
16.3
3.2
0.93
41.0
74
1.7
* Время обработки 60 мин.
единений Fe3+ является предпочтительным, так как
окислителя до 3.44 ммоль·л-1 приводит к снижению
его растворы и соли более устойчивы при хранении
константы скорости реакции окисления тиоцианатов
и обладают меньшей коррозионной активностью [19].
в 1.9 раза (с 4.97·10-2 до 2.86·10-2 мин-1) и увеличе-
Влияние концентрации Fe3+ и S2O82- на кинетику
нию времени их полупревращения с 13.9 до 24.2 мин.
окисления тиоцианатов. Экспериментально уста-
Изменение концентрации Fe3+ в интервале 0.25-
новлено, что увеличение концентрации персульфа-
0.5 ммоль·л-1 не оказывает существенного влия-
та с 5.16 до 8.6 ммоль·л-1 практически не оказыва-
ния на скорость окисления тиоцианатов в системе
ет влияния на скорость и эффективность процесса
{УФ/S2O82-/Fe3+} (рис. 3). Увеличение концентрации
окисления тиоцианатов в комбинированной системе
Fe3+ до 0.86 ммоль·л-1 приводит к росту константы
{УФ/S2O82-/Fe3+} (рис. 2). Уменьшение концентрации
скорости реакции окисления тиоцианатов в 2.7 раза
Рис. 2. Кинетика окисления тиоцианатов в комбинированной системе {УФ/S2O82-/Fe3+} при различных мольных
соотношениях [S2O82-]/[SCN-].
[Fe3+] = 0.86 ммоль·л-1, рН 5.8, 25°С.
294
Батоева А. А. и др.
Рис. 3. Кинетика окисления тиоцианатов в комбинированной системе {УФ/S2O82-/Fe3+} при различных мольных
соотношениях [Fe3+]/[SCN-].
[S2O82-] = 5.16 ммоль·л-1, рН 5.8, 25°С.
(с 1.87 до 4.97·10-2 мин-1) и снижению времени их
анатов и сокращение времени, необходимого для их
полупревращения с 37.1 до 13.9 мин. Дальнейшее
полной деструкции, с 90 до 10 мин (рис. 5). Энергия
увеличение концентрации железа не оказывает столь
активации реакции окисления тиоцианатов в ком-
существенного влияния на кинетику протекающего
бинированной системе {УФ/S2O82-/Fe3+}, рассчи-
процесса.
танная по константам скорости реакции, составила
Таким образом, экспериментально установлено,
86 кДж·моль-1.
что оптимальными являются следующие соотноше-
Дополнительно проведены эксперименты без тер-
ния реагирующих веществ — [S2O82-]:[SCN]:[Fe3+] =
мостатирования. В этих условиях температура об-
= 3:1:(0.5-0.6).
рабатываемого раствора поднималась со скоростью
Влияние рН. Одним из важных преимуществ пер-
сульфата перед пероксидом водорода является его
меньшая чувствительность к изменению реакции
среды. Экспериментально установлено, что данный
параметр практически не оказывает влияния на ки-
нетику окисления тиоцианатов в комбинированной
системе {УФ/S2O82-/Fe3+} в рассмотренном диапазо-
не рН (5.8-10.0) (рис. 4). При этом нужно отметить,
что при добавлении реагентов в раствор происходит
резкое снижение рН, раствор приобретает крова-
во-красный цвет, характерный для тиоцианатных
комплексов железа.
Влияние температуры. При воздействии есте-
ственного солнечного излучения обрабатываемые
растворы, как правило, нагреваются до 40-45°С
(в летний период), поэтому важно изучить влияние
Рис. 4. Кинетика окисления тиоцианатов в комбини-
температуры на кинетику окисления тиоцианатов.
рованной системе {УФ/S2O82-/Fe3+} при различных рН.
При повышении температуры до 40°С наблюдается
[S2O82-]=5.16 ммоль·л-1, [Fe3+] = 0.86 ммоль·л-1, 25°С.
существенное ускорение процесса окисления тиоци-
рН: 1 — 10, 2 — 5.8, 3 — 7.0.
Фотокаталитическое окисление тиоцианатов в водных растворах
295
Рис. 5. Кинетика окисления тиоцианатов в комбинированной системе {УФ/S2O82-/Fe3+} при разных температурах.
[S2O82-] = 5.16 ммоль·л-1, [Fe3+] = 0.86 ммоль·л-1, рН 5.8.
T (°С): 1 — 25, 2 — 30, 3 — 40.
0.5 град·мин-1 от теплового излучения ксеноновой
концентрацию спиртов в растворе брали с большим
лампы (рис. 6). Кинетическая кривая окисления ти-
избытком по отношению как к окислителю, так и к
оцианатов в системе {УФ/S2O82-/Fe3+} практически
тиоцианатам.
совпадает с полученной при 30°С (в условиях термо-
Экспериментально установлено, что при добавле-
статирования), и в течение 30 мин происходит полная
нии метанола эффективность окисления тиоцианатов
конверсия тиоционатов (рис. 5).
снизилась на 31% при 90 мин экспозиции, а трет-бу-
Выявление роли активных форм кислорода.
танола — на 12% (рис. 7). Полученные результаты
Константы скорости реакций взаимодействия тио-
свидетельствуют о том, что окисление тиоцианатов
цианатов с сульфатными анион-радикалами и с ги-
в комбинированной системе {УФ/S2O82-/Fe3+} про-
дроксильными радикалами близки и составляют
текает по сложному ион-радикальному механизму с
5.2·109 моль-1·л·c-1 и 1.1·1010 моль-1·л·c-1 соответ-
участием как гидроксильных радикалов, так и суль-
ственно [20, 21]. Для выявления роли активных форм
фатных анион-радикалов.
кислорода при окислении тиоцианатов в комбини-
рованной системе {УФ/S2O82-/Fe3+} проведены экс-
перименты с добавлением «ловушек» радикалов —
ингибиторов радикальных реакций — метилового и
трет-бутилового спиртов. Константа взаимодействия
метанола с гидроксильными радикалами составляет
(1.2-2.8)·108 моль-1·л·c-1, с сульфатными анион-ради-
калами — (1.6-7.7)·107 моль-1·л·c-1 [22]. Константа
взаимодействия трет-бутанола с гидроксильными
составляет (3.8-7.6)·108 моль-1·л·c-1, с сульфатны-
ми анион-радикалами — (4.0-9.1)·105 моль-1·л·c-1
[22]. Таким образом, метанол будет одновременно
реагировать как с гидроксильными радикалами, так
и с сульфатными анион-радикалами, в то время как
трет-бутанол в первую очередь — с гидроксильны-
ми радикалами. Так как константы скоростей реакций
Рис. 6. Кинетика окисления тиоцианатов в системе
взаимодействия метанола и трет-бутанола с рассма-
{УФ/S2O82-/Fe3+} без термостатирования.
триваемыми радикалами ниже, чем у тиоцианатов,
[S2O82-] = 5.16 ммоль·л-1, [Fe3+] = 0.86 ммоль·л-1, рН 5.8.
296
Батоева А. А. и др.
Сибирского отделения Российской академии наук
(проект № 0339-2019-0005).
Конфликт интересов
Авторы заявляют об отсутствии конфликта инте-
ресов, требующего раскрытия в данной статье.
Информация об авторах
Батоева Агния Александровна, д.т.н., доц., ORCID:
Сизых Марина Романовна, к.т.н., доц., ORCID:
Мункоева Варвара Анатольевна, инж., ORCID:
Список литературы
Рис. 7. Эффективность окисления тиоцианатов в
системе {УФ/S2O82-/Fe3+} в присутствии ингибиторов
[1] Douglas Gould W., King M., Mohapatra B. R.,
радикальных реакций.
Cameron R. A., Kapoor A., Koren D. W. A critical
[S2O82-] = 5.16 ммоль·л-1, [Fe3+] = 0.86 ммоль·л-1, [СН₃OH] =
review on destruction of thiocyanate in mining effluents
= [C4H10O] = 400 ммоль·л-1, рН 5.8, 25°С.
// Minerals Eng. 2012. V. 34. P. 38-47.
[2] Bhunia F., Saha N. C., Kaviraj A. Toxicity of thiocyanate
to fish, plankton, worm, and aquatic ecosystem // Bull.
Выводы
Environ. Contam. Toxicol. 2000. V. 64. P. 197-204.
Дополнительное облучение квазисолнечным све-
том ведет к существенной интенсификации процес-
[3] Dash R. R., Gaur A., Balomajumder Ch. Cyanide in
сов окисления тиоцианатов в железо-персульфатных
industrial wastewaters and its removal: A review on
biotreatment // J. Hazard. Mater. 2009. V. 163. P. 1-11.
системах и возникновению синергических эффектов.
Степень конверсии и скорость окисления тиоциана-
[4] Ryu B.-G., Kim J., Yoo G., Lim J.-T., Kim W., Han J.-I.,
тов в рассмотренных окислительных системах из-
Yang J.-W. Microalgae-mediated simultaneous treatment
меняется в ряду {УФ/S2O82-/Fe3+} ≈ {УФ/S2O82-/
of toxic thiocyanate and production of biodiesel //
Fe2+} > {S2O82-/Fe3+} > {S2O82-/Fe2+} >{УФ /S2O82-/
Bioresour. Technol. 2014. V. 158. P. 166-173. https://
Fe0} > {S2O82-/Fe0} >> {УФ/S2O82-}. Установлены
doi.org/10.1016/j.biortech.2014.01.128
оптимальные условия для полного окисления тиоциа-
[5] Huang Y., Hou X., Liu S., Ni J. Correspondence
натов в комбинированной системе {УФ/S2O82-/Fe3+}:
analysis of bio-refractory compounds degradation and
рН 5.8-10.0, соотношение реагирующих веществ
microbiological community distribution in anaerobic
[S2O82-]:[SCN]:[Fe3+] = 3:1:(0.5-0.6). При этом реа-
filter for coking wastewater treatment // Chem. Eng. J.
лизуется сопряженный ион-радикальный механизм
2016. V. 304. P. 864-872.
с участием генерируемых in situ активных форм кис-
лорода, преимущественно гидроксильных радикалов
[6] Oulego P., Collado S., Laca A., Díaz M. Iron (II) as
catalyst for thiocyanate wet oxidation: Mechanism and
и сульфатных анион-радикалов.
modelization // Chem. Eng. J. 2017. V. 316. P. 813-822.
Финансирование работы
[7] Miklos D. B., Remy C., Jekel M., Linden K. G.,
Drewes J. E., Hübner U. Evaluation of advanced
Исследования выполнены при финансовой под-
oxidation processes for water and wastewater
держке Российского фонда фундаментальных ис-
treatment — A critical review // Water Res. 2018.
следований и Правительства Республики Бурятия
V. 139. P. 118-131.
(проект РФФИ-РБ № 18-48-030005) и Федерального
государственного бюджетного учреждения на-
[8] Sharma A., Ahmad J., Flora S. J. S. Application of
уки Байкальского института природопользования
advanced oxidation processes and toxicity assessment of
Фотокаталитическое окисление тиоцианатов в водных растворах
297
transformation products // Environ. Res. 2018. V. 167.
[15] Kusic H., Peternel I., Ukic S., Koprivanac N.,
P. 223-233. doi.org/10.1016/j.envres.2018.07.010
Bolanca T., Papic S., Bozic A. L. Modeling of iron
[9] Matzek L. W., Carter K. E. Activated persulfate
activated persulfate oxidation treating reactive azo
for organic chemical degradation: A review //
dye in water matrix // Chem. Eng. J. 2011. V. 172.
Chemosphere. 2016. V. 151. P. 178-188.
[16] Song Y., Fang G., Zhu Ch., Zhu F., Wu S., Chen N.,
[10]
Garkusheva N., Matafonova G., Tsenter I., Beck S.,
Wu T., Wang Y., Gao J., Zhou D. Zero-valent iron
Batoev V., Linden K. Simultaneous atrazine
activated persulfate remediation of polycyclic aromatic
degradation and E. coli inactivation by simulated
hydrocarbon-contaminated soils: An in situ pilot-scale
solar photo-Fenton-like process using persulfate // J.
study // Chem. Eng. J. 2019. V. 355. P. 65-75. https://
Environ. Sci. Health. Part A. 2017/ V. 52. P. 849-855.
doi.org/10.1016/j.cej.2018.08.126
[17] Santos-Juanes L., García Einschlag F. S., Amat A. M.,
[11]
Khandarkhaeva M. S., Batoeva A. A., Aseev D. G.,
Arques A. Combining ZVI reduction with photo-
Sizykh M. R., Tsydenova O. V. Oxidation of atrazine in
Fenton process for the removal of persistent pollutants
aqueous media by solar- enhanced Fenton-like process
// Chem. Eng. J. 2017. V. 310. N 2. P. 484-490. https://
involving persulfate and ferrous ion. // Ecotoxicol.
doi.org/10.1016/j.cej.2016.04.114
Environ. Saf. 2017. V. 137. P. 35-41.
[18] Budaev S. L., Batoeva A. A., Tsybikova B. A. Effect
of Fenton-like reactions on the degradation of
[12]
Xie P., Zhang L., Chen J., Ding J., Wan Y., Wang S.,
thiocyanate in water treatment // J. Environ. Chem.
Wang Z., Zhou A., Ma J. Enhanced degradation of
Eng. 2014. V. 2. Р. 1907-1911.
organic contaminants by zero-valent iron/sulfite
process under simulated sunlight irradiation // Water
[19] Запольский А. К., Баран А. А. Коагулянты и фло-
Res. 2019. V. 149. P. 169-178.
кулянты в процессах очистки воды: Свойства.
Получение. Применение. Л.: Химия, 1987. C.108.
[13]
Хандархаева М. С., Батоева А. А., Асеев Д. Г.,
[20] Neta P., Huie R. E., Ross A. B. Rate constants for
Сизых М. Р. Фотоактивация процесса окисления
reactions of inorganic radicals in aqueous solution //
п-хлорфенола в водных растворах // ЖПХ. 2015.
J. Phys. Chem. Ref. Data. 1988. V.17. N 3. P. 1027-
Т. 88. № 5. С. 1420-1426.
[21] Buxton G. V., Greenstock C. L., Helman W. P.,
[Khandarkhaeva M. S., Batoeva A. A., Aseev D. G.,
Ross A. B. Critical review of rate constants for
Sizykh M. R. Photoactivation of the oxidation process
reactions of hydrated electrons, hydrogen atoms and
of para-chlorophenol in aqueous solutions // Russ. J.
hydroxyl radicals (•OH/•O-) in aqueous solution //
Appl. Chem. 2015. V. 88. P. 1605-1611.
J. Phys. Chem. Ref. Data. 1988. V. 513. P. 513-886.
[14]
Lahti M., Vilpo J., Hovinen J. Spectrophotometric
[22] Liang H. Y., Zhang Y.-G., Huang S.-B., Hussain I.
determination of thiocyanate in human Saliva // J.
Oxidative degradation of p-chloroaniline by copper
Chem. Educ. 1999 V. 76. N 9. P. 1281-1282. https://
oxidate activated persulfate // Chem. Eng. J. 2013.
doi.org/10.1021/ed076p1281
V. 218. P. 384-391.