Получение сульфата калия путем конверсии фосфогипса и хлорида калия в аммиачном растворе
341
Журнал прикладной химии. 2020. Т. 93. Вып. 3
УДК 631.733.2
ПОЛУЧЕНИЕ СУЛЬФАТА КАЛИЯ ПУТЕМ КОНВЕРСИИ ФОСФОГИПСА
И ХЛОРИДА КАЛИЯ В АММИАЧНОМ РАСТВОРЕ
© И. И. Гончарик, З. А. Готто*, А. Л. Навныко, Н. В. Колбун
Институт общей и неорганической химии НАН Беларуси,
220072, Республика Беларусь, г. Минск, ул. Сурганова, д. 9/1
* E-mail: zima.gotto@bk.ru
Поступила в Редакцию 16 июля 2019 г.
После доработки 19 ноября 2019 г.
Принята к публикации 14 декабря 2019 г.
Исследована возможность получения сульфата калия путем конверсии сульфата кальция (фосфо-
гипса) и хлорида калия в аммиачном растворе. Определены оптимальные условия проведения данного
процесса при различных концентрациях раствора аммиака. При использовании 25%-ного раствора
NH3 время перемешивания составляет 30-60 мин, норма расхода KСl — 160% от стехиометрии. При
использовании 40%-ного раствора аммиака время перемешивания практически не влияет на конвер-
сию, а норма расхода KCl составляет только 120% от стехиометрии. Температура конверсии в обоих
случаях должна составлять 15-20°С, массовое соотношение гипса и аммиака — 1:(3-5).
Ключевые слова: конверсия; фосфогипс; хлорид калия; аммиачный раствор
DOI: 10.31857/S0044461820030056
Основным калийным удобрением в сельском хо-
и KCl с получением сульфата калия или сингенита
зяйстве является хлористый калий. Однако внесение
(K2SO4·CaSO4·H2O).
хлорсодержащего удобрения под хлорофобные куль-
В основе процесса конверсии хлорида калия и
туры (такие как картофель, свекла, цитрусовые и т. д.)
сульфата кальция лежит растворимость солей в си-
ограничено, а иногда и недопустимо. В настоящее
стеме K+, Ca2+||Cl-, SO42--H2O. Литературные данные
время выпуск бесхлорных удобрений ограничен —
физико-химического исследования этой системы при
только 10% от всего выпуска калийных удобрений.
различных температурах показывают, что основную
Наибольшим спросом для хлорофобных культур
часть диаграммы, отражающую взаимную раство-
пользуется сульфат калия. Одним из перспективных
римость солей данной системы, занимает поле кри-
путей его получения является конверсия хлорида
сталлизации гипса, тогда как поле кристаллизации
калия сульфатами натрия, магния, железа, кальция
сульфата калия ничтожно мало. Следовательно, пря-
[1]. Из указанных солей наибольший интерес пред-
мая конверсия между гипсом и хлористым калием в
ставляет сульфат кальция, который является широко
водной среде с получением сульфата калия практи-
распространенным минералом в земной коре, а также
чески невозможна.
отходом при производстве фосфорных удобрений в
Однако в растворе с добавками некоторых орга-
виде фосфогипса [2].
нических жидкостей (ацетон, изопропиловый спирт
Известны способы переработки фосфогип-
и др.), а также и азотсодержащих веществ (моче-
са на бесхлорные калийные удобрения путем
вина, моно-, ди-, триэтаноламин) [4] наблюдается
конверсии его с карбонатом калия [3] или хлори-
существенное изменение растворимости сульфатов,
дом калия как прямой конверсией [4], так и через
заключающееся в уменьшении растворимости K2SO4
сульфат аммония [5]. Наибольший практический ин-
и увеличении CaSO4. Тогда взаимодействие CaSO4 и
терес представляет прямая конверсия фосфогипса
KCl возможно по реакциям
CaSO4 + 2KCl + H2O → K2SO4·CaSO4·H2O + CaCl2,
(1)
CaSO4 + 2KCl → K2SO4 + CaCl2.
(2)
342
Гончарик И. И. и др.
С целью интенсификации данного процесса пред-
трации получали насыщением 25%-ного раствора
ложено также проводить конверсию этих солей в
аммиака газообразным аммиаком.
водно-аммиачном растворе [6, 7]. Однако четкие ре-
Конверсию фосфогипса с хлоридом калия в ам-
комендации по условиям процесса взаимодействия
миачном растворе проводили следующим образом.
фосфогипса и KCl с целью получения сульфата калия
В колбу, снабженную гидрозатвором, что необходимо
отсутствуют. Так, в работе [6] показана возможность
во избежание потерь аммиака, вводили фосфогипс,
получения K2SO4, а в [7] — только сингенита.
KCl и добавляли аммиачный раствор. Затем суспен-
Для понимания механизма процесса, происходя-
зию после интенсивного перемешивания на магнит-
щего при проведении конверсии фосфогипса и KCl
ной мешалке фильтровали и после сушки твердой
в аммиачном растворе, нами рассмотрена диаграмма
фазы исследовали составы твердой и жидкой фаз на
растворимости солей в системе K+, Ca2+||Cl-, SO42--
ионы K+, Ca2+, Cl-, SO42- по известным методикам,
NH3-H2O, тем более что она изучена в широком ин-
а также содержание аммиака в жидкой фазе. Ион
тервале как температур, так и концентраций амми-
SO42- определяли комплексонометрическим и грави-
ака в системе. Показано, что поле кристаллизации
метрическим методами, K+ — пламенно-фотометри-
сульфата калия значительно больше, чем в водной
ческим, Ca2+ — комплексонометрическим титровани-
системе без аммиака [7]. Эти данные свидетельству-
ем трилоном Б, Cl- — методом прямого титрования
ют о перспективности получения сульфата калия кон-
раствором AgNO3 в присутствии K2CrO4 в твердой
версией гипса с хлоридом калия в водно-аммиачных
фазе, а пробы жидкой фазы предварительно доводили
растворах.
азотной кислотой до нейтральной среды. Содержание
Реакция обменного взаимодействия гипса с хло-
аммиака в фильтрате определяли по ГОСТ 3760-79
ридом калия обратима, поэтому степень превращения
«Реактивы. Аммиак водный. Технические условия».
исходных соединений в сульфат калия зависит от
В таблицах представлены составы твердых фаз без
температуры, времени перемешивания, концентрации
учета солей, внесенных жидкой фазой.
водно-аммиачного раствора, нормы расхода KCl от
стехиометрии.
Обсуждение результатов
Целью данной работы явилось изучение конвер-
сии фосфогипса, полученного в виде отхода при про-
Для определения оптимальных условий проведе-
изводстве фосфорной кислоты, хлоридом калия по
ния данного процесса изучено влияние нормы рас-
реакции (2) в присутствии 25 и 40%-ных растворов
хода KCl, времени перемешивания, температуры,
аммиачной воды.
количества аммиака на процесс получение K2SO4
путем конверсии KCl и CaSO4 в 25%-ном аммиачном
растворе.
Экспериментальная часть
В результате исследований установлено (табл. 1,
Для исследований использовали фосфогипс сле-
рис. 1), что увеличение нормы расхода KCl от стехио-
дующего состава (в пересчете на сухое вещество,
метрии оказывает положительное действие на данный
мас%): CaO — 32.13, SO4 — 55.04, P2O5 — 0.6, F —
процесс, которое выражается повышенным содержа-
0.5, SiO2 — 0.2, предварительно высушенный на воз-
нием K2SO4 в конечном продукте. Так, при стехиоме-
духе до влажности около 21%. Квалификация KCl —
трическом соотношении CaSO4 и KCl минералогиче-
х.ч. по ГОСТ 4234-77, 25%-ного аммиака — ч.д.а. по
ский состав твердой фазы содержит 73.41% сингенита
ГОСТ 3760-79, изм. 1, 2. Аммиак 40%-ной концен-
и 24.98% K2SO4. При увеличении расхода KCl до
Таблица 1
Влияние нормы расхода KCl от стехиометрии на качественно-количественные показатели конверсии KCl
и фосфогипса (время перемешивания 40 мин, массовое соотношение гипса и аммиака 1:4)
Норма расхода KCl
Солевой состав твердой фазы, мас%
Минералогический состав твердой фазы, мас%
от стехиометрии, мас%
KCl
CaSO4
K2SO4
KCl
cингенит
CaSO4
K2SO4
100
0
30.13
63.93
0
73.41
—
24.98
140
2.79
10.52
87.28
2.79
24.12
—
74.48
160
1.07
5.42
93.10
1.07
—
5.42
93.10
176
0.60
4.87
93.22
0.60
—
4.87
93.22
Получение сульфата калия путем конверсии фосфогипса и хлорида калия в аммиачном растворе
343
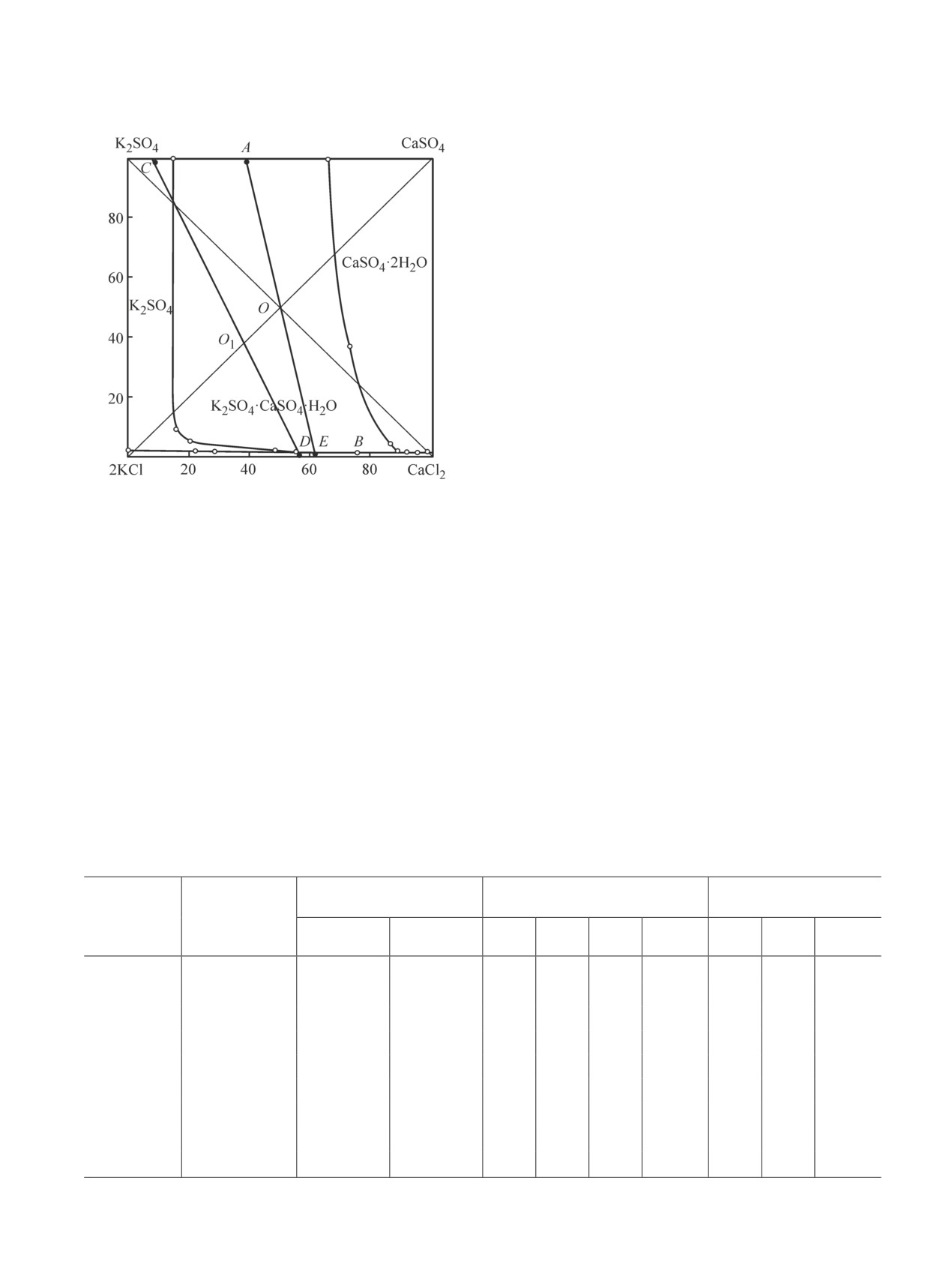
твердой и жидкой фаз, полученных при конверсии
солей, построили лучи кристаллизации, используя
расходы KCl, равные стехиометрической норме (луч
AE) и 160% от стехиометрической нормы (луч CD).
Следует отметить, что луч АE проходит через точку
O, подтверждающий стехиометрическую норму ком-
понентов, а луч CD — через точку O1, подтверждаю-
щий 160%-ный избыток KCl от стехиометрии. В пер-
вом случае состав твердой фазы находится в области
кристаллизации сингенита, во втором — в области
кристаллизации сульфата калия, что соответствует
полученным экспериментальным данным.
Влияние времени перемешивания на содержание
K2SO4 в готовом продукте при всех нормах расхода
KCl в 25%-ном растворе аммиака носит экстремаль-
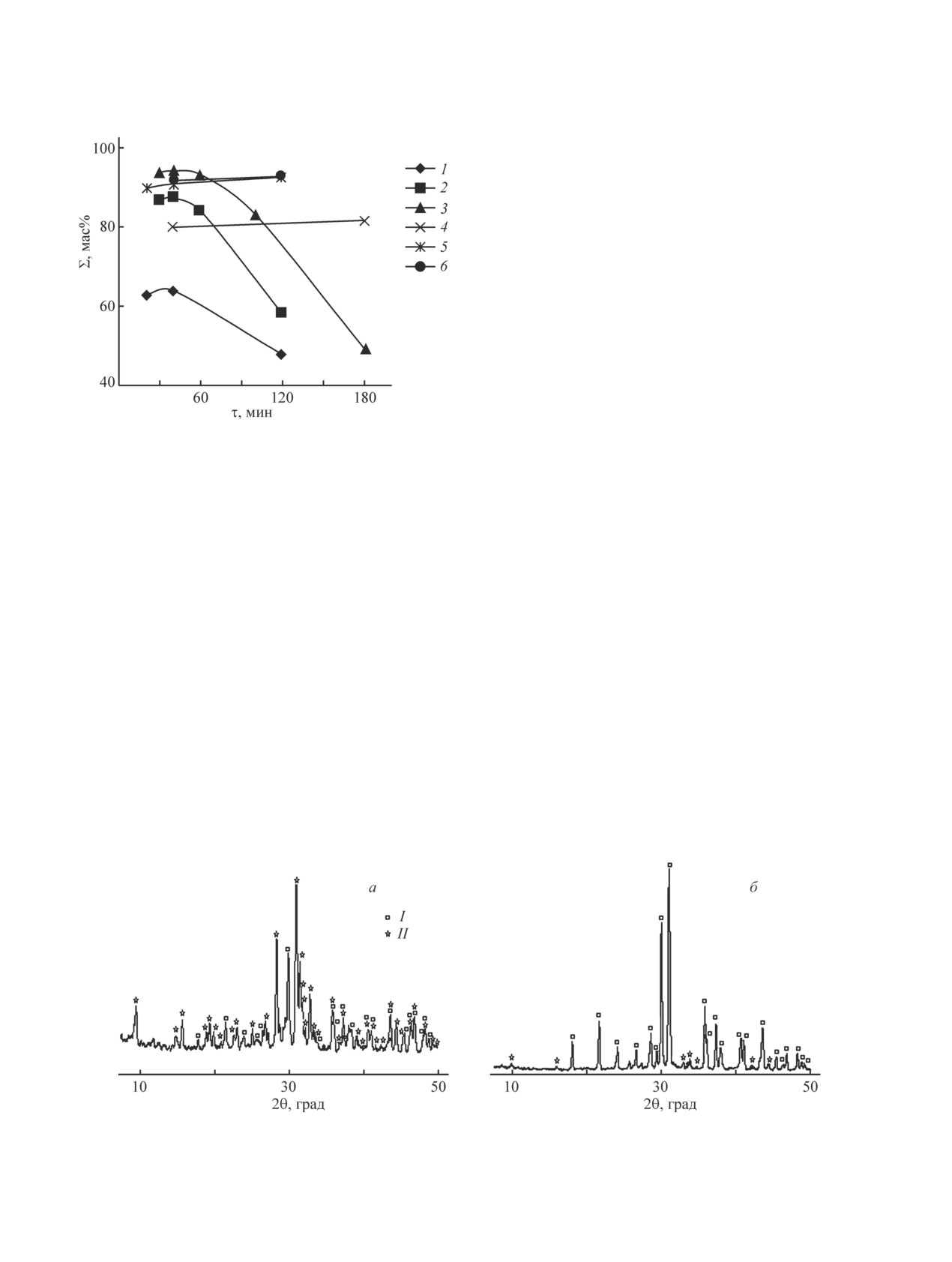
Рис. 1. Влияние времени перемешивания на содержа-
ный характер с максимумом при времени переме-
ние сульфата калия в готовом продукте при различных
шивания 30-60 мин (рис. 1, кривые 1-3). Появление
нормах расхода KCl от стехиометрии и концентрации
максимума на рисунке объясняется тем, что данная
аммиака.
реакция является обратимой, поэтому после опре-
В 25%-ном растворе аммиака: 1 — стехиометрическая
деленного времени перемешивания данный процесс
норма KCl, 2 — 140% KCl от стехиометрии, 3 — 160%
проходит в обратном направлении, в результате чего
KCl от стехиометрии.
В 40%-ном растворе аммиака: 4 — стехиометрическая
в твердой фазе содержание сульфата калия умень-
норма KCl, 5 — 120% KCl от стехиометрии, 6 — 160%
шается, а содержание сингенита растет. Поэтому все
KCl от стехиометрии.
последующие опыты проводили при норме расхода
KCl 160% от стехиометрии и времени перемешива-
140% от стехиометрии в твердой фазе повышается
ния 40 мин.
содержание K2SO4 до 74.48%, а сингенита умень-
Важным показателем при проведении конверсии
шается до 24.12%. При норме расхода KCl, равной
между KCl и фосфогипсом является температура.
160% от стехиометрии, твердая фаза содержит около
Как известно, повышение температуры при прочих
93.10% K2SO4 и небольшое количество CaSO4 (около
равных условиях ускоряет химический процесс, по-
5.42%), что доказано как химическим, так и рент-
нижает вязкость среды, что должно приводить к уско-
генофазовым методами исследований (рис. 2 а, б).
рению столкновений молекул реагирующих веществ.
На диаграмме K+, Ca2+||Cl-, SO42--NH3-H2O
Однако проведение конверсии CaSO4 и KCl при
(рис. 3) в 25%-ном аммиачном растворе по составам
высоких температурах нежелательно по нескольким
Рис. 2. Рентгенограммы полученных твердых фаз.
I — K2SO4 (арканит), II — K2SO4·CaSO4·H2O (сингенит).
а — стехиометрическая норма KCl, б — 160% KCl от стехиометрии.
344
Гончарик И. И. и др.
в-третьих, повышение температуры способствует
понижению растворимости аммиака в воде. Так, ес-
ли при 0°C максимальное содержание NH3 в воде
составляет 46.7%, то при 50°C падает до 18.6% при
парциальном давлении 760 мм рт. ст.
На основании вышеописанного изучена конверсия
солей CaSO4 и KCl в 25%-ном аммиачном раство-
ре при температурах от 0 до 30°C. Исследования
проводили при норме расхода KCl от стехиометрии
160% и времени перемешивания 40 мин. Как и сле-
довало ожидать, повышение температуры привело
к уменьшению содержания K2SO4 в твердой фазе
(табл. 2). Так, если при 0°C концентрация K2SO4
в твердой фазе достигает 93-94%, то уже при 20 и
30°C этот показатель падает до 89.14 и 66.49% соот-
ветственно. На основании химического и рентгено-
фазового анализа в последнем случае (30°C) четко
фиксируется в твердой фазе наряду с K2SO4 также и
Рис. 3. Изотерма растворимости солей.
сингенит. Резкое ухудшение качества готового про-
O при 25°C
Cистема K+, Ca2+||Cl-, SO42--NH3-H2
дукта при этой температуре является следствием
в 25%-ном NH3.
обратимости данной реакции, что и привело к пере-
ходу K2SO4 в сингенит. В случае перемешивания в
причинам: во-первых, как было показано ранее [4],
течение 20 мин при этой температуре образование
повышение температуры отрицательно сказывается
сингенита не обнаружено. Содержание K2SO4 соста-
на реакции обмена между CaSO4 и KCl в связи с
вило 90.33%, т. е. обратная реакция не наблюдалась.
понижением растворимости ангидрита, во-вторых,
При анализе полученных результатов установлено,
растворение KCl в воде и взаимодействие CaSO4 с
что при 0°C содержание K2SO4 достигло наибольше-
KCl — эндотермические процессы, которые сопрово-
го значения 93-94%. Однако прирост этого показате-
ждаются поглощением тепла из окружающей среды,
ля вряд ли оправдает энергоэкономические затраты
в результате чего происходит охлаждение системы до
при проведении конверсии при 0°C по сравнению с
14°С, что может также влиять на ход данной реакции;
осуществлением процесса при более высоких темпе-
Таблица 2
Влияние температуры на качественно-количественные показатели, полученные при конверсии KСl и CaSO4
в 25%-ном аммиачном растворе (массовое соотношение фосфогипса и аммиака 1:4,
норма расхода KCl от стехиометрии 160%)
Содержание NH3
Ионный состав твердой фазы,
Солевой состав твердой
Время
Температура,
в растворе, мас%
мас%
фазы, мас%
перемешивания,
°С
мин
до
после
K+
Ca2+
Cl-
SO42-
KCl
CaSO4
K2SO4
фильтрации
фильтрации
0
40
24.70
21.02
41.77
1.57
0.34
54.62
0.72
5.35
92.23
0
40
24.45
20.66
43.41
1.50
0.34
56.45
0.72
5.08
95.91
15
40
23.19
20.69
42.23
1.49
0.31
55.02
0.66
5.07
93.33
15
20
24.80
21.69
41.19
1.86
0.43
54.48
0.89
6.32
90.73
20
40
24.33
20.75
40.42
1.61
0.38
53.00
0.79
5.46
89.14
20
20
—
—
41.15
2.37
0.42
55.64
0.89
8.03
90.64
25
40
24.03
20.98
39.58
2.65
0
54.94
—
8.98
88.14
30
40
22.60
13.58
31.71
6.76
1.70
52.85
3.56
22.95
66.49
30
20
23.97
18.78
41.04
2.71
0.45
56.34
0.95
9.25
90.33
Получение сульфата калия путем конверсии фосфогипса и хлорида калия в аммиачном растворе
345
ратурах — 15-20°C. Также проведение конверсии при
вождается понижением концентрации солей в жид-
низкой температуре требует сложного нестандартного
кой фазе, что в итоге отрицательно скажется на эф-
оборудования. Таким образом, оптимальной темпера-
фективности данного процесса, так как необходимо
турой для проведения данного процесса необходимо
будет в дальнейшем упаривать большое количество
считать 15-20°C, при которой концентрация K2SO4 в
воды. Так, при массовом соотношении фосфогипса и
твердой фазе достигает около 93-91%.
аммиака 1:2 сумма солей в жидкой фазе составляет
Важным показателем при проведении конверсии
14.10%, в том числе содержание KCl, CaCl2 — 6.92 и
KCl и фосфогипса является количество введенного
7.03% соответственно. При массовых соотношениях
аммиака в реакционную фазу, которое выражает-
1:3, 1:4 и 1:5 суммы солей в твердой фазе составляют
ся массовым соотношением количеств фосфогипса
9.80, 8.64 и 6.06% соответственно, а при 1:8 — только
и аммиака. Опыты проводили, используя 25%-ный
3.92% (табл. 3). На основании вышепредставленного
аммиачный раствор, при 160%-ном избытке KCl от
оптимальное массовое соотношение фосфогипса и
стехиометрии и времени перемешивания 40 мин.
аммиака будет равно 1:(3-5), при этом содержание
Для исследований использовали различные массовые
K2SO4 в твердой фазе достигает 92.70-93.87%.
соотношения гипса и аммиака 1:(2-8).
Представленные результаты исследований пока-
На основании проведенных исследований было
зывают возможность проведения конверсии KCl и
установлено (табл. 3), что увеличение концентрации
фосфогипса в 25%-ном растворе аммиака, однако в
аммиака в реакционной среде повышает содержание
литературе система K+, Ca2+||Cl-, SO42--NH3-H2O
K2SO4 в готовом продукте. Так, если при массовом
изучена и в присутствии 40%-ного раствора аммиака
соотношении фосфогипса и аммиака 1:2 содержание
[8]. При сравнении изотерм растворимости солей в
K2SO4 в твердой фазе составило 85.43%, то при их
системах, содержащих в растворе 25 и 40% аммиака,
соотношениях, равных 1:3, 1:4 и 1:5, этот показатель
четко видно, что поле кристаллизации K2SO4 в 40%-
повышается до 92.7, 93.27 и 93.8% соответственно, а
ном растворе значительно больше, чем в 25%-ном
при дальнейшем его увеличении до 1:8 наблюдается
растворе. Поэтому представляет интерес изучить
некоторое понижение содержания K2SO4 в готовом
влияние 40%-ного раствора аммиака на данную кон-
продукте до 91.90%. Вероятно, это можно объяснить
версию при различном времени перемешивания и ко-
сильным разбавлением данной системы, вызываю-
личественном соотношении исходных компонентов.
щим растворение K2SO4.
В результате исследований установлено, что и в
В результате исследований также установлено,
этом случае увеличение нормы расхода KCl от сте-
что при всех расходах аммиачной воды полученная
хиометрии оказывает положительное действие на
суспензия обладает высокой скоростью фильтрации.
данный процесс. Так, если при стехиометрическом
Однако повышение расхода аммиачной воды сопро-
соотношении KCl и фосфогипса в 40%-ном растворе
Таблица 3
Влияние массового соотношения фосфогипса и аммиака на результаты конверсии
(расход KCl 160% от стехиометрии, концентрация аммиака 25%)
Время
Ионный состав, мас%
Солевой состав, мас%
Сумма,
перемешивания,
Фосфогипс:NH3
Фаза
K+
Ca2+
Cl-
SO42-
KCl
CaCl2
CaSO4
K2SO4
мас%
мин
40
1:2
Жидкая
3.63
2.56
7.74
0.11
6.92
7.03
0.15
14.1
Твердая
41.64
1.40
0.14
54.30
0.29
—
4.73
85.43
40
1:3
Жидкая
2.54
1.79
5.44
0.03
4.84
4.92
0.04
9.8
Твердая
42.51
1.72
0.48
55.69
1.01
—
5.84
92.7
40
1:4
Жидкая
2.07
1.40
4.32
0.03
3.95
4.74
0.05
8.74
Твердая
42.30
1.68
0.40
55.67
0.84
—
5.72
93.27
30
1:5
Жидкая
1.61
1.07
3.68
0.02
3.07
2.96
0.03
6.06
Твердая
42.42
1.83
0.27
55.85
0.58
—
6.22
93.87
40
1:8
Жидкая
1.01
0.72
2.16
0.04
1.92
1.95
0.05
3.92
Твердая
41.31
2.22
0.34
56.06
0.73
—
7.54
91.19
346
Гончарик И. И. и др.
аммиака твердая фаза содержит 81.66% K2SO4, то
трии. Представленные режимы обеспечат содержание
при 110 и 120%-ном избытке KCl от стехиометрии
K2SO4 в готовом продукте 91-93%.
этот показатель повышается до 90.32 и 91.67% соот-
ветственно (время перемешивания 2 ч). Дальнейшее
Конфликт интересов
повышение избытка KCl от стехиометрии до 160% не
Авторы заявляют об отсутствии конфликта инте-
оказало существенного влияния на содержание K2SO4
ресов, требующего раскрытия в данной статье.
в твердой фазе (рис. 2, кривые 4-6). При данной кон-
центрации аммиака для получения максимального
содержания K2SO4 в готовом продукте (около 92%)
Информация об авторах
необходимо создать только 120%-ный избыток KCl
Гончарик Инна Иосифовна, к.т.н., ORCID: https://
от стехиометрии, тогда как в случае использования
orcid.org/0000-0001-9843-9529
25%-ного раствора аммиака такое содержание K2SO4
в твердой фазе достигается только при 160%-ном
0000-0003-1840-134Х
избытке KCl.
При использовании 40%-ного раствора аммиака
0000-0002-2216-436X
увеличение времени перемешивания не ухудшает
качественно-количественные показатели взаимо-
0000-0001-7202-8051
действия KCl и фосфогипса, а наблюдается некото-
рое повышение содержания K2SO4 в твердой фазе
Список литературы
(рис. 1). Так, при времени перемешивания 20 мин
содержание K2SO4 в твердой фазе составило 89.77%,
[1] Букша Ю. В., Оспова Г. В., Сафрыгин Ю. С.
а при времени перемешивания 2 ч — 92.54%. Даже
Конверсионные способы получения сульфата ка-
при 160%-ном избытке KCl от стехиометрии и пере-
лия // Горн. журн. 2007. № 8. С. 83-85.
мешивании 40 и 120 мин этот показатель составил
[2] Ющенко И. С. Характеристика насыпного грун-
та (фосфогипс) // Геол., геоэкол. и ресурс. потенц.
91.71 и 92.72% соответственно. Это свидетельствует
Урала и сопредел. терр. 2017. № 5. С. 99-102.
о том, что использование 40%-ного раствора аммиа-
[3] Пат. UA 93253 (опубл. 2014). Спосіб переробки
ка в данной системе не вызывает перехода сульфата
фосфогіпсу в комплексне добриво з використанням
калия в сингенит и гипс, характерного для системы с
напівпродукту виробництва екстракційної фосфат-
25%-ным раствором аммиака.
ної кислоти.
Таким образом, нами показана возможность полу-
[4] Гончарик И. И., Шевчук В. В., Кудина О. А., Мо-
чения K2SO4 при взаимодействии KCl и фосфогипса
жейко Ф. Ф. Получение сульфата калия взаимодей-
с использованием как 25%-ного, так и 40%-ного рас-
ствием хлорида калия и сульфата кальция // Весцi
твора аммиака. Содержание K2SO4 в готовом продук-
НАН Беларусi. Сер. хiм. навук. 2017. № 3. С. 98-103.
те 92-93%.
[5] Гончарик И. И., Можейко Ф. Ф., Пинаев Г. Ф.,
Кудина О. А. Получение бесхлорных калийных удо-
брений // Весцi НАН Беларусi. Сер. хiм. навук. 2010.
№ 4. С. 118-123.
Выводы
[6] Samir I. Abu-Eishah,
Ali A. Bani-Kananeh,
Проведенные исследования конверсии гипса
Mamdouh A. Allawzi K2SO4 production via the double
decomposition reaction of KCl and phosphogypsum //
хлористым калием в водно-аммиачном растворе с
Chem. Eng. J. 2000. V. 76. N 3. P. 197-207. https://
исходной концентрацией 25% NH3 доказывают воз-
doi.org/10.1016/S1385-8947(99)00158-8
можность технического осуществления получения
[7] Сафрыгин Ю. С., Букша Ф. В., Паскина А. В.,
K2SO4 и позволяют выбрать оптимальные параме-
Копылев Б. А. Исследование условий конверсион-
тры конверсии: температура 15-20°C, время пере-
ного получения сингенита в системе K+, Ca2+||Cl-,
мешивания 30-60 мин, 160%-ный избыток KCl от
SO42--NH3-H2O при 25°С // ЖПХ. 1986. № 2.
стехиометрии, массовое соотношение гипса и ам-
С. 245-251.
миака 1:(3-5). При использовании 40%-ного рас-
[8] Симотюк Н. П., Соколов И. Д., Дрогомирецкий П. В.
твора время перемешивания практически не влияет
Изучение растворимости в системе K+, Ca2+||Cl-,
на конверсию, а норму расхода KCl в этом случае
SO42--H2O при 0° С в 40%-ном водно-аммиачном
можно снизить до 120%-ного избытка от стехиоме-
растворе // ЖПХ. 1978. № 7. С. 1539-1542.