Влияние газообразных продуктов на кинетику термического разложения...
347
Журнал прикладной химии. 2020. Т. 93. Вып. 3
УДК 661.152.32:543.573:543.572:544-971.2:544.4.032.7
ВЛИЯНИЕ ГАЗООБРАЗНЫХ ПРОДУКТОВ НА КИНЕТИКУ ТЕРМИЧЕСКОГО
РАЗЛОЖЕНИЯ ХЛОРИДСОДЕРЖАЩИХ КОМПЛЕКСНЫХ УДОБРЕНИЙ
НА ОСНОВЕ НИТРАТА АММОНИЯ
© К. Г. Горбовский1, А. И. Казаков2, А. М. Норов1, А. И. Михайличенко3
1 Научно-исследовательский институт по удобрениям и инсектофунгицидам
им. проф. Я. В. Самойлова,
162622, Вологодская область, г. Череповец, Северное шоссе, д. 75
2 Институт проблем химической физики РАН,
142432, г. Черноголовка Московской обл., пр. Академика Семенова, д. 1
3 Российский химико-технологический университет им. Д. И. Менделеева,
125047, г. Москва, Миусская пл., д. 9
E-mail: sulfur32@bk.ru
Поступила в Редакцию 22 августа 2019 г.
После доработки 19 ноября 2019 г.
Принята к публикации 14 декабря 2019 г.
Представлены результаты исследования влияния газообразных продуктов на кинетику термиче-
ского разложения хлоридсодержащих комплексных удобрений на основе нитрата аммония с исполь-
зованием методов термогравиметрии и дифференциальной сканирующей калориметрии. Анализ
экспериментальных данных осуществляли с помощью метода подбора модели Шестака-Берггрена
и дифференциального изоконверсионного метода Фридмана. По итогам проведенных исследований
определены зависимости скорости разложения от степени разложения и сделан вывод о причинах
влияния собственной атмосферы на кинетику экзотермического разложения.
Ключевые слова: нитрат аммония; комплексные удобрения; термогравиметрия; дифференциальная
сканирующая калориметрия; собственная атмосфера; экзотермическое разложение
DOI: 10.31857/S0044461820030068
Нитрат аммония является одним из наиболее ши-
ния (промоторы), так и замедлять его (ингибито-
роко используемых видов минеральных удобрений
ры). К промоторам относятся хлоридсодержащие
для сельского хозяйства и используется как компо-
соединения, в частности хлорид калия (основной
нент в комплексных удобрениях с возможностью ши-
источник калия для комплексных удобрений) [7-11]
рокого варьирования содержания наиболее важных
и хлорид аммония [7, 9]. Ингибиторами разложения
питательных элементов — азота, фосфора и калия.
нитрата аммония служат фосфаты аммония и калия
Главным достоинством таких азотно-фосфорно-ка-
[NH4H2PO4, (NH4)2HPO4 и KH2PO4] [9, 12, 13], ко-
лийных (NPK) удобрений является возможность по-
торые являются основными продуктами в составе
лучения широко ассортимента продукции в зависимо-
удобрений, получаемых при кислотной переработке
сти от требований рынка. Основными недостатками
фосфатного сырья. Кроме того, в состав комплексных
нитрата аммония и удобрений на его основе являются
удобрений могут входить сульфат аммония и сульфат
повышенные требования к пожаро- и взрывобезопас-
калия, которые также являются ингибиторами [9, 14,
ности [1-6].
15]. Широкие вариации содержания азота, фосфора
Особенностью комплексных удобрений являет-
и калия в удобрениях и соотношения промоторов и
ся то, что в их состав могут входить компоненты,
ингибиторов разложения нитрата аммония не всег-
способные как ускорять разложение нитрата аммо-
да позволяют однозначно предсказать характер тер-
348
Горбовский К. Г. и др.
мического поведения удобрений на основе нитрата
нентов и фазовый состав этих образцов были пред-
аммония. Еще более непредсказуемым такое пове-
ставлены ранее в работах [19, 20]. Содержание основ-
дение становится в отсутствие отвода газообразных
ных компонентов и фазовый состав представлены в
продуктов разложения из реакционной зоны. В про-
табл. 1.
изводственных условиях на стадиях гранулирования
Термогравиметрия (ТГ) и дифференциальная ска-
и сушки удобрение всегда находится в контакте с
нирующая калориметрия (ДСК). Измерения ТГ и
различными газами, которые содержат в себе пары
ДСК проводили на дифференциальном сканирующем
воды и продукты частичного разложения соединений,
калориметре Netzsch STA 449 F5 Jupiter в потоке га-
входящих в состав удобрения. В случае возникнове-
зообразного азота (70 см3∙мин-1) при β = 2, 4, 6, 8 и
ния экзотермического самоподдерживающегося раз-
10 град·мин-1 в интервале температур 20-250°С. Для
ложения в технологическом процессе при хранении
измерений использовали стандартные корундовые
или транспортировке образующиеся газообразные
тигли (объем 85 мм3, диаметр 6.8 мм) и держатель
соединения также будут находиться в непосредствен-
образца типа S (Pt - 10% Pt/Rh). В качестве эталона
ном контакте с удобрением и конденсированными
использовали пустой тигель. Для исследования слу-
продуктами его разложения. Так, в работе [16] было
чая, когда газообразные продукты сразу же удалялись
показано, что газообразные продукты разложения
из реакционной системы и не взаимодействовали
смеси NH4NO3 и KCl способствуют протеканию экзо-
с конденсированной фазой образца, использовали
термического разложения, даже если компоненты не
открытый тигель (открытая система). Для изучения
находятся друг с другом в непосредственном контакте
влияния газообразных продуктов разложения на эк-
в результате образования HCl. Напротив, аммиак и
зотермическое разложение тигли накрывали корун-
вода, которые образуются при разложении NH4NO3,
довой крышкой с отверстием 1 мм (квазизакрытая
NH4H2PO4, (NH4)2HPO4 и (NH4)2SO4, замедляют раз-
система). Газовая атмосфера, формируемая над об-
ложение NH4NO3 [8, 17, 18].
разцом в таких условиях, называется собственной.
Ранее в работах [19-21] мы исследовали влияние
В таком случае отвод образующихся газов ограничи-
степени аммонизации фосфорной кислоты на тер-
вается, и они находятся в непосредственном контакте
мическое разложение на примере NPK-удобрения
с исследуемым образцом. Взвешивание осуществля-
марки 22:11:11. Данная работа является продолжени-
ли на внутренних весах с точностью 10-4 мг. Масса
ем этих исследований, ее цель — изучение влияния
образца составляла около 5 мг. Калибровку прибора
газообразных соединений, образующихся в резуль-
проводили по параметрам фазовых переходов стан-
тате разложения хлоридсодержащих комплексных
дартных веществ (In, Sn, Bi, Zn чистотой 99.99%).
удобрений на основе нитрата аммония, на кинетику
Для обработки экспериментальных данных и постро-
экзотермического процесса разложения.
ения дифференциальной термогравиметрической
(ДТГ) кривой применяли программное обеспечение
Netzsch Proteus Thermal Analysis. Коррекцию базовой
Экспериментальная часть
линии осуществляли с помощью встроенной функции
Исходные вещества. Исследование проводили на
TGBeFlat. Измерение проводили в режиме контроля
примере двух образцов удобрения марки 22:11:11,
температуры образца. Температуру фазовых перехо-
полученных с различной степенью аммонизации фос-
дов стандартных веществ определяли по точке пере-
форной кислоты. Степень аммонизации определяется
сечения касательных с фрагментами кривой ДСК с
величиной мольного отношения [NH3]:[H3PO4] (М).
минимальным и максимальным значениями произ-
Способ получения, содержание основных компо-
водной (до экстремума пика). Аналогично находили
Таблица 1
Состав исследуемых образцов
№
Содержание, мас%
М
Фазовый состав
образца
Nам
Nнитр
Р2О5
K2O
S
Cl
H2O
1
1.04
13.6
10.8
11.7
11.4
4.0
8.3
0.55
(NH4,K)H2PO4, (NH4,K)NO3, (NH4,K)2SO4,
KCl, NH4Cl
2
1.71
14.9
7.6
11.4
11.4
5.6
8.6
0.59
(NH4)2HPO4, (NH4,K)H2PO4, (NH4,K)NO3,
(NH4,K)2SO4, KCl, NH4Cl
Влияние газообразных продуктов на кинетику термического разложения...
349
температуру, при которой реакция разложения начи-
вычислений принимали, что параметр z не зависит от
нает протекать с заметной скоростью.
температуры.
Вычисления. Кинетику экзотермического разло-
Определение энергии активации Е и предэкспо-
жения исследуемых образцов можно описать с помо-
ненциального множителя A осуществляли с исполь-
щью традиционного уравнения скорости реакции [22]
зованием дифференциального изоконверсионного
метода Фридмана [22] по уравнению
dα/dt = Aexp(-E/RT)f(α),
(1)
ln(dα/dt) = ln[Af(α)] - E/RT.
(3)
где α — степень разложения, t — время, A — предэкс-
поненциальный множитель, E — энергия активации,
Величину E определяли по тангенсу угла наклона
R — универсальная газовая постоянная, T — абсо-
прямой, построенной в координатах ln(dα/dt)-1/T
лютная температура, f(α) — модель реакции.
для заданного значения α, величину A — по значе-
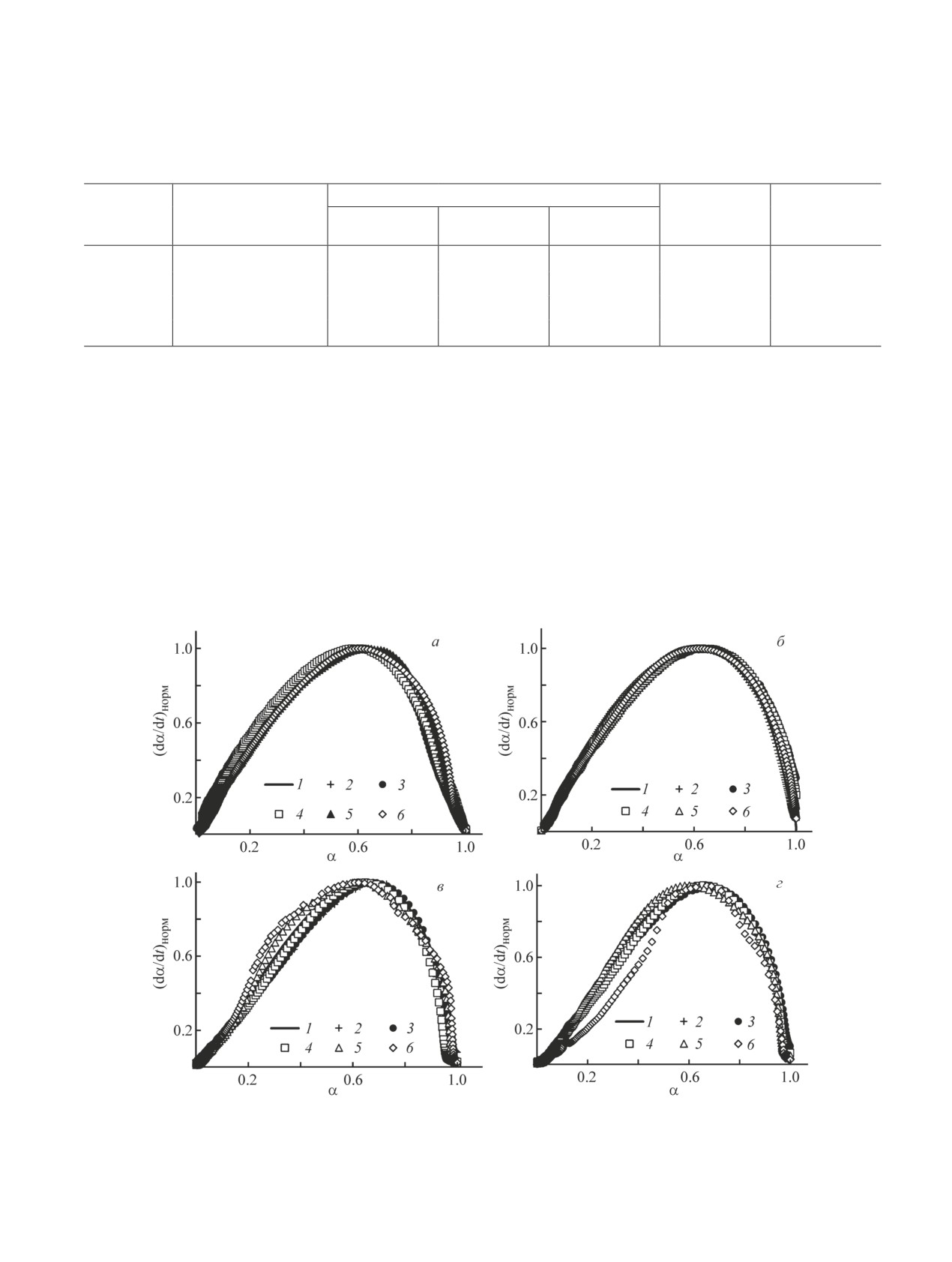
Выбор f(α) осуществляли с помощью метода
нию свободного члена той же прямой с помощью
Шестака-Берггрена путем подбора наиболее подхо-
ранее определенной функции f(α) для заданного зна-
дящей модели в координатах (dα/dt)норм-α при раз-
чения α. В итоге были получены зависимости E и
личных скоростях нагрева β, где (dα/dt)норм = (dα/dt)/
lnA от α.
(dα/dt)макс. В качестве функции f(α) использовали [23]
Обсуждение результатов
f(α) = (αm + z)(1 - α)n,
(2)
До начала экзотермического разложения обра-
где m, n и z — постоянные значения.
зец № 1 (рис. 1, а) в открытой системе подвергает-
Параметры m и n влияют на форму и положение
ся удалению гигроскопической влаги и полиморф-
максимума кривой (dα/dt)норм. В то же время пара-
ному превращению твердого раствора (NH4,K)NO3
метр z = k1/k2, где k1 — константа скорости реакции
в NH4NO3·2KNO3. Далее образец плавится. Терми-
типа A → B, k2 — константа скорости реакции типа
ческое поведение образца № 2 (рис. 1, б) отличается
A + B → 2B. На основании результатов работы [9],
лишь тем, что одновременно с полиморфным перехо-
в которой исследовали разложение смеси нитрата
дом протекает разложение (NH4)2HPO4 с образовани-
аммония c ингибитором (вода) и промотором (KCl),
ем NH3 и NH4H2PO4. В открытой системе разложение
можно принять, что параметр z равен 2∙10-4. При
начинается раньше, чем в квазизакрытой (в открытой
более высоком значении z наблюдается отклонение
системе разложение начинается около 110°С, в квази-
экспериментальных данных от расчетной кривой на
закрытой — около 135°С). Потеря массы в результате
начальной стадии разложения. Также для упрощения
разложения (NH4)2HPO4 составляет около 3%. Далее
Рис. 1. Кривые ТГ и ДСК разложения исследуемых образцов при скорости нагрева β = 10 град∙мин-1.
Образец: а — № 1, б — № 2.
Кривая ТГ: 1 — в открытой системе, 2 — в квазизакрытой системе; кривая ДСК: 3 — в открытой системе, 4 — в квази-
закрытой системе.
350
Горбовский К. Г. и др.
Таблица 2
Данные термического анализа образцов № 1 и 2 при скорости нагрева 10 град·мин-1
Температура, °С
№ образца
Тип системы
начала
окончания
- ΔH, Дж·г-1
Δm, мас%
пика
разложения
разложения
1
Открытая
195.7
220.9
232.5
601.2
62.6
Квазизакрытая
214.8
230.7
238.2
893.8
61.1
2
Открытая
193.4
220.4
233.0
501.6
55.8
Квазизакрытая
220.6
231.6
239.8
820.6
51.0
происходит интенсивное экзотермическое разложе-
построении базовой линии по Безье) в открытой
ние, данные о котором представлены в табл. 2.
системе меньше, чем в квазизакрытой. Также при
Разложение в собственной атмосфере (табл. 2)
экзотермическом разложении образца № 2 выделяет-
протекает при более высоких температурах, чем в
ся меньше тепла, чем при разложении образца № 1.
открытой системе. Температуры начала, пика и окон-
Общая потеря массы при разложении также зависит
чания экзотермического разложения в открытой си-
от типа системы и образца. Образец № 1 разлагается
стеме для обоих образцов практически одинаковы.
с большей потерей массы, чем образец № 2, однако в
В квазизакрытой системе температуры для образца
квазизакрытой системе потеря массы меньше, чем в
№ 2 имеют более высокие значения, чем для образ-
открытой системе.
ца № 1. Количество выделяемого тепла зависит от
Для образца № 1 (рис. 2, а, б) в открытой си-
образца и типа системы. Теплота разложения (при стеме наиболее подходящей функцией является
Рис. 2. Аппроксимация экспериментальных данных функциями f(α) с использованием метода Шестака-Берггрена.
Образец: а — № 1 в открытой системе, б — № 2 в открытой системе, в — № 1 в квазизакрытой системе, г — № 2 в ква-
зизакрытой системе.
1 — модель реакции f(α); β (град·мин-1): 2 — 2, 3 — 4, 4 — 6, 5 — 8, 6 — 10.
Влияние газообразных продуктов на кинетику термического разложения...
351
f(α) = (α1.2 + 2∙10-4)(1 - α)0.9, а в квазизакрытой —
f(α) = (α1.3 + 2∙10-4)(1 - α)0.7. Для образца № 2
(рис. 2, в, г) в открытой системе полученные
зависимости лучше всего описываются функцией
f(α) = (α1.2 + 2∙10-4)(1 - α)0.7, а в квазизакрытой —
f(α) = (α1.3 + 2∙10-4)(1 - α)0.7.
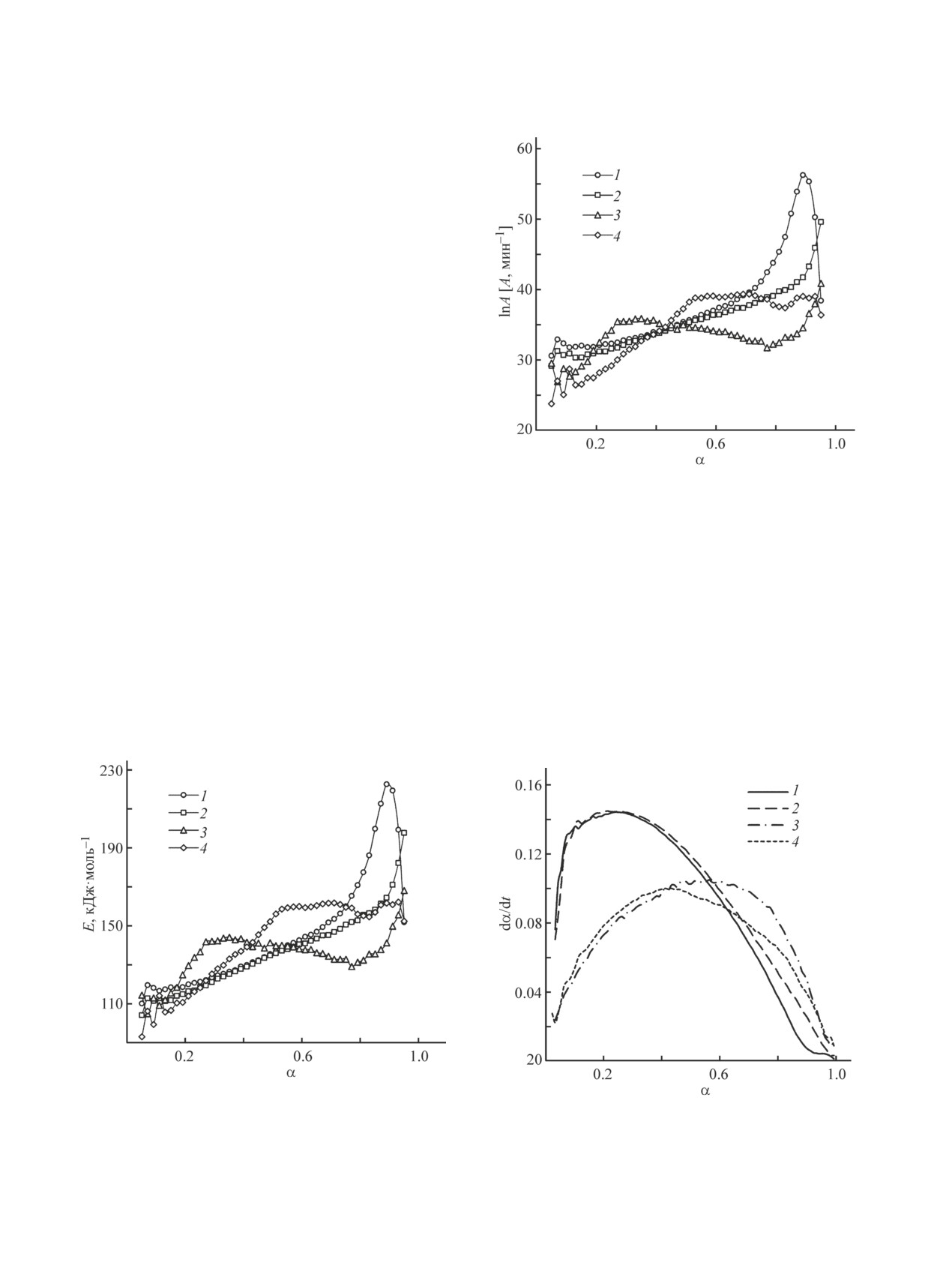
Кривые E-α (рис. 3) и lnA-α (рис. 4) для каждого
отдельного случая имеют одинаковую форму. Для об-
разцов № 1 и 2 в открытой системе на большей части
α наблюдается увеличение E и lnA. Небольшой уча-
сток роста кривых на начальной стадии разложения
может быть связан с влиянием процесса плавления.
Резкое убывание кривых на завершающей стадии
разложения для образца № 1 в открытой системе мо-
жет быть связано со стадией затвердевания образца.
Форма кривых E-α и lnA-α в квазизакрытой системе
имеет более сложный вид, что может быть связано
с влиянием на процесс разложения газообразных
Рис. 4. Зависимость предэкспоненциального множителя
продуктов.
от степени разложения, определенная с помощью мето-
да Фридмана.
Наиболее высокая скорость разложения (рис. 5)
наблюдается в открытой системе. В обоих случаях
Образец: 1 — № 1 в открытой системе, 2 — № 2 в откры-
той системе, 3 — № 1 в квазизакрытой системе, 4 — № 2
кривые скорости практически одинаковы. В начале
в квазизакрытой системе.
разложения скорость за счет самоускорения быстро
увеличивается, достигая максимального значения при
α = 0.26, и далее быстро снижается практически до
самоускорением до α = 0.60. Далее скорость посте-
полного прекращения разложения. Разложение в ква-
пенно снижается. При α более 0.60 скорость разложе-
зизакрытой системе имеет более низкую скорость для
ния образца № 1 в квазизакрытой становится выше,
обоих образцов до определенной глубины реакции.
чем в открытой системе. Разложение образца № 2 в
Процесс разложения образца № 1 также протекает с
квазизакрытой системе начинается с небольшого сни-
жения скорости, однако затем возрастает до α = 0.43 и
Рис. 3. Зависимость энергии активации от степени раз-
ложения, определенная с помощью метода Фридмана.
Рис. 5. Моделирование процесса разложения при 200°С.
Образец: 1 — № 1 в открытой системе, 2 — № 2 в откры-
Образец: 1 — № 1 в открытой системе, 2 — № 2 в откры-
той системе, 3 — № 1 в квазизакрытой системе, 4 — № 2
той системе, 3 — № 1 в квазизакрытой системе, 4 — № 2
в квазизакрытой системе.
в квазизакрытой системе.
352
Горбовский К. Г. и др.
далее снижается. До этого значения на всем участке
теплового эффекта [27-29]. Данные измерений, пред-
самоускорения кривые скорости экзотермического
ставленные в работе [27], показали, что в результате
разложения образцов № 1 и 2 практически совпада-
разложения нитрата аммония в открытой системе вы-
ют. Выше α = 0.43 кривая скорости для образца № 2
деляются следующие соединения (в порядке умень-
оказывается ниже, чем для образца № 1, вплоть до
шения концентрации): H2O, NH3, N2O, NO, NO2,
практически полного разложения. Скорость разложе-
HNO3 (количества NO2 и HNO3 очень малы). В за-
ния образца № 2 в квазизакрытой системе оказывает-
крытой системе газовая фаза обогащается аммиаком
ся ниже, чем в открытой системе, до α = 0.66, далее
как более летучим компонентом, а жидкая — азотной
кривые пересекаются и их положение изменяется.
кислотой. Накопление азотной кислоты приводит к
Начальной стадией разложения нитрата аммония
тому, что разложение протекает с самоускорением.
является обратимая равновесная передача протона с
Описанный выше механизм разложения нитрата ам-
катиона NH4+ на анион NO3- с образованием молекул
мония является ионным и реализуется до температу-
NH3 и HNO3 и их распределение между конденсиро-
ры ниже 300°С. При температурах более 300°С разло-
ванной и газовой фазами [24-26]:
жение осуществляется по радикальному механизму,
а скорость процесса определяется гомолитическим
NH4NO3 NH4+ + NO3- NH3 + HNO3.
(4)
разрывом связи в молекуле HNO3 [18, 30, 31].
Фосфаты и сульфаты, входящие в состав исследуе-
Далее происходит окисление иона NH4+ молеку-
мых образцов, снижают скорость разложения нитрата
лой HNO3:
аммония путем уменьшения концентрации молекул
азотной кислоты в жидкой фазе в результате проте-
NH4+ + HNO3 → NH3NO2+ + H2O,
(5)
кания обменных реакций [9, 12-15]:
NH3NO2+ → NO2+ + H2O,
(6)
HPO42- + HNO3 H2PO4- + NO3-,
(14)
NO2+ + NH3 → N2O + H3O+,
(7)
H2PO4- + HNO3 H3PO4 + NO3-,
(15)
или в общем виде
SO42- + HNO3 HSO42- + NO3-.
(16)
NH4NO3 → N2O + 2H2O.
(8)
Показатели констант ионизации рKa для H2PO4-,
H3PO4 и HSO4- соответственно равны 7.21, 2.14 и
Реакция (8) является экзотермической. Помимо
1.95, что значительно больше рKa(HNO3) = -1.43.
основной также могут протекать побочные экзотер-
Константы равновесия указанных реакций при стан-
мические реакции [26]:
дартных условиях Kp равны соответственно 4.4·108,
5.4·102 и 2.4·103, а энтальпии реакций ΔH25° состав-
NH4NO3 → N2 + 0.5O2 + 2H2O,
(9)
ляют 4.2, 8.3 и 22 кДж·моль-1·град-1, из чего мож-
NH4NO3 → 0.8N2 + 1.8H2O + 0.4HNO3.
(10)
но сделать вывод, что равновесия реакций (14)-(16)
смещены в сторону образования продуктов нейтра-
Параллельно происходит разложение азотной кис-
лизации HNO3, и в соответствии с принципом Ле
лоты [26]:
Шателье-Брауна с увеличением температуры смеще-
ние будет увеличиваться. В работе [12] показано, что
HNO3 NO2 + 0.5H2O + 0.25O2,
(11)
в смеси NH4NO3 и NH4H2PO4 в составе газообразных
HNO3 + NO2 → HNO2 + NO + O2,
(12)
продуктов практически отсутствует HNO3, что связа-
HNO2 + HNO3 → 2NO2 + H2O.
(13)
но с протеканием реакции (15).
Хлоридсодержащие соединения (NH4Cl и KCl)
Общий тепловой эффект процесса разложения
ускоряют разложение нитрата аммония в закрытой
зависит от степени ограничения реакционного про-
системе за счет каталитического эффекта хлорид-
странства. Скорость выделения тепла определяется
анионов. В зависимости от среды разложение нитрата
реакцией (8) и поэтому растет с увеличением содер-
аммония в присутствии Cl- может протекать по ра-
жания свободной азотной кислоты в системе. В от-
дикальному пути (в плаве) [32] или по ионному пути
крытой системе NH3 и HNO3 легко удаляются из
(в водном растворе) [33]. Исследуемые в данной рабо-
реакционной системы, накопления азотной кислоты
те образцы к моменту начала разложения теряют всю
не происходит, разложение протекает без самоускоре-
гигроскопическую воду, а содержание воды, которая
ния, и увеличение вклада эндотермических реакций
может быть образована в результате дегидратации
приводит к суммарному снижению экзотермического
кристаллогидратов примесных соединений, слишком
Влияние газообразных продуктов на кинетику термического разложения...
353
мало [21]. Таким образом, разложение нитрата ам-
содержания NH4NO3 общая скорость разложения, а
мония в присутствии Cl- описывается следующими
также самоускорение постепенно снижаются до тех
реакциями:
пор, пока процесс полностью не завершится.
Для дальнейшего понимания роли газообразных
NO2+ + Cl- → NO2 + Cl,
(17)
продуктов в экзотермическом разложении NPK-
Cl + NH4+ → NH3+ + HCl,
(18)
удобрений на основе нитрата аммония необходимо
NH3+ + NO2 → NH3NO2+,
(19)
также рассмотреть термическую устойчивость ин-
дивидуальных соединений, входящих в состав ис-
далее по реакциям (9) и (10). Параллельно протекают
следуемых образцов помимо NH4NO3. Наименьшей
побочные реакции:
термической стабильностью среди них обладает
(NH4)2HPO4. Как установлено в работе [35], разло-
Cl + Cl → Cl2,
(20)
жение (NH4)2HPO4 может начинаться уже при 85°С
3Cl2 + 2NH3 → N2 + 6HCl,
(21)
в результате обратимой эндотермической реакции
Cl + NH3 → NH2 + HCl,
(22)
[36, 37]:
NH2 + NO → N2 + H2O.
(23)
(NH4)2HPO4 NH4H2PO4 + NH3.
(24)
В присутствии хлорид-анионов образование ка-
Кроме того, до 250°С протекают также реакции
тиона NH3NO2+ происходит в результате радикаль-
ных реакций с ожидаемо более низкой энергией ак-
(NH4)2HPO4 H3PO4 + 2NH3,
(25)
тивации, чем при разложении нитрата аммония по
NH4H2PO4 H3PO4 + NH3,
(26)
ионному механизму, что объясняет более высокую
скорость реакции. В присутствии хлорид-анионов
4H3PO4 → 2H4P4O7 + 2H2O.
(27)
экзотермическое разложение нитрата аммония может
осуществляться даже в открытой системе и с замет-
NH4H2PO4 является более устойчивым, чем
ным самоускорением.
(NH4)2HPO4, и начинает разлагаться около 154°С
В открытой системе при разложении нитрата ам-
по реакции (26) с последующей поликонденсацией
мония основной вклад в тепловой эффект вносят
H3PO4 [38]. KH2PO4 около 192°С дегидратирует по
эндотермические реакции, однако для рассматривае-
реакции [39]
мых образцов NPK-удобрений присутствие хлорид-
анионов приводит к тому, что в процессе разложения
2KH2PO4 → K2H2P2O7 + H2O.
(28)
начинают преобладать экзотермические реакции, в
результате чего общий процесс также протекает с
Сульфат аммония начинает частично разлагаться
выделением тепла.
около 240°С по реакции [36, 40]
Совместное присутствие ингибиторов и промо-
торов разложения нитрата аммония приводит к то-
(NH4)2SO4 → NH4HSO4 + NH3.
(29)
му, что температура начала разложения смещается
в область более высоких температур, однако затем
Однако при такой температуре, когда экзотермиче-
происходит интенсивное экзотермическое разложе-
ское разложение практически завершилось, продукты
ние [9, 34]. Разложение начинается с диссоциации
разложения (NH4)2SO4 вряд ли будут оказывать вли-
нитрата аммония [реакция (4)] с образованием NH3 и
яние на общий процесс.
HNO3. Происходит постепенное накопление HNO3 в
Хлорид аммония при температурах более 200°С
реакционной системе. Общая скорость процесса низ-
сублимируется [41], однако в данных условиях веро-
ка и лимитируется разложением катиона NH3NO2+, в
ятно, что к моменту достижения этой температуры
результате чего наблюдается небольшое увеличение
практически весь NH4Cl прореагирует с NH4NO3.
выделения тепла. При достижении определенного
K2SO4 и KCl являются наиболее термически устой-
критического значения α в реакционной системе нака-
чивыми соединениями в рассматриваемой системе и
пливается такое количество NH3NO2+, что его разло-
не образуют газообразных продуктов разложения в
жение приводит к началу самоускорения. После этого
исследуемом интервале температур.
содержание хлорид-анионов в системе постепенно
При разложении исследуемых образцов в откры-
снижается в результате удаления из реакционной зо-
той системе газообразные продукты диссоциации, а
ны газообразных HCl, Cl2 и других хлорсодержащих
также термораспада NH4H2PO4 и (NH4)2HPO4 удаля-
соединений. Как следствие этого, а также снижения
ются из реакционной системы, не оказывая влияния
354
Горбовский К. Г. и др.
на последующий ход процесса. Частичное протека-
составляет несколько часов, а из-за перемешивания
ние реакций (25) и (26) с образованием H3PO4 может
и воздействия топочных газов реализуется непрерыв-
способствовать дополнительному накоплению HNO3
ный теплообмен, при условии поддержания необ-
в системе, в результате этого, а также из-за высокого
ходимых технологических параметров вероятность
содержания хлорид-анионов в исходном веществе
самонагрева гранулированного материала ниже по
образец начинает разлагаться с интенсивным само-
сравнению с условиями, когда материал находится в
ускорением. Однако из-за того, что образующиеся
неподвижном состоянии. В таких условиях глубина
хлорсодержащие газовые соединения и молекулы
протекания экзотермического разложения будет неве-
азотной кислоты легко удаляются из системы, про-
лика, и присутствие NH3 и H2O будет способствовать
цесс самоускорения быстро прекращается, и скорость
снижению скорости разложения и снижению вероят-
разложения постепенно снижается. Более низкое со-
ности появления хлорсодержащих газовых соедине-
держание нитрата аммония в образце № 2 по срав-
ний в отходящих газах, выбросы которых более опас-
нению с образцом № 1 не оказывает значительного
ны для окружающей среды, требуют дополнительных
влияния на скорость разложения, однако оно оказы-
затрат и приводят к значительной коррозии оборудо-
вает влияние на количество выделяющегося тепла,
вания. В связи с этим увеличение степени аммониза-
которое в случае образца № 2 оказывается ниже.
ции фосфорной кислоты позволяет максимально сни-
В квазизакрытой системе из-за ограничения отво-
зить риск протекания экзотермического разложения.
да газообразных соединений образующийся NH3 в
При хранении и транспортировке больших масс
результате протекания реакций (4) и (24)-(26) продол-
удобрений и условиях соблюдения всех норм безопас-
жает контактировать с конденсированной фазой, сни-
ности воздействие высоких температур отсутствует.
жая как скорость разложения, так и самоускорение.
Продолжительность хранения удобрений на складе
В результате степень разложения, при которой ско-
может составлять несколько суток или недель. При
рость процесса достигает максимального значения,
возникновении пожара (наиболее частая причина
смещается до более высоких значений по сравнению
аварий при хранении удобрений на основе нитрата
с открытой системой. Хлорсодержащие соединения
аммония [2]) или появлении другого источника тепла
также не сразу удаляются из системы, продолжая
неконтролируемое разложение может произойти до-
контактировать с конденсированной фазой, однако их
статочно глубоко, что может привести к образованию
присутствие не приводит к резкому увеличению ско-
большого количества хлорсодержащих газов и выде-
рости процесса из-за того, что их влияние частично
лению большого количества тепла и, в конечном сче-
нивелируется ранее образовавшимся NH3. Однако,
те, привести к тепловому взрыву. В таком случае при
как видно из данных ДСК, это способствует значи-
хранении и транспортировке удобрений необходима
тельному выделению тепла. Более высокое содержа-
реализация таких условий, которые в максимально
ние (NH4)2HPO4 в образце № 2 в результате его тер-
возможной степени позволят удалить образующиеся
мораспада способствует более высокому содержанию
газы из реакционной зоны. В этом случае также про-
NH3 в газообразных продуктах разложения, в резуль-
дукт, полученный с более высокой степенью аммони-
тате чего скорость в начальный момент разложения
зации фосфорной кислоты, проявляет более высокую
снижается, а затем появляется самоускорение. Также
термическую устойчивость.
это способствует тому, что максимальная скорость
достигается при более низкой степени разложения,
Выводы
чем для образца № 1. Как и в случае с открытой си-
стемой, в собственной атмосфере для образца № 2 в
Таким образом, нами проведены исследования
результате экзотермического разложения выделяется
влияния газообразных продуктов на термическое
меньше тепла, чем для образца № 1.
разложение в открытой и квазизакрытой системах
Таким образом, влияние собственной атмосфе-
комплексных NPK-удобрений на основе нитрата ам-
ры проявляется с двух сторон. С одной стороны, в
мония, полученных с различной степенью аммони-
присутствии газообразных продуктов наблюдается
зации фосфорной кислоты. Анализ эксперименталь-
более низкая скорость разложения до около полови-
ных данных, выполненный с использованием метода
ны разложения образца. С другой — в собственной
Шестака-Берггрена и дифференциального изокон-
атмосфере происходит значительное увеличение ко-
версионного метода Фридмана, позволил определить
личества выделяющегося тепла.
функцию f(α) процесса экзотермического разложения
В производственных условиях на стадиях грану-
и зависимости энергии активации и предэкспонен-
лирования и сушки, где время пребывания продукта
циального множителя от степени разложения. На
Влияние газообразных продуктов на кинетику термического разложения...
355
основе полученных результатов определены зависи-
accidents // J. Hazard. Mater. 2016. V. 304. P. 134-
мости скорости разложения от степени разложения.
Установлено, что в открытой системе начальная ско-
[3] Marlair G., Michit C., Turcotte R., Singh S. Comments
about the paper entitled «Lessons to be learned from
рость разложения выше по сравнению с квазизакры-
an analysis of ammonium nitrate disasters in the last
той системой. Максимальная скорость разложения
100 years» by Pittman et al. (J. Hazard. Mater. 280
в открытой системе достигается при более низких
(2014). P. 472-477) // J. Hazard. Mater. 2016. V. 303.
степенях разложения, чем в квазизакрытой системе.
P. 177-180.
В то же время разложение в присутствии собстенной
атмосферы характеризуется большим количеством
[4] Deshy N., Bourdeaux T., Ayrault N., Kordek M.-A., Le
выделяющегося тепла, чем при разложении в откры-
Coze J. C. First lessons of the Toulouse ammonium
той системе, и более низкой скоростью распада до
nitrate disaster, 21st September, AZF plant, France //
около половины разложения образца. Более высокое
J. Hazard. Mater. 2004. V. 111. N 1-3. P. 131-138.
содержание (NH4)2HPO4 в исходном образце спо-
собствует достижению максимальной скорости при
[5] Hadden R. M., Rein G. Small-scale experiments of
более низкой степени разложения.
self-sustaining decomposition of NPK fertilizer and
application to events aboard the Ostedijk in 2007 // J.
Hazard. Mater. 2011. V. 186. N 1. P. 731-737. http://
Финансирование работы
doi.org/10.1016/j.jhazmat.2010.11.047
А. И. Казаков использовал финансирование по теме
[6] Laboureur D. M., Han Z., Harding B. Z., Pineda A.,
Pittman W. C., Rosas C., Jiang J., Mannan M. S. Case
0089-2019-0005 государственного задания (№ государ-
study and lessons learned from the ammonium nitrate
ственной регистрации АААА-А19-119101500098-3)
explosion at the West Fertilizer facility // J. Hazard.
«Фундаментальные и проблемно-ориентированные
Mater. 2016. V. 308. N 3. P. 164-172.
исследования в области создания энергетических кон-
денсированных систем (ЭКС) различного назначения
[7] Li X.-R., Koseki H. Study of the contamination of
(СТРТ, порохов, ВМ, пиротехнических составов) с
chlorides in ammonium nitrate // Process Safety and
повышенным уровнем эффективности и эксплуата-
Environmental Protection. 2005. V. 83. N 13. P. 31-37.
ционных свойств».
[8] Han Z., Sachdeva S., Papadaki M. I., Mannon M. S.
Ammonium nitrate thermal decomposition with
Конфликт интересов
additives // J. Loss Prevention in the Process
Авторы заявляют об отсутствии конфликта инте-
Industries. 2015. V. 35. P. 307-315.
ресов, требующего раскрытия в данной статье.
[9] Рубцов Ю. И., Стрижевский И. И., Казаков А. И.,
Мошкович Е. Б., Андриенко Л. П. Кинетические
Информация об авторах
закономерности влияния Cl- на термическое раз-
Горбовский Константин Геннадиевич, к.т.н.,
ложение аммиачной селитры // ЖПХ. 1989. Т. 78.
№ 11. С. 2417-2422.
Казаков Анатолий Иванович, д.х.н., ORCID:
[10] Oxley J. C., Smith J. L., Rogers E., Yu. M. Ammonium
nitrate: Thermal stability and explosivity modifiers //
Thermochim. Acta. 2002. V. 384. N 1-2. P. 23-45.
Норов Андрей Михайлович, к.т.н., ORCID: https://
orcid.org/0000-0002-9140-0637
[11] Рубцов Ю. И., Казаков А. И., Шведов К. К.
Михайличенко Анатолий Игнатьевич, д.х.н.,
Исследование кинетических закономерностей и
механизма разложения бинарных смесей на осно-
ве нитрата аммония с экзо- и эндотермическими
превращениями компонентов // Хим. физика. 2007.
Список литературы
Т. 26. № 5. С. 70-77.
[1] Pittman W., Han Z., Harding B., Rosas C., Jiang J.,
[12] Yang M., Chen X., Yuan B., Wang Y., Rangwala A. S.,
Pineda A., Mannan M. S. Lessons to be learned from
Cao H., Niu Y., Zhang Y., Fan A., Yin S. Inhibition
an analysis of ammonium nitrate disasters in the 100
effect of ammonium dihydrogen phosphate on the
years // J. Hazard. Mater. 2014. V. 280. P. 472-477.
thermal decomposition characteristics and thermal
sensitivity of ammonium nitrate // J. Analyt. Appl.
[2] Babrauskas V. Explosions of ammonium nitrate
Pyrol. 2018. V. 134. P. 195-201.
fertilizer in storage or transportation are preventable
356
Горбовский К. Г. и др.
[13] Рубцов Ю. И., Стрижевский И. И., Казаков А. И.,
2016. Т. 89. № 9. С. 1089-1098 [Gorbovskiy K. G.,
Андриенко Л. П., Мошкович Е. Б. Возможности
Kazakov A. I., Norov A. M., Pagaleshkin D. A.,
снижения скорости термического разложения
Mikhaylichenko A. I. Thermal decomposition study
аммиачной селитры // ЖПХ. 1989. Т. 62. № 10.
of chloride-containing complex ammonium nitrate-
С. 2169-2173.
based fertilizers by thermogravimetry and differential
[14] Казаков А. И., Иванова О. Г., Курочкина Л. С.,
scanning calorimetry // Russ. J. Appl. Chem. 2016.
Плишкин Н. А. Кинетика и механизм термическо-
V. 89. N 9. P. 1383-1392.
го разложения смесей нитрата аммония и сульфата
аммония // ЖПХ. 2011. Т. 84. № 9. С. 1465-1472
[22]
Vyazovkin S., Chrissafis K., Di Lorenzo M. L., Koga N.,
[Kazakov A. I., Ivanova O. G., Kurochkina L. S.,
Pijolat M., Roduit B., Sbirrazzuoli N., Sunol J. J.
Plishkin N. A. Kinetics and mechanism of thermal
ICTAC Kinetics Committee recommendations for
decomposition of ammonium nitrate and sulfate
collecting experimental thermal analysis data for
mixtures // Russ. J. Appl. Chem. 2011. V. 84. N 9.
kinetic computations // Thermochim. Acta. 2014.
P. 1516-1523.
V. 590. P. 1-23.
[15] Han Z., Sachdeva S., Papadaki M., Mannan M. S.
[23]
Burnham A. K. Use and misuse of logistic equations
Calorimetry studies of ammonium nitrate — Effect
for modeling chemical kinetics // J. Thermal Anal.
of inhibitors, confinement, and heating rate // J. Loss
Calorim. 2017. V. 127. N 1. P. 1107-1116. http://
Prevention Process Industries. 2015. V. 38. P. 234-
dx.doi.org/10.1007/s10973-015-4879-3
[24]
Izato Y., Miyake A. Thermal decomposition of molten
[16] Izato Y., Miyake A. Thermal decomposition mechanism
ammonium nitrate (AN). Chemical equilibrium in
of ammonium nitrate and potassium chloride mixtures
molten AN // J. Thermal Anal. Calorim. 2015. V. 122.
// J. Thermal Anal. Calorim. 2015. V. 212. N 1. P. 287-
N 2. P. 595-600.
[17] Рубцов Ю. И., Казаков А. И., Морозкин С. Ю.,
[25]
Dunuwille M., Yoo C.-S. Phase diagram of ammonium
Андриенко Л. П. Кинетика тепловыделения при
nitrate // J. Chem. Phys. 2013. V. 139. N 214503.
термическом распаде технической аммиачной се-
литры // ЖПХ. 1984. Т. 57. № 9. С. 1926-1929.
[26]
Манелис Г. Б., Назин Г. М., Рубцов Ю. И.,
[18] Brower K. R., Oxley J. C., Tewari M. Evidence for
Струнин В. А. Термическое разложение и горение
hemolytic decomposition of ammonium nitrate at
взрывчатых веществ и порохов. М.: Наука, 1996.
high temperature // J. Phys. Chem. 1989. V. 93. N 10.
С. 116-125.
[27]
Yang M., Chen X., Wang Y., Yuan B., Niu Y., Zhang Y.,
[19] Gorbovskiy K., Kazakov A., Norov A., Malyavin A.,
Liao R., Zhang Z. Comparative evaluation of thermal
Mikhaylichenko A. Properties of complex ammonium
decomposition behavior and thermal stability
nitrate-based fertilizers depending on the degree of
of powdered ammonium nitrate ubder different
phosphoric acid ammoniation // Int. J. Ind. Chem.
atmosphere conditions // J. Hazard. Mater. 2017.
2017. V. 8. N 3. P. 315-327.
V. 337. P. 10-19.
[20] Горбовский К. Г., Лобачева М. П., Кочетова И. М.,
[28]
Cao H.-Q., Jiang L., Duan Q.-L., Zhang D.,
Норов А. М., Малявин А. С., Михайличенко А. И.
Chen H.-D., Sun J.-H. An experimental and theoretical
Влияние нитрата аммония на термическое разло-
study of optimized selection and model reconstruction
жение комплексных азотно-фосфорно-калийных
for ammonium nitrate pyrolysis // J. Hazard. Mater.
удобрений // Хим. технология. 2015. Т. 1. № 12.
2019. V. 364. P. 539-547.
С. 705-713 [Gorbovskiy K. G., Lobacheva M. P.,
Kochetova I. M., Norov A. M., Malyavin A. S.,
[29]
Skarlis S. A., Nicolle A., Berthout D., Dujardin C.,
Mikhaylichenko A. I. Influence of ammonium
Granger P. Combined experimental and kinetic
nitrate on the thermal decomposition of complex
modeling approaches of ammonium nitrate thermal
nitrogen-phosphorus-potassium fertilizers // Theoret.
decomposition // Thermochim. Acta. 2014. V. 584.
Foundation Chem. Eng. 2016. V. 50. N 5. P. 798-805.
[30]
Izato Y., Miyake A. Kinetic analysis of the thermal
[21] Горбовский К. Г., Казаков А. И., Норов А. М.,
decomposition of liquid ammonium nitrate based on
Пагалешкин Д. А., Михайличенко А. И. Исследо-
thermal analysis and detailed reaction simulations // J.
вание термического разложения хлоридсодержа-
Thermal Anal. Calorim. 2018. V. 134. N 1. P. 813-823.
щих комплексных удобрений на основе нитрата
аммония методами термогравиметрии и диффе-
[31]
Cagnina S., Rotureau P., Fayet G., Adamo C.
ренциальной сканирующий калориметрии // ЖПХ.
The ammonium nitrate and its mechanism of
Влияние газообразных продуктов на кинетику термического разложения...
357
decomposition on the gas phase: A theoretical study
monitoring the effect of fire retardants on cellulose
and a DFT benchmark // Phys. Chem. Chem. Phys.
pyrolysis // Analyt. Chim. Acta. 2000. V. 409. P. 203-
2013. V. 15. N 26. P. 10849-10858.
[37] Marcilla A., Beltran M. I., Gomez-Siurana A.,
[32]
Keenan A. G., Dimitriades B. Mechanism for
Martinez-Castellanos I., Berenguer D. TGA/FTIR
the chloride-catalyzed thermal decomposition of
study of the pyrolysis of diammonium hydrogen
ammonium nitrate // J. Chem. Phys. 1962. V. 37. N 8.
phosphate — tobacco mixture // J. Analyt. Appl. Pyrol.
2015. V. 112. P. 48-55.
[33]
MacNeil J. H., Zhang H. T., Berseth P., Trogler W. C.
Catalytic decomposition of ammonium nitrate in
[38] Pardo A., Romero J., Orbiz E. High-temperature
superheated aqueous solution // J. Am. Chem. Soc.
behavior of ammonium dihydrogen phosphate //
1997. V. 119. N 41. P. 9738-9744.
J. Phys.: Conference Series. 2017. V. 935. N 012050.
P. 1-5.
[34]
Han Z., Sachdeva S., Papadaki M. I., Mannan S.
Effects of inhibitor and promoter mixtures on
[39] Park J.-H., Lee K.-S., Choi B.-C. High-temperature
ammonium nitrate fertilizer explosion hazards //
transformation in KH2PO4 and RbH2PO4 crystals //
Thermochim. Acta. 2016. V. 624. P. 69-75.
J. Phys.: Condensed Matter. 2001. V. 13. P. 9411-
[35]
Maciejewski M., Rudnicki R. Correlation between
[40] Kosova D. A., Emelina A. L., Bykov M. A. Phase
isothermal and rising temperature experiments.
transition of some sulfur-containing ammonium salt //
Thermal
decomposition of diammonium
Thermochim. Acta. 2014. V. 595. P. 61-66.
hydrophosphate // Thermochim. Acta. 1987. V. 113.
P. 305-320.
[41] Oszak-Humienik M. On the thermal stability of some
ammoniuim salts // Thermochim. Acta. 2001. V. 378.
[36]
Statheropoulos M., Kyriakou S. A. Quantitative
N 1-2. P. 107-112.
thermogravimetric-mass spectrometric analysis for