406
Фарион И. А. и др.
Журнал прикладной химии. 2020. Т. 93. Вып. 3
УДК 612.396.11:547.32:57.085.23
ПРИВИВКА НЕНАСЫЩЕННЫХ ВЫСШИХ ЖИРНЫХ КИСЛОТ
К ХИТОЗАНУ В ВОДНОЙ СРЕДЕ
© И. А. Фарион1, В. Ф. Бурдуковский1, Б. Ч. Холхоев1, П. С. Тимашев2,3,
К. Н. Бардакова2,3, Ю. В. Герасимов4, А. Г. Грошева4, Н. Н. Воробьева2, Р. К. Чайлахян2,4
1 Байкальский институт природопользования СО РАН,
670047, г. Улан-Удэ, ул. Сахьяновой, д. 6
2 Институт фотонных технологий Федерального научно-исследовательского центра
«Кристаллография и фотоника» РАН,
124190, г. Троицк (Москва), ул. Пионерская, д. 2
3 Институт регенеративной медицины Первого московского государственного медицинского
университета им. И. М. Сеченова РАН,
119991, г. Москва, ул. Трубецкая, д. 8-2
4 Федеральный научно-исследовательский центр эпидемиологии и микробиологии
им. Н. Ф. Гамалеи,
123098, г. Москва, ул. Гамалеи, д. 18
Е-mail: fariv@mail.ru
Поступила в Редакцию 22 мая 2019 г.
После доработки 29 сентября 2019 г.
Принята к публикации 14 декабря 2019 г.
Взаимодействием хитозана с ненасыщенными высшими жирными кислотами в подкисленной водной
среде и в присутствии смеси гидрохлорида N-этил-N′-(диметиламинопропил)карбодиимида с N-ги-
дроксисукцинимидом получены привитые амиды со степенью модификации, достигающей 9%. Про-
дукты нерастворимы в водных растворах одноосновных кислот, а лишь способны набухать, образуя
гидрогели, максимальная степень набухания которых составляет 1442%. Гидрогели демонстрируют
хорошую биосовместимость и адгезию мультипотентных стромальных клеток костного мозга, что
определяет их перспективность для дизайна скаффолдов-носителей клеток.
Ключевые слова: хитозан; ненасыщенные высшие жирные кислоты; модификация полимеров; гидро-
гели; биоимплантаты-скаффолды
DOI: 10.31857/S0044461820030135
Аминополисахарид хитозан и его функционали-
длины углеводородного остатка в привитых к ма-
зированные производные привлекают внимание ис-
кромолекуле хитозана амидах карбоновых кислот
следователей в области регенеративной медицины
приводит к возрастанию совместимости с клетками
для дизайна имплантатов-скаффолдов [1-3]. Одним
крови, при этом формирование нерастворимых гидро-
из способов функционализации являются реакции
гелей происходит при меньших степенях модифика-
ацилирования хитозана карбоновыми кислотами или
ции. Учитывая данный факт, вполне разумно пред-
их производными [4-19]. В работе [18] была прове-
положить, что для модификации хитозана с целью
дена серия экспериментов по модификации хитозана
придания перечисленных свойств при наименьших
ангидридами карбоновых кислот с различной длиной
степенях модификации перспективно использование
углеводородного остатка в среде водного метанола
высших жирных кислот, в том числе и ненасыщенных.
с целью придать совместимость хитозану с клетка-
Преимуществом ненасыщенных высших жирных
ми крови. Авторы статьи показали, что увеличение кислот (НВЖК) со связями HC=CH в цис-конфигура-
Прививка ненасыщенных высших жирных кислот к хитозану в водной среде
407
ции перед насыщенными твердыми аналогами явля-
Образцы в таблетках с KBr подготавливали следую-
ется их жидкое агрегатное состояние при нормальных
щим образом. Обезвоженный KBr (600 мг) тщательно
условиях, благоприятствующее эмульгированию и
перетирали в агатовой ступке с исследуемым образ-
соответственно равномерному распределению в ре-
цом (6 мг). Полученную порошкообразную смесь
акционной массе при проведении реакций. Кроме
запрессовывали в таблетку, которую выдерживали
того, сами НВЖК являются экологически чистыми
в вакуум-шкафу при 70-80°С в течение 1 сут. Перед
веществами природного происхождения, которые,
съемкой ИК-спектров образцы хранились в эксика-
как известно, являются продуктом омыления расти-
торе над P2O5. Культивирование мультипотентных
тельных масел.
стромальных клеток проводилось в СО2-инкубаторе
Необходимо отметить, что сведения о модифика-
NU-4950, NuAire, США.
ции хитозана карбоновыми кислотами, в том числе
Модификация хитозана ненасыщенными выс-
НВЖК, исключительно в водной среде в отсутствие
шими жирными кислотами. Мольное соотноше-
токсичных органических сорастворителей имеются в
ние НВЖК:элементарные звенья хитозана = 1:1.
ограниченном количестве.
В трехгорлую колбу емкостью 250 мл, снабженную
Целью работы являлась модификация хитозана
мешалкой, помещали хитозан (5.70 г, 0.03136 ос-
смесью НВЖК в среде нетоксичного и доступного
ново-моль), дистиллированную воду (80 мл) и остав-
растворителя — воды и изучение биологической со-
ляли на ночь в инертной атмосфере. Затем также
вместимости привитых производных, а также адгезии
в инертной атмосфере добавляли додецилсульфат
к ним мультипотентных стромальных клеток костно-
натрия (0.22 г), перемешивали в токе аргона в те-
го мозга человека.
чение 1 ч и добавляли НВЖК в количестве 9.58 мл
(8.7535 г, 0.03136 моль) и интенсивно перемешивали
в течение 1 ч. К полученной смеси добавляли раствор
Экспериментальная часть
N-гидроксисукцинимида (3.6074 г, 0.03136 моль) в
Исходные реагенты и растворители. Хитозан
8 мл дистиллированной воды, перемешивали в те-
(200 кДа, степень деацетилирования 95%, содержа-
чение 20 мин, добавляли 0.3 мл 35%-ного водно-
ние основного вещества 90%; ЗАО «Биопрогресс»,
го раствора HCl и продолжали перемешивание при
г. Москва). Смесь ненасыщенных высших жирных
20°C до образования однородной вязкой массы, к
кислот (ρ = 0.914 г·мл-1; содержание, мас%: 70 —
которой в один прием добавляли раствор гидро-
линоленовой, 25 — линолевой и 5 — олеиновой;
хлорида N-этил-N′-(диметиламинопропил)карбо-
Sigma-Aldrich, США), после использования храни-
диимида (6.0117 г, 0.03136 моль) в 8 мл холодной
лась в атмосфере аргона в темном месте. Выбор сме-
дистиллированной воды, интенсивно перемешивали
си НВЖК обосновывается тем, что она дешевле и
реакционную массу 3-4 мин, быстро выдавливали
доступнее, чем индивидуальные НВЖК, ввиду того,
в герметично закрываемую форму из полипропи-
что разделение данной смеси на компоненты требу-
лена с инертной атмосферой и оставляли на 1 сут
ет дополнительных затрат. Гидрохлорид N-этил-N′-
при 20-25°C. Образовавшуюся реакционную массу
(диметиламинопропил)карбодиимида (Sigma-Aldrich,
осторожно помещали в 800 мл водного раствора 2%-
США) после использования хранился в атмосфе-
ной CH3COOH и оставляли на ночь. После этого
ре аргона в темном месте. N-Гидроксисукцинимид
гидрогель был декантирован, промыт дистиллирован-
(Sigma-Aldrich, США). Додецилсульфат натрия,
ной водой и снова залит 800 мл 2%-ной CH3COOH.
н-C12H25OSO3Na (Sigma-Aldrich, США). Водный
Данную операцию повторяли 4-5 раз. Затем гидро-
раствор HCl (х.ч., 35% HCl; ОАО «Башкирская со-
гель выдерживали в дистиллированной воде 3 сут, по-
довая компания», г. Стерлитамак). Ацетон (ч.д.а.),
сле этого в 25%-ном водном растворе NH3 в течение
толуол (х.ч.) и циклогексан («чистый») (ЗАО
3 сут и многократно промывали дистиллированной
«Экос-1», г. Москва). CH3COOH и HCOOH (х.ч.;
водой до pH 6-7. Завершающую стадию очистки
ЗАО «Химреактив», г. Нижний Новгород). Водный
проводили обработкой дистиллированной водой в
раствор NH3 (ч.д.а., 25% NH3; ЗАО «Реактив»,
аппарате Сокслета (74-76°C, 1 сут). Перед съемкой
г. Ангарск). Фосфатно-солевой буферный раствор
ИК-спектров образцы обезвоживали сначала промыв-
(ЗАО «ЛенРеактив», г. Санкт-Петербург).
кой ацетоном, потом циклогексаном с последующим
Приборы и оборудование. ИК-спектры были по-
высушиванием в вакууме. Окончательное обезво-
лучены на спектрометре ALPHA Bruker, Германия,
живание было осуществлено азеотропной отгонкой
в таблетках с KBr. KBr был обезвожен при 600°С
воды с толуолом с последующим удалением толуола
в течение 1 сут и хранился в эксикаторе над P2O5.
в вакууме при нагревании. Степень прививки НВЖК
408
Фарион И. А. и др.
к хитозану составляла 9%. Аналогично проводили
NH2 реагируют 2 моль хлорангидрида с образованием
модификацию хитозана НВЖК при мольном соотно-
привитого линейного диациламида. Еще один пример
шении НВЖК:элементарные звенья хитозана = 1:7.
использования галоидангидридов описан в работе
Степень прививки НВЖК к хитозану составляла 4%.
[13], где для получения привитого сложного эфира
Клеточные испытания сколлапсированных ги-
хондроитин-сульфата и α-линоленовой кислоты ис-
дрогелей на основе модифицированного НВЖК хи-
пользовался хлорангидрид данной кислоты. В то же
тозана. Испытания сколлапсированных гелей моди-
время из-за чувствительности галоидангидридов к
фицированного хитозана проводили в Федеральном
влаге необходимо тщательно высушивать как моди-
государственном бюджетном учреждении «Научно-
фицируемые полисахариды, так и растворители.
исследовательский центр эпидемиологии и микро-
Циклические или линейные ангидриды дикарбо-
биологии имени почетного академика Н. Ф. Гама-
новых или монокарбоновых кислот являются аци-
леи» Министерства здравоохранения Российской
лирующими реагентами с умеренной реакционной
Федерации. In vitro исследовали устойчивость пре-
способностью и менее чувствительны к гидролизу,
бывания образцов в культуральной среде, адгезию и
чем галоидангидриды. При твердофазных реакциях в
рост на них мультипотентных стромальных клеток
условиях сдвиговых деформаций такие циклические
(МСК) костного мозга человека, in vivo определяли
ангидриды, как малеиновый, янтарный и фталевый,
их биосовместимость. Получение штаммов МСК
проявляют хорошую реакционную способность по
костного мозга человека проводили по методике,
отношению к хитозану, образуя привитые амидокис-
описанной в [20].
лоты [5]. Ввиду меньшей чувствительности к гидро-
Испытания на биосовместимость. Испытания
лизу реакции с участием циклических ангидридов
были проведены на мышах-самцах линии СВА мас-
могут быть проведены в смеси вода-органический
сой 20-22 г. Для получения МСК костного мозга
растворитель, например, в водно-метанольных средах
мышей или кроликов их усыпляли эфиром, с соблю-
даже при повышенных температурах [17]. В таких
дением правил асептики выделяли бедренные кости,
же средах были реализованы реакции ацилирования
обрезали концы и шприцем вымывали костный мозг
хитозана линейными ангидридами карбоновых кис-
во флакон с питательной средой. Дальнейшие дей-
лот, содержащими в алкильном радикале 1-5 атомов
ствия были аналогичны процедурам при получении
углерода [18], причем ацилирование проходит по
штаммов МСК костного мозга человека. С целью
аминогруппам элементарных звеньев с образованием
определения биосовместимости фрагменты скол-
только привитых амидов в отличие от вышеприве-
лапсированных гелей были трансплантированы под
денного примера с хлорагнидридами [19]. В то же
капсулу почки мышей как с адгезированными на них
время при использовании линейных ангидридов мо-
аутологичными МСК мышей, так и без клеток [21].
нокарбоновых кислот в реакцию вовлекается только
Все манипуляции проводили при соблюдении
1 моль ацильного фрагмента. К тому же циклические
правил гуманного обращения с животными в соот-
и особенно линейные ангидриды низших карбоновых
ветствии с требованиями Европейской конвенции
кислот токсичны и обладают сильным раздражаю-
по защите позвоночных животных, требованиями
щим действием.
национального руководства и руководства учрежде-
Свободные карбоновые кислоты, наоборот, имеют
ния по содержанию и использованию лабораторных
крайне низкую ацилирующую способность, особен-
животных.
но по отношению к группам OH. С группами NH2
элементарных звеньев хитозанов они образуют при-
витые аммониевые соли, которые при нагревании в
Обсуждение результатов
сочетании со сдвиговыми деформациями (механиче-
Известно большое количество способов моди-
ское воздействие) превращаются в привитые амиды
фикации хитозана карбоновыми кислотами или их
[4, 5]. При этом для нормального протекания подоб-
производными.
ной твердофазной реакции хитозана со свободными
Для исчерпывающей функционализации поли-
карбоновыми кислотами необходим значительный
сахаридов используются высокореакционные гало-
мольный избыток данных кислот по отношению к
идангидриды кислот. В частности, взаимодействие
элементарным звеньям аминополисахарида наряду
хитозана с избытком хлорангидрида гексановой кис-
с жесткими условиями реакции, которые могут вы-
лоты в среде хлороформа и в присутствии пиридина
звать деструкцию полисахаридов. Следует также
приводит к полному ацилированию всех групп OH и
обратить внимание еще на один важный момент —
NH2 элементарных звеньев [19], при этом с группой
такая высшая жирная кислота, как стеариновая, в
Прививка ненасыщенных высших жирных кислот к хитозану в водной среде
409
этих условиях вообще не образует привитых амидов
в качестве сореагента предпочтительно ввиду его
в отличие от других исследованных низших моно- и
нетоксичности.
дикарбоновых кислот [5]. Поэтому для ацилирования
С учетом вышеизложенного нами был предло-
высшими жирными кислотами в мягких условиях
жен подход к модификации высокомолекулярно-
перспективно использование распространенных в
го хитозана НВЖК в водной среде при комнатной
последнее время таких конденсирующих агентов-ак-
температуре в присутствии гидрохлорида N-этил-
тиваторов, как карбодиимиды. Карбодиимиды могут
N′-(диметиламинопропил)карбодиимида, кон-
применяться либо одни, либо в смесях с диалкилами-
денсирующего агента-активатора, совместно с
нопиридинами или N-гидроксисукцинимидом [6-12].
N-гидроксисукцинимидом по следующей схеме:
При этом использование N-гидроксисукцинимида
+
+
-
+
-
Минимальное количество солюбилизатора, HCl,
лиз макромолекул хитозана по гликозидным связям
подбиралось таким образом, чтобы было протониро-
исключен. Водные растворы низших карбоновых
вано количество групп NH2, достаточное для раство-
кислот, таких как HCOOH и CH3COOH, не исполь-
рения исходного хитозана при наличии необходимого
зовались в качестве солюбилизаторов из-за возмож-
числа свободных групп NH2, реагирующих с НВЖК.
ных конкурирующих с НВЖК реакций ацилирования
По причине связывания HCl группами NH2 хито-
групп NH2.
зана с образованием полимерной соли и проведения
При реакции хитозана с НВЖК происходит аци-
процесса при низких температурах кислотный гидро- лирование групп NH2 и как результат образование
410
Фарион И. А. и др.
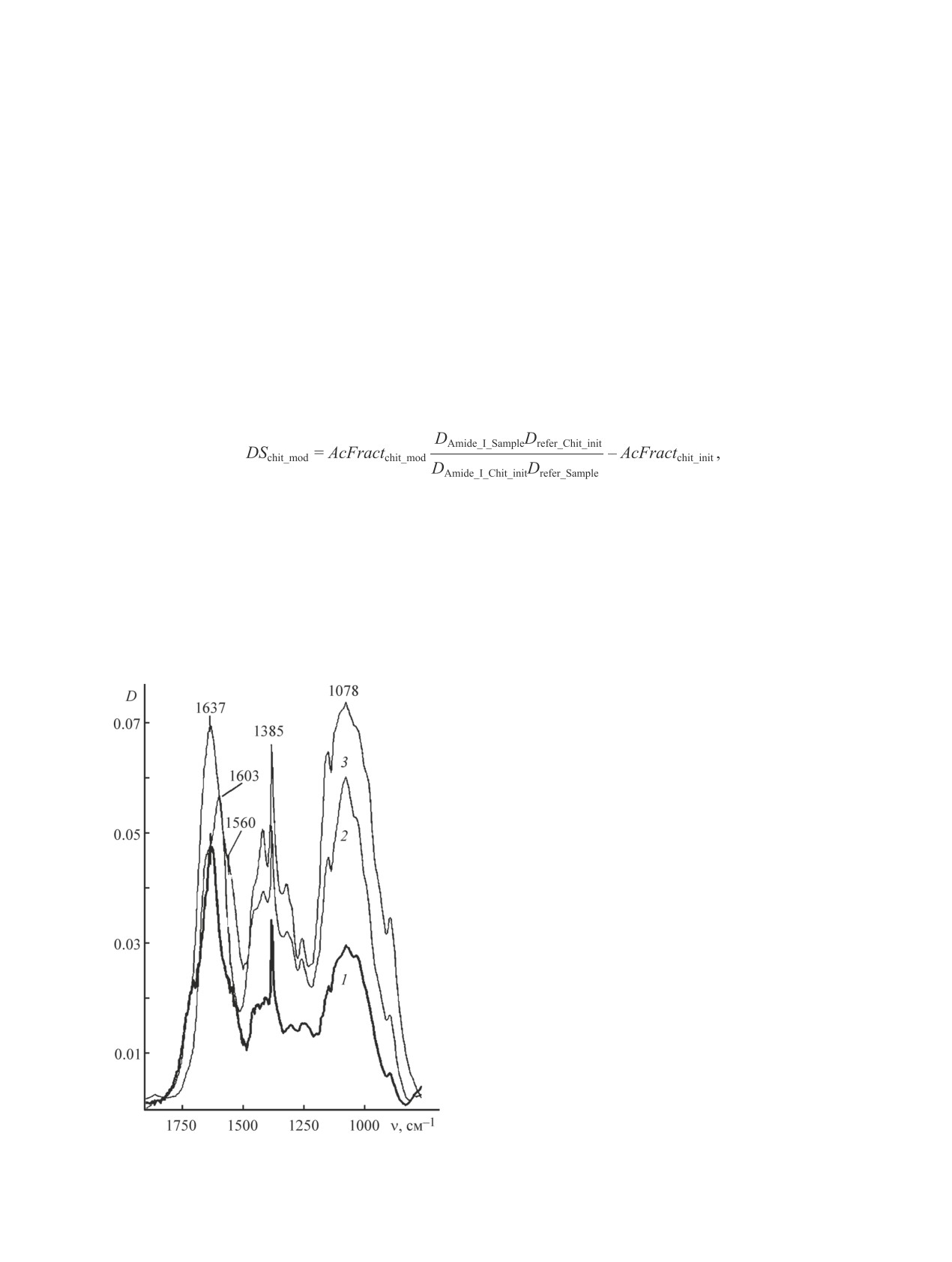
привитых амидов. Это подтверждается тем, что
в модифицированных хитозанах становится более
полоса Амид I в модифицированных образцах при
отчетливой полоса Амид II с плечом при 1560 см-1.
1637 см-1 на ИК-спектрах (рис. 1) имеет намного
Полосы деформационных колебаний связей N-H
большую оптическую плотность в максимуме по
при 1603 см-1, соответствующие остаточным (неа-
отношению к полосе при 1078 см-1 из серии харак-
цилированным) группам NH2 в модифицированных
теристических полос деформационных колебаний
образцах, не проявляются из-за перекрывания силь-
углеводного скелета в области 820-1220 см-1, а также
ной полосой Амид I. В то же время полоса группы
к характерной полосе симметричных деформацион-
NH2 при 1603 см-1 отчетливо наблюдается в спектре
ных колебаний связи C-H в CH2 при 1385 см-1 по
исходного хитозана.
сравнению с аналогичной полосой Амид I в исходном
Степень модификации привитого хитозана с уче-
хитозане, принадлежащей остаточным ацетиламид-
том доли ацетильных групп в исходном хитозане 5%
ным группам в «хитиновых» элементарных звеньях.
была рассчитана по уравнению (1), где для расчетов
Все это свидетельствует об успешном протекании
были использованы данные ИК-спектроскопии со-
процесса модификации хитозана НВЖК. Кроме того,
гласно методике [22]:
(1)
где DSchit_mod и AcFractchit_init — степень модифика-
глощения при 1078 см-1 (валентные асимметричные
ции хитозана НВЖК и доля ацетамидных групп в ис-
C-O-C глюкопиранозных циклов) модифицирован-
ходном хитозане соответственно (%); DAmide_I_Sample и
ного и исходного хитозана соответственно.
DAmide_I_Chit_init — оптические плотноcти в максиму-
Так, максимальное значение степени модифика-
ме ИК-полос поглощения при 1637 см-1 (валентные
ции 9% удается достичь при мольном соотношении
C=O, Амид-1) модифицированного и исходного хи-
НВЖК:элементарные звенья хитозана = 1:1. В то
тозана соответственно; Drefer_Sample и Drefer_Chit_init —
же время при мольном соотношении 1:7 получается
оптические плотности в максимуме ИК-полос по-
привитое производное со степенью модификации 4%.
Степени модификации 4 и 9% в достаточной мере
отличаются от теоретически возможных, таких как 14
и 100% при соотношениях 1:7 и 1:1 соответственно.
Факт образования привитых производных с мень-
шими степенями модификации можно объяснить
пространственными затруднениями, создаваемыми
длинными углеводородными фрагментами приви-
тых НВЖК и образованием гидрофобной сетки за
счет взаимодействия данных фрагментов НВЖК по
типу «жирная капля» в сильнополярной реакцион-
ной среде. По-видимому, подобные гидрофобные
сетки на поздних стадиях реакции захватывают мо-
лекулы НВЖК через углеводородные фрагменты,
препятствуя их диффузии к элементарным звеньям
хитозана.
Необходимо отметить, что наибольшая степень
модификации, достигнутая в нашем случае, сопо-
ставима с [8, 9], где прививку линоленовой кисло-
ты осуществляли к низкомолекулярному хитозану
(5-20 кДа) при очень большом, 10 и 100-кратном,
избытке N-этил-N′-(диметиламинопропил)карбо-
диимида по отношению к линоленовой кислоте в
водно-ацетоновых или водно-этанольных смесях при
60-80°С. В данных случаях большой мольный избы-
Рис. 1. ИК-спектры (в таблетках с KBr) хитозанов: со
ток N-этил-N′-(диметиламинопропил)карбодиимида
степенью модификации 9 (1), 4% (2) и исходного (3).
был необходим, по-видимому, из-за склонности его
Прививка ненасыщенных высших жирных кислот к хитозану в водной среде
411
конъюгатов с карбоновыми кислотами к различным
фрагментов с поверхности. В то же время выдержи-
побочным процессам при повышенных температурах
вание гидрогелей в 2%-ных растворах CH3COOH
и в отсутствие N-гидроксисукцинимида. Все полу-
сразу после синтеза не приводило к фрагментации
ченные привитые производные низкомолекулярных
их поверхностных слоев, поскольку образцы в этом
хитозанов были растворимы в подкисленной водной
случае не были обезвожены, что не создавало силь-
среде с образованием агрегатов-мицелл.
ных напряжений при последующем набухании.
Полученный нами продукт с наибольшей сте-
При испытании образцов сколлапсированного ге-
пенью модификации 9% не растворяется в 2%-ном
ля со степенью модификации 4% на адгезию МСК
водном растворе CH3COOH. Это, очевидно, связано
костного мозга человека и их биологическую совме-
с сильным увеличением гидрофобности макромоле-
стимость уже через несколько часов можно было
кул модифицированного НВЖК хитозана из-за нали-
наблюдать адгезированные и делящиеся клетки, а
чия боковых длинных углеводородных фрагментов
через неделю культивации наблюдался интенсивный
НВЖК, а также уменьшением количества свободных
рост клеток. После этого образцы с клетками были
аминогрупп по причине их ацилирования. Образцы
перенесены в чистые лунки с новой культуральной
с небольшими степенями модификации также не
средой и выдержаны дополнительно 1 неделю, при
растворяются, но уже способны набухать.
этом происходил процесс дополнительного роста
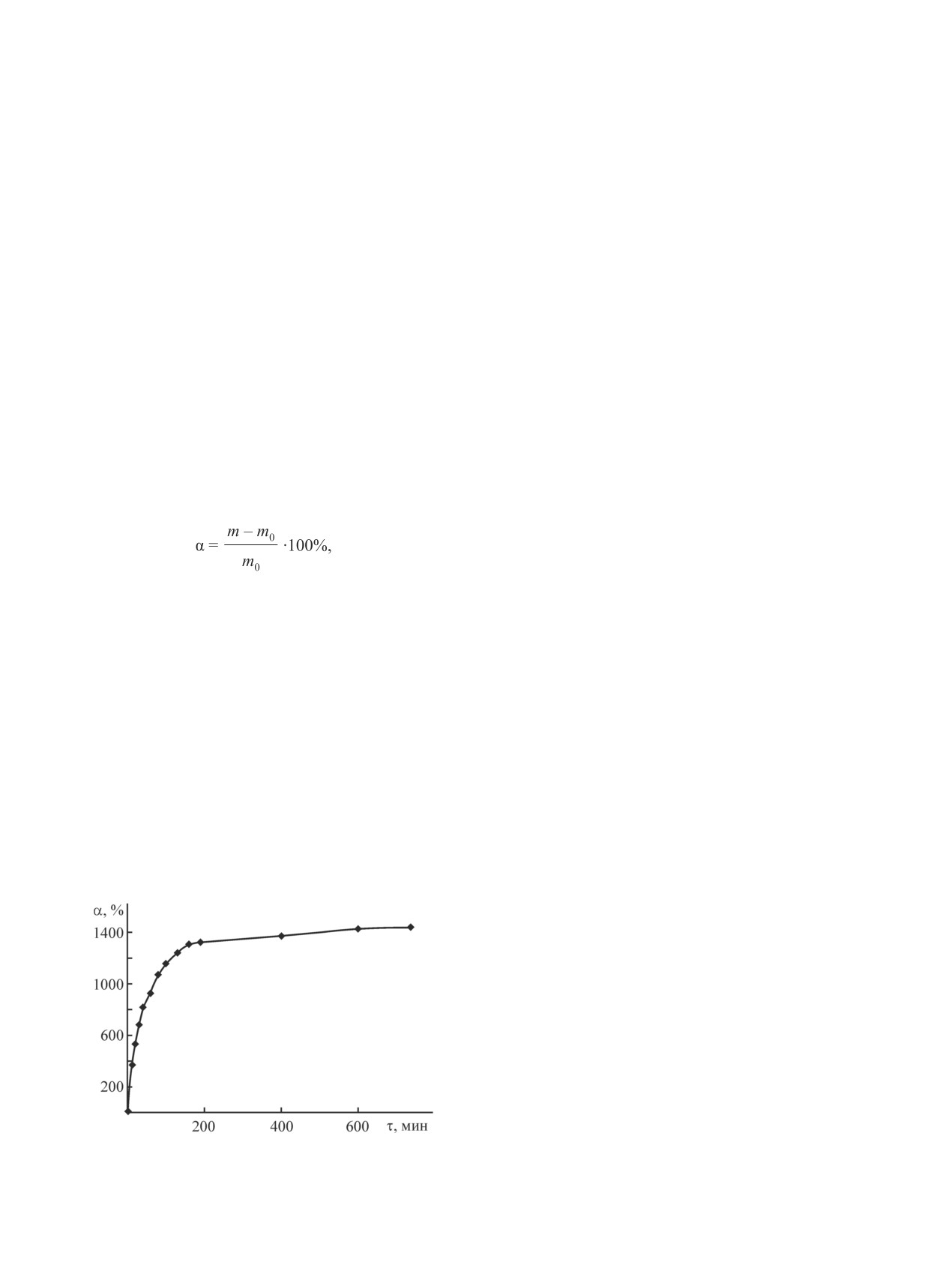
Степень набухания α образца со степенью моди-
клеток. Биосовместимость разработанных матери-
фикации 4% в 0.5%-ном водном растворе CH3COOH
алов, трансплантируемых под капсулу почки мы-
рассчитывали по уравнению
шей как с адгезированными на них аутологичными
МСК, так и без клеток, была удовлетворительной,
(2)
воспаления вокруг трансплантатов не было. В образ-
цах, содержащих МСК, наблюдалось активное депо-
нирование фосфатов кальция. Таким образом, можно
где m и m0 — массы набухшего и исходного образцов
сделать заключение о перспективности применения
соответственно (г).
модифицированных НВЖК хитозанов в регенера-
Наибольшая степень набухания при сохранении
тивной медицине в качестве биоимплантатов-скаф-
целостности в сильнонабухшем состоянии характер-
фолдов.
на для производного со степенью модификации 4%.
Кинетика набухания приведена на рис. 2, из которого
видно, что после 190 мин от начала процесса проис-
Выводы
ходит выход значения α на «плато», а максимальное
Разработан метод прививки ненасыщенных
значение α составляет 1442% после 740 мин. При ис-
высших жирных кислот к хитозану в присутствии
пользовании 1-4%-ных водных растворов CH3COOH
конденсирующей системы — гидрохлорид N-этил-
происходило разрушение образца, вероятно, из-за
N′-(диметиламинопропил)карбодиимида/N-гидрок-
более высокой скорости набухания поверхностных
сисукцинимид. Привитые амиды с максимальной
слоев по сравнению с внутренними, что приводило к
степенью прививки 9% нерастворимы и не набухают
сильным напряжениям и как следствие к отслаиванию
в подкисленных водных средах, тогда как образцы с
небольшой степенью прививки 4% способны образо-
вывать гидрогели со степенью набухания 1442%, об-
ладающие хорошей биологической совместимостью
и адгезией к ним мультипотентных стромальных кле-
ток костного мозга человека.
Финансирование работы
Работа выполнена при поддержке гранта
Российского научного фонда № 16-15-00042 (синтез
и биологические испытания полученных привитых
производных хитозана) и в рамках государственного
задания Байкальского института природопользования
СО РАН (определение степеней модификации и набу-
Рис. 2. Кинетика набухания гидрогеля со степенью мо-
хания производных хитозана).
дификации 4% в 0.5%-ном водном растворе CH3COOH.
412
Фарион И. А. и др.
Конфликт интересов
during solid-phase synthesis // Polym. Sci. Ser. B.
2011. V. 53. N 5-6. P. 358-370.
Авторы заявляют об отсутствии конфликта инте-
ресов, требующего раскрытия в данной статье.
[5] Rogovina S. Z., Vikhoreva G. A., Akopova T. A.,
Gorbacheva I. N., Zelenetskii S. N. Reactions of
chitosan with solid carbonyl-containing compounds
Информация об авторах
under shearing deformation conditions // Mend.
Фарион Иван Александрович, к.х.н., ORCID:
Comm. 1998. V. 8. N 3. P. 107-109. https://
doi.org/10.1070/MC1998v008n03ABEH000923
Бурдуковский Виталий Федорович, д.х.н., ORCID:
[6] Riva R., Ragelle H., Rieux A., Duhem N., Jérôme C.,
Préat V. Chitosan and chitosan derivatives in drug
delivery and tissue engineering // Adv. Polym. Sci.
Холхоев Бато Чингисович, к.х.н., ORCID: https://
2011. V. 244. P. 19-44.
orcid.org/0000-0002-5963-1099
Тимашев Петр Сергеевич, д.х.н., ORCID: https://
[7] Du Y.-Z., Lu P., Zhou J.-P., Yuan H., Hu F.-Q. Stearic
orcid.org/0000-0001-7773-2435
acid grafted chitosan oligosaccharide micelle as a
Бардакова Ксения Николаевна, ORCID: https://
promising vector for gene delivery system: Factors
orcid.org/0000-0002-3942-5706
affecting the complexation // Int. J. Pharm. 2010.
Герасимов Юрий Викторович, к.б.н., ORCID:
V. 391. P. 260-266.
Грошева Алла Германовна, к.б.н., ORCID: https://
[8] Du Y.-Z., Wang L., Yuan H., Hu F/-Q. Linoleic
orcid.org/0000-0002-0951-5380
acid grafted chitosan oligosaccharide micelles for
Воробьева Наталия Николаевна, ORCID: https://
intracellular drug delivery and reverse drug resistance
orcid.org/0000-0001-6698-1460;
of tumor cells // Int. J. Biol. Macromol. 2011. V. 48.
Чайлахян Рубен Карпович, д.м.н., ORCID: https://
P. 215-222.
orcid.org/0000-0002-4005-9790
[9] Du Y.-Z., Wang L., Yuan H., Wei X.-H., Hu F.-Q.
Preparation and characteristics of linoleic acid-
Список литературы
grafted chitosan oligosaccharide micelles as a carrier
[1] Costa-Pinto A. R., Reis R. L., Neves N. M. Scaffolds
for doxorubicin // Coll. Surf. B: Biointerfaces. 2009.
based bone tissue engineering: The role of chitosan //
V. 69. P. 257-263.
Tissue Eng.: Part B. 2011. V. 17. N 5. P. 331-347.
[10] Ye Y.-Q., Yang F.-L., Hu F.-Q., Du Y.-Z., Yuan H.,
[2] Mathews S., Gupta P. K., Bhonde R., Totey S.
Yu H.-Y. Core-modified chitosan-based polymeric
Chitosan enhances mineralization during osteoblast
micelles for controlled release of doxorubicin // Int. J.
differentiation of human bone marrow-derived
Pharm. 2008. V. 352. P. 294-301.
mesenchymal stem cells, by upregulating the associated
genes. // Cell Prolif. 2011. V. 44. P. 537-549. https://
[11] Li Q., Du Y.-Z., Yuan H., Zhang X.-G., Miao J.,
doi.org/10.1111/j.1365-2184.2011.00788.x
Cui F. D., Hu F.-Q. Synthesis of lamivudine stearate
[3] Oh J., Kim K., Won S. W., Cha C., Gaharwar A. K.,
and antiviral activity of stearic acid-g-chitosan
Selimović Š., Bae H., Lee K. H., Lee D. H., Lee S.-H.,
oligosaccharide polymeric micelles delivery system //
Khademhosseini A. Microfluidic fabrication of cell
Eur. J. Pharm. Sci. 2010. V. 41. P. 498-507.
adhesive chitosan microtubes // Biomed. Microdevices.
2013. V. 15. P. 465-472.
[12] Hu F.-Q., Wu X.-L., Du Y.-Z., You J., Yuan H. Cellular
uptake and cytotoxicity of shell crosslinked stearic
[4] Демина Т. С., Акопова Т. А., Владимиров Л. В.,
acid-grafted chitosan oligosaccharide micelles
Щеголихин А. Н., Кечекьян А. С., Перов Н. С.,
encapsulating doxorubicin // Eur. J. Pharm. Biopharm.
Чернышенко А. О., Зеленецкий А. Н. Исследование
2008. V. 69. P. 117-125.
взаимодействия хитозана и 2,2-бис-(гидрокси-
метил)пропионовой кислоты в условиях твердо-
[13] Xiao Y., Li P., Cheng Y., Zhang X., Sheng J., Wang D.,
фазного синтеза // Высокомолекуляр. соедине-
Li J., Zhang Q., Zhong C., Cao R., Wang F. Enhancing
ния. 2011. Т. 53Б. № 6. С. 995-1008 [Demina T. S.,
the intestinal absorption of low molecular weight
Akopova T. A., Vladimirov L. V., Shchegolikhin A. N.,
chondroitin sulfate by conjugation with α-linolenic
Kechek′yan A. S., Perov N. S., Chernyshenko A. O.,
acid and the transport mechanism of the conjugates //
Zelenetskii A. N. The study of the interaction between
Int. J. Pharm. 2014. V. 465. P. 143-158.
chitosan and 2,2-bis(hydroxymethyl)propionic acid
Прививка ненасыщенных высших жирных кислот к хитозану в водной среде
413
[14]
Collins M. N., Birkinshaw C. Hyaluronic acid based
Грошева А. Г., Куралесова А. И., Москвина И. Л.,
scaffolds for tissue engineering — A review //
Баграташвили В. Н. Активация мультипотентных
Carbohydr. Polym. 2013. V. 92. P. 1262-1279. https://
стромальных клеток костного мозга лазерным и
doi.org/10.1016/j.carbpol.2012.10.028
КВЧ-излучением и их сочетанным воздействием //
[15]
Mutasher S. H., Salih A. A., Al-Lami H. S. Preparation
Современные технологии в медицине. 2017. Т. 9.
of some chitosan derivatives and study their effect on
№ 1. C. 28-37.
human genetic material // Der Pharma Chemica. 2016.
V. 8. N 11. P. 125-134.
[21] Chaikhalyan R. K., Yusupov V. I., Gorskaya Yu. F.,
Kuralesova A. I., Gerasimov Yu. V., Sviridov A. P.,
[16]
Sridhari T. R., Dutta P. K. Synthesis and
Tambiev A. Kh., Vorob′eva N. N., Grosheva A. G.,
characterization of maleilated chitosan for dye house
Shishkova V. V., Moskvina I. L., Bagratashvili V. N.
effluent // Indian J. Chem. Technol. 2000. V. 7.
Effects of acoustic and EHF impulses on multipotent
P. 198-201.
stromal cells during formation of bone marrow
[17]
Tikhonov V. E., Stepnova E. A., Babak V. G.,
containing heterotopic organs in tissue engineered
Krayukhina M. A., Berezin B. B., Yamskov I. A.
constructions // Bull. Exp. Biol. Med. 2015. V. 158.
Amphiphilic N-[2(3)-(dodec-2′-en-1′-yl)succinoyl]-
N 5. P. 688-691.
chitosan: Synthesis and properties // React. &
Funct. Polym.
[22] Богомолова Т. Б., Козлова Н. В., Чвалун С. Н.
doi.org/10.1016/j.reactfunctpolym.2007.11.002
Модификация хитозана прививкой гликолевой
[18]
Lee K. Y., Ha W. Sh., Park W. H. Blood compatibility
кислоты с ее последующей поликонденсацией в
and biodegradability of partially N-acylated chitosan
процессе термообработки // Высокомолекуляр.
derivatives. // Biomaterials. 1995. V. 16. P. 1211-1216.
соединения. 2009. Т. 51Б. № 9. С. 1695-1703
[Bogomolova T. S., Kozlova N. V., Chvalun S. N.
[19]
Neamnark A., Rujiravanit R., Supaphol P.
Modification of chitosan via grafting of glycolic acid
Electrospinning of hexanoyl chitosan // Carbohyd.
followed by polycondensation during heat treatment //
Polym. 2006. V. 66. P. 298-305.
Polym. Sci. Ser. B. 2009. V. 51. N 9-10. P. 352-359.
[20]
Чайлахян Р. К., Герасимов Ю. В., Юсупов В. И.,
Свиридов А. П., Тамбиев А. Х., Воробьева Н. Н.,