852
Сударева Н. Н. и др.
Журнал прикладной химии. 2020. Т. 93. Вып. 6
УДК 66.021.081.3-66.091.1
ВЛИЯНИЕ РЕОЛОГИЧЕСКИХ ХАРАКТЕРИСТИК
ПОЛИМЕРОВ ОБОЛОЧКИ КАРБОНАТНО-КАЛЬЦИЕВЫХ ЯДЕР
НА СТРУКТУРУ И ФУНКЦИИ ПЕРОРАЛЬНЫХ СИСТЕМ ДОСТАВКИ
© Н. Н. Сударева, В. Ю. Елоховский, Н. Н. Сапрыкина
Институт высокомолекулярных соединений РАН,
199004, г. Санкт-Петербург, 9-я линия В.О., д. 31
E-mail: nnsas@mail.ru
Поступила в Редакцию 7 июля 2019 г.
После доработки 12 февраля 2019 г.
Принята к публикации 21 февраля 2020 г.
Исследованы реологические характеристики смесей полимеров, используемых в качестве многослой-
ных полиэлектролитных оболочек на карбонатных ядрах — системах доставки лекарственных сое-
динений. Показано, что структура оболочек определяется прежде всего первым полимерным слоем,
его избыточным зарядом, концентрацией и ионным окружением. Корректность интерпретации
вискозиметрических данных подтверждена данными сканирующей электронной микроскопии кар-
бонатных ядер с полимерными оболочками, сформированными в различных условиях. Молекулярная
масса полимеров влияет на профили высвобождения терапевтического белка, инкапсулированного в
системы доставки, в жидкости, моделирующие желудочно-кишечные среды.
Ключевые слова: пероральные системы доставки; карбонатно-кальциевые ядра; полиэлектролитные
оболочки; реологические характеристики
DOI: 10.31857/S0044461820060110
Системы доставки лекарственных препаратов на-
меламин-формальдегидных частицах методом по-
ходят все более широкое применение в медицине.
следовательного нанесения слоев полиэлектролитов
Их использование предполагает увеличение стабиль-
с избыточными зарядами разных знаков (методом по-
ности инкапсулированных лекарственных средств,
лиэлектролитной сборки) [4]. Пористые карбонатные
уменьшение их дозы и токсичности, продление
ядра — СаСО3 предложены в качестве «жертвенных»
воздействия на организм. Важную роль в усвоении
матриц еще в 2004 г. [5]. Их с успехом используют
лекарственных препаратов играет взаимодействие
для доставки лекарственных средств до сих пор [2,
носителей с тканями-мишенями, которое определя-
6-8]. Пористые ватериты — одна из полиморфных
ется структурными, в частности, поверхностными
модификаций СаСО3 — представляют собой сфери-
характеристиками систем доставки. Следовательно,
ческие композиции из гексагональных кристаллов
умение управлять поверхностными свойствами но-
с диаметром сфер от 0.05 до 5 мкм. Обычно после
сителей и их функциональными характеристиками
нанесения полиэлектролитных оболочек карбонатные
должно приводить к повышению эффективности
ядра растворяют в кислой среде или при помощи
использования систем доставки. Системы на базе
ЭДТА, формируя системы доставки в виде капсул,
частиц с лекарственными средствами, покрытых по-
содержащих лекарственные препараты.
лиэлектролитными оболочками, обладают наиболь-
Одна из целей использования систем доставки —
шей вариативностью. Они позволяют включать в
пролонгирование высвобождения инкапсулированно-
состав конструкции различные вещества, в том числе
го лекарственного средства. Следовательно, сохране-
ингибиторы протеаз [1-3], а также изменять поверх-
ние пористой структуры ядер должно способствовать
ностные характеристики систем доставки. Впервые
торможению диффузии лекарственного средства в
подобные структуры, состоящие из полиэлектролит-
организме и увеличивать время его воздействия.
ных слоев, были сформированы на микрометровых
Именно пористые ватериты СаСО3 использованы в
Влияние реологических характеристик полимеров оболочки карбонатно-кальциевых ядер...
853
данной работе в качестве ядер, которые покрывают
ковязкого медицинского назначения производства
полиэлектролитными оболочками. Эти структуры
Архангельского водорослевого комбината и высо-
предназначены для пероральной доставки лекар-
ковязкого фирмы Sigma-Aldrich) и полиамфолита —
ственных препаратов, т. е. они должны защищать ин-
желатина кислотной обработки (тип А, Rousselot
капсулированное соединение от воздействия кислой
SAS, Франция) и щелочной обработки (тип В, ОАО
среды желудка и высвобождать его в щелочной среде
Можелит, Беларусь). Их характеристики и условия
кишечника, способствуя проникновению в кровь. Для
определения молекулярной массы приведены в таб-
создания пероральных систем доставки на СаСО3
лице.
ядрах формировали оболочки из биосовместимых,
Гидродинамические параметры и наличие ком-
биодеградируемых, неиммуногенных и дешевых по-
плексообразования в растворах смесей полимеров
лимеров натурального происхождения — альгината
определяли с использованием капиллярного ви-
и желатина [9]. pH-Зависимый полианион альгинат
скозиметра и реометра. При помощи капиллярного
давно и широко используют в качестве компонента
вискозиметра Уббелоде определяли вязкость: спе-
систем пероральной доставки [10-12]. В кислой среде
цифическую ηсп = ηсмеси/ηжел или относительную
желудка он нерастворим, следовательно, защищает
ηотн = ηальг/ηNaCl. Вискозиметр имел следующие раз-
инкапсулированные препараты, а в щелочной сре-
меры: длина и толщина капилляра были равны 20 см
де кишечника набухает и постепенно растворяется,
и 0.2 мм соответственно, объем шарика равнялся
высвобождая их. Актуальные примеры использова-
3 мл. Реометр Physica MCR301 (Anton Paar, Австрия)
ния альгината и желатина в качестве компонентов
позволяет определять реологические характеристики
систем доставки синоменина (препарата для лечения
полимерных растворов в широком диапазоне скоро-
артрита) и артемизинина (его открытие удостоено
стей сдвига. В двойном коаксиально-цилиндрическом
Нобелевской премии в 2015 г.) приведены в работах
измерительном узле DG26.7-SN4044 реализуется
[13, 14]. В большинстве случаев полиэлектролитная
скорость сдвига ( ) в диапазоне 0.001-10 000 с-1.
сборка происходит согласно базовой методике [5] c
Измерения на обоих устройствах проводили при тер-
использованием растворов равных концентраций по-
мостатировании растворов, Т = 20°С.
лимеров близкой молекулярной массы. Возможность
Синтез пористых СаСО3 ядер проводили согласно
варьирования интенсивности полиэлектролитных
методике [5], модифицированной в [15]. Cливали 1 М
взаимодействий при изменении соотношения компо-
растворы Na2CO3 и CaCl2·2H2O и интенсивно пере-
нентов ранее не рассматривалась.
мешивали в течение 30 с. После 15 мин созревания
Цель настоящей работы — исследование влияния
суспензии полученные ядра промывали и сушили
характеристик полиэлектролитов и их взаимодей-
согласно вышеупомянутой методике. Формирование
ствия в процессе формирования на СаСО3 ядрах по-
на СаСО3 ядрах многослойных полиэлектролитных
лиэлектролитных оболочек на структурные и функ-
оболочек проводили согласно [5], варьируя концен-
циональные свойства систем доставки лекарственных
трации растворов полиэлектролитов (2 или 5 мг·мл-1
средств.
в воде или в растворе NaCl концентрацией 0.2 или
0.5 моль·л-1). Перемешивание суспензий СаСО3 ядер
в растворах полиэлектролитов сначала осуществляли
Экспериментальная часть
в течение 1 мин в ультразвуковой ванне при частоте
В работе использовали соли NaCl, Na2CO3,
35 кГц (Fritsch GMBH, Idar-Oberstein, Германия), за-
CaCl2·2H2O (все — ч.д.а.; Sigma-Aldrich), промыш-
тем 10 мин на программируемом ротаторе-миксере
ленные образцы полианиона — альгината Na (низ-
MultiBio RS-24 (ООО BioSan, Латвия). Промывку и
Характеристики использованных полимеров
Характеристики использованных полимеров
Полимер
Изоточка pI
Mпик, кДa
условия хроматографии
Желатин A
7.7-9.0
355
Sephadex G-200, 0.15 M NaCl
Желатин B
5.0
330
Sephadex G-200, 0.15 M NaCl
Альгинат Na низковязкий
—
360
PolySep GFC Linear (1-10000 кДa), элюент: 0.04 М трифтор-
ацетат натрия + 0.05% NaN3, V = 0.25 мл·мин-1, Т = 50°С,
Альгинат Na высок
овязкий
—
1300
колонка: 7.8 × 300 мм + 7.8 × 50 мм
854
Сударева Н. Н. и др.
сушку осуществляли по указанной в [5] методике.
определяли концентрацию белка в надосадочной
Для получения полиэлектролитных оболочек разной
жидкости (спектрофотометрически с использовани-
структуры наносили растворы полимеров в разной
ем калибровки в соответствующей среде).
последовательности и с разными концентрациями.
Кроме того, использовали растворы альгината раз-
Обсуждение результатов
личных молекулярных масс — как низкой, так и вы-
сокой вязкости.
Назначение полиэлектролитных капсул в качестве
Наличие полимерной оболочки на СаСО3 ядрах и
систем доставки — замедленное высвобождение ин-
структуру ее поверхности визуализировали с помо-
капсулированных лекарственных веществ через поры
щью сканирующей электронной микроскопии. Для
оболочек. Структура получаемых полиэлектролитных
получения микрофотографий использовали скани-
оболочек зависит от характеристик используемых по-
рующий электронный микроскоп Supra 55VP (Carl
лиэлектролитов и их взаимодействия в процессе по-
Zeiss, Германия). Атомный состав образцов опре-
лиэлектролитной сборки и, следовательно, коррели-
деляли при помощи приставки для энергодисперси-
рует с реологическими свойствами смеси полимеров.
онной спектроскопии, используя X-Max 80 детек-
Для оценки реологического поведения смесей
тор (Oxford Instruments, Великобритания). Данные
полианиона — альгината Na и полиамфолитов —
атомного состава усредняли по 6-8 измерениям.
желатина А (рI 8) или желатина В (pI 5) разного со-
Среднеквадратичная погрешность 15%.
става в водных растворах различной ионной силы
Временные профили высвобождения терапевти-
выбраны две скорости сдвига
= 0.63 и
= 630 с-1.
ческих белков из карбонатных ядер, покрытых тремя
В ходе формирования полиэлектролитной оболочки
парами слоев альгинат Na-желатин А, определяли в
на СаСО3 ядрах взаимодействие макромолекул про-
средах, моделирующих состав желудка (0.1 M HCl)
исходит в условиях движения раствора одного по-
и кишечника (0.07 М Na-фосфатный буферный раст-
лимера около СаСО3 ядер, чья поверхность покрыта
вор, NаФБ, рН 7.9). Использовали белки: антиок-
вторым полимером. Скорость сдвига определяется
сидант супероксиддисмутаза (молекулярная масса
диаметром вращения платформы ротатора и скоро-
32 кДа) и антагонист рецептора интерлейкина (моле-
стью его вращения. Она равна примерно 0.63 с-1.
кулярная масса 15-18 кДа), оба получены из Научно-
Параметры использованного капиллярного вискози-
исследовательского института особо чистых биопре-
метра Уббелоде обеспечивают скорость сдвига, рав-
паратов, Санкт-Петербург, Россия. Инкубирование
ную 630 с-1. Реометр позволяет определять вязкость
систем доставки в модельной среде желудка при
растворов при обеих скоростях сдвига.
Т = 37°С и постоянном перемешивании длилось 2 ч,
Зависимости вязкости смесей водных растворов
в модельной среде кишечника системы доставки на-
желатина А и альгината Na, а также желатина В и
ходились при тех же условиях в течение 5 ч. Через
альгината Na от состава смеси (доли желатина в
1-2 ч инкубирования пробы центрифугировали и
смеси с альгинатом Na) при разных скоростях сдви-
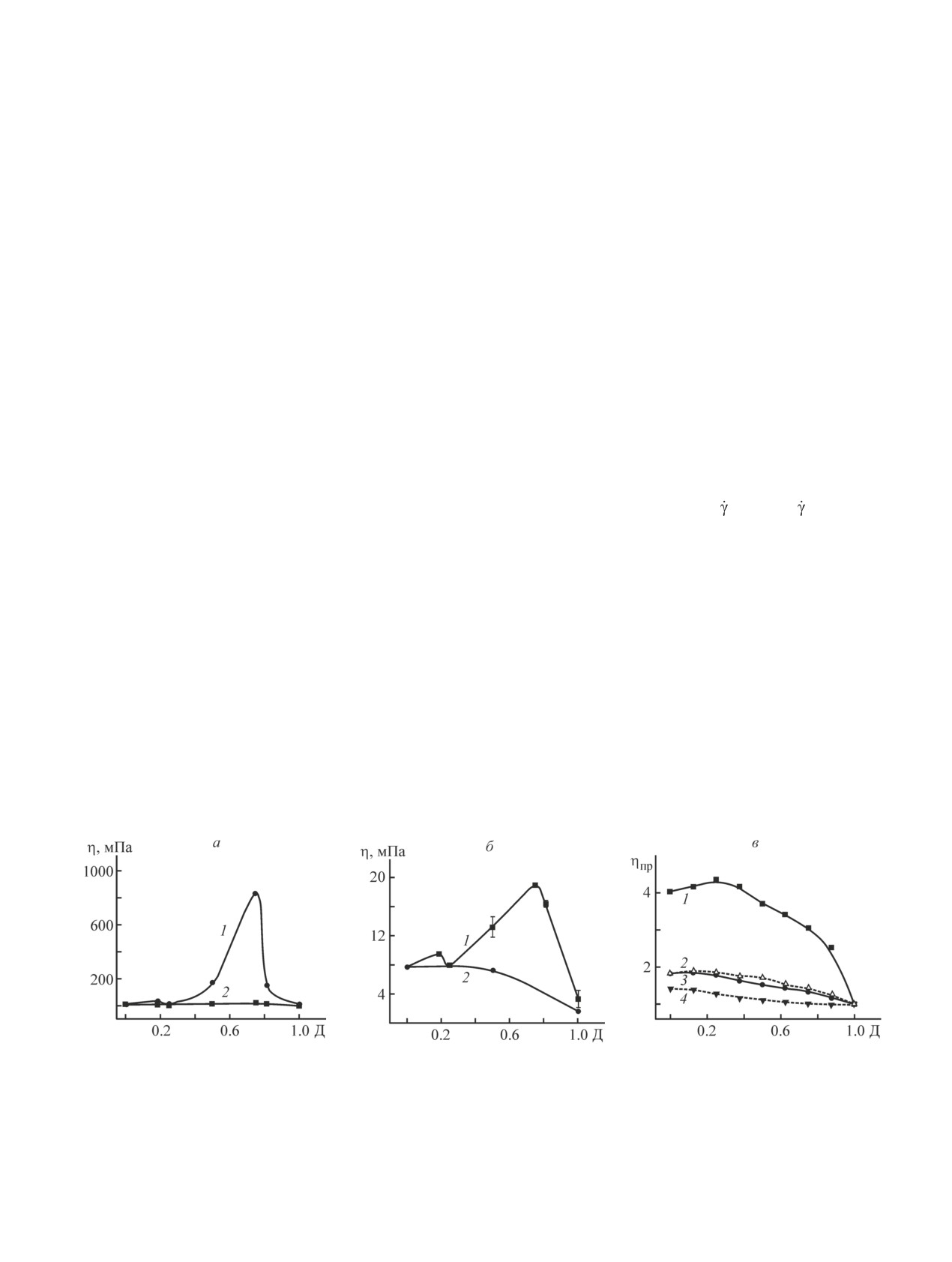
Рис. 1. Зависимости вязкости (а, б) смесей растворов желатин А/альгинат Na (1) и желатин В/альгинат Na (2) и
приведенной вязкости (ηпр = ηсмеси/ηЖел В) (в) смесей растворов желатин В/альгинат Na от доли желатина в смеси
с альгинатом Na (Д).
Суммарная концентрация полимеров 5 мг·мл-1.
Скорость сдвига (с-1): 0.63 (а), 630 (б, в).
Реометр (а, б), капиллярный вискозиметр (в).
Растворы в Н2О (а-в, кривые 1), растворы в NaCl (в) концентрацией 0.5 (2), 0.2 (3) и 1 моль·л-1 (4).
Влияние реологических характеристик полимеров оболочки карбонатно-кальциевых ядер...
855
га характеризуют интенсивность взаимодействия
полимеров в смесях (рис. 1). Увеличение вязкости
свидетельствует об увеличении взаимодействия поли-
меров. Наибольшая вязкость проявляется для смеси,
содержащей 75% желатина А и 25% альгината Na при
скорости сдвига
= 0.63 с-1, т. е. в условиях, близких
к условиям процесса формирования полиэлектро-
литной оболочки (рис. 1, а, кривая 1). При таком
же составе смеси, но при высоких скоростях сдвига
наблюдаем меньшую интенсивность взаимодействия
(рис. 1, б, кривая 1). Желатин А, имеющий изоточку
при рН 8, имеет в нейтральной среде избыточный
положительный заряд, что является причиной взаи-
модействия его с полианионом альгинатом Na.
Желатин В в нейтральной среде не взаимодейству-
ет с молекулами альгината Na, так как имеет избыточ-
ный отрицательный заряд (рI 5). Изменение вязкости
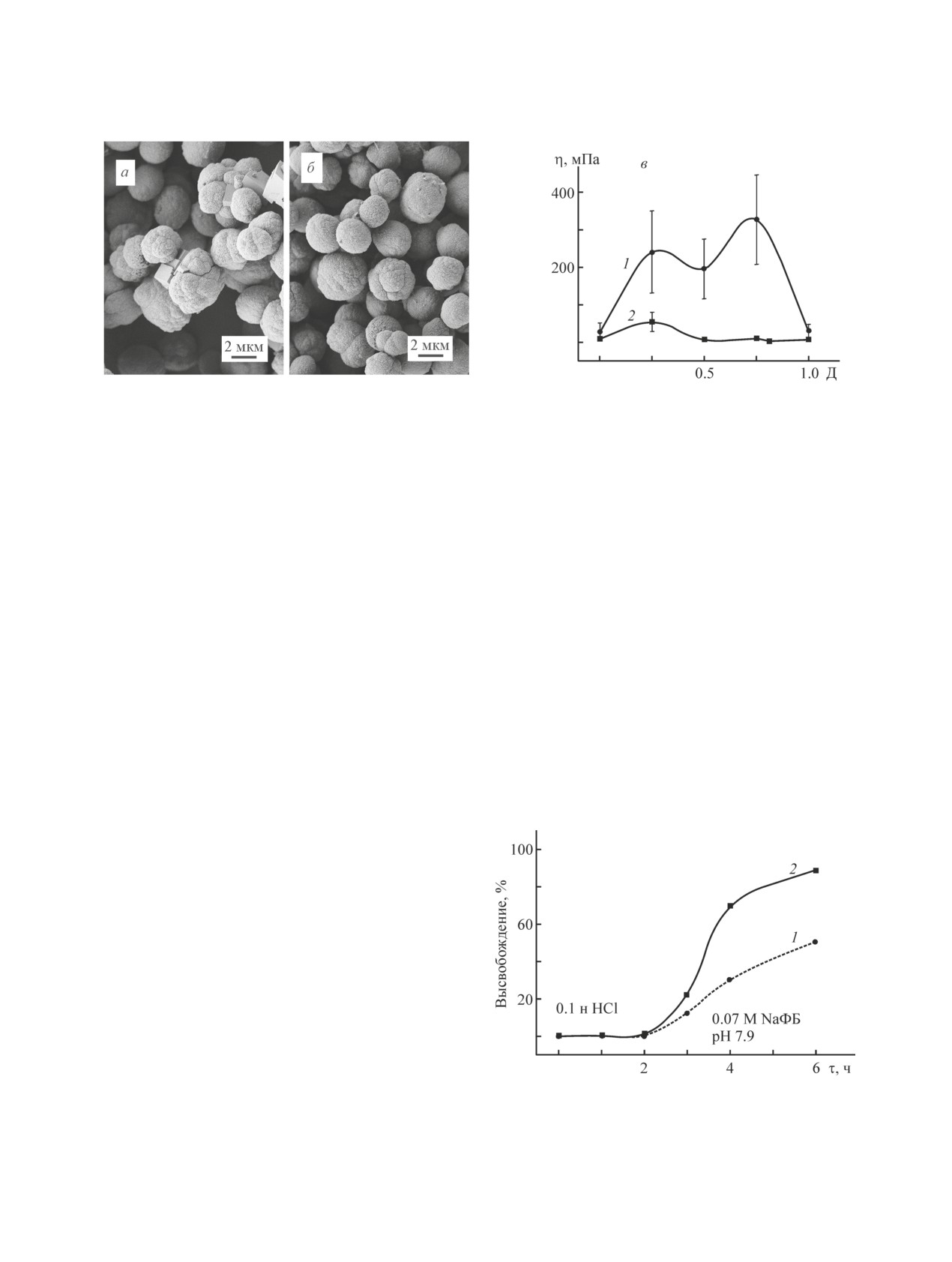
Рис. 2. CaCO3 ядра, покрытые 5 парами слоев
смеси при изменении ее состава происходит плавно.
альгинат Na/желатин А = 1/3 (а) и альгинат
Профили вязкостных зависимостей для смесей рас-
Na/желатин А = 3/1 (б).
творов желатина В и альгината Nа, полученных как
Водные растворы, суммарная концентрация полимеров
2 мг·мл-1.
на капиллярном вискозиметре (рис. 1, в), так и на
реометре при обеих скоростях сдвига (рис. 1, а, б,
кривые 2), подтверждают это наблюдение.
щий следующий слой поликатиона (при нейтральном
Обнаруженное при помощи реологических ис-
значении рН), взаимодействует с альгинатом Na даже
следований взаимодействие молекул альгината Na
внутри пор. Описанные особенности взаимодействия
и желатина А проявляет себя при формировании по-
полиэлектролитов на поверхности СаСО3 ядер под-
лиэлектролитных оболочек на СаСО3 ядрах. В ра-
тверждены видом полиэлектролитных оболочек кар-
боте [16] был определен ζ-потенциал карбонатных
бонатных ядер на микрофотографиях (рис. 2).
ядер, который равен 0 при рН 8.5. В нейтральной
Поведение смеси полиэлектролитов желатина В и
среде ядра имеют избыточный положительный заряд,
альгината Na при повышении ионной силы растворов
поэтому для формирования первого слоя полиэлек-
наблюдали в капиллярном вискозиметре при больших
тролитной оболочки был использован полианион
скоростях сдвига ( = 630 с-1), сравнивая зависимости
альгинат Na.
относительной вязкости смесей от состава смесей
При соотношении концентраций полиэлектроли-
(рис. 1, в). Более интенсивное экранирование заря-
тов альгината Na и желатина А, равном 1/3, исполь-
дов на молекулах полиэлектролитов при увеличении
зованных для формирования оболочки, концентра-
ионной силы растворов приводит к ослаблению взаи-
ция первого слоя (полианиона альгината Na) мала,
модействия молекул и, следовательно, к уменьшению
полимер не полностью покрывает поверхность ядер.
вязкости смеси. Закономерность немного (в пределах
Полимер второго слоя желатин A (pI 8) при значе-
погрешности) нарушается в растворах солей 0.5 и
нии рН 6 имеет положительный избыточный заряд
0.2 М (рис. 1, в, кривые 2, 3).
и поэтому не склонен взаимодействовать с пористой
При малых скоростях сдвига (реометр,
= 0.63 с-1)
поверхностью карбонатных ядер, несущих также из-
в области концентрации NaCl 0.2 моль·л-1 проявля-
быточный положительный заряд. Желатин А взаимо-
ются минимальные (по сравнению с растворами в
действует только с имеющимся на поверхности ядер
воде и в 0.5 М растворе NaCl) различия вязкостных
альгинатом Na. В дальнейшем на поверхности фор-
характеристик смесей желатина А и альгината Na раз-
мируется плотная оболочка, не проникающая в ядра.
ного состава, что следует из приведенных на рис. 3, а
Во втором случае при соотношении концентраций
данных. В методике формирования полиэлектролит-
альгинат Na/желатин А = 3/1 количество альгината Na
ных оболочек на СаСО3 ядрах, предложенной автора-
у поверхности ядер больше, что позволяет молекулам
ми [5], последовательное нанесение слоев проводят
полианиона полностью покрыть поверхность ядра и
из растворов полиэлектролитов в 0.2 М NaCl. Как по-
даже проникнуть в поры. Следовательно, заряд по-
казывают полученные нами данные, такая ионная си-
верхности ядер экранирован. Желатин A, формирую-
ла раствора обеспечивает наибольшую стабильность
856
Сударева Н. Н. и др.
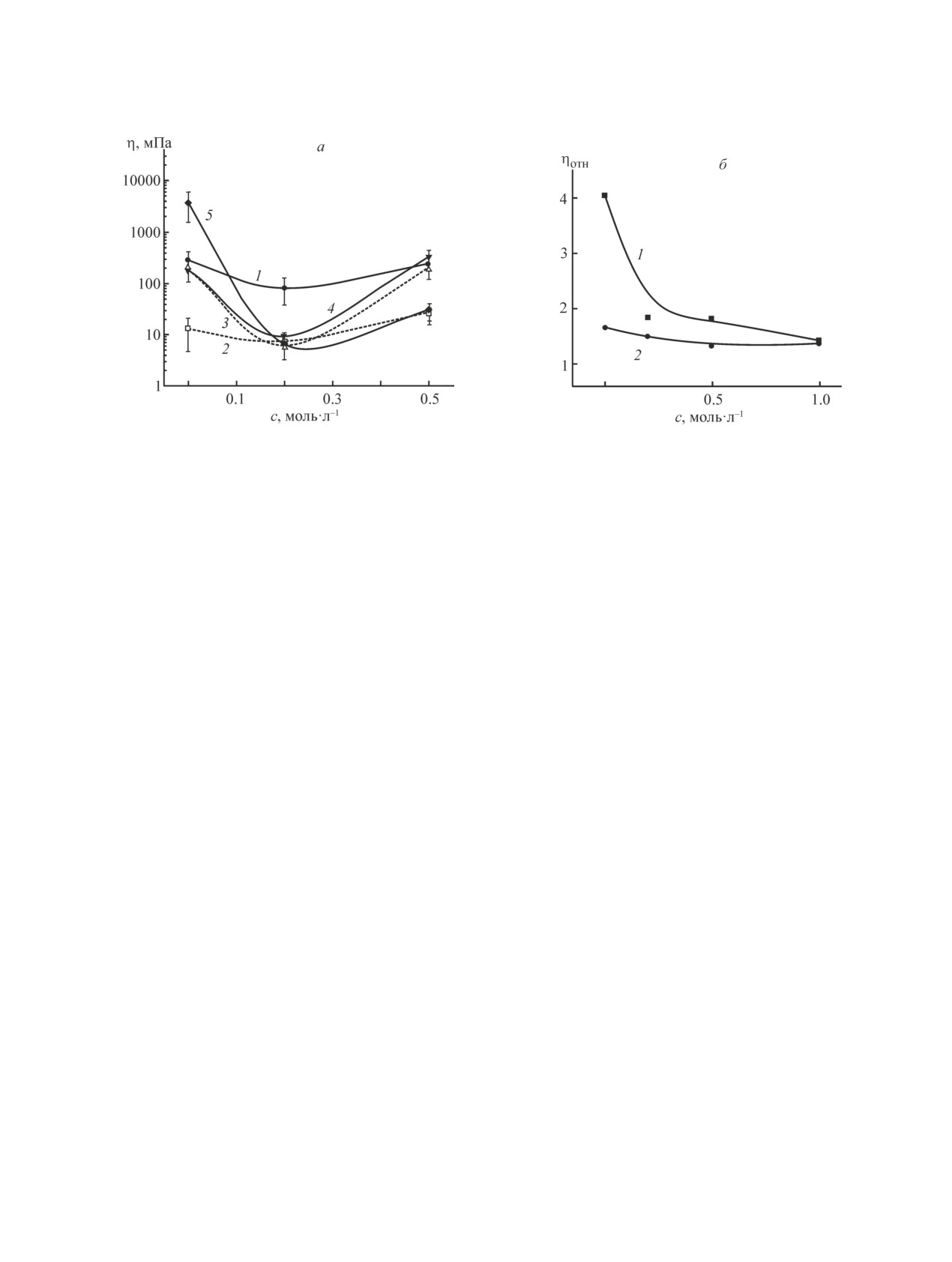
Рис. 3. Зависимость вязкости смесей желатина А и альгината Na разного состава (а) и относительной вязкости
(ηотн =ηальг/ηNaCl) растворов альгината Na (б) от концентрации NaCl.
а) Реометр, скорость сдвига 0.63 с-1.
Доля желатина А в смеси с альгинатом Na: 1 — 0.0, 2 — 0.25, 3 — 0.50, 4 — 0.75, 5 — 1.0.
Суммарная концентрация полимеров 2 мг·мл-1.
б) Вискозиметр, скорость сдвига 630 с-1.
Концентрация альгината Na (мг·мл-1): 1 — 5, 2 — 2.
структуры комплекса при возможных отклонениях в
силы окружающей среды вследствие экранирования
концентрациях растворов полиэлектролитов.
зарядов на поверхности белка (определяющих его
Зависимости вязкости полианиона альгината Na
нативную глобулярную конформацию) молекула же-
от концентрации NaCl (рис. 3, б) свидетельствуют
латина трансформируется таким образом, что взаи-
о естественном увеличении вязкости растворов по-
модействие с молекулами альгината Na усиливается.
лимеров при увеличении их концентрации. Влияние
Как было показано выше, большую роль в форми-
ионной силы на вязкость раствора альгината Na (при
ровании полиэлектролитной оболочки играет взаи-
концентрации 2 мг·мл-1) менее выражено при боль-
модействие первых слоев полимеров, нанесенных на
ших скоростях сдвига (рис. 3, б, кривая 2), чем при
СаСО3 ядра. Наличие соли экранирует эти взаимодей-
малых (рис. 3, а, кривая 1) т. е. в условиях полиэлек-
ствия (отталкивание желатина А от поверхности ядра,
тролитной сборки. Здесь следует отметить, что при
не полностью покрытого альгинатом Na при малых
максимальных скоростях сдвига полиэлектролитный
его концентрациях), поэтому полимерная пленка,
эффект может не наблюдаться, преобладающее вли-
образующаяся на ядрах из-за сильных интерполимер-
яние на вязкость оказывает формирование структур,
ных взаимодействий, отсутствует.
возникающих в сдвиговом потоке.
Определение вязкости полимеров и их смесей при
При меньшей скорости сдвига (0.63 с-1) вязкости
помощи реометра не учитывает изменение вязкости
смесей при соотношениях полимеров желатин А/
растворителя при изменении концентрации NaCl в
альгинат Na = 3/1 и 1/3 в растворах 0.2 и 0.5 М NaCl
растворах. Результаты, приведенные на рис. 3, а и
(рис. 4, в) близки. Структуры оболочек СаСО3 ядер,
4, в, не корректировали на вязкость 0.2 и 0.5 М рас-
состоящих из 5 пар слоев альгината Na и желатина
творов NaCl, поскольку вязкость 1 М раствора NaCl
А, нанесенных в разных концентрационных соот-
больше вязкости воды всего на 4%. Наблюдаемый
ношениях из растворов полиэлектролитов в 0.5 М
эффект изменения вязкости смесей в растворах NaCl
NaCl, также не демонстрируют явно выраженных
превышает 4%.
морфологических различий (рис. 4, а, б).
Метод энергодисперсионной спектроскопии ис-
Отметим, что, как и в случае с желатином В
пользовали для детектирования состава полиэлектро-
(рис. 1, кривые 2, 3), вязкость смеси больше в случае
литных оболочек СаСО3 ядер. Определен атомный
большей концентрации соли (рис. 4, в, кривые 1, 2).
состав различных участков поверхности оболочки.
Предложим следующее объяснение кажущегося про-
Сравнивали оболочки, сформированные из пяти пар
тиворечия. Один из участников взаимодействия —
слоев альгината Na и желатина А при различных
полиамфолит белок желатин. При увеличении ионной
соотношениях полиэлектролитов: первый вариант —
Влияние реологических характеристик полимеров оболочки карбонатно-кальциевых ядер...
857
Рис. 4. СаСО3 ядра, покрытые 5 парами полиэлектролитных слоев альгинат Na/желатин А = 1/3 (а) и альгинат Na/
желатин А = 3/1 (б) из растворов в 0.5 М NaCl суммарной концентрации 2 мг·мл-1, зависимость вязкости смеси
растворов желатина А и альгината Na от состава смеси (Д) при концентрациях NaCl 0.2 (2) и 0.5 моль·л-1 (1) при
той же суммарной концентрации (в).
Скорость сдвига 0.63 с-1.
альгинат Na/желатин А =1/3 в воде (рис. 2, а); второй
гината Na в поры ядра. Оболочка с высоковязким
вариант — альгинат Na/желатин А = 3/1 в 0.5 М NaCl
альгинатом Na (молекулы большего размера) фор-
(рис. 4, б). В первом случае наблюдается формирова-
мируется на поверхности ядра. Подобное поведение
ние плотной оболочки, не проникающей в ядра, где
полиэлектролитов различной молекулярной массы
концентрация внешнего слоя полипептида желатина
было продемонстрировано при помощи сканирующей
А втрое больше, чем альгината Na, наружный слой
электронной микроскопии и конфокальной микро-
содержит 2.5% азота. Во втором случае, когда со-
скопии на примерах гидрохлорида полиаллиламина
держание желатина втрое меньше, чем содержание
в паре с полистиролсульфонатом [17] или гиалуроно-
альгината Na, формируется оболочка, проникающая
вой кислотой [18].
в поры (рис. 4, б), азот на поверхности не обнаружен.
Реологические характеристики смесей растворов
Содержание азота (N) в молекуле желатина А состав-
полиэлектролитов, использованных для формирова-
ляет 16 ± 3%. Кроме того, спектральный анализ сви-
ния полиэлектролитных оболочек, определяли при
детельствует о наличии атомов Na и Сl в случае фор-
помощи реометра (при скорости сдвига, характерной
мирования оболочки из растворов полимеров в 0.5 М
для процесса нанесения полиэлектролитных слоев,
NaCl. Следовательно, данные энергодисперсионного
анализа адекватно отражают состав синтезируемых
объектов и коррелируют с условиями процесса их
обработки.
На структуру поверхности полиэлектролитных
оболочек существенное влияние оказывает молеку-
лярная масса используемых полимеров. Было прове-
дено сравнение морфологии оболочек, изготовленных
из трех пар слоев альгинат-желатин. Использовали
два образца альгината Na: высокой и низкой вязко-
сти. Терапевтический белок — антиоксидант супер-
оксиддисмутаза инкапсулирован в СаСО3 ядра при
соосаждении. Оболочку из трех пар слоев альгинат
Na/желатин А в соотношении 1/1 при суммарной кон-
центрации 2 мг·мл-1 формировали из растворов по-
Рис. 5. Временные профили высвобождения суперок-
лимеров в 0.2 М NaCl для низковязкого альгината Na
сиддисмутазы из CaCO3 ядер, покрытых тремя парами
и в H2O для высоковязкого полимера. Существенным
слоев альгинат Na/желатин А, в среды, имитирующие
является факт более глубокого проникновения низ-
разные разделы желудочно-кишечного тракта.
ковязкого, т. е. с молекулами меньшего размера, аль-
Альгинат: 1 — низковязкий, 2 — высоковязкий.
858
Сударева Н. Н. и др.
= 0.63 с-1). Вязкость смеси желатина А и альгината
Использование альгината Na различной вязкости
Na высокой вязкости (в соотношении 1/1) в H2O при
при формировании полиэлектролитных оболочек на
суммарной концентрации полимеров 2 мг·мл-1 равна
СаСО3 ядрах играет важную роль в процессе иссле-
41 мПа∙с. Для низковязкого альгината Na вязкость
дования высвобождения инкапсулированного белка
смеси в 0.2 М NaCl при той же суммарной концентра-
в растворы, имитирующие среды желудочно-кишеч-
ции равна 16 мПа∙с (близкое значение вязкости было
ного тракта. Варьирование плотности и глубины про-
получено в предыдущих экспериментах по определе-
никновения полиэлектролитной оболочки в поры
нию влияния ионной силы раствора на реологические
СаСО3 ядер может контролировать скорость высвобо-
характеристики, рис. 4, в, кривая 2).
ждения инкапсулированного объекта в имитаторную
Рис. 6. Микрофотографии карбонатных ядер, покрытых тремя парами слоев альгинат Na/желатин А (1/1).
Исходные ядра (а, б); после 2 ч пребывания в среде, имитирующей желудок, — 0.1 н HCl (в, г).
После 24 ч пребывания в среде, имитирующей кишечник, — 0.07 М ФБ, рН 7.9 (д, е).
Альгинат: а, в, д — низковязкий; б, г, е — высоковязкий.
Влияние реологических характеристик полимеров оболочки карбонатно-кальциевых ядер...
859
среду. Это предположение подтверждает вид времен-
трехслойной оболочки из альгината Na низкой вяз-
ных профилей высвобождения супероксиддисмутазы
кости и желатина А на карбонатных ядрах с белком
в среды, имитирующие по составу желудок и кишеч-
(антагонистом рецептора интерлейкина 1), содержит-
ник, из СаСО3 в полиэлектролитных оболочках из
ся 7.2 мг·мл-1 белка, тогда как высоковязкий альги-
трех пар альгината (различных молекулярных масс) и
нат Na в ходе формирования аналогичной оболочки
желатина А (рис. 5). В среде, имитирующей желудок,
позволяет выйти большему количеству белка —
высвобождения белка не наблюдали в течение 2 ч.
9.1 мг·мл-1.
СаСО3 ядра должны растворяться в кислой среде.
Альгинат не растворяется даже в комплексе с жела-
Выводы
тином, что и служит защитой карбонатного ядра и
Показано, что молекулярная масса полиэлектро-
инкапсулированного белка.
литов и их взаимодействие влияют на структуру и
Результаты высвобождения фермента суперок-
функции систем доставки на базе пористых СаСО3
сиддисмутазы из систем доставки описанной выше
ядер, покрытых полиэлектролитными (альгинат на-
структуры коррелируют с видом СаСО3 ядер в обо-
трия-желатин) оболочками.
лочках разного состава после пребывания в средах,
Обнаружено, что уменьшение молекулярной мас-
имитирующих разные отделы желудочно-кишечно-
сы альгината натрия позволяет в процессе форми-
го тракта (микрофотографии ядер представлены на
рования оболочки проникать молекулам внутрь по-
рис. 6). Различия в исходных структурах оболочек,
ристой среды СаСО3 ядер, затрудняя в дальнейшем
полученных с использованием альгината Na раз-
высвобождение инкапсулированного белка в среде
ной молекулярной массы, причины которых были
желудочно-кишечного тракта. При этом реологи-
описаны выше, видны на рис. 6, а, б. После пребы-
ческие характеристики смесей полиэлектролитов
вания в среде, имитирующей желудок, в течение 2 ч
коррелируют со структурой оболочек.
оболочки стабильны независимо от молекулярной
Регулирование структуры оболочек карбонатных
массы использованного альгината (как низковязко-
ядер за счет использования смесей полиэлектролитов
го — рис. 6, в, так и высоковязкого — рис. 6, г), что
оказывает существенное влияние на функциональ-
подтверждено отсутствием высвобождения белка
ные характеристики систем доставки, а также может
(рис. 5). После 24 ч пребывания в среде, имитиру-
играть важную роль при реализации различных фи-
ющей кишечник, наблюдаются разрушения струк-
зиологических механизмов «захвата» инкапсулиро-
туры СаСО3 ядер, интенсивность которых опреде-
ванного препарата.
ляется структурой полиэлектролитной оболочки
(рис. 6, д, е). В случае использования высоковязкого
Конфликт интересов
альгината Na полиэлектролитная оболочка интенсив-
но растворяется в щелочной среде за 24 ч, благодаря
Авторы заявляют об отсутствии конфликта инте-
своему расположению на поверхности ядер, более
ресов, требующего раскрытия в данной статье.
доступному для среды, имитирующей кишечник (рис.
6, е). Ядра экспонируются в среду, содержащую соли
Информация об авторах
НPO42-, где вступают в реакцию ионного обмена,
превращаясь в ядра СаНPO4, имеющие значительно
Сударева Наталья Николаевна, к.ф.-м.н., ORCID:
более рыхлую структуру, чем карбонатные ядра [19].
Структура ядер изменена, что позволяет инкапсули-
Елоховский Владимир Юрьевич, к.т.н., ORCID:
рованному белку быстро высвобождаться из систе-
мы доставки (рис. 5, кривая 2). При использовании
Сапрыкина Наталья Николаевна, к.х.н., ORCID:
низковязкого альгината Na, частично проникшего в
пористую матрицу карбонатных ядер, разрушение
структур оболочек не столь драматично, наблюдается
Список литературы
некоторое количество целых ядер (рис. 6, д), высвобо-
[1] Балабушевич Н. Г., Печенкин М. А., Зоров И. Н.,
ждение белка заторможено (рис. 5, кривая 1).
Шибанова Е. Д., Ларионова Н. И. Мукоадгезивные
Дополнительным подтверждением того факта, что
полиэлектролитные микрочастицы, содержащие
полиэлектролитное покрытие с низковязким альги-
рекомбинантный инсулин человека и его анало-
натом Na лучше удерживает белок в ядрах, служат
ги аспарт и лизпро // Биохимия. 2011. Т. 76. № 3.
данные хроматографического анализа. В суммарных
С. 400-405.
супернатантах, полученных в ходе формирования
860
Сударева Н. Н. и др.
[Balabushevich N., Pechenkin M., Zorov I.,
[10]
Zhang Y., Wei W., Lu P., Wang L., Ma G. Preparation
Larionova N., Sibanova E. Mucoadhesive
and evaluation of alginate-chitosan microspheres for
polyelectrolyte microparticles containing recombinant
oral delivery of insulin // Eur. J. Pharm. Biopharm.
human insulin and its analogs aspart and lispro //
2011. V. 77. N 1. P. 11-19.
Biochem. (Mosc). 2011. V. 76. N 3. P. 327-331. https://
doi.org/10.1134/S0006297911030059].
[11]
Tu L., He Y., Yang H., Wu Z., Yi L. Preparation and
[2] Shi D., Ran M., Zhang L., Huang H., Li X., Chen M.,
characterization of alginate-gelatin microencapsulated
Akashi M. Fabrication of biobased polyelectrolyte
Bacillus subtilis SL-13 by emulsification/internal
capsules and their application for glucose-triggered
gelation // J. Biomat. Sci. Polym. E. 2015 V. 26. N 12.
insulin delivery // ACS Appl. Mater. Interfaces. 2016.
P. 735-749.
V. 8. N 22. P. 13688-13697.
[12]
Sudareva N., Suvorova O., Saprykina N., Vilesov A.,
[3] Kakran M., Muratani M., Tng W. J., Liang H.,
Bel′tyukov P., Petunov S. Alginate-containing systems
Trushina D. В., Sukhorukov G. B., Ng H. H.,
for oral delivery of superoxide dismutase/ Comparison
Antipina M. N. Layered polymeric capsules inhibiting
of various configuration and their properties // J.
activity of RNAses for intracellular delivery of
Microencapsul. 2016. V. 33. N 5. P. 487-496. https://
messenger RNA // J. Mater. Chem. B. 2015. V. 3.
doi.org/10.1080/02652048.2016.1206146
P. 5842-5848.
[13]
Shi D., Greever R., Chen Y. Preparation and
characterization of novel sinomenine microcapsules
[4] Sukhorukov G., Donath E., Davis S., Lichtenfeld H.,
for oral controlled drug delivery // Drug. Dev. Ind.
Caruso F., Popov V., Möhwald H. Stepwise
Pharm. 2010. V. 36. N 4. P. 482-489.
polyelectrolyte assembly on particle surfaces: A novel
approach to colloid design // Polym. Adv. Technol. 1998.
[14]
Chen Y., Lin X., Park H., Greever R. Study of
artemisinin nanocapsules as anticancer drug delivery
(SICI)1099-1581(1998100)9:10/11<759::AID-
systems // Nanomedicine. 2009. V. 5. N 3. P. 316-322.
PAT846>3.0.CO;2-Q
[5] Volodkin D. V., Petrov A. I., Prevеt M., Sukhorukov G.
[15]
Sudareva N., Popova H., Saprykina N., Bronnikov S.
Matrix polyelectrolyte microcapsules: New system for
Structural optimization of calcium carbonate
macromolecule encapsulation // Langmuir. 2004. V. 20.
cores as templates for protein encapsulation
// J.
N 8. P. 3398-3406.
Microencapsul. 2014. V. 31. N 4. P. 333-343. https://
doi.org/10.3109/02652048.2013.858788
[6] Volodkin D. CaCO3 templated micro-beads and
[16]
Volodkin D., Larionova N., Sukhorukov G. Protein
-capsules for bioapplications // Adv. Coll. Interface
encapsulation via porous CaCO3 microparticles
Sci. 2014. V. 207. P. 306-324.
templating // Biomacromolecules. 2004. V. 5. N 5.
[7] Richardson J., Maina J., Ejima H., Hu M., Guo J.,
[17]
Petrov A., Volodkin D., Sukhorukov G. Protein-
Cho M.., Gunavan S., Lybaert L., Hagemeyer C., De
calcium carbonate co-precipitation. A tool for protein
Geest B., Caruso F. Versatile loading of diverse cargo
encapsulation // Biotechnol. Prog. 2005. V. 21. N 3.
into functional polymer capsules // Adv. Sci. 2015. V. 2.
N 1-2. P. 1400007 (6 pp).
[18]
Szarpak A., Pignot-Paintrand I., Nicolas C., Picart
C., Auzély-Velty R. Multilayer assembly of hyaluronic
[8] Sudareva N., Suvorova O., Saprykina N., Smirnova N.,
acid/poly(allylamine): Control of the buildup for the
Bel′tiukov P., Petunov S., Radilov A., Vilesov A.
production of hollow capsules // Langmuir. 2008.
Two-level delivery systems based on CaCO3 cores
V. 24. N 17. P. 9767-9774.
for oral administration of therapeutic peptides // J.
Microencapsul. 2018. V. 35. N 7-8. P. 619-634. https://
[19]
Sudareva N. N., Saprykina N. N., Popova E. V.,
doi.org/10.1080/02652048.2018.1559247
Vilesov A. D. Porous calcium carbonate cores as
[9] Polomska A., Leroux J.-C., Brambilla D. Layer-by-
templates for preparation of peroral proteins delivery
layer coating of solid drug cores: A versatile method
systems / Ed. A. Cohen. Calcium Carbonate:
to improve stability, control release and tune surface
Occurrence, Characterization and Applications. New
properties // Macromol. Biosci. 2017. V. 17. N 1.
York: Nova Sci. Publ., Inc. (NOVA), 2015. P. 73-95.