Электролиз с углеродными волокнистыми электродами в процессах извлечения платиновых металлов...
1033
Журнал прикладной химии. 2020. Т. 93. Вып. 7
УДК 541:546.91
ЭЛЕКТРОЛИЗ С УГЛЕРОДНЫМИ ВОЛОКНИСТЫМИ ЭЛЕКТРОДАМИ
В ПРОЦЕССАХ ИЗВЛЕЧЕНИЯ ПЛАТИНОВЫХ МЕТАЛЛОВ
ИЗ МИНЕРАЛЬНОГО И ТЕХНОГЕННОГО СЫРЬЯ
© В. К. Варенцов, В. И. Варенцова
Новосибирский институт химии твердого тела и механохимии СО РАН,
630128, г. Новосибирск, ул. Кутателадзе, д. 18
Поступила в Редакцию 22 апреля 2019 г.
После доработки 23 января 2020 г.
Принята к публикации 19 марта 2020 г.
Приведены результаты исследований электроизвлечения платиновых металлов на электроды из
углеродных волокнистых материалов из растворов, образующихся при переработке медно-никелевых
руд, золото- и серебросодержащих концентратов (аффинажа золота и серебра), платино-рениевых
катализаторов, имитационных растворов утилизации отработанного ядерного топлива. Использо-
ваны комбинированные схемы, включающие электролиз с углеродными волокнистыми электродами,
анодную лабилизацию соединений платиновых металлов, экстракцию и ионный обмен. Извлечение
платиновых металлов до низких остаточных концентраций реализовано из различных растворов:
сернокислых, солянокислых, солянокислых с тиомочевиной, аммонийных, азотно-азотистокислых,
азотнокислых. Использован электролиз с постоянным и переменным токовыми режимами, а также
схемы осаждение-анодное растворение, осаждение-растворение за счет работы короткозамкнутой
электрохимической системы углеродный волокнистый материал-сплав металлов-раствор элек-
тролита. Ряд процессов успешно опробован в опытно-промышленном и промышленном масштабах.
Испытания проводили на опытно-промышленных электролизерах с углеродными волокнистыми элек-
тродами, разработанных совместно со специальным конструкторским бюро горнообогатительного
оборудования.
Ключевые слова: платиновые металлы; электроизвлечение; растворы; углеродные волокнистые
электроды; минеральное и техногенное сырье; промышленные испытания
DOI: 10.31857/S0044461820070154
Основной сырьевой базой платиновых металлов
мышленность платиновых металлов является вто-
являются сульфидные медно-никелевые руды. При
ричное сырье: отработанные катализаторы, изделия
их переработке на различных стадиях технологиче-
электронной техники, отработанные электролиты,
ского процесса получают концентраты, растворы и
промывные растворы гальванотехники и др. [2-7].
шламы, содержащие платиновые металлы, золото,
Отдельно следует отметить азотно-азотистокислые
серебро, цветные металлы [1, 2]. Выделение плати-
растворы, образующиеся при переработке отработан-
новых металлов из концентратов осуществляется на
ного ядерного топлива, содержащие платину, родий,
аффинажных предприятиях по технологиям, пред-
рутений и различные металлы [8].
усматривающим перевод металлов в раствор и их
Многообразие и сложный ионный состав рас-
селективное выделение различными методами.
творов: солянокислые, сернокислые, солянокислые
Наряду с этим платиновые металлы содержатся
с тиомочевиной, аммонийные, азотно-азотистокислые
в шламах и растворах аффинажа золота и серебра
растворы — обусловливают необходимость разра-
(отработанные электролиты, промывные растворы).
ботки процессов, сочетающих различные способы
Источником дополнительного поступления в про-
выделения платиновых металлов: экстракция, хи-
1034
Варенцов В. К., Варенцова В. И.
мическое осаждение, ионный обмен, электролиз и
ка) с получением сплава металлов; анодным раство-
др. [1-8]. Перспективным является электролиз, обе-
рением металлов в растворах электролитов; раство-
спечивающий в одну стадию получение продукта в
рением металлов за счет работы короткозамкнутой
виде металла или сплава металлов. Для растворов с
электрохимической системы металл-углеродный во-
низким содержанием металлов в растворе перспек-
локнистый материал-раствор электролита.
тивно использование электролиза с проточными трех-
Содержание платиновых и цветных металлов,
мерными электродами, в частности, с электродами из
золота и серебра в растворах определяли атом-
углеродных волокнистых материалов. Электролиз
но-абсорбционным и (или) спектральным метода-
может использоваться как самостоятельно, так и в
ми. Содержание металлов в катодных осадках при
комбинации с экстракцией или ионным обменом.
переработке растворов аффинажа золота и серебра
Хорошо зарекомендовал себя в процессах электро-
определяли пробирным методом. Наличие осадка
осаждения золота, серебра и цветных металлов из
платиновых металлов на катоде и его качество кон-
различных растворов электролиз с электродами из
тролировали электронно-микроскопическим методом.
углеродных волокнистых материалов [9, 10].
Исследования выполнены на модельных и про-
Настоящая работа посвящена исследованию из-
мышленных растворах, образующихся в различных
влечения платиновых металлов из растворов пере-
технологических процессах переработки минераль-
работки минерального и вторичного сырья с исполь-
ного и техногенного сырья, в ряде случаев непосред-
зованием электролиза с углеродными волокнистыми
ственно на предприятиях (Норильский горно-ме-
электродами.
таллургический комбинат, Новосибирский завод
цветных металлов).
Было изучено электроизвлечение платиновых ме-
Экспериментальная часть
таллов из следующих растворов:
Методика экспериментов электроизвлечения пла-
— растворы переработки минерального сырья —
тиновых металлов на углеродные волокнистые элект-
медно-никелевых руд (табл. 1);
роды аналогична использованной при электроосажде-
— растворы, получающиеся при аффинаже золота
нии золота, серебра и других металлов из растворов
и серебра: отработанные электролиты и промыв-
[9, 10]. Катодную поляризацию проводили от источ-
ные растворы, растворы выщелачивания анодного
ника постоянного тока типа Б-5-49 или ТЭС-50 в усло-
шлама, реэкстракты, полученные при извлечении
виях циркуляции раствора, содержащего платиновые
платиновых металлов из растворов аффинажа золота
металлы, сквозь объем электрода в ячейках специ-
и серебра (табл. 2);
альной конструкции с габаритной катодной поверх-
— растворы переработки отработанных плати-
ностью 2 и 30 см2 [10]. В качестве катода использо-
но-рениевых катализаторов (табл. 2);
вали углеродные волокнистые материалы различной
— растворы, образующиеся при утилизации от-
электропроводности: высокоэлектропроводные —
работанного ядерного топлива — имитационные
ВИНН-250, НТМ-200, низкоэлектропроводные —
водно-хвостовые растворы, в том числе реэкстракты,
НТ-1, КНМ, ВВП-66-95, НТМ-100 [10]; в качестве
полученные при извлечении палладия из этих раство-
анода — платину или платинированный титан.
ров (составы растворов приведены далее по тексту).
Электродные пространства в большинстве случаев
Растворы характеризуются сложным составом,
разделялись ионообменной мембраной МК-40-2Л.
концентрация платиновых металлов, как правило,
Поляризационные исследования проводили при 25°С
значительно меньше концентрации сопутствующих
на полярографе типа РА-2 с платиновым или графи-
металлов.
товым микроэлектродом с обновляемой поверхно-
Промышленные испытания процесса электроиз-
стью. Электроды сравнения — насыщенный хлор-
влечения платиновых металлов на углеродные волок-
серебряный или каломельный электрод. Значения
нистые электроды из солянокислых растворов аффи-
потенциалов, приведенные в статье, даны в водо-
нажа золота (табл. 2) проводили на установке ЭУЭ
родной шкале. Электролиз в потенциостатических
(ТУ 246-0608-91), включающей электролизер ЭУ-5В
условиях проводили с использованием потенциоста-
с пятью катодными камерами с суммарной катодной
та типа П-5848 или ПИ-50 на плоских электродах.
поверхностью 0.7 м2 и шестью анодными камерами.
Углеродные волокнистые катоды с платиновыми
Электродные камеры разделены ионообменными
металлами перерабатывали различными методами:
мембранами МК-40-2Л, аноды — платинированный
пирометаллургической обработкой (озоление и плав-
титан.
Электролиз с углеродными волокнистыми электродами в процессах извлечения платиновых металлов...
1035
Таблица 1
Составы растворов, образующихся в процессе переработки минерального сырья, содержащего платиновые
элементы
Концентрация вещества в растворе, г·л-1
раствор выщелачивания
раствор выщелачивания
Компонент
раствор ванн анодного
раствор выщелачивания
анодного шлама после
пылей уноса после
растворения никеля
концентрата
рафинирования меди
цементации серебра
Pt
0.009
0.0025
0.08
Pd
0.003
0.006
0.170
Rh
0.003
0.001
0.080
Ru
0.006
0.005
0.020
Ir
0.015
0.004
0.004
Au
0.001
0.001
Ag
0.035
0.150
0.01
Ni
90.0
45.0
0.008
9.20
Cu
0.90
55.0
0.10
10.40
Fe
1.50
5.00
Se
0.015
NaOH
5.0
Na2SO3
108.0
H2SO4
80.0
35.0
120.0
Таблица 2
Растворы, образующиеся в технологии аффинажа золота и серебра и переработки платино-рениевых
катализаторов
Концентрация вещества в растворе, г·л-1
отработанные
промывные
растворы
Компонент
реэкстракты, полученные
растворы
электролиты
растворы
переработки
при извлечении платиновых
выщелачивания
и промывные растворы
аффинажа
платино-рениевых
металлов из растворов
анодного шлама
аффинажа золота
серебра
катализаторов
Au
62.50-0.44
0.496-0.004
0.230
1.505
Ag
1.0-0.1
0.018
0.147
Pd
22.40-0.06
0.1-0.001
0.615
0.025
0.025
0.250
Pt
11.10-0.02
0.092-0.004
0.500
1.6-0.25
Rh
0.050-0.4
Cu
11.0-0.06
55.0-11.0
7.9
Ni
0.3-0.02
0.025
0.115
0.025
0.500
1.60-0.25
Te
0.4-0.02
0.001
0.007
Zn
0.3-0.02
7.9
Fe
4.2-1.5
0.390
3.26
Cd
16.0
Re
0.25
Al
25.0
HСl
110-2.0
18.75
18.75
20.0
110
37.5-18.7
HNO3
12.6-6.3
NH4Cl
100
NH4NO3
20
TM
38.0
1036
Варенцов В. К., Варенцова В. И.
Обсуждение результатов
Ток, проходящий через углеродный волокнистый
электрод в перечисленных выше растворах, может
расходоваться на ряд катодных реакций: реакции,
предшествующие или параллельно протекающие с
процессом осаждения платиновых металлов, рав-
новесные потенциалы которых положительнее или
сравнимы с равновесными потенциалами платино-
вых металлов, например, реакции восстановления
кислорода, трехзарядного железа, нитрит- и нитрат--
ионов, осаждения золота, серебра, теллура; реакции,
равновесные потенциалы которых отрицательнее
равновесных потенциалов платиновых металлов, —
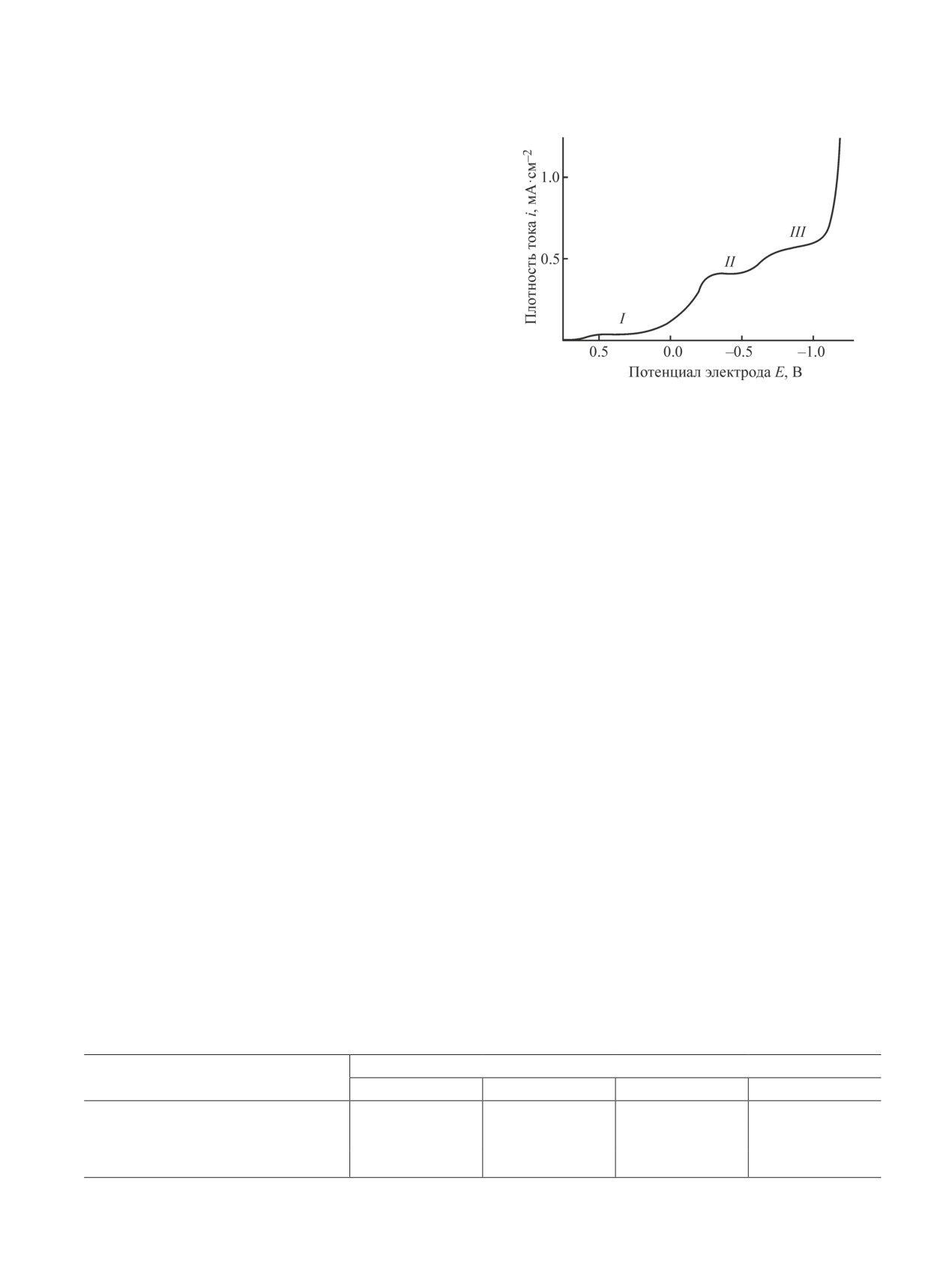
Катодная поляризационная кривая раствора состава
осаждение цветных металлов, интенсивное выделе-
(г·л-1): Pt — 0.080, Pd — 0.170, Cu — 10.4, Ni — 9.2,
ние газообразного водорода.
H2SO4 — 100; Ест = +0.854 В (н.в.э.).
Необходимость избирательного электроизвлече-
ния платиновых металлов накладывает ограничения
Наиболее показательными явились данные, по-
на токовый режим, а следовательно, на производи-
лученные при совместном восстановлении платины
тельность процесса и обусловливается реакциями
и палладия из сернокислого раствора, содержащего
осаждения цветных металлов и (или) выделения
медь и никель.
газообразного водорода. Поскольку электрохими-
Катодная поляризационная кривая характеризует-
ческий процесс протекает по всей толщине угле-
ся тремя областями потенциалов, в которых величина
родного волокнистого материала, важным является
плотности тока незначительно зависит от потенциала
обеспечение таких условий электролиза, при которых
электрода (см. рисунок). Предположительно, в первой
во всем объеме электрода протекало бы осаждение
области потенциалов происходит электроосаждение
преимущественно платиновых металлов. При этом
платины и палладия, во второй — меди, в третьей —
подбираются условия электролиза, при которых на
никеля.
наиболее «нагруженных» участках электрода, т. е.
Для подтверждения предположения об электро-
с наиболее высоким потенциалом, не осаждаются
осаждении палладия и платины в этой области по-
цветные металлы и интенсивно не выделяется во-
тенциалов были проведены исследования в потен-
дород.
циостатических условиях на плоских электродах
Для оценки принципиальной возможности пре-
и проанализировано изменение состава раствора.
имущественного электроосаждения платиновых
В первой области потенциалов (рис. 1) электро-
металлов при минимальном (или отсутствии) влия-
осаждаются платина и палладий, медь и никель в
нии процессов осаждения цветных металлов и (или)
этой области потенциалов не осаждаются (табл. 3).
выделения водорода проведены поляризационные
Поляризационные исследования растворов (табл. 1
исследования на модельных и реальных растворах.
и 2) показали, что область потенциалов осаждения
Для ряда растворов проведен электролиз в потенцио-
платиновых металлов, предшествующая осаждению
статических условиях на плоских электродах.
цветных металлов и интенсивному выделению водо-
Таблица 3
Изменение состава раствора при электролизе в потенциостатических условиях
Исходный состав раствора (г·л-1): Pt — 0.080, Pd — 0.170, Cu — 10,4, Ni — 9.2, H2SO4 — 100;
Ест = +0.854 В (н.в.э.)
Концентрация металлов в растворе, г·л-1
Потенциал электрода Е (н.в.э.), В
Pt
Pd
Cu
Ni
0.554
0.0054
0.0013
10.30
9.20
0.404
0.0064
0.0014
10.50
9.15
0.354
0.0064
0.0012
10.50
9.20
Электролиз с углеродными волокнистыми электродами в процессах извлечения платиновых металлов...
1037
рода, изменяется в широком интервале потенциалов
отработанных платино-рениевых катализаторов; рас-
и может достигать 0.8-0.9 В.
творы, образующиеся при утилизации отработанного
Наличие в растворах дополнительного комплексо-
ядерного топлива — имитационные водно-хвостовые
образователя, например, тиомочевины смещает ста-
растворы, в том числе реэкстракты, полученные при
ционарный потенциал платинового или палладиевого
извлечении палладия из этих растворов.
электродов в отрицательную сторону на 350-400 мВ
Приведенные в табл. 4 результаты показывают,
при исходном значении +(680-780) мВ.
что в начальный период электролиза (~60 мин) из
Поскольку концентрация ионов платиновых ме-
раствора извлекаются только платина и палладий.
таллов в растворах, как правило, много меньше кон-
В дальнейшем в результате перераспределения по-
центрации ионов цветных металлов, достижение
тенциала по объему электрода и смещения его в от-
потенциала выделения цветных металлов приведет
рицательную сторону электроосаждается медь (ее
к быстрому заполнению углеродного волокнистого
концентрация в растворе уменьшается), осадок при-
электрода осадком этих металлов и прекращению
обретает розовый цвет. При этом электроосаждения
осаждения металлов в объеме электрода. Поэтому ос-
никеля не выявлено.
новным условием извлечения платиновых металлов
Результаты исследований, выполненных на пред-
является обеспечение их осаждения по всему объему
приятии на лабораторных установках, показали воз-
электрода при потенциалах положительнее потенциа-
можность электроизвлечения платиновых металлов
ла выделения цветных металлов на наиболее «нагру-
из растворов: ванн анодного растворения никеля, вы-
женных» участках электрода. Учитывая результаты
щелачивания анодного шлама после рафинирования
исследований закономерностей функционирования
меди, выщелачивания пылей уноса после цементации
углеродных волокнистых электродов [9, 10], для из-
серебра (табл. 1) — на 90-98% на углеродные волок-
влечения платиновых металлов из указанных выше
нистые электроды с низкой электропроводностью.
растворов использовали электроды малой толщи-
Незначительное включение цветных металлов в
ны 1-3 мм. Такие электроды обеспечивают мини-
катодный осадок, имевшееся в ряде случаев, можно
мальную разницу потенциала по толщине электрода,
существенно снизить или избежать, изменяя вели-
следовательно, возможность отделения платиновых
чину тока в процессе электролиза. Например, при
металлов от присутствующих в растворе цветных
таком режиме электролиза остаточная концентра-
металлов и уменьшение отрицательного влияния ре-
ция платиновых металлов в сернокислом растворе
акции выделения водорода на электроизвлечение
(табл. 1) менее 0.00005 г·л-1, медь и никель в осадке
платиновых металлов.
не обнаружены.
Ниже приведены результаты исследований элек-
Эффективность электроизвлечения металлов
троизвлечения платиновых металлов для следующих
из растворов аффинажа золота зависит от вида
растворов: cернокислые растворы, образующиеся при
углеродного волокнистого материала (НТМ-200,
переработке медно-никелиевых руд; отработанные
ВИНН-250, НТ-1, ВВП-66-95), габаритной плотности
электролиты и промывные растворы, получающиеся
тока (100-1000 А·м-2), концентрации соляной кис-
при аффинаже золота и серебра, растворы выщела-
лоты (92-150 г·л-1), скорости циркуляции раствора
чивания анодного шлама; реэкстракты, полученные
(2.0-4.2 см3·с-1) (табл. 2). Найдены условия элек-
при извлечении платиновых металлов из растворов,
тролиза и вид углеродного волокнистого материала,
аффинажа золота и серебра; растворы переработки
обеспечивающие эффективное электроизвлечение
Таблица 4
Изменение концентрации платины и палладия при их электроизвлечении из сернокислого раствора
Катод — ВВП-66-95; плотность тока 330 А·м-2; исходный состав раствора (г·л-1): Pt — 0.080, Pd — 0.170,
Cu — 10.4, Ni — 9.2, H2SO4 — 100; Ест = +0.854 В (н.в.э.)
Изменение концентрации металлов в растворе, г·л-1, при времени электролиза, мин
Металл
0
30
60
90
120
Pt
0.080
0.015
0.005
0.0023
0.0015
Pd
0.170
—
0.004
0.0019
0.0010
Cu
10.1
10.0
10.2
8.1
6.4
Ni
10.6
10.8
10.7
10.6
10.6
1038
Варенцов В. К., Варенцова В. И.
платиновых металлов более чем на 99.5%: габарит-
чение 95-99.9% благородных металлов без значитель-
ная плотность тока 1000 А·м-2, скорость циркуляции
ного включения в катодный осадок цветных металлов
раствора 3 см3·с-1, углеродный волокнистый мате-
(не более 1-5%). Углеродный катод с осажденны-
риал ВИНН-250. Платиновые металлы осаждаются
ми металлами подвергали пирометаллургической
совместно с золотом, скорость осаждения палладия
переработке, содержание благородных металлов в
больше, чем платины, совместно с платиновыми ме-
катодном осадке 90-99% в зависимости от состава
таллами осаждается теллур. Степень извлечения ме-
раствора и условия ведения процесса электролиза.
таллов, их содержание в катодном осадке зависят от
Особенностью растворов, образующихся при пе-
состава раствора, режима электролиза.
реработке отработанных катализаторов риформинга,
Результаты промышленных испытаний подтвер-
является наличие в солянокислых растворах рения,
дили данные лабораторных исследований. Наряду с
который может восстанавливаться совместно с пла-
золотом полностью извлекаются платина и палладий.
тиной (табл. 2). Исследовано влияние плотности то-
Пробирный анализ сплавов катодных осадков показал
ка (250-1000 А·м-2) на электроизвлечение платины
наличие в них золота, платины, палладия и родия
на углеродные волокнистые материалы вида КНМ
(табл. 5). Технология и установка были приняты в
и ВИНН-250 при температуре раствора 25 и 50°С.
эксплуатацию.
Электроосаждение рения проводили при плотно-
Наряду с электроизвлечением платиновых ме-
стях тока до 7500 А·м-2. Результаты исследований
таллов из указанных солянокислых растворов аф-
позволили найти условия, обеспечивающие извлече-
финажа золота изучено их извлечение из реэкстрак-
ние платины при низких плотностях тока до следо-
тов, полученных при электролизе этих растворов
вых остаточных концентраций без осаждения рения.
(табл. 2). Найдены условия, обеспечивающие полное
Выявлено каталитическое влияние осадка платины
извлечение платиновых металлов из этих раство-
на электроосаждение рения. Так, рений совместно с
ров на углеродные волокнистые материалы с низкой
платиной начинает осаждаться при плотностях тока
электропроводностью при плотностях тока не более
более 600 А·м-2, при отсутствии в растворе платины
1000 А·м-2. Установлено, что скорость извлечения
даже при плотности тока 2500 А·м-2 рений не осаж-
палладия из этих растворов больше, чем платины.
дается. Увеличение температуры раствора до 50°С
Исследовано электроосаждение благородных
увеличивает скорость осаждения металлов, особенно
металлов (золото, серебро, платина, палладий, ро-
платины.
дий) из азотнокислых растворов аффинажа серебра
Опытно-промышленные испытания процесса
(табл. 2) на углеродные волокнистые катоды с низкой
электроизвлечения платины и рения из солянокислых
электроповодностью. Учитывая высокое содержа-
растворов переработки катализаторов риформинга
ние цветных металлов и необходимость преимуще-
проведены на пилотной установке. Установка состо-
ственного электроизвлечения платиновых металлов,
яла из электролизера, включающего две катодные
электролиз вели при низких плотностях тока (70-
и три анодные камеры кассетного типа с автоном-
200 А·м-2). С целью повышения электропроводности
ным питанием растворами, емкостей для католита
раствора концентрацию азотной кислоты увеличили
(раствор, содержащий платину и рений) и анолита
до 30 г·л-1. Показано, что при электролизе в первую
(раствор серной кислоты 30 г·л-1). Аноды — плати-
очередь осаждаются золото и платина, затем серебро,
нированный титан, катодный материал — ВИНН-250.
палладий, родий и теллур. Совместно с родием и
Электродные камеры разделены мембраной
теллуром может осаждаться медь. Увеличение плот-
МК-40-2Л. Габаритная поверхность одного катода
ности тока и содержания азотной кислоты в растворе
122 см2.
способствует более полному выделению благородных
Электроизвлечение платины проводили из раство-
металлов. Найдены условия, обеспечивающие извле-
ра, содержащего (г·л-1): Pt — 0.19, Re — 0.26, HCl —
Таблица 5
Пробирный анализ сплава катодных осадков
Проба
Условия выделения металлов
Лигатура
Au
Ag
Pt
Pd
Rh
Cu
Лабораторные
901.86
1.13
6.26
18.66
—
1.40
70.69
Промышленные
954.90
—
0.13
0.55
0.01
—
44.41
Электролиз с углеродными волокнистыми электродами в процессах извлечения платиновых металлов...
1039
18.5, HNO3 — 3.2. Результаты испытаний показа-
лых растворов на углеродные волокнистые электро-
ли, что платину можно извлекать из солянокислых
ды с последующим анодным растворением осадка
растворов переработки катализаторов со степенью
металлов или растворением за счет работы коротко-
извлечения более 95% при комнатной температуре.
замкнутой электрохимической системы углеродный
Одной из важных задач переработки отходов отра-
волокнистый материал-платиновые металлы-рас-
ботанного ядерного топлива является извлечение пла-
твор электролита и последующим электролитиче-
тиновых металлов: палладия, родия и рутения — из
ским осаждением с целью отделения палладия от
сложных по составу многокомпонентных водно-хво-
сопутствующих металлов, в том числе от родия и ру-
стовых растворов. Содержание компонентов в ими-
тения. Для осуществления возможности раздельного
тационном растворе (г·л-1): Pd — 0.11, Rh — 0.1,
электроизвлечения платиновых металлов из имитаци-
Ru — 0.05, Mo — 2.0, Zr — 1.8, La — 1.5, Fe — 1.0,
онных растворов использовали режимы электролиза
Ni — 0.2, Sb — 0.001, Te — 0.1, Se — 0.2, Ag — 0.06,
с постоянной и изменяющейся в процессе электро-
Cs — 1.25, Cr — 0.24, Ba — 0.9, Ce — 1.0, Sr —
лиза габаритной плотностью тока (500-7500 А·м-2).
1.8; HNO3 — 3.0 моль·л-1; HNO2 — 0.01 моль·л-1.
Установлено, что Pd, Ag, Te можно извлечь более чем
Результаты анализа состава растворов и рассчитан-
на 99% при относительно низких плотностях тока. Rh
ных равновесных потенциалов окислительно-восста-
и Ru начинают осаждаться при плотностях тока более
новительных реакций компонентов, входящих в эти
2000 А·м-2, увеличение плотности тока до 5000 А·м-2
растворы, показали возможность использования элек-
позволяет значительно увеличить извлечение родия и
тролиза для извлечения Pd, Rh, Ru, Ag. Совместно с
рутения. Изменения концентрации в растворе других
осаждением этих металлов возможны реакции вос-
указанных выше металлов, в частности Sb, Mo, Ni,
становления ионов Fe, Mo, Sb. Предпочтительными
Cr, La, находятся в пределах погрешности анализа.
являются электроды из углеродных волокнистых
Параллельно с осаждением платиновых металлов
материалов, обладающие высокой реакционной по-
идет восстановление азотной кислоты. Негативное
верхностью, химической, электрохимической и ра-
влияние на эффективность их осаждения оказывают
диационной стойкостью в этих растворах.
ионы железа, молибдена, нитрит-ионы. Электролиз
Исследования проводили в нескольких вариантах.
при плотностях тока 7000-7500 А·м-2 сопровождает-
1. Электроизвлечение платиновых металлов на
ся образованием гидроксидов металлов (Sb, Mo, Ni,
углеродные волокнистые электроды как при их ин-
Cr, Fe, La), которые блокируют поверхность углерод-
дивидуальном, так и при совместном (в том числе с
ного волокнистого электрода.
серебром, сурьмой) присутствии в азотно-азотисто-
Анодное растворение сплава металлов, осажден-
кислых растворах. Исследование электроосажде-
ных на углеродный волокнистый электрод, или рас-
ния Pd, Rh, Ru, Ag, Sb в зависимости от условий
творение металлов в растворах соляной или азотной
электролиза (плотности тока, скорости протока рас-
кислоты за счет работы короткозамкнутой электро-
твора), вида углеродного волокнистого материала
химической системы углеродный волокнистый ма-
(ВИНН-250, КНМ, НТ-1) и состава раствора пока-
териал-сплав металлов-раствор кислоты позволили
зали возможность их количественного извлечения
отделить палладий от большинства сопутствующих
на катоды из углеродных волокнистых материалов.
металлов. Последующее электроосаждение и рас-
Палладий, серебро и сурьма извлекаются до низких
творение полученного осадка указанными методами
остаточных концентраций при низких плотностях
обеспечило высокую очистку палладия. Дальнейшее
тока (100-500 А·м-2). Родий и рутений при этом не
электроизвлечение палладия в виде металлического
извлекаются.
осадка из этих растворов не представляет трудностей,
Установлено, что эффективность электроосаж-
содержание палладия в катодном осадке более 99.9%.
дения родия при его индивидуальном присутствии
3. Электроизвлечение платиновых металлов элек-
в растворе определяется формой его нахождения в
тролизом на углеродные волокнистые электроды из
растворе. Если для родия, находящегося в полиядер-
реэкстрактов, образующихся при экстракционном ме-
ной форме, можно обеспечить степень извлечения до
тоде выделения платиновых металлов из водно-хво-
98%, то для родия в форме [Rh(NO2)3(H2O)3] — не
стовых растворов. Исследования выполнены совмест-
более 20% за 3.5-4 ч электролиза при плотности тока
но с сотрудниками Института неорганической химии
5000 А·м-2. Наличие в растворе рутения и молибдена
СО РАН. Реэкстракцию осуществляли растворами,
значительно снижает степень извлечения родия.
содержащими NH4OH — 3.0 моль·л-1, соли аммо-
2. Электроизвлечение платиновых металлов из
ния (г·л-1): NH4NO3 — 7.5-100.0, NH4HCO3 — 30.0,
указанных выше имитационных азотно-азотистокис-
NH4Cl — 30.0 — в их различных комбинациях и соот-
1040
Варенцов В. К., Варенцова В. И.
ношении концентраций. Предварительно проведены
билизации прочных комплексных соединений пла-
специальные исследования электроизвлечения палла-
тиновых металлов на электродах из углеродного
дия на углеродный волокнистый электрод и плоские
волокнистого материала перед их сорбцией или
электроды из растворов, содержащих NH4OH и аммо-
экстракцией. Исследования по анодной лабилиза-
нийные соли, моделирующих различные по составу
ции иридия проводили на модельных и реальных
реэкстракты, в том числе из растворов с добавлением
сернокислых растворах ванн анодного растворения
экстрагента. Отрицательного влияния экстрагента на
никеля и меди. Результаты исследований позволи-
электроизвлечение палладия не выявлено. Также не
ли совместно с сотрудниками Института химии и
выявлено отрицательного влияния электролиза (при
химической технологии СО РАН разработать про-
электрорастворении палладия) на последующее экс-
цесс извлечения иридия из сернокислого раствора.
тракционное извлечение палладия [8].
Раствор, содержащий иридий, циркулирует между
При моделировании экстракционно-электрохими-
электролизером и ионообменной колонкой: в элек-
ческой схемы извлечения палладия из имитацион-
тролизере происходит анодная лабилизация инертных
ных азотно-азотистокислых растворов исходный со-
форм иридия, в колонке — сорбция его лабильных
став раствора следующий (г·л-1): Pd — 1.076-0.920,
форм.
Ag — 0.041-0.045, Sb — 0.012-0.014, Se — 0.016,
Опытно-промышленные испытания технологии
Te — 0.245-0.270; HNO3 — 3.0 моль·л-1, HNO2 —
и аппаратуры процесса извлечения иридия из про-
0.01 моль·л-1. Состав полученного реэкстракта, из
мышленных растворов проводили на Норильском
которого осаждали палладий электролизом (г·л-1):
горно-металлургическом комбинате. Испытания
NH4NO3 — 10.0, Pd — 9.450-6.080, Ag — 0.070, Sb —
проводили с растворами, содержащими (г·л-1): Ir —
<0.00002, Se — <0.00002, Te — <0.00001; NH4OH —
0.015-0.020, H2SO4 — 80.0, Ni — 70.0, Cu — 0.2,
3.0 моль·л-1. Электроизвлечение палладия и сопут-
Fe — 20.0 с добавкой NaCl — 30.0. Процесс состоял
ствующих металлов из этого раствора проводили
из двух стадий. На первой, предварительной стадии
двумя методами: 1) основное количество палладия
осуществляли окисление железа(II), раствор циркули-
осаждали на плоский титановый катод до достижения
ровал между емкостью и электролизером. На второй
концентрации палладия около 1.0 г·л-1, оставшееся
стадии при окислении иридия раствор циркулиро-
количество палладия извлекали на катод из углерод-
вал между емкостью, электролизером и колонкой с
ного волокнистого материала ВИНН-250; 2) элек-
ионообменной смолой. Использовали электролизер
троизвлечение проводили в одну стадию на катод
с одной анодной и двумя катодными камерами, га-
из углеродного волокнистого материала. В обоих
баритная поверхность анода 960 см2. Электродные
случаях степень извлечения палладия более 99.5%.
камеры разделяли ионообменной мембраной
Последующее анодное растворение катодного осадка
МА-41-2Л. В качестве анодного материала исполь-
проводили в водном растворе HCl — 4.0 моль·л-1.
зовали углеродный волокнистый материал марки
Из полученного солянокислого раствора извлечение
НТМ-100, токоподвод — платинированный титан,
палладия осуществляли двумя методами: электрохи-
катод — титановая пластина.
мическим осаждением и экстракцией.
Результаты опытно-промышленных испытаний
Результаты исследований процесса извлечения и
показали, что разработанный процесс позволяет из-
аффинажа палладия из имитационных растворов при
влекать 95-97% иридия до остаточных концентраций
моделировании всей схемы, включающей двухста-
менее 1 мг·л-1, содержание его в полученных концен-
дийную экстракцию, электроизвлечение и электрора-
тратах (озоленной ионообменной смоле) — 4-19%
створение катодного осадка металлов (от маточного
(табл. 6). Следует отметить, что совместно с иридием
раствора до получения труднорастворимого палладо-
из промышленных растворов сорбируются и другие
азоаммина), подробно описаны в [8].
присутствующие в растворе платиновые металлы:
Платиновые металлы склонны к образованию
родий, рутений, платина, палладий (табл. 6). Можно
инертных комплексных соединений, особенно ха-
предположить, что при анодной обработке раствора
рактерных для иридия, родия, рутения, осмия, что
происходит лабилизация не только инертных форм
значительно осложняет задачу их извлечения из про-
иридия, но и других платиновых металлов, присут-
мышленных растворов. Наиболее сложным является
ствующих в растворе.
извлечение иридия, одним из основных источни-
Изменений показателей процесса электролиза в
ков которого являются ванны анодного растворе-
период промышленных испытаний вследствие воз-
ния, в частности никеля и меди. Перспективным и
можных изменений состояния поверхности углерод-
интересным является использование анодной ла-
ного волокнистого материала при анодной поляри-
Электролиз с углеродными волокнистыми электродами в процессах извлечения платиновых металлов...
1041
Таблица 6
Состав концентратов, полученных при проведении опытно-промышленных испытаний процесса извлечения
иридия из сернокислых растворов
Содержание в озоленном ионите, %
Ионит
платина
палладий
родий
иридий
рутений
сумма платиновых металлов
АМП
0.33
0.13
0.40
10.30
1.53
12.67
АМП+АВ-17
0.70
0.27
0.70
19.10
2.90
23.67
зации не выявлено. Электронно-микроскопические
Конфликт интересов
исследования образцов углеродных волокнистых
Авторы заявляют об отсутствии конфликта инте-
анодов, использованных в промышленных испыта-
ресов, требующего раскрытия в данной статье.
ниях, также не выявили каких-либо изменений в их
структуре.
Информация об авторах
Варенцов Валерий Константинович, д.т.н., проф.,
Выводы
Варенцова Валентина Ивановна, к.х.н.,
Таким образом, нами показана возможность эф-
фективного применения электролиза с углеродными
волокнистыми электродами для извлечения плати-
Список литературы
новых металлов из растворов, образующихся при
переработке минерального и техногенного сырья.
[1] Касиков А. Г., Дворникова А. М., Кшуманева Е. С.,
Для извлечения платиновых металлов на углеродные
Тюкин А. П. Экстракционное извлечение палладия
волокнистые электроды из сложных по составу раст-
из растворов гидрохлоридного выщелачивания пер-
воров необходимо использовать электролиз с посто-
вичного платинометалльного концентрата // Цв.
янным и переменным токовыми режимами, двух- и
металлы. 2018. № 7. С. 51-56.
трехстадийный электролиз, включающий электро-
[2] Андреев Ю. В., Петров Г. В., Грейвер Т. Н., Кова-
осаждение, анодное растворение выделившихся ме-
таллов, а также растворение за счет работы коротко-
замкнутой электрохимической системы углеродный
волокнистый материал-сплав металлов-раствор элек-
№ 510. С. 58-61.
тролита. Это обеспечивает отделение платиновых
[3] Jayakumar M., Venkatesan K. A., Srinivasan T. G.,
металлов от сопутствующих металлов, например,
Vasudeva Rao P. R. Extraction-electrodeposition
платины и палладия от меди и никеля (сернокислые
(EX-EL) process for the recovery of palladium from
растворы), платины от рения (солянокислые раство-
high-level liquid waste // J. Appl. Electrochem. 2009.
ры), палладия от родия и рутения (азотно-азотисто-
V. 39. N 10. Р. 1955-1962.
кислые растворы). Электролиз с углеродными во-
локнистыми электродами может использоваться как
[4] Gupta B., Singh I., Mahandra H. Extraction and
separation studies on Pt(IV), Ir(III) and Rh(III) using
самостоятельно, так и в сочетании с ионным обменом
sulphur containing extractant // Separation Purification
и экстракцией и позволяет обеспечить низкие оста-
Technol. 2014. V. 132. P. 102-109.
точные концентрации и высокую степень извлечения
платиновых металлов до 95-99.9%.
[5] Giridhar P., Venkatesan K. A., Srinivasan T. G.,
Результаты лабораторных исследований и про-
Rao P. R. V. Extraction of fission palladium by Aliquat
мышленных испытаний показали высокую эффектив-
336 and electrochemical studies on direct recovery from
ность технологии, совмещающей анодную электро-
химическую лабилизацию соединений платиновых
P. 30-39.
металлов на анодах из углеродных волокнистых мате-
риалов и последующее их сорбционное или экстрак-
[6] Wojnicki M., Pacławski K., Rudnik E. Kinetic studies
ционное концентрирование.
of the removal of Pt(IV) chloride complex ions from
1042
Варенцов В. К., Варенцова В. И.
acidic aqueous solutions using activated carbon //
Hydrometallurgy. 2011. V. 110. N 1-4. P. 56-61.
Теорет. основы хим. технологии. 2018. Т. 52. № 4.
С. 391-402.
[7]
[Varentsov V. K., Koshev A. N., Sukhov I. F.
phosphonium bromide as extractant for Rh(III), Ru(III)
[8]
Татарчук В. В. Дружинина В. В., Корда Т. М.,
Theoret. Foundations Chem. Eng. 2018. V. 52. N 4.
Варенцов В. К., Ренард Э. В., Торгов В. Г. Апробация
P. 495-505.
экстракционного процесса и аффинажа осколочного
палладия из имитационных нитратно-нитритных
[10] Варенцов В. К., Кошев А. Н., Варенцова В. И.
растворов // Химия в интересах устойчив. развития.
Современные проблемы электролиза и задачи оп-
2003. № 4. С. 659-666.
тимизации процессов в реакторах с трехмерными
[9]
Варенцов В. К., Кошев А. Н, Сухов И. Ф. Процессы
углеродными электродами. Пенза: ПГУАС, 2015.
С. 105-119.