Журнал прикладной химии. 2021. Т. 94. Вып. 4
КАТАЛИЗ
УДК 544.77:665.654.2
О МЕХАНИЗМЕ УДАЛЕНИЯ СЕРЫ ПРИ ГИДРОКОНВЕРСИИ
В ПРИСУТСТВИИ КАТАЛИЗАТОРА MoS2
© Х. М. Кадиев, А. М. Гюльмалиев, М. Х. Кадиева
Институт нефтехимического синтеза им. А. В. Топчиева РАН,
119991, ГСП-1, г. Москва, Ленинский пр., д. 29
E-mail: kadiev@ips.ac.ru
Поступила в Редакцию 9 августа 2020 г.
После доработки 29 декабря 2020 г.
Принята к публикации 15 февраля 2021 г.
Обсуждаются практические и теоретические аспекты превращения серосодержащих компонентов
при гидроконверсии тяжелого нефтяного сырья в присутствии каталитических систем на основе
наноразмерного MoS2. Термодинамическим расчетом температурных зависимостей равновесного
состава продуктов реакций гидрирования серосодержащих соединений установлено, что в широком
температурном интервале наиболее устойчивым продуктом является тиофен. Квантово-химически-
ми методами показано, что при хемосорбции молекулы водорода на валентно-ненасыщенных атомах
Мо происходит разрыв связи Н—Н, миграция атомов Н к другим валентно-ненасыщенным атомам
Мо, а также к атомам S. Исследование взаимодействия молекулы Н2S с кластерами Mo2S4 и Mo3S6
показало, что хемосорбция Н2S происходит на валентно-ненасыщенных атомах Мо с последующим
отрывом и миграцией атомов Н по поверхности кластера и выполнением ненасыщенным атомом S
роли донора — переносчика водорода. Показано, что серосодержащие соединения (меркаптаны, ти-
офен и дибензотиофен) также через атомы S хемосорбируются на валентно-ненасыщенных атомах
Мо, расположенных на гранях кластеров MoS2.
Ключевые слова: гидроконверсия; дисульфид молибдена; хемосорбция; гидрогенолиз; десульфуриза-
ция; метод функционала электронной плотности DFT b3lyp; переходное состояние; поверхность
потенциальной энергии
DOI: 10.31857/S0044461821040125
В результате роста спроса на энергоносители и
для десульфуризации тяжелого сырья. К настоящему
истощения запасов нефти в переработку все больше
времени изучено большое количество катализаторов
вовлекаются тяжелые нефти [1]. Для улучшения каче-
десульфуризации на основе сульфидов металлов Co,
ства товарных нефтепродуктов применяются гидро-
Ni, Mo на твердых носителях, эффективность кото-
генизационные процессы, в ходе которых удаляются
рых оценивается в реакциях превращения модельных
S-, N- и O-содержащие соединения, одновременно
серосодержащих соединений. Некоторые из этих
протекают реакции гидрогенолиза насыщенных и
катализаторов успешно применяются в промышлен-
гидрирования ненасыщенных соединений, а также
ных процессах [4]. В работах [2-5] обсуждается син-
десульфуризации [2-6], в связи с чем большое вни-
тез наноразмерных частиц MoS2 и их применение
мание уделяется разработке новых каталитических
в каталитической гидроконверсии и десульфуриза-
систем на основе сульфидов переходных металлов
ции тяжелого сырья. Однако, как отмечено в работе
525
526
Кадиев Х. М. и др.
[6], в настоящее время остаются малоизученными
соединяющий два минимума энергии на поверхности
природа активных центров катализаторов на основе
потенциальной энергии.
сульфидов переходных металлов, в частности MoS2,
Области термодинамической устойчивости мо-
механизм активации молекулы Н2 на активных цен-
дельных серосодержащих структур различной при-
трах катализаторов, а также механизм реакции пре-
роды оценивали с применением программного пакета
вращения серосодержащих компонентов сырья.
HSC Chemistry 6.***
Квантово-химические исследования реакций уда-
В исследованиях реакции удаления серы в про-
ления серы, катализируемых наноразмерными части-
цессе гидроконверсии использовали результаты ги-
цами MoS2, стабилизированными в углеводородной
дроконверсии тяжелого нефтяного сырья на пилот-
среде без традиционного твердого носителя, позволят
ной установке, описанной в работе [3]. Опыты по
установить энергетические характеристики элемен-
гидроконверсии проводили при Р = 7 МПа, T = 445°C,
тарных актов реакций, протекающих на активных
H2/сырье = 1000 нл/л как в присутствии наноразмер-
центрах катализатора, и способствуют дальнейшему
ного катализатора (MoS2) концентрацией 0.05 мас%
развитию методов получения и эффективного приме-
(в расчете на Мо), так и в его отсутствие. Катализатор
нения каталитических систем гидроочистки.
получали in situ из водного раствора прекурсора ката-
Цель работы — экспериментальная оценка актив-
лизатора [(NH4)6Mo7O24·4H2O (х.ч., ООО «Компания
ности катализатора (MoS2) в процессе гидроконвер-
Лабтех»)]. Исследованные образцы гудрона были
сии тяжелого нефтяного сырья, оценка термодина-
отобраны на разных нефтеперерабатывающих заво-
мической стабильности модельных серосодержащих
дах и различались по физико-химическим свойствам
соединений в условиях гидроконверсии и теорети-
и составу, в частности по содержанию серы, смол и
ческий анализ механизма гидрирования модельных
асфальтенов (табл. 1).
серосодержащих соединений.
Для уменьшения влияния глубины превращения
сырья на степень удаления серы в процессе гидро-
конверсии исследования активности катализатора
Экспериментальная часть
(MoS2) в процессе десульфуризации проводили при
Квантово-химические расчеты выполнены с при-
конверсии фракции сырья, выкипающей выше 520°C
менением метода функционала электронной плотно-
(далее фракция 520°C+), за проход равной 56-58%.
сти DFT b3lyp с использованием базисного набора
Фракционный состав сырья и продуктов реакции
DGDZVP [7]. Энергетические характеристики ато-
определяли по ГОСТ 11011-85 «Нефть и нефтепро-
мов и молекул оценивали по полной электронной
дукты. Метод определения фракционного состава в
энергии с учетом энергии нулевых колебаний Е0.
аппарате АРН-2». Содержание серы определяли с
Проведен расчет энергии минимумов и седловых то-
помощью рентгенофлуоресцентного энергодиспер-
чек на поверхности потенциальной энергии и сечений
сионного анализатора Спектроскан S (ООО «НПО
поверхности потенциальной энергии по координате
«СПЕКТРОН»). Групповой состав сырья определяли
реакций.
методом жидкостно-адсорбционной хроматографии с
Потенциальные поверхности энергии взаимодей-
градиентным вытеснением и разделением на лабора-
ствия молекул М с кластерами MoS2 строили с оп-
торном жидкостном хроматографе Градиент-М (АО
тимизацией геометрических параметров комплекса
«ИНХП»).
М + кластер MoS2. Положение переходного состояния
Количество серы, удаленной из широкой фракции
между двумя минимумами на поверхности потенци-
продуктов (гидрогенизатов) и дистиллятных фракций
альной энергии определяли с применением методов
(НК-180°C, 180-350°C) в ходе каталитической гидро-
линейного синхронного транзита (TS) и квадратич-
конверсии (∆S, %), вычисляли по формуле
ного синхронного транзита (QST2, QST3)* по нали-
чию только одного мнимого собственного значения
,
(1)
матрицы Гессе**. Путем поиска внутренней коорди-
наты реакции (метод IRC) определяли путь реакции,
где S0 — содержание серы (мас%) в гидрогенизатах
и дистиллятных фракциях, полученных в опытах без
* Бутырская Е. В., Нечаева Л.С. Компьютерная химия.
катализатора, SMo — содержание серы (мас%) в ги-
Воронеж: Издат.-полиграф. центр Воронеж. гос. ун-та,
2011. С. 23.
** Цирельсон В. Г. Квантовая химия молекулы, молеку-
лярные системы и твердые тела. М.: БИНОМ. Лаборатория
граммного пакета HSC Chemistry, 2020 (дата обращения:
знаний, 2010. С. 30-33.
10.08.2020).
О механизме удаления серы при гидроконверсии в присутствии катализатора MoS2
527
Таблица 1
Свойства сырья гидроконверсии
Показатель
Гудрон 1
Гудрон 2
Гудрон 3
Плотность сырья, кг·м-3
1013
1003
991
Cодержание фр. >520°С, мас%
84.9
83.4
85.6
Содержание серы, мас%
3.3
3.5
2.9
Содержание смол, мас%
29.1
30.4
26.4
Содержание асфальтенов, мас%
10.9
13.4
4.7
Вязкость при 100°C, мм2·с-1
365
394
466
дрогенизатах и дистиллятных фракциях, полученных
акционную способность типичных серосодержащих
в опытах в присутствии катализатора.
соединений, таких как меркаптаны, сульфиды, ди- и
полисульфиды, тиофен, тиофан, тиазол, бензотиофан,
дибензотиофен, в реакциях гидрирования в условиях,
Обсуждение результатов
близких к условиям процесса гидроконверсии, т. е.
Реакционная способность сераорганических со-
при температуре Т = 420°С и давлении Р = 7 МПа.
единений в процессе десульфуризации в присут-
Перечень исходных серосодержащих соединений и
ствии традиционных алюмоникель-молибденовых
продуктов реакций гидрирования серосодержащих
катализаторов уменьшается в следующей последова-
соединений, а также их начальное количество C0
тельности: меркаптаны > дисульфиды > сульфиды ~
приведены в табл. 2.
~ тиофаны > тиофены > бензотиофены > дибензоти-
Термодинамические расчеты при давлении в зоне
офены [7, 8]. Представляет интерес рассмотреть ре- реакции 7 МПа показали, что единственным серо-
Таблица 2
Модельные серосодержащие соединения различного класса
Соединение
C0, моль
Соединение
C0, моль
СН3СН2SH
1
1
СН3СН2CH2SH
1
1
СН3СН2CH2CH2SH
1
1
СН3СН2CH2CH2CH2SH
1
Н2
20*
СН3СН2CH2CH2H2CH2SH
1
H2S
0
СН3СН2CH2CH2H2CH2CH2SH
1
S2
0
S(CH3)2
1
CH4
0
CH3CH2SCH3
1
CH3CH3
0
S(CH2CH3)2
1
CH3CH2CH3
0
CH3CH2CH2SCH3
1
0
CH3CH2S—SCH3
1
* Исходное число молей Н2 принято C0 = 20 моль, чтобы обеспечить избыток водорода для протекания реакции де-
структивного гидрирования.
528
Кадиев Х. М. и др.
Таблица 3
Результаты гидроконверсии тяжелого нефтяного сырья
Показатель
Гудрон 1
Гудрон 2
Гудрон 3
Катализатор
—
MoS2
—
MoS2
—
MoS2
Температура, °C
445
445
445
445
445
445
Объемная скорость подачи сырья, ч-1
3.0
3.0
2.0
2.0
1.5
1.5
Конверсия фракции 520°C+, мас%
60.2
56.7
65.1
58.4
69.6
56.2
Содержание серы в продуктах, мас%:
S0
SMo
∆S
S0
SMo
∆S
S0
SMo
∆S
Гидрогенизат
3.28
2.12
35
3.59
2.57
28
2.37
2.11
11
Фракция НК-180°C
1.26
1.01
20
1.02
0.75
26
0.95
0.63
33
Фракция 180-350°C
2.74
1.97
28
2.21
1.89
14
2.1
1.88
10
содержащим органическим соединением, которое
что может быть обусловлено отсутствием термоста-
присутствует в равновесной системе в небольшом ко-
бильных серосодержащих компонентов в составе
личестве практически во всем интервале температур,
фракции НК-180°C. Характер изменения степени
является тиофен (рис. 1). Этот вывод согласуется со
удаления серы, наблюдаемый для фракций продуктов
сложившимся мнением, что среди серосодержащих
гидроконверсии сырья с разными характеристиками,
соединений в нефтях наиболее устойчивыми являют-
позволяет предположить, что устойчивые в условиях
ся тиофен и его производные [9]. Следует ожидать,
гидроконверсии моно- и полициклические гомологи
что в условиях гидроконверсии полное удаление серы
тиофена концентрируются преимущественно в вы-
не представляется возможным, о чем свидетельству-
сококипящих фракциях продуктов гидроконверсии.
ют результаты гидроконверсии образцов тяжелого
Таким образом, состав сырья и присутствие катали-
нефтяного сырья на пилотной установке (табл. 3).
затора влияют в целом на эффективность процесса
Введение катализатора позволяет снизить содер-
гидроконверсии, важной частью которого является
жание серы в продуктах гидроконверсии (табл. 3).
превращение серосодержащих компонентов.
Кроме того, в условиях каталитической гидроконвер-
Нами был проведен анализ взаимодействия мо-
сии в присутствии наноразмерного MoS2 степень уда-
лекулы водорода Н2 с кластером MoS2. Согласно
ления серы из гидрогенизата и фракции 180-350°C
литературным данным [10, 11], атомы Мо в кластерах
снижается вместе со снижением плотности и повы-
MoS2 гексагональной и ромбоэдрической кристал-
шением вязкости исходного сырья (табл. 1). Степень
лических структур окружены шестью атомами S в
удаления серы из фракции НК-180°C при этом растет,
тригонально-призматической (2Н) и октаэдрической
координации (1Т). Активными центрами в катали-
тических реакциях являются координационно-не-
насыщенные атомы Mo, расположенные на ребрах
кристаллической структуры. Различия в кристалли-
ческих структурах 2Н и 1Т обусловливают различия
их электронной структуры (рис. 2). В колебатель-
ном спектре 2Н-структуры присутствует мнимая
частота, свидетельствующая о том, что минимум
энергии кластера Mo3S6 не найден, так как кластер с
точечной симметрией С3h имеет вырожденную вол-
новую функцию и, согласно эффекту Яна-Теллера,
неустойчив.* После хемосорбции Н2 комплекс
[H2∙∙∙Mo3S6] переходит в устойчивое состояние, и
система характеризуется минимумом электронной
энергии [12].
Рис. 1. Равновесный состав продуктов гидрирования
* Цирельсон В. Г. Квантовая химия молекулы, молеку-
модельных серосодержащих соединений.
лярные системы и твердые тела. М.: БИНОМ. Лаборатория
S(M) — моноклинная сера, S — ромбическая сера.
знаний, 2010. С. 330.
О механизме удаления серы при гидроконверсии в присутствии катализатора MoS2
529
E0 = -14320.7113 a. e.
E0 = -14320.8096 a. e.
ΔE = - 62 ккал·моль-1
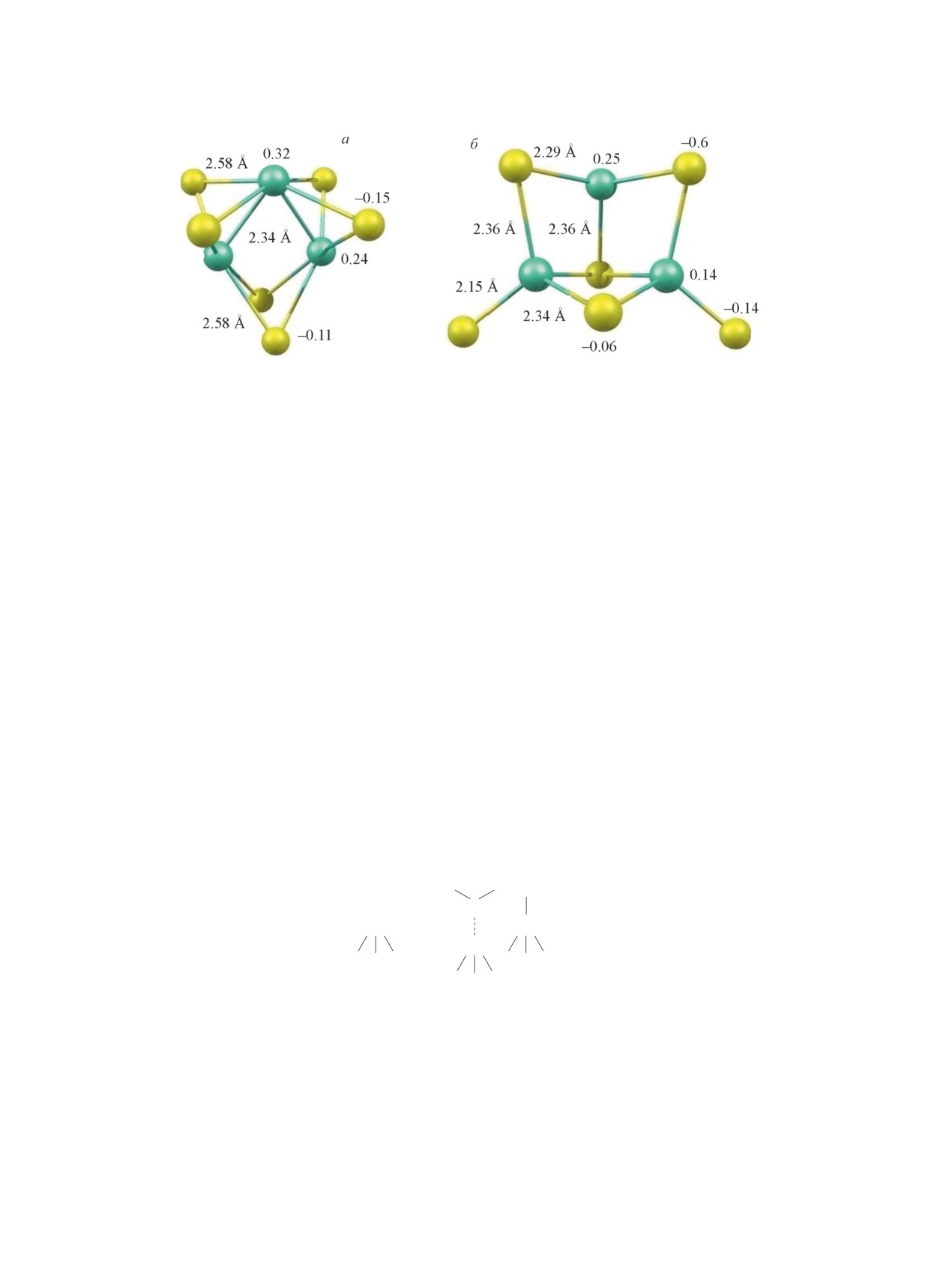
Рис. 2. Малликеновские заряды на атомах и длины связей кластеров Mo3S6 кристаллических модификаций MoS2
типа 2H (а) и 1Т (б).
Рассмотрим в качестве модельных кластеров с
поверхностным атомам кристаллической решетки
разными размерами кластеры Mo2S4 и Mo3S6. После
кластера MoS2 после их хемосорбции на атоме Мо
присоединения Н2 к кластеру Mo3S6 2Н-модификации
подтверждается существованием минимумов элек-
система [H2∙∙∙Mo3S6] не имеет вырожденных элек-
тронной энергии комплексов и низкими значениями
тронных уровней (симметрию С3h), и при оптими-
энергии переходного состояния между локальными
зации структуры комплекса полная энергия системы
минимумами, показывающими, что структуры, соот-
снижается до минимума. В случае 1Т-модификации
ветствующие этим минимумам, могут легко перехо-
кластера Mo3S6 комплекс с Н2 энергетически намно-
дить друг в друга.
го более устойчив, чем в случае 2Н-модификации
При изучении взаимодействия Н2S с кластером
кластера Mo3S6 (рис. 3). Существенно то, что сна-
Mo3S6 рассмотрены схемы реакций (1)-(3). Стадии
чала молекула Н2 с разрывом связи Н—Н координи-
образования комплекса [H2S∙∙∙Mo3S6] (2) и его раз-
руется координационно-ненасыщенными атомами
рушения на продукты Mo3S7 + H2 (3) являются эк-
Мо, а затем, благодаря низким значениям энергии
зотермическими. Следовательно, Н2S в присутствии
перехода между минимумами энергии, возможна
MoS2 становится донором водорода, атом S входит в
миграция атомов Н к другим атомам Мо и атомам S
координационную сферу валентно-ненасыщенного
(рис. 3). Следовательно, в кристаллической решет-
атома Mo, находящегося на грани кластера, а атомы
ке кластеров MoS2 валентно-ненасыщенные атомы
H могут участвовать в реакциях гидрирования или
Мо, расположенные на ребрах, играют роль «актив-
образовывать молекулу Н2.
ного центра». Возможность миграции атомов Н по
H
H
S
S
Mo + H2S →
→ Mo + H2;
(1)
Mo
Mo3S6 + H2S → [H2S∙∙∙Mo3S6], ΔE0 = -15 ккал·моль-1;
(2)
[H2S∙∙∙Mo3S6] → Mo3S7 + H2, ΔE0 = -1 ккал·моль-1.
(3)
Энергия активации реакции H2S с кластером
единения водорода с образованием хемосорбирован-
Mo3S6 составляет 13 ккал·моль-1, энергия хемосо-
ного на кластере H2S — составляет 51 ккал·моль-1
рбции H2S на Mo3S6 — 15 ккал·моль-1, а энерге-
(рис. 4, табл. 4). Следовательно, хемосорбированный
тический барьер реакции разложения комплекса
H2S на кластере Mo3S6 практически в равной степени
[H2S∙∙∙Mo3S6] на продукты Mo3S7 и Н2 составляет
является донором и акцептором водорода.
51 ккал·моль-1. Барьер обратной реакции — присо-
530
Кадиев Х. М. и др.
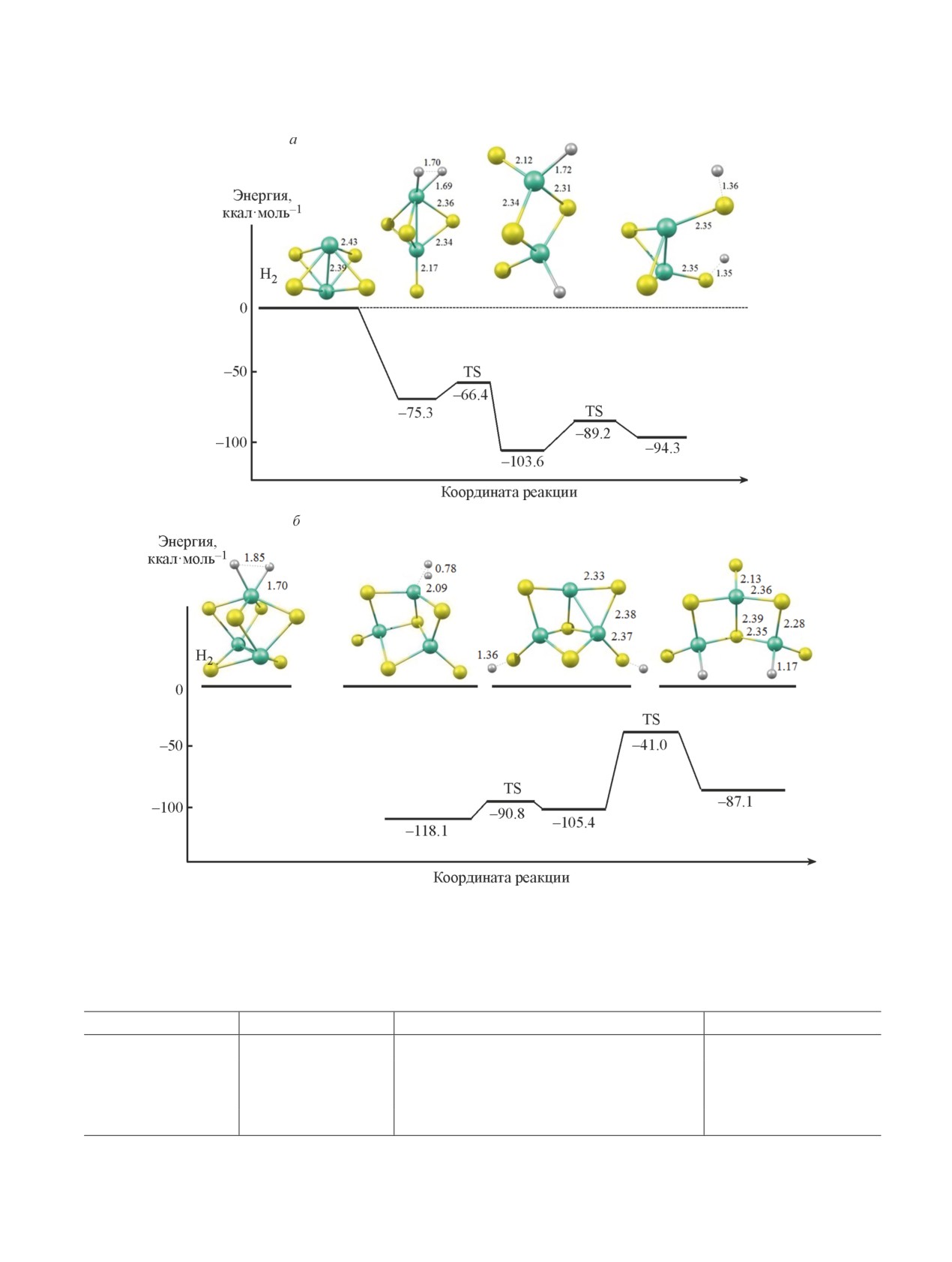
Рис. 3. Энергии некоторых локальных минимумов и переходных состояний между ними на поверхности потенци-
альной энергии взаимодействия в комплексах [H2∙∙∙Mo2S4] (а) и [H2∙∙∙Mo3S6] (б).
Таблица 4
Энергия ∆Е0 процесса отрыва атома водорода от сероводорода*
Молекула
E0, а. е.
Реакция
∆Е0,** ккал·моль-1
H
-0.5005
H2S = SH• + H
85
H2
-1.1660
H2S = S + H2
101
SH•
-398.7078
[H2S∙∙∙Mo3S6] = [Mo3S7H]• + H
39
H2S
-399.3443
[H2S∙∙∙Mo3S6] = Mo3S7 + H2
-1
* Е0(S ) = -398.0179 а. е., Е0(Mo3S7) = -14720.1783 а. е., Е0(Mo3S7H•) = -14719.6152 а. е.
** 1 а. е. = 627.5095 ккал·моль-1.
О механизме удаления серы при гидроконверсии в присутствии катализатора MoS2
531
Рис. 4. Энергии некоторых локальных минимумов и переходных состояний на поверхности потенциальной энергии
взаимодействия Н2S с кластером Mo3S6.
При изучении взаимодействия меркаптанов
нулю. В равновесном состоянии энергия адсорбции
(R—SH2), в частности, этантиола, с кластером Mo3S6
молекулы на поверхности складывается из энергий
учитывали, что при координации атомов S этантиола
межмолекулярных взаимодействий различной приро-
на атоме Мо кластера Mo3S6 возможны два маршру-
ды, которые зависят от взаимного расположения мо-
та превращения: по первому образуются Mo3S6—
лекул. Следовательно, устойчивость π-типа структур
SH2 и этилен (рис. 5, а; энергия активации Еакт =
комплекса адсорбент-адсорбат будет зависеть от раз-
= 25 ккал·моль-1), по второму — Mo3S7 и этан
меров адсорбата. Таким образом, для конденсирован-
(рис. 5, б; согласно методу расчета IRC, Еакт =
ных ароматических систем адсорбция π-типа должна
= 11 ккал·моль-1). Хемосорбция меркаптанов на кла-
быть более устойчивой. Но, как было показано выше,
стерах MoS2, как и в случае с H2S, происходит через
при хемосорбции на валентно-ненасыщенном ато-
атомы S с последующим встраиванием атома S в
ме Мо образуется комплекс σ-типа с более прочной
координационную сферу валентно-ненасыщенных
связью, следовательно, для малых молекул энергия
атомов Мо.
хемосорбции может быть выше, чем энергия адсорб-
Одним из обсуждаемых в литературе вопросов
ции. Важно отметить, что дибензотиофен через атомы
является характер взаимодействия серосодержащих
S по σ-типу координируется с атомом Мо, π-орбитали
ароматических структур, таких как тиофен, дибензо-
атомов бензольных колец в верхней занятой молеку-
тиофен и их производных, с поверхностью кластера
лярной орбитали комплекса не участвуют, что также
дисульфида молибдена [4]. В работе [13] показано,
свидетельствует о σ-характере связи молекулы дибен-
что состояние, когда плоскость молекулы параллель-
зотиофена с кластером Mo3S6 (рис. 6, а, б).
на поверхности катализатора (π-адсорбция), энер-
Тиофен и его производные гидрируются труднее,
гетически более выгодно, чем в случае, когда пло-
чем меркаптаны [9]. В случае взаимодействия Mo3S6-
скость молекулы расположена перпендикулярно к
SH2 + тиофен (рис. 6, в, г) происходит поэтапное
поверхности катализатора (σ-адсорбция). Отметим,
гидрирование тиофена. Интересно отметить, что в про-
что адсорбция является самопроизвольным процес-
цессе гидрогенолиза тиофена за счет взаимодействия
сом и протекает с энергией активации, близкой к
SH-группы катализатора с Н2 образуется H2S [14].
532
Кадиев Х. М. и др.
Рис. 5. Энергетические характеристики реакции взаимодействия этантиола с кластером Mo3S6: энергии локальных
минимумов стадии образования Mo3S6—SH2 и этилена (а) и поверхности потенциальной энергии стадии образо-
вания Mo3S7 и этана (б).
Рис. 6. Оптимизированная структура комплексов Mo3S6 + дибензтиофен (а) и контур ее верхней занятой молеку-
лярной орбитали (б), комплексов Mo3S6—SH2 + тиофен (в, г).
О механизме удаления серы при гидроконверсии в присутствии катализатора MoS2
533
взаимодействии с активными центрами катализатора
MoS2 выступает в роли донора водорода.
Финансирование работы
Исследование выполнено на базе Института не-
фтехимического синтеза РАН за счет гранта Россий-
ского научного фонда.
Конфликт интересов
Авторы не имеют конфликта интересов, требую-
щего раскрытия в данной статье.
Рис. 7. Температурная зависимости равновесного со-
става продуктов реакции гидрирования тиофена без его
Информация об авторах
деструкции.
Кадиев Хусаин Магамедович, д.х.н.,
Термодинамическую устойчивость продуктов ре-
Гюльмалиев Агаджан Мирза-оглы, д.х.н.,
акции гидрирования тиофена оценим по равновес-
ному составу продуктов гидрирования. Возможные
Кадиева Малкан Хусаиновна, к.х.н.,
продукты реакции гидрирования тиофена без его
деструкции следующие:
Список литературы
[1] Хаджиев С. Н., Кадиев Х. М., Кадиева М. Х. Синтез
,
,
,
,
и свойства наноразмерных систем в качестве катали-
CH3
заторов гидроконверсии тяжелого нефтяного сырья
// Нефтехимия. 2014. Т. 54. № 5. С. 327-351. https://
CH3—C—SH,
doi.org/10.7868/S0028242114050062 [Khadzhiev S. N.,
Kadiev Kh. M., Kadieva M. Kh. Synthesis and
CH3
properties of nanosized systems as efficient catalysts
for hydroconversion of heavy petroleum feedstock //
CH3CH2CH2CH2SH,
CH3CH(SH)CH2CH3,
Petrol. Chem. 2014. V. 54. N 5. P. 323-346.
(CH3)2CHCH2SH, CH3CH2CH(SH)CH3, (CH3CH2)2S,
CH3CH2CH2—S—CH3. Устойчивыми при давлении
[2] Khadzhiev S. N., Kadiev Kh. M., Yampolskaya G. P.,
7 МПа во всем интервале температур являются мо-
Kadieva M. Kh. Trends in the synthesis of metal oxide
лекулы бутан-2-тиола и тиофена (рис. 7).
nanoparticles through reverse microemulsions in
hydrocarbon media // Adv. Colloid Interface Sci. 2013.
V. 197-198. P. 132-145.
Выводы
В процессе гидроконверсии тяжелого нефтяного
[3] Кадиев Х. М., Хаджиев С. Н., Кадиева М. Х. Синтез
сырья в присутствии каталитических систем на ос-
и применение наночастиц полифункционального ка-
нове сульфида молибдена активными центрами ката-
тализатора для гидроконверсии природного битума
// Нефтехимия. 2013. Т. 53. № 5. С. 337-348.
лизатора, на которых протекают первичные реакции
молекул водорода и серосодержащих соединений,
[Kadiev Kh. M., Khadzhiev S. N., Kadieva M. Kh.
являются валентно-ненасыщенные атомы молибдена,
Synthesis and use of polyfunctional catalyst
расположенные на гранях кристаллической струк-
nanoparticles for hydroconversion of natural bitumen
туры кластера MoS2. Серосодержащие соединения
// Petrol. Chem. 2013. V. 53. N 5. P. 298-308.
(меркаптаны, тиофен, дибензотиофен) взаимодей-
ствуют с MoS2 по σ-механизму, при деструкции хемо-
[4] Томина Н. Н., Пимерзин А. А., Моисеев И. К. Суль-
сорбированных серосодержащих соединений атомы
фидные катализаторы гидроочистки нефтяных фрак-
серы входят в координационную сферу атома молиб-
ций // Рос. хим. журн. 2008. Т. LII. № 4. С. 41-52.
дена кластера MoS2, а в присутствии H2 могут выде-
[5] Никульшин П. А., Томина Н. Н., Пимерзин А. А.
литься в виде H2S. Сероводород в атмосфере H2 при
Активность катализаторов гидродесульфирова-
534
Кадиев Х. М. и др.
ния на основе гетерополисоединений молибдена
[11]
Хаджиев С. Н., Кадиев Х. М., Гюльмалиев А. М.,
6 ряда в реакции гидрогенолиза тиофена // Изв.
Кадиева М. Х. Свойства и структура наноразмер-
вузов. Химия и хим. технология. 2007. Т. 50. № 9.
ных каталитических систем на основе сульфидов
С. 54-57.
молибдена // Наногетероген. катализ. 2017. Т. 2.
[6] Krebs E., Daudin A., Raybaud P. DFT study of
№ 2. С. 110-118.
CoMoS and NiMoS catalysts: From nano-crystallite
morphology to selective hydrodesulfurization // Oil
[Khadzhiev S. N., Kadiev Kh. M., Gulmaliev A. M.,
Gas Sci. Technol. 2009. V. 64. N 6. Р. 707-718.
Kadieva M. Kh. Properties and structure of nanosized
catalyst systems based on molybdenum sulfides //
[7] Никульшин П. А., Еремина Ю. В., Томина Н. Н.,
Petrol. Chem. 2017. V. 57. N 14. P. 1277-1286.
Пимерзин А. А. Влияние природы предшест-
венников алюмоникельмолибденовых катализа-
[12]
Dumeignil F., Paul J.-F., Veilly E., Qian E. W.,
торов на их активность в гидродесульфировании
Ishihara A., Payen E., Kabe T. Description of
// Нефтехимия. 2006. Т. 46. № 5. С. 371-376
coordinatively unsaturated sites regeneration over
[Nikulʹshin P. A., Eremina Yu. V., Tomina N. N.,
MoS2-based HDS catalysts using 35S experiments
Pimerzin A. A. Influence of nature of preсursors
combined with computer simulations // Appl. Catal.
of aluminum-nickel-molybdenum catalysts on
A: General. 2005. V. 289. Р. 51-58.
their performance in hydrodesulfurization //
Petrol. Chem. 2006. V. 46. N 5. P. 343-348.
[13]
Cristol S., Paul J.-F., Payen E., Bougeard D.,
Hutschka F., Clemendot S. DBT derivatives adsorption
[8] Breysse M., Djega-Mariadassou G., Pessayre S.,
over molybdenum sulfide catalysts: A theoretical study
Geantet C., Vrinat M., Perot G., Lemaire M. Deep
// J. Catal. 2004. V. 224. Р. 138-147.
desulfurization: Reactions, catalysts and technological
challenges // Catal. Today. 2003. V. 84. Р. 129-138.
[14]
Kogan V. M., Isaguliants G. V. The HDS mechanism:
Which «auxiliary» process takes place — sulfur
[9] Калечиц И. В. Химия гидрогенизационных про-
isotopic exchange or replacement — and why is it
цессов в переработке топлив. М.: Химия, 1973.
important to know it? // Catal. Today. 2008. V. 130.
C. 240-255.
N 1. P. 243-248.
[10] Qing T., De-en J. Stabilization and band-gap tuning of
the 1T-MoS2 monolayer by covalent functionalization
// Chem. Mater. 2015. V. 27. Р. 3743-3748.