РАСПЛАВЫ
4 · 2019
УДК 544.35
ТЕМПЕРАТУРЫ ЛИКВИДУСА РАСПЛАВОВ KF-KCl-KI
© 2019 г. А. О. Худорожковаa, А. В. Исаковa, *, А. А. Редькинa, Ю. П. Зайковa
aИнститут высокотемпературной электрохимии УрО РАН,
Екатеринбург, 620990 Россия
*e)mail: isakov@ihte.uran.ru
Поступила в редакцию 12.08.2018
После доработки 29.08.2018
Принята к публикации 05.09.2018
Определены температуры ликвидуса тройной взаимной системы KF-KCl-KI
при мольном соотношении KF/KCl 0.8 и 2 методом термического анализа кривых
охлаждения и дифференциальной сканирующей калориметрии. Получены темпера
турные зависимости температуры ликвидуса от содержания иодида калия для рас
плавов [45KF-55KCl, мол. %]-KI, [66KF-34KCl, мол. %]-KI зарегистрированы.
Результаты обобщены в виде двух разрезов тройной взаимной системы KF-KCl-KI.
Данные, полученные методом термического анализа, согласуются с данными диф
ференциальной сканирующей калориметрии и термогравиметрии. Методом син
хронного термического анализа подтверждено, что система KF-KCl-KI имеет эв
тектику 25KF-34KCl-41KI (мол. %) с температурой плавления 750 K.
Ключевые слова: фторид калия, хлорид калия, иодид калия, температура ликвидуса,
термический анализ, дифференциальная сканирующая калориметрия.
DOI: 10.1134/S023501061904008X
ВВЕДЕНИЕ
Расплавы солей широко используются в технологиях металлургии и высокотемпе
ратурных электрохимических процессах для получения металлов, материалов и спла
вов различного назначения [1]. Расплавленные солевые электролиты находят примене
ние в атомной энергетике [2, 3]. Многокомпонентные расплавы галогенидов щелочных
металлов являются перспективными электролитами для развития электрохимических
процессов получения компактных осадков и наноматериалов [4-6].
Важной характеристикой солевых расплавов является температура первичной кри
сталлизации - температура ликвидуса. Исследование свойств расплавов, выбор пара
метров процессов основанных на данных о плавлении. Знание температур ликвидуса
позволяет подобрать состав флюсов и расплавленных электролитов обладающих наи
меньшей температурой кристаллизации. Исследовано значительное количество слож
ных солевых систем, данные по которым систематизированы в работах [7, 8]. Однако
по мере развития представлений о процессах получения материалов может потребо
ваться исследование новых взаимных систем.
В последнее время развиваются процессы получения электролизом расплавов
кремния и тонких пленок кремния на различных подложках [9-12]. В системе KF-
KCl-K2SiF6 получены результаты, позволяющие применить расплавы солей для син
теза частей фотоэлектрических элементов [11].
Перспективной системой для синтеза тонких пленок кремния (толщиной до 800 нм
[10]) являются расплавы на основе KF-KCl-KI, содержащие гексафторсиликат ка
лия. Получены данные по катодным процессам в расплавах KF-KCl-KI-K2SiF6 и
данные по структуре и морфологии катодных осадков [10, 13, 14]. Однако развитие
376
А. О. Худорожкова, А. В. Исаков, А. А. Редькин, Ю. П. Зайков
синтеза тонких пленок кремния из расплавов KF-KCl-KI-K2SiF6 требует знания их
физико химических свойств, в том числе температур первичной кристаллизации
тройной взаимной системы KF-KCl-KI. Перспективными расплавами для синтеза
тонких пленок кремния являются KF-KCl-KI-K2SiF6 с мольным соотношением
KF/KCl равным 0.8 и 2.
На сегодняшний день имеются данные по температурам ликвидуса и солидуса си
стемы KF-KCl-KI. Построены диаграммы состояния двойных систем KF-KCl, KF-KI,
KI-KCl [7, 8]. В работах [15-18] представлены данные и расчеты по проекции темпе
ратур ликвидуса KF-KCl-KI системы.
В работе [15] выполнено исследование температур ликвидуса расплавов KF-KCl-KI.
Данные обобщены в виде концентрационного треугольника KF-KCl-KI с проекцией
температур ликвидуса. На треугольнике графически представлены два разреза с по
стоянным мольным соотношением KCl/KI. Численные данные в работе не представ
лены, за исключением точки тройной эвтектики KF-KCl-KI с составом 25KF-
34KCl-41KI (мол. %) и температурой плавления 761 K. Значения температур плавле
ния индивидуальных солей, принятые в работе [15] ниже известных для KF на 6 K и
KI на 5 K. Температура эвтектики KCl-KI также на 13 K ниже принятой. Исследова
ние проводили на воздухе, сведений о специальной подготовке индивидуальных со
лей не представлено. Позже эти результаты были приведены в работе [16].
В статье [17] представлена диаграмма KF-KCl-KI, рассчитанная при помощи ин
терполяционного метода Колера из систем: KF-KCl, KF-KI, KI-KCl. Точность рас
четов температуры ликвидуса составила ±20 К. Установлено, что расчетная тройная
эвтектика соответствует составу 25KF-34KCl-41KI (мол. %) с температурой ликвиду
са 753 K. В работе [18] предложен способ выявления эвтектической области тройных
солевых систем. На основании расчетов показано, что температура плавления состава
25KF-34KCl-41KI (мол. %) может составлять около 761 K.
В работе [19] определены температуры ликвидуса систем KF-KCl-K2SiF6 и KF-
KCl-K2SiF6-SiO2. Показано, что перспективными расплавами для получения крем
ниевых материалов по совокупности свойств являются системы KF-KCl-K2SiF6 с
мольным соотношением KF/KCl равным 0.8 и 2. Однако влияние добавок KI на диа
пазоны гомогенности фонового расплава исследовано не было.
Таким образом, доступны только расчетные численные данные по расплавам
KF⎯KCl-KI.
Основной целью данной работы было исследование влияния содержания KI на
температуру ликвидуса перспективных для синтеза тонких пленок кремния расплавов
KF-KCl-KI с получением численных данных для последующего использования в
электрохимическом эксперименте.
Обобщение полученных данных по взаимной системе KF-KCl-KI методами син
хронного термического анализа и анализа кривых охлаждения позволит оценить зоны
гомогенности расплавов для синтеза тонких пленок кремния.
МЕТОДИКА ЭКСПЕРИМЕНТА
Изучение температур ликвидуса проводили в расплавах KF-KCl-KI приготовлен
ных из индивидуальных солей. Для приготовления расплавов использовали: KF · HF
(99.97 мас. %) и KCl (99.9 мас. %) производства “Реахим”, KI (чистотой 99.9 мас. %)
предоставленный “Химреактивснаб”.
Хлорид калия сушили в стеклоуглеродном тигле под вакуумом при температуре
923 K в течение 4 ч. Затем соль плавили и выдерживали при 1073 K в течение часа, по
сле чего охлаждали.
Иодид калия для удаления кислородных примесей иодировали с использованием
кристаллического иода. Смесь иода и иодида калия помещали в стеклоуглеродный кон
Температуры ликвидуса расплавов KF-KCl-KI
377
6
Ar
7
5
8
4
Ar
3
9
2
10
1
Рис. 1. Схема ячейки для измерения темпертары ликвидуса: 1 - кварцевая реторта; 2 - графитовая подстав
ка; 3 - стеклоуглеродный контенер; 4 - графитовые экраны; 5 - фторопластовая пробка; 6 - вход аргона;
7 - резиновые уплотнения; 8 - выход аргона; 9 - термопара; 10 - расплав солей.
тейнер с закрытый крышкой и вели процесс иодирования при 723 К до испарения иода.
Кристаллический иод добавляли с избытком для удаления кислорода по реакции:
2K2O + 2I2 = 4KI + O2.
(1)
Подготовленный хлорид калия смешивали с калием фтористым кислым в необхо
димом количестве и переплавляли на воздухе. Расплав KF-KCl выдерживали на воз
духе в течение 3 ч. Фторид водорода удалялся из расплава вследствие термического
разложения KF · HF. Далее KF-KCl замораживали и направляли на приготовление
расплавов. Образцы готовили сплавлением KF-KCl и KI.
Определение температуры ликвидуса проводили методом термического анализа.
Регистрацию кривых охлаждения расплава проводили в специальной оснастке в атмо
сфере аргона. Схема ячейки для измерения температур ликвидуса представлена на
рис. 1.
Исследования проводили в стеклоуглеродном контейнере марки СУ 2000. После
расплавления погружали термопару в расплав и отключали нагрев печи. Затем вели
регистрацию зависимости термо ЭДС от времени - кривых охлаждения. Типичный
вид кривых охлаждения представлен на рис. 2.
Для регистрации кривых использовали платинородиевую термопару марки (типа)
ТПП 10 E производства АО “ЕЗ ОЦМ” c измеряемым диапазоном температур 273-
1573 К. Предел отклонения для термопары в диапазоне температур 273-1373 К со
ставлял ±1 К. Температуру окружающей среды компенсировали погружением холод
ных концов термопары в термостатированный сосуд со льдом и дистиллированной
водой. Регистрацию температуры проводили с помощью высокоомного мультиметра
Appa 109 N (APPA Technology Corporation). Взвешивание солей и образцов производи
ли на весах Shimadzu с точностью 0.001 г. Хранение солей и плавов осуществляли в
светонепрозрачной таре, размещенной в сухом боксе с атмосферой азота.
378
А. О. Худорожкова, А. В. Исаков, А. А. Редькин, Ю. П. Зайков
E, мВ
5.9
5.5
5.1
4.7
4.363
4.3
4.110
3.9
0
1000
2000
3000
4000
5000
6000
Время, с
Рис. 2. Кривая охлаждения расплава [45KF-55KCl]-50 KI, мол. %.
Определение диапазонов гомогенности расплавов проводили методом синхронно
го термического анализа, используя термический анализатор TA 449C Jupiter. Син
хронный термический анализ включал в себя два метода: дифференциальную скани
рующую калориметрию и термогравиметрию. Анализ выполняли в атмосфере аргона.
Скорость нагрева составляла 10 град/мин.
Химический состав солей контролировали при помощи метода эмисионной спек
троскопии с индуктивно связанной плазмой на спектрометре iCAP 6300 Duo Thermo
scientific. Мольное соотношение в расплавах KF-KCl контролировали измерением
температуры ликвидуса и сопоставлением с данными работ [7, 19].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Были изучены свойства расплавов с мольным соотношением KF/KCl равном 0.8
и 2. Эти соотношения характеризуют центральную часть тройной взаимной системы
KF-KCl-KI и позволяют наиболее полно составить представление о проекции темпе
ратур ликвидуса в концентрационном треугольнике. Экспериментальные данные по
температурам ликвидуса представлены в табл. 1.
Результаты термического анализа показывают, что добавки иодида калия в расплав
45 KF-55KCl (мол. %), (отношение KF/KCl = 0.8) приводят к снижению температуры
ликвидуса вплоть до эвтектической точки. Для системы состава 66.6KF-33.4KCl (мол. %)
введение иодида калия имеет схожую тенденцию.
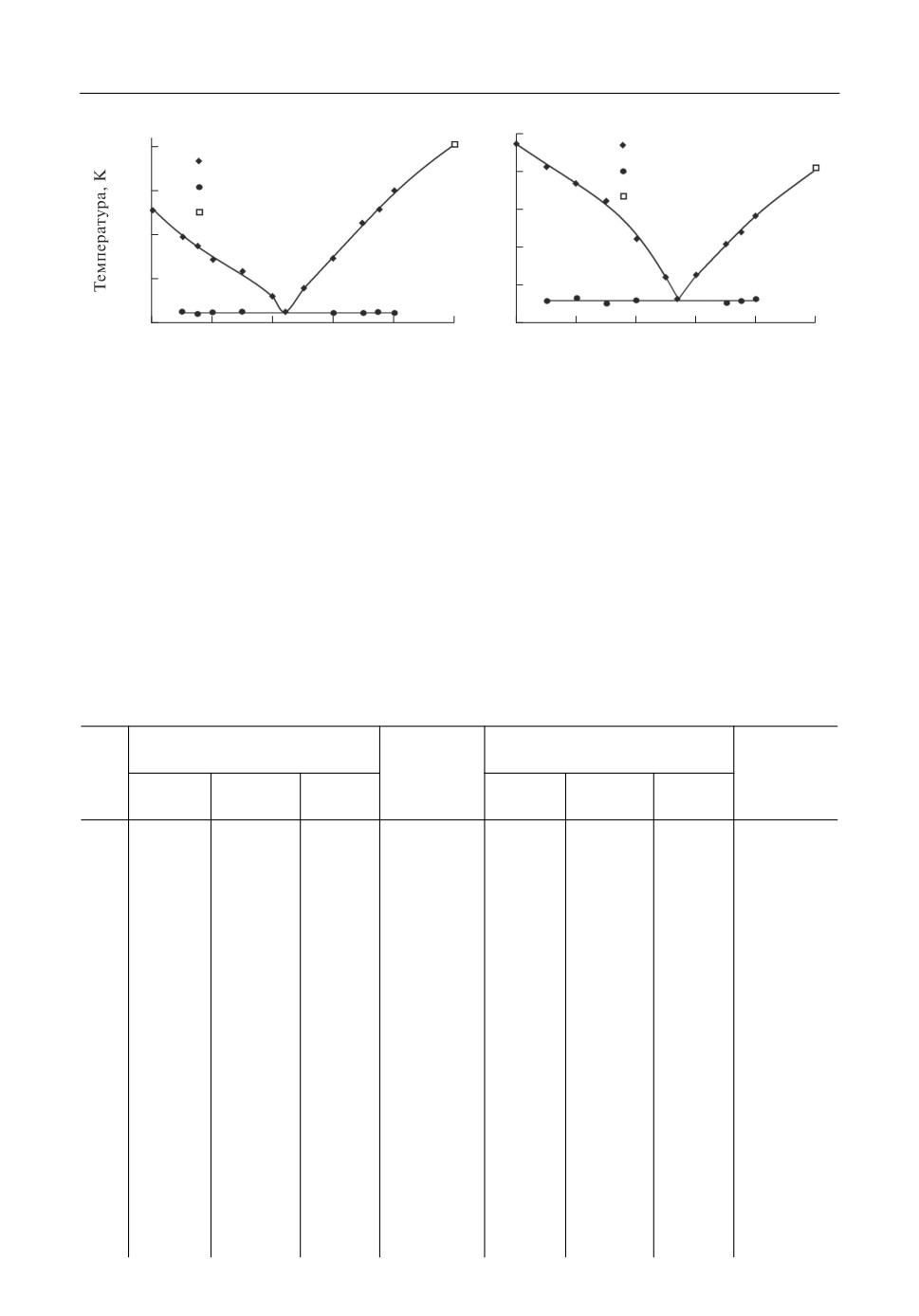
Полученные данные представлены в виде квази бинарных диаграмм, представлен
ных на рис. 3.
Установлено, что квази-бинарные диаграммы расплавов [45KF-55KCl мол. %]-KI,
[66 KF -34KCl мол. %]-KI представляют собой диаграммы эвтектического типа. Вы
явлено, что квази-бинарная эвтектика для расплава [45KF-55KCl мол. %]-KI суще
ствует при концентрации 44 мол. % KI при 761 К. Для расплава [66KF-34KCl мол. %]-KI
эвтектическая точка находится при концентрации KI 54 мол. % при 775 K. В зависи
мости от состава происходит смещение точки квази эвтектики. Это объясняется раз
личной температурой первичной кристаллизации исходных хлоридно фторидных со
ставов.
Температуры ликвидуса расплавов KF-KCl-KI
379
а
б
1000
950
- ликвидус
- ликвидус
950
– солидус
- солидус
900
- данные [17]
- данные [17]
900
850
850
800
800
750
750
0
20
40
60
80
100
0
20
40
60
80
100
KI, мол. %
KI, мол. %
Рис. 3. Квази бинарная диаграмма плавкости систем: a - [45KF-55KCl мол. %]-KI; б - [66KF-
34KCl мол. %]-KI.
Полученные значения температур ликвидуса составов 66KF- 34KCl и 45KF-
55KCl мол. % согласуются с литературными данными [15]. Температура плавления ин
дивидуального KI [17] находится в тренде восходящей ветви диаграмм (рис. 3).
Для проверки данных, полученных методом термического анализа, перспективные
фоновые расплавы системы KF-KCl-KI (табл. 1, № 12 и № 26), с содержанием KI
Таблица 1
Температуры ликвидуса системы KF-KCl-KI
[45KF-55KCl мол. % ]-KI
[66.6 KF-33.4KCl мол. %]-KI
№
Tliq, K (°C)
Tliq, K (°C)
KF мол. %
KCl мол. %
KI мол. %
KF мол. %
KCl мол. %
KI мол. %
1
45.00
55.00
-
878 (605)
66.60
33.40
-
985 (712)
2
40.50
49.50
10
848 (575)
60.00
30.00
10
954 (681)
3
38.25
46.75
15
838 (565)
-
-
-
-
4
36.00
44.00
20
821 (548)
53.30
26.70
20
932 (659)
5
31.50
38.50
30
809 (536)
46.60
23.40
30
909 (636)
6
27.00
33.00
40
779 (506)
40.00
20.00
40
859 (586)
7
25.00
31.00
44
761 (488)
-
-
-
-
8
22.50
27.50
50
788 (515)
33.30
16.70
50
807 (534)
9
-
-
-
-
37.00
19.00
54
775 (502)
10
18.00
22.00
60
823 (550)
26.60
13.40
60
811 (538)
11
13.50
16.50
70
863 (590)
20.00
10.00
70
852 (579)
12
11.25
13.75
75
880 (607)
16.70
8.30
75
869 (596)
13
9.00
11.00
80
901 (628)
13.30
6.70
80
890 (617)
14
-
-
100
954 (681) [17]
-
-
100
954 (681) [17]
380
А. О. Худорожкова, А. В. Исаков, А. А. Редькин, Ю. П. Зайков
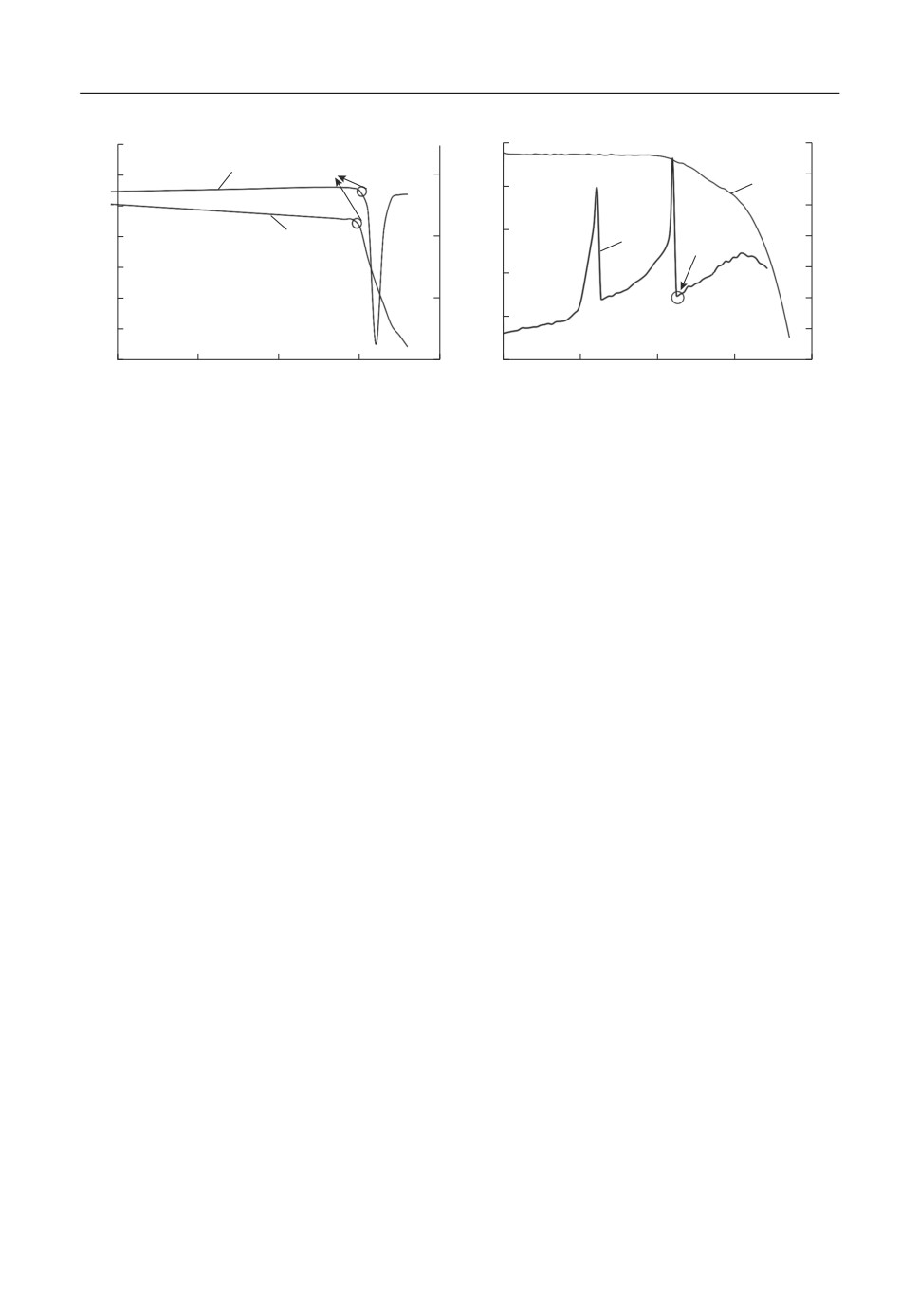
ДСК, мВт/мг
ДСК, мВт/мг
ТГ, %
а
б
ТГ, %
1.5
0.5
100
1
750
1.0
100
99
0.4
2
0.5
98
0.3
0
99
97
2
1
876
0.5
96
0.2
1.0
98
95
0.1
1.5
94
2.0
97
0
93
600
650
700
750
800
600
750
850
950
1050
Температура, K
Температура, K
Рис. 4. Кривые полученные методом дифференциальной сканирующей калориметрии (1) и термогравимет
рического анализа (2) трехкомпонентной системы KF-KCl-KI: а - 45KF-55KCl -75KI; б - 25KF-34KCl-
41KI, мол. %.
75 мол. %, были исследованы методом СТА. Результаты исследования состава № 12
(табл. 1) приведены на рис. 4.
На рис. 4а представлены данные ДСК и ТГ для состава № 12 (табл. 1). Установлено,
что температура ликвидуса исследуемого состава составляет 876 K. Это значение хоро
шо согласуется с данными термического анализа кривых охлаждения данного образца.
Разница между результатами полученными разными методами составляет 4 К или 0.5%.
Наименьшей температурой ликвидуса в тройной системе обладает эвтектический
состав 25KF-34KCl-41KI (мол. %) представленный на рис. 4б. Согласно литературе
[15] данный состав имеет температуру ликвидуса 761 К. Анализируя полученные дан
ные ДСК и ТГ установлено, что температура фазового перехода в эвтектической точке
равна 750 К. Разница между полученными и литературными данными составляет 11 К
или 1.33%.
Параллельные исследования изменения веса образцов и сигнала ДСК показывают,
что убыль массы образцов происходит при прохождении точки плавления (солидуса
или ликвидуса).
ВЫВОДЫ
Методом термического анализа и СТА впервые определены температуры первич
ной кристаллизации расплавов KF-KCl-KI при мольном соотношении KF/KCl рав
ном 0.8 и 2. Для построения квази бинарных диаграмм были так же определены тем
пературы солидуса. Показано, что квази бинарные диаграммы состояния расплавов
[45KF-55KCl]-KI, [66KF-34KCl]-KI (мол. %) могут быть отнесены к эвтектическому
типу. Разница между результатами полученными разными методами не превышала 5 К.
Работа выполнена при финансовой поддержке Российского научного фонда, про
ект № 18 73 00227.
СПИСОК ЛИТЕРАТУРЫ
1. Po l m e a r Y. , S t J o h n D . , N i e J . F. , Q i a n M . Light alloys: Metallurgy of the light
metals. Berlin: Butterworth Heinemann Ltd., 2016.
2. D o l a n T. J . Molten salt reactors and thorium energy. Cambridge: Woodhead Publishing.
2017.
Температуры ликвидуса расплавов KF-KCl-KI
381
3. G u o S . , Z h a n g J . , W u W. , Z h o u W . Corrosion in the molten uoride and chloride
salts and materials development for nuclear applications // Progress in Materials Science. 2018. 97.
P. 448-487.
4. Z h o u Z . , Z h a n g Y. , H u a Y. , D o n g P. , L i n Y. , X u M . , Wa n g D . , L i X . ,
H a n L . , D u a n J . // Journal of Alloys and Compounds. 2018. 751. P. 307-315.
5. Z h u L . , B a i S . , Z h a n g H . , Ye Y. // Applied Surface Science. 2013. 256. P. 537-
545.
6. N a o r Po m e r a n t z A . , E l i a z N . , G i l e a d i E . Electrodeposition of rhenium-tin
nanowires // Electrochimica Acta. 2011. 56. P. 6361-6370.
7. П о с ы п а й к о В . И . , А л е к с е е в а Е . А . , В а с и н а Н . А . Диаграммы плавкости
солевых систем Часть II. Двойные системы с общим катионом М.: Металлургия, 1979.
8. П о с ы п а й к о В . И . , А л е к с е е в а Е . А . , В а с и н а Н . А . Диаграммы плавкости
солевых систем Часть III. Двойные системы с общим катионом М.: Металлургия, 1979.
9. K u z n e t s o v a S . V. , D o l m a t o v V. S . , K u z n e t s o v S . A . Voltammetric study of
electroreduction of silicon complexes in a chloride-fluoride melt // Russian J. Electrochemistry.
2009. 45. № 7. P. 742-748.
10. I s a k o v A . V. , Z h a n g X . , J i a n g S . , Z ay k o v Yu . P. Electrochemical obtaining of
fine Si films in KF- KCl-KI-K2SiF6 melts // Tsvetnye Metally. 2017. 11. P. 49-54.
11. Pe n g J . , Y i n H . , Z h a o J . , Ya n g X . , B a r d A . J . , S a d o w a y D . R .
//
Adwanced functional materials. 2018. 28(1703551). P. 1-6.
12. Ya n g X . , J i L . , Z o u X . , L i m T. , Z h a o J . , Y u E . T. , B a r d A . J . //
Angewandte Chemie. 2017. 56. № 47. Р. 15078-15082.
13. За й к ов Ю .П ., Жу к С .И ., И сако в А .В ., Гри ш ен кова О .В ., И саев В .А .
Электроосаждение кремния из расплава KF-KCl-KI-K2SiF6 // Расплавы. 2016. № 5. С. 441-
445.
14. I s a k o v A . V. , A p i s a r o v A . P. , K h u d o r o z h k o v a A . O . , L a p t e v M . V. ,
Z a i k ov Y. P. Electrodeposition of silicon onto copper substrate from KF-KCl-KI-K2SiF6 melt //
J. Physics: Conference Series. 2018. 1134. № 1. P. 012-021.
15. Н а г о р н ы й Г. И . Сложная взаимная система из фторидов, хлоридов и иодидов на
трия и калия // Известия сектора физико химического анализа. XI. C. 291-325.
16. В оскресен ская Н .К ., Е всеева Н .Н ., Б ерулъ С .И ., В ерещ ети н а И .П .
Справочник по плавкости систем из безводных неорганических солей. Т. 2. М.: Издательство
Академии Наук СССР, 1961. 587 с.
17. S a n g s t e r J . M . , Pe l t o n A . D . Critical coupled evaluation of phase diagrams and ther
modynamic properties of binary and ternary alkali salt systems. Special report to the phase equilibria
program, Part D: The 60 ternary common ion systems involving (Li, Na, K, Rb, Cs) and (F, Cl, Br, I).
American Ceramic Society; Westerville, Ohio. 1987. Р. 2-181.
18. А ф а н а с ь е в О . С . , Е г о р о в а Г. Ф . Расчет состава и температур трех и четырех
компонентных систем по известным характеристикам двухкомпонентных систем // Вестн.
Сам. гос. техн. ун та. Сер. Физ. мат. науки. 2011. 4. № 25. C. 134-145.
19. Z a i k ov Y. P. , R e d k i n A . A . , A p i s a r ov A . A . , K o r z u n I . V. , K u l i k N . P. ,
Isakov A.V., Kataev A.A., Chemezov O.V. Silica solubility in molten fluoride chlo
ride electrolytes and density of KF-KCl-K2SiF6-SiO2 melts // J. Chemical and Engineering Data.
2013. 58. № 4. P. 932-937.
20. K n a c k e O . , K u b a s c h e w s k i O . , H e s s e l m a n K . Thermochemical properties of
inorganic substances. Berlin: 2nd ed., Springer Verlag. 1991.
382
А. О. Худорожкова, А. В. Исаков, А. А. Редькин, Ю. П. Зайков
Liquidus Temperatures of KF-KCl-KI Melts
A. O. Khudorozhkova1, A. V. Isakov1, A. A. Red’kin, Yu. P. Zaikov1
1Institute of High Temperature Electrochemistry, Ural Branch of Russian Academy of Sciences,
Yekaterinburg, Russia
The liquidus temperatures of KF-KCl-KI molten ternary system were investigated using
thermal analysis of cooling curves method and STA method. The temperature dependences of
liquidus temperature vs potassium iodide concentration for [45KF-55KCl mol %]-KI and
[66KF-34KCl mol %]-KI melts were determined. Experimental data are summarized as
two dependences of liquidus temperature vs. content of KI in KF-KCl. The thermal analy
sis data were verified by STA. It was confirmed, the KF-KCl-KI system has a eutectic
25KF-31KCl-44KI (mol %) but with a melting point about 750 K.
Keywords: potassium fluoride, potassium chloride, potassium iodide, liquidus tempera
ture, phase diagram
REFERENCES
1. Polmear Y., StJohn D., Nie J. F., Qian M. Light alloys: Metallurgy of the light metals. Berlin:
Butterworth Heinemann Ltd., 2016.
2. Dolan T.J. Molten salt reactors and thorium energy. Cambridge: Woodhead Publishing. 2017.
3. Guo S., Zhang J., Wu W., Zhou W. Corrosion in the molten uoride and chloride salts and mate
rials development for nuclear applications // Progress in Materials Science. 2018. 97. P. 448-487.
4. Zhou Z., Zhang Y., Hua Y., Dong P., Lin Y., Xu M., Wang D., Li X., Han L., Duan J. // Journal
of Alloys and Compounds. 2018. 751. P. 307-315.
5. Zhu L., Bai S., Zhang H., Ye Y. // Applied Surface Science. 2013. 256. P. 537-545.
https:// doi.org/10.1016/j.apsusc.2012.11.041
6. Naor-Pomerantz A., Eliaz N., Gileadi E. Electrodeposition of rhenium-tin nanowires // Elec
trochimica Acta. 2011. 56. P. 6361-6370.
7. Posypaiko V.I., Alekseeva E.A., Vasina N.A. Diagrammy plavkosti solevych system. Сhast II.
Dvoynye sistemy s obschim kationom [Melting diagrams of salt systems: Part II: binary systems with a
common cation].: Metallurgia, 1979 (in Russian).
8. Posypaiko V.I., Alekseeva E.A., Vasina N.A. Diagrammy plavkosti solevych system. Сhast II.
Dvoynye sistemy s obschim kationom [Melting Diagrams of salt systems: Part III: Binary systems with
a common cation].: Metallurgia., 1979 (in Russian).
9. Kuznetsova S.V., Dolmatov V.S., Kuznetsov S.A. Voltammetric study of electroreduction of sili
con complexes in a chloride-fluoride melt // Russian J. Electrochemistry. 2009. 45. № 7. P. 742-748.
10. Isakov A.V., Zhang X., Jiang S., Zaykov Yu.P. Electrochemical obtaining of fine Si films in
KF-KCl-KI-K2SiF6 melts // Tsvetnye Metally. 2017. 11. P. 49-54.
11. Peng J., Yin H., Zhao J., Yang X., Bard A.J., Sadoway D.R. // Adwanced functional materials.
2018. 28(1703551). P. 1-6.
12. Yang X., Ji L., Zou X., Lim T., Zhao J., Yu E.T., Bard A.J. // Angewandte Chemie. 2017. 56.
№ 47. Р. 15078-15082.
13. Zaikov Yu.P., Zhuk S.I., Isakov A.V., Grishenkova O.V., Isaev V.A. Elektroosazhdenie krem
niya iz rasplava KF-KCl-KI-K2SiF6 [Electrodeposition of silicon from KF-KCl-KI-K2SiF6 melt] //
Rasplavy. 2016. № 5. Р. 441-445 (in Russian).
14. Isakov A.V., Apisarov A.P., Khudorozhkova A.O., Laptev M.V., Zaikov Y.P. Electrodeposition
of silicon onto copper substrate from KF-KCl-KI-K2SiF6 melt // J. Physics: Conference Series.
2018. 1134. № 1. P. 012-021.
Температуры ликвидуса расплавов KF-KCl-KI
383
15. Nagorniy G.I. Slozhnaya vzaimnaya sistema iz ftoridov, hloridov i iodidov natriya i kaliya
[Complex mutual system of fluorides, chlorides and iodides of sodium and potassium] // Izvestiya sec
tora phisiko khimicheskogo analiza. 1938. XI. Р. 291-325 (in Russian).
16. Voskresenskaya N.K., Evseeva N.N., Berul’ S.I., Vereshchetina I.P. Spravochnik po plavkosti
sistem iz bezvodnyh neorganicheskih solej. Tom 2 [Handbook of fusibility systems of anhydrous inor
ganic salts. V. 2.]. M.: Izdatel’stvo Akademii Nauk SSSR, 1961 (in Russian).
17. Sangster J.M., Pelton A.D. Critical coupled evaluation of phase diagrams and thermodynamic
properties of binary and ternary alkali salt systems. Special report to the phase equilibria program, Part
D: The 60 ternary common ion systems involving (Li, Na, K, Rb, Cs) and (F, Cl, Br, I). American
Ceramic Society; Westerville, Ohio. 1987. Р. 2-181.
18. Afanasiev O.S., Egorova G.F. Raschet sostava i temperatur trekh i chetyrekhkompanentnyh
sistem po izvestnym harakteristikam dvuhkomponentnyh sistem [Calculation of three and four com
ponent eutectic system temperature and composition on the basis of two component system known
characteristics] // Vestn. Samar. Gos. Tekhn. Univ. Ser. Fiz. Mat. Nauki. 2011. 4. № 25. Р. 134-145
(in Russian).
19. Zaikov Y.P., Redkin A.A., Apisarov A.A., Korzun I.V., Kulik N.P., Isakov A.V., Kataev A.A.,
Chemezov O.V. Silica solubility in molten fluoride chloride electrolytes and density of KF-KCl-
K2SiF6-SiO2 melts // J. Chemical and Engineering Data. 2013. 58. № 4. P. 932-937.
20. Knacke O., Kubaschewski O., Hesselman K., Thermochemical properties of inorganic sub
stances. Berlin: 2nd ed., Springer Verlag. 1991.