РАСПЛАВЫ
4 · 2019
УДК 541.123.2.034.6 143
КОЭФФИЦИЕНТ АКТИВНОСТИ ЦЕЗИЯ В РАСПЛАВАХ Cs-CsI
© 2019 г.
a, В. М. Ивенкоa, *, Л. А. Циовкинаa
В. В. Чебыкин
aИнститут высокотемпературной электрохимии УрО РАН, Екатеринбург, Россия
*e mail: V. Ivenko@ihte.uran.ru
Поступила в редакцию 09.07.2018
После доработки 15.09.2018
Принята к публикации 07.11.2018
Из тензиметрических данных (20 составов от 0.39 до 90 мол. % Cs) исследования
расплавов Cs-CsI получены аппроксимирующие уравнения для коэффициентов ак
тивности цезия в конкретных опытах. Обсуждены условия проведения эксперимен
та и их влияние на погрешность полученных экспериментальных данных.
Ключевые слова: расплавы, растворы, коэффициенты активности, цезий, фторид цезия.
DOI: 10.1134/S0235010619040054
Термодинамические характеристики растворов часто определяют из тензиметриче
ских данных. Для расплавов Cs-CsI давление насыщенных паров измерены статиче
ским тензиметрическим методом на установке, описанной в работе [1]. Материал
установки, контактирующий с цезием и иодидом цезия, - сталь 12Х18Н9Т. Коррози
онных процессов при контакте иодида цезия с данной сталью данным методом не об
наружено, хотя известно, что данная сталь незначительно взаимодействует со фтори
дами цезия [2] и калия [3] . Иодид цезия марки х. ч. сушился под вакуумом с последу
ющей очисткой зонной плавкой по методике описанной в работе [4], а цезий особой
чистоты (основная примесь калий, менее 0.01 мас. %) запаянный в ампулы, вскрывал
ся и перегонялся в прибор в вакууме при давлении остаточных газов около 1 Па.
Конструкция прибора позволяла после эксперимента изменять концентрацию це
зия отгонкой его части в вакууме не вскрывая прибор. Все это позволяет снизить не
контролируемые контакты цезия и его соли с окружающей средой.
Тензиметрический метод измерения позволяет определять общее давление в прибо
ре при определенной температуре расплава. Для определения термодинамических ха
рактеристик цезия необходимо знание парциального давления цезия и его концентра
цию в расплаве.
Схема расчета [5] позволяет рассчитать концентрацию цезия в расплаве при каждой
измеряемой температуре. Общее давление складывалось из парциальных давлений
цезия и мономера и димера иодида цезия. Предполагалось отсутствие соединений в
паре на основе цезия и его солевого компонента.
Особенностью данных расплавов является большое различие в давлении паров ин
дивидуальных компонентов, отличающиеся в зависимости от температуры на 2-3 по
рядка. Вклад парциального давления солевого компонента в общее давление заметен
лишь для разбавленных растворов щелочного металла. При увеличении концентрации
цезия общее давление паров возрастает на столько, что вклад давления солевого ком
понента приближается к погрешности определения общего давления. Также необхо
димо отметить, что в области разбавленных растворов цезия солевой компонент про
являет себя как близкий к идеальному, т.к. коэффициент активности его при прибли
жении концентрации к 100% стремится к 1.
Коэффициент активности цезия в расплавах Cs-CsI
405
ln yCs
1.8
NCs = 0.392 мол. %
NCs
= 4.32 мол. %
1.6
NCs = 11.2 мол. %
NCs = 52.1 мол. %
1.4
NCs = 90 мол. %
1.2
1.0
0.8
0.6
0.4
0.2
0
0.00082 0.00084 0.00086 0.00088 0.00090 0.00092 0.00094 0.00096 0.00098
0.001
0.00102
1/T, K-1
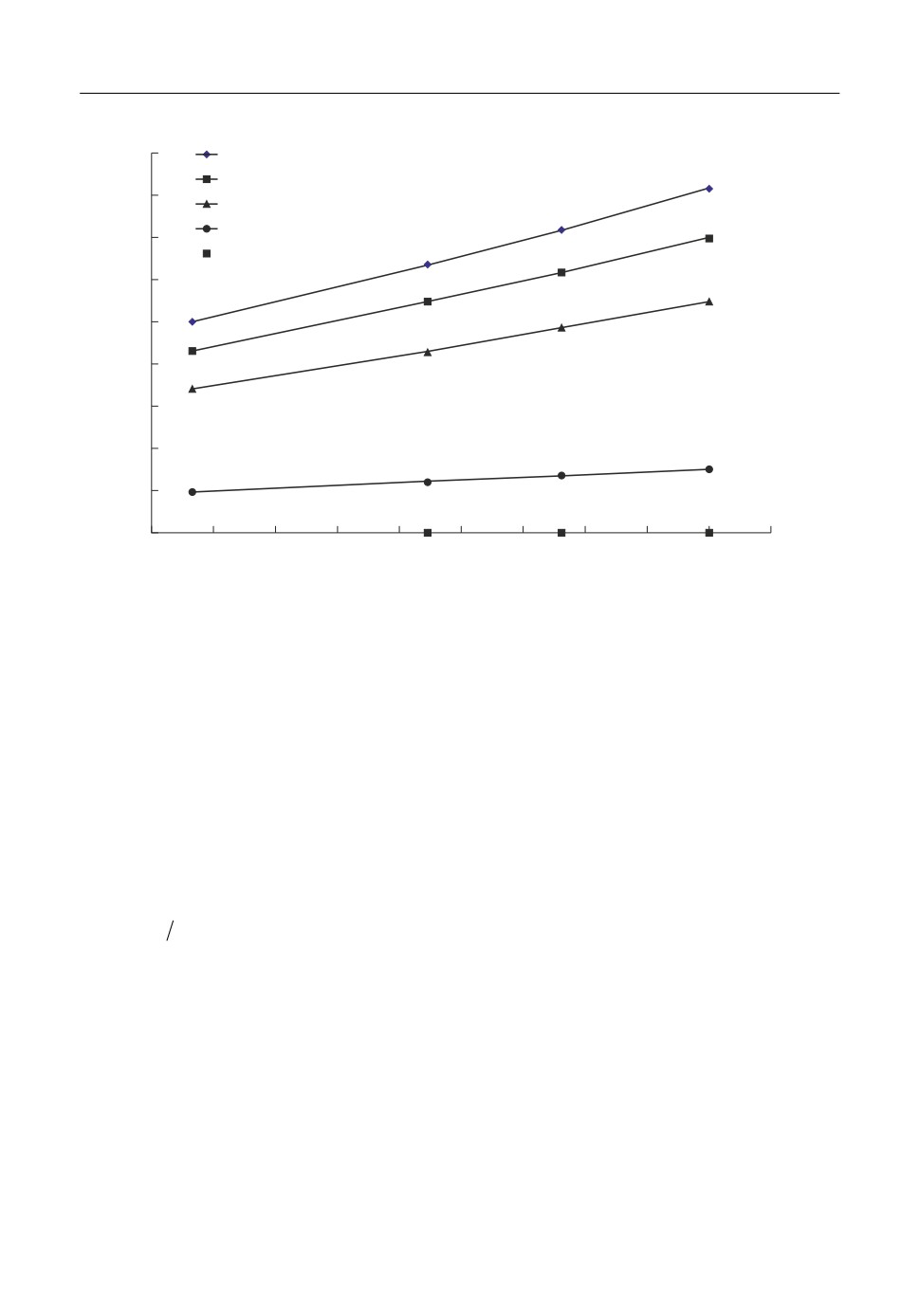
Рис. 1. Зависимость коэффициента активности цезия от температуры для расплавов Cs-CsI.
Схема расчета, однако, учитывала неидеальность солевого компонента после реше
ния уравнения Гиббса-Дюгема и после последующего определения парциального
давления цезия вновь позволяла рассчитать коэффициент активности щелочного ме
талла. После сравнения рассчитанных коэффициентов активности цезия в приближе
нии идеальности солевого компонента и после учета его не идеальности делался вы
вод о целесообразности повторной итерационной процедуры определения неидеаль
ности солевого компонента.
Все необходимые данные по давлению цезия и его иодида рассчитывались с ис
пользованием справочника [6]. Из парциального давления пара цезия по этому же
справочнику рассчитывалась фугитивность цезия при каждой температуре и фугитив
ность цезия над индивидуальным цезием при данной температуре. Коэффициент ак
тивности цезия в расплаве находили из выражения:
γ
Cs
=
f (f
0
N
Cs
).
где γCs - коэффициент активности цезия, f - фугитивность цезия при его парциальном
давлении, f0 - фугитивность цезия над индивидуальным цезием при данной темпера
туре, NCs - мольная доля цезия.
Вид аппроксимирующего уравнения для γCs:
B
ln γ
Cs
=
A
+
+
C⋅(lnT)± Δ.
T
Коэффициенты уравнения, общая погрешность на доверительном уровне 0.95 с ис
пользованием при расчете коэффициента Стьюдента, число экспериментальных то
чек и интервал температуры исследования в однофазной области для конкретных
опытов приведены в табл. 1.
На рис. 1 показана температурная зависимость для экспериментальных данных
lnγCs от 1/Т. Видно, что lnγCs в этих координатах линейно убывает с ростом температуры.
406
В. В. Чебыкин, В. М. Ивенко, Л. А. Циовкина
Таблица 1
№
NCs · 100
А
В
С
Δ
Число т.
ΔТ, К
1
0.392
-67.6639
12580
8.21672
0.0123
25
926
1190
2
0.606
-44.7019
9575.9
5.3221
0.0120
15
911
1173
3
0.911
-43.2173
9212.5
5.153
0.0163
11
927
1180
4
1.06
-37.4774
8303.4
4.4326
0.0352
13
910
1191
5
1.27
-40.2126
8573.1
4.7999
0.0154
11
915
1242
6
1.32
-40.9292
8896.1
4.8616
0.0102
21
921
1236
7
4.32
-19.3257
5581.5
2.1878
0.0040
28
914
1234
8
7.26
-27.0893
6255.8
3.1893
0.0085
16
898
1253
9
8.48
-12.9962
4310.1
1.4322
0.0108
15
886
1232
10
11.2
-22.4608
5366.6
2.6359
0.0088
21
893
1241
11
19.4
-4.8843
2464.7
0.4777
0.0140
11
880
1219
12
25.4
-15.5206
3531.4
1.5443
0.0100
17
870
1284
13
29.6
-4.2383
1838.9
0.4409
0.0118
12
878
1232
14
37.0
-4.1973
1567.3
0.4545
0.0093
12
878
1234
15
44.2
-0.9632
856.3
0.0722
0.0101
13
870
1200
16
52.1
1.8594
289.3
-0.2600
0.0120
13
870
1200
17
61.7
4.1947
-221
-0.5488
0.0106
16
870
1200
18
70.9
1.2236
29.59
-0.1666
0.0155
12
870
1200
19
79.6
3.3907
-324.46
-0.4364
0.0099
15
870
1200
20
90.0
1.2541
-137.6
-0.1579
0.0138
15
870
1200
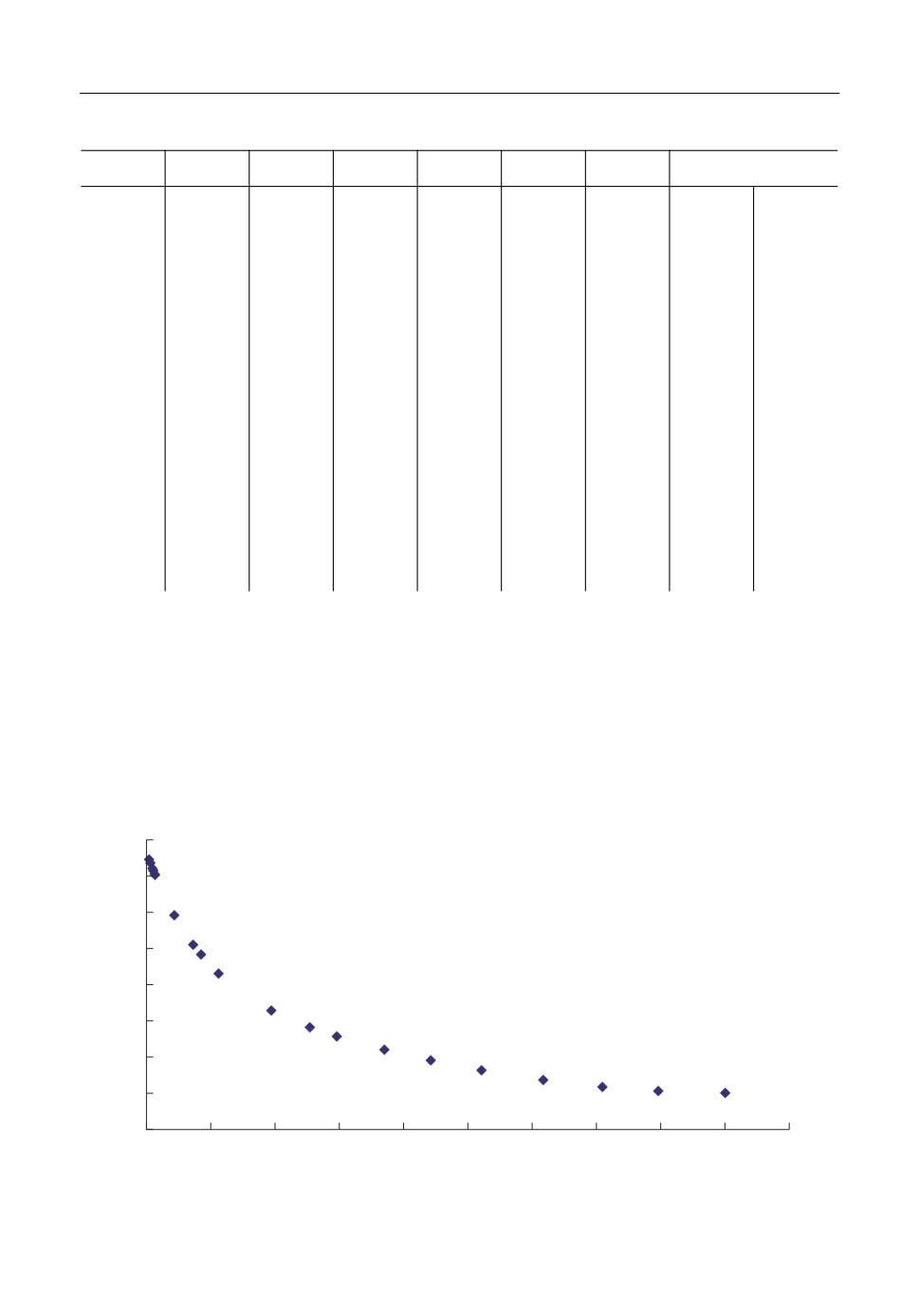
На рис. 2 показана концентрационная зависимость коэффициента активности це
зия для конкретных опытов при температуре 1050 К.
Видно, что коэффициент активности цезия максимален при небольших концентра
циях щелочного металла и резко убывает с ростом его концентрации. После 70 мол. %
цезия, его коэффициент активности практически равен 1.
yCs
4.5
4.0
3.5
3.0
2.5
2.0
1.5
1.0
0.5
0
10
20
30
40
50
60
70
80
90
100
NCs, мол. %
Рис. 2. Зависимость коэффициента активности цезия в расплавах Cs-CsI от его концентрации для темпера
туры 1050 К.
Коэффициент активности цезия в расплавах Cs-CsI
407
Величины коэффициента активности цезия в этих растворах, по видимому, меньше
чем у всех расплавов щелочных металлов в собственных галогенидах, в том числе они
меньше, чем у калия и натрия [7, 8], однако вид зависимости от концентрации и темпе
ратуры схож. Известно также, что цезиевые металло солевые смеси не имеют выражен
ного купола расслоения [9], однако т.к. коэффициенты активности цезия больше 1, то
это может указывать на тенденцию к расслоению.
СПИСОК ЛИТЕРАТУРЫ
1. С м и р н о в М . В . , Ч е б ы к и н В . В . , Ц и о в к и н а Л . А . , К р а с н о в Ю . Н .
Прибор для измерения давления агрессивных высокотемпературных сред статическим мето
дом // Журн. физ. Химии. 1977. 51. № 7. С. 1848-1850.
2. Ч е б ы к и н В . В . , И в е н к о В . М . , Ц и о в к и н а Л . А . , С м и р н о в М . В . Экс
периментальное исследование давления насыщенных паров растворов цезия в его расплав
ленных галогенидах. I. Система Cs-CsF. Свердловск, 1987. Деп. в ВИНИТИ 12.01.1987.
№ 799. В 87.
3. И в е н к о В . М . , Ц и о в к и н а Л . А . Давление насыщенных паров и термодинамиче
ские свойства калия, растворенного в расплавленном фториде калия // Расплавы. 1998. № 5.
С. 41-47.
4. Ш и ш к и н В . Ю . , М и т я е в В . С . Очистка галогенидов щелочных металлов мето
дом зонной плавки // Изв. АНСССР, Неорган. Материалы. 1982. 18. № 11. С. 1917-1918.
5. И в е н к о В . М . , Ц и о в к и н а Л . А . Коэффициент активности калия в его концен
трированных растворах в расплавленных хлориде, бромиде и иодиде калия // Расплавы. 1998.
№ 5. С. 48-52.
6. Термодинамические свойства индивидуальных веществ: Справ, изд е / Под ред.
В.П. Глушко. М.:Наука. 1978.
7. S m i r n o v M . V. , C h e b y k i n V. V. , Ts i o v k i n a L . A . // Electrochimica Acta. 1981.
26. №. 9. P. 1275-1288.
8. S m i r n o v M . V. I ve n k o V. M . // Electrochimica Acta. 1990. 35. № 2. Р. 529-538.
9. B r e d i g M . A . Mixtures of metals with molten salts. In Molten salts chemistry / Ed. bу
M. Blander. New York ets.: Interscience Publ., 1964. P. 367-425.
The Coefficient of Activity of Cesium in Melts Cs-CsI
1, V. M. Ivenko1, L. A. Tsiovkina1
V. V. Chebykin
1Institute of High Temperature Electrochemistry of Ural Branch of the RAS, Yekaterinburg, Russia
From tensimetric data (20 compositions from 0.39 to 90.0 mol % Cs) of Cs-CsI melts,
approximating equations were obtained for the coefficients of cesium activity in specific ex
periments. The conditions of the experiment and their influence on the error of the experi
mental data are discussed.
Keywords: melts, solutions, activity coefficients, cesium, cesium fluoride
REFERENCES
1. Smirnov M.V., Chebykin V.V., Tsiovkina L.A., Krasnov Yu.N. Pribor dlya izmereniya davleniya
agressivnykh vysokotemperaturnykh sred staticheskim metodom [A device for measuring the pressure of
aggressive high temperature media by the static method] // Zhurnal fiz. Khimii. 1977. 51. № 7. P. 1848-
1850.
2. Chebykin V.V., Ivenko V.M., Tsiovkina L.A., Smirnov M.V. Eksperimental'noye issledovaniye
davleniya nasyshchennykh parov rastvorov tseziya v yego rasplavlennykh galogenidakh. I. Sistema Cs-
CsF. [Experimental study of the saturated vapor pressure of cesium solutions in its molten halides.
I. System Cs-CsF.] Sverdlovsk, 1987. Dep. v VINITI 12.01.1987. № 799. В 87.
408
В. В. Чебыкин, В. М. Ивенко, Л. А. Циовкина
3. Ivenko V.M., Tsiovkina L.A. Davleniye nasyshchennykh parov i termodinamicheskiye svoystva
kaliya, rastvorennogo v rasplavlennom ftoride kaliya [Saturated vapor pressure and thermodynamic
properties of potassium dissolved in molten potassium fluoride] // Rasplavy. 1998. № 5. P. 41-47.
4. Shishkin V.Yu., Mityayev V.S. Ochistka galogenidov shchelochnykh metallov metodom zonnoy
plavki [Purification of alkali metal halides by zone melting] // Izv. ANSSSR, Neorgan. Materialy.
1982. 18. № 11. P. 1917-1918.
5. Ivenko V.M., Tsiovkina L.A. Koeffitsiyent aktivnosti kaliya v yego kontsentrirovannykh rastvorakh
v rasplavlennykh khloride, bromide i iodide kaliya [The activity coefficient of potassium in its concen
trated solutions in molten potassium chloride, bromide and iodide] // Rasplavy. 1998. № 5. P. 48-52.
6. Termodinamicheskiye svoystva individual'nykh veshchestv [Thermodynamic properties of indi
vidual substances]: Sprav, izd ye / Pod red. V.P. Glushko. M.:Nauka. 1978.
7. Smirnov M.V., Chebykin V.V., Tsiovkina L.A. // Electrochimica Acta. 1981. 26. №. 9. P. 1275-
1288.
8. Smirnov M.V. Ivenko V.M. // Electrochimica Acta. 1990. 35. № 2. Р. 529-538.
https:// doi.org/10.1016/0013 4686(90)87040 9
9. Bredig M.A. Mixtures of metals with molten salts. In Molten salts chemistry / Ed. bу M. Blander.
New York ets.: Interscience Publ., 1964. P. 367-425.