Почвоведение, 2023, № 5, стр. 603-612
Новый продуцент боррелидина Streptomyces rochei 3IZ-6 и его перспективы в защите растений
И. Г. Широких a, И. А. Остерман b, c, Д. А. Лукьянов b, c, В. И. Марина b, c, М. В. Бирюков b, О. А. Белозерова d, Е. Б. Гугля d, e, А. А. Широких a, Я. И. Назарова a, Н. А. Боков a, Ю. В. Закалюкина b, *
a Федеральный аграрный научный центр Северо-Востока им. Н.В. Рудницкого
610007 Киров, ул. Ленина, 166а, Россия
b МГУ им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
c Сколковский институт науки и технологий
121205 Москва, Большой бульвар, 30, стр. 1, Россия
d Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
117997 Москва, ул. Миклухо-Маклая, 16/10, Россия
e Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
* E-mail: juline@soil.msu.ru
Поступила в редакцию 24.08.2022
После доработки 10.01.2023
Принята к публикации 10.01.2023
- EDN: IECJXE
- DOI: 10.31857/S0032180X22601050
Аннотация
Почвенные актиномицеты выделяли из верхнего горизонта грумусоли (Vertisols) на западном берегу оз. Кинерет в окрестности г. Тверия (Нижняя Галилея, Израиль). Проверка антибиотической активности 26 природных изолятов рода Streptomyces с использованием высокопроизводительного скрининга на основе двойной репортерной системы позволила выявить актинобактериальный штамм 3IZ-6, обладающий способностью ингибировать синтез белка. Методами полифазной таксономии штамм 3IZ-6 отнесен к виду Streptomyces rochei. Активное вещество S. rochei 3IZ-6 выделяли и очищали при помощи гравитационной обращеннофазовой и высокоэффективной жидкостной хроматографии. С помощью toe-print анализа и данных масс-спектрофотометрии продуцируемый антибиотик идентифицировали как боррелидин. При совместном культивировании на твердых средах штамм 3IZ-6 способен подавлять рост фитопатогенных микроорганизмов: Fusarium solani, F. sambucinum, Botrytis cinerea, а также карантинного объекта Curtobacterium flaccumfaciens. Установлено выраженное фитотоксическое действие культуральной жидкости 3IZ-6 на семена пшеницы мягкой (Tritiсum aestivum L). Штамм Streptomyces rochei 3IZ-6 может найти применение в биотехнологии как продуцент боррелидина – ценного природного соединения с широким спектром антибиотического действия, в частности, как агент биоконтроля для защиты сельскохозяйственных растений от фитопатогенов и сорняков.
ВВЕДЕНИЕ
Актуальность изучения актиномицетных сообществ в почвах различных биоклиматических зон и географических областей обусловлена в первую очередь широкомасштабным биотехнологическим использованием актиномицетов. С тех пор как З. Ваксман выделил из почвы штамм Streptomyces griseus (продуцента первого противотуберкулезного антибиотика стрептомицина), именно почвенные представители филума Actinomycetota стали предметом пристального внимания исследователей. Несмотря на то, что к настоящему времени выделено и описано около трех тысяч биологически активных молекул, продуцируемых стрептомицетами [25], потребность в обнаружении новых или уточнении природы открытых противомикробных соединений остается актуальной.
Наряду с исключительным среди других прокариот потенциалом антибиотического действия, актиномицеты играют важную роль в биогеохимическом круговороте, в процессах формирования и развития почв. Известно, что абсолютное и относительное обилие актиномицетов увеличиваются при переходе от почв холодного гумидного климата к почвам более южных и засушливых областей [2]. В современной литературе представлена информация об актиномицетных комплексах почв отдельных регионов с различным сочетанием факторов почвообразования, однако сведений об актинобиоте и ее антибиотическом потенциале в почвах, сформированных в условиях средиземноморской влажностной пульсации, недостаточно.
Оз. Кинерет находится на северо-востоке Израиля, в Иорданской рифтовой долине – одном из самых низких на Земле участков суши. Побережье озера расположено ниже уровня моря на 209–215 м [3]. Несмотря на сравнительно высокую минерализацию (содержание хлоридов около 300 мг/л), воды озера пригодны для питья, а само озеро служит крупнейшим резервуаром пресной воды в регионе [4].
Климат побережья оз. Кинерет ‒ субтропический средиземноморский, с продолжительным жарким засушливым летом и прохладной дождливой зимой. Территория относится к средиземноморской флористической области. Естественная растительность состоит из однолетних и многолетних трав (Oryzopsis sp., Avena sterilis, Hordeum bulbosum) и одиноко стоящих деревьев (Prunus amygdalus, Pistacia atlantica). Расширение сельскохозяйственных угодий и систем орошения вокруг озера привело к почти полному исчезновению естественной растительности [18, 28].
Почвенный покров побережья представлен широким спектром почв, сменяющих друг друга на очень малых расстояниях – в пределах нескольких метров. Почвообразующими породами служат рыхлые коры выветривания базальтов и базальтовых туфов с большим количеством тяжелого по гранулометрическому составу мелкозема [6]. Наиболее характерными для данной территории являются рендзины (Rendzinas), протогрумусоли (Cambisols, Lithosols) и грумусоли (Vertisols) [34]. Последние относятся к наиболее распространенным в этой сложной почвенной мозаике [28].
В настоящей работе представлены результаты исследования состава и антибиотического потенциала актиномицетного комплекса грумусоли и характеристика выделенного из этой почвы нового продуцента ценного антибиотика – боррелидина.
ОБЪЕКТЫ И МЕТОДЫ
Отбор образцов и выделение актиномицетов. Образцы для исследования отбирали из верхнего слоя (0–10 см) темной cлитой трещиноватой глинистой почвы, соответствующей описанию грумусолей [6], согласно мировой коррелятивной базе почвенных ресурсов WRB, Vertisols.
Отбор проводили в феврале 2018 г. под злаковым разнотравьем на окраине г. Тверия, расположенного на западном берегу оз. Кинерет (32°46′43″ N, 35°31′36″ Е) (рис. S1 ). Анализировали три смешанных образца, каждый из которых составляли объединением пяти индивидуальных проб, отобранных на площади 100 м2. Актинобактерии выделяли при поверхностном посеве из разведений почвенных суспензий на казеин-глицериновый агар и среду с пропионатом натрия [9]. В качестве селективного приема почву перед посевом прогревали при 100°С в течение 1 ч. После инкубации (28°С, 21 сут) отбирали выросшие колонии мицелиальных прокариот, объединяя их в отдельные морфотипы, согласно общности культуральных и морфологических признаков. Чистоту выделенных культур определяли общепринятыми методами: микроскопически и высевом на агаризованную минеральную среду Гаузе 1 [1]. Отобранные штаммы поддерживали на скошенном овсяном агаре при +4°С, а при длительном хранении ‒ в виде споровых суспензий в 20% глицероле при ‒80°С.
Скрининг антибиотической активности. Скрининг выделенных штаммов на антибиотическую активность проводили с использованием репортерной флуоресцентной системы на основе штамма Escherichia coli JW5503 ΔtolC с внедренной плазмидой pDualrep2, которая позволяет одновременно с классическим тестом на эффективность ингибирования роста определять механизм действия антибиотика [23]. Выделенные из посева актиномицеты выращивали в течение 10 сут на овсяном агаре, затем из агара с культурами вырезали блоки диаметром 5 мм и помещали их на плотную среду Luria Bennet, предварительно засеянную репортерным штаммом. В присутствии ингибиторов синтеза белка или молекул, нарушающих репликацию ДНК, репортерный штамм после инкубации (37°С, 18 ч) способен вырабатывать флуоресцентные белки RFP и Katushka2S, которые визуализируются в сканере ChemiDoc (Bio-Rad) в каналах Су-3 и Су-5 соответственно.
Установление химической природы активного вещества. Экстракция и очистка активного вещества. Штамм 3IZ-6, отобранный при первичном антибиотическом скрининге, выращивали в погруженной культуре (30°С, 10 сут) на шейкере (2000 об./мин) в среде состава (г/л): мальтоза – 10, пептон – 10, гидролизат казеина – 2, дрожжевой экстракт – 2, NaCl – 6. Освобожденную от клеток культуральную жидкость (КЖ) наносили на хроматографическую колонку Poly-Prep Columns (Bio-Rad) с сорбентом LPS-500H (Техносорбент) и затем элюировали в градиенте вода-ацетонитрил (v/v). С помощью скрининга на репортерной системе выявляли активную фракцию. Разделение, очистку и идентификацию целевого вещества осуществляли методами высокоэффективной жидкостной хроматографии и масс-спектрометрии как описано ранее [30].
Изучение механизма действия активного вещества. Активную фракцию, полученную методом твердофазной экстракции КЖ штамма 3IZ-6, концентрировали на вакуумном испарителе (SpeedVac®) и использовали для определения минимальной ингибирующей концентрации в отношении репортерного штамма E. coli JW5503 ΔtolC pDualrep2 [26].
Эту фракцию использовали в toe-print анализе [22] и для изучения трансляции in vitro [7] с помощью готового набора E. coli S30 Extract System for Linear Templates (Promega) согласно инструкции производителя. Трансляцию проводили в течение 30 мин при 37°С, кинетику реакции детектировали на приборе Victor X5 2030 (Perkin Elmer): каждую точку измеряли 30 раз, интервал между раундами измерения составлял 30 с.
Полифазная идентификация штамма-продуцента. Описание культуральных и морфологических признаков. Культуральные признаки штамма 3IZ-6 учитывали после 21-дневной инкубации при 28°C на мальтозо-дрожжевом (ISP 2), овсяном (ISP 3), крахмало-нитратном (ISP 4), глицерол-аспарагиновом (ISP 5), пептонно-дрожжевом агаре с железом (ISP 6) и тирозиновом агаре (ISP 7) [27]. Окраску воздушного и субстратного мицелия оценивали по шкале RAL CLASSIC® и сопоставляли с аналогичными данными, приведенными для близких штаммов в базе BacDive (https://bacdive. dsmz.de/).
Форму цепочек и орнаментации поверхности спор изучали с помощью светового (Fisherbrand AX-502, Thermo Fisher Scientific) и сканирующего электронного микроскопа (Camscan-S2).
Определение физиологических особенностей. Рост штамма 3IZ-6 при различных температурах (от 4 до 50°C), в диапазоне рН (от 4 до 11 ед.) и при различных концентрациях NaCl (1, 2.5, 5, 6 и 7.5%) оценивали на среде Гаузе 1 после инкубации в течение 8 сут.
Утилизацию природных полимеров, а также способность образовывать кислоту при росте на среде с различными источниками углерода (рис. S2 ) оценивали как описано ранее [32, 33].
Для оценки чувствительности штамма 3IZ-6 к различным антибиотикам использовали диски индикаторные ДИ-ПЛС-50-01 по ТУ 9398-001-39484474-2000 (НИЦФ, Россия).
Филогенетический анализ последовательностей гена 16S рРНК. Амплификацию фрагмента гена 16S рРНК штамма 3IZ-6 проводили с использованием универсальных бактериальных праймеров 16SF75 (5'-AGTGGCGGACGGGTGAGTAA-3') и 16SR1100 (5'-TTACTAGCGATTCCGACTTCA-3'). Полимеразно-цепную реакцию (ПЦР) выполняли при следующих условиях: начальная денатурация при 95°С в течение 4 мин, далее 32 цикла (94°С в течение 20 с, 58°С в течение 30 с и 72°С в течение 45 с), после чего окончательное удлинение при 68°С в течение 5 мин. Продукты ПЦР секвенировали на анализаторе ДНК ABI3130xl (Thermo Fisher Scientific, USA) в НПК “Синтол” (Россия).
Прямые и обратные прочтения целевого фрагмента редактировали и собирали с помощью программы GeneStudio software Version 2.2.0.0. Итоговую последовательность 16S рРНК депонировали в GenBаnk (OK412986) (https://submit.ncbi.nlm.nih.gov/) и использовали для сравнительного филогенетического анализа с родственными типовыми штаммами стрептомицетов в программе MEGA software Version X (https://www.megasoftware.net). Для построения филограмм применяли методы присоединения соседей (Neighbor Joining, NJ) и максимального правдоподобия (Maximum Likelyhood, ML) для 1000 альтернативных деревьев. Эволюционные дистанции между последовательностями рассчитывали с помощью модели Тамуры-Ней (Tamura-Nei’s model).
Анализ ингибиторной активности штамма-продуцента против возбудителей болезней растений. Для оценки способности штамма 3IZ-6 угнетать развитие фитопатогенных микроорганизмов использовали штаммы из Всероссийской коллекции микроорганизмов (Пущино) и рабочей коллекции лаборатории биотехнологии растений и микроорганизмов ФАНЦ Северо-Востока (Киров) (табл. 1). Для роста тест-культур бактерий и оценки методом агаровых блоков антибактериальной активности штамма использовали среду RHM [10]. Культивирование фитопатогенных грибов и оценку их способности расти в присутствии штамма 3IZ-6 проводили на картофельно-декстрозном агаре [8] при 25°С в течение 10–12 сут.
Таблица 1.
Возбудители болезней растений, использованные для оценки антифитопатогенной активности
| Микроорганизм | Коллекция, номер штамма | Возбудитель [5] |
|---|---|---|
| Fusarium sambucinum | ВКМ F-842 | Сухая гниль клубней картофеля |
| Botrytis cinerea | ВКМ F-4549 | Серая гниль томата, перца, кабачка, салата, земляники и др. |
| Rhizoctonia solani | ВКМ F-2935 | Ризоктониоз, стеблевой ожог фасоли |
| Fusarium oxysporum | ВКМ F-137 | Фузариоз фасоли, гороха, фузариозное увядание люпина, фузариозная гниль томата, лука-порея, тыквенных культур |
| Cercospora carotae | ВКМ F-2164 | Церкоспороз моркови |
| Alternaria solani | ВКМ F-3048 | Альтернариозная (бурая) пятнистость томата и баклажана |
| Fusarium solani | ВКМ F-819 | Фузариозная гниль томата и фузариозное увядание тыквенных культур, фузариоз гороха |
| Oospora pustulans (Polyscytalum pustulans) | ВКМ F-886 | Парша бугорчатая, или ооспороз картофеля |
| Alternaria radicina | ВКМ F-1863 | Черная гниль сельдерейных (зонтичных) культур |
| Curtobacterium flaccumfaciens | ФАНЦ- G29г4 | Бактериальное увядание зернобобовых культур (фасоль, горох, соя, маш и др.) |
| Bacillus aryabhattai | ФАНЦ- G11г3 | Нет |
| Bipolaris sorokinianа | ФАНЦ-ША | Гельминтоспориозная корневая гниль зерновых культур, темно-бурая пятнистость ячменя |
| Fusarium proliferatum | ФАНЦ-ТЖ | Болезни многих видов растений, преимущественно в теплицах |
| F. сulmorum | ФАНЦ-T-8 | Фузариоз злаков, корневая гниль многих видов растений |
| F. oxysporum | ФАНЦ-ШТ | Фузариоз фасоли, гороха, фузариозное увядание люпина, корневая гниль многих видов растений |
| Alternaria alternatа | ФАНЦ-ША | Пятнистость томата, оливковая плесень злаков |
| Trichoderma sp. | ФАНЦ-ВК | Нет |
Оценка фитотоксичности штамма 3IZ-6. Для оценки возможной фитотоксичности и выделения активного вещества штамм 3IZ-6 культивировали как описано выше. Семена пшеницы (Tritiсum aestivum L.) замачивали в нативной и разбавленной водой КЖ стрептомицета (1 : 10) на 20 ч и проращивали в рулонной водно-бумажной культуре (20°С, 5 сут), при фотопериоде 16 ч и освещенности 7 кЛк. В контроле семена замачивали в воде. В каждом варианте опыта закладывали в рулоны по 100 семян. Учитывали всхожесть, линейные размеры и воздушно-сухую биомассу проростков. Статистическую обработку данных выполняли стандартными методами с использованием пакета Microsoft Excel 8.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Общая численность актиномицетов в образцах исследуемой почвы составила 105–106 колониеобразующих единиц/г, вне зависимости от используемой среды. Актиномицетный комплекс грумусолей включал представителей родов Streptomyces и олигоспоровые формы, которые разграничивали на основе характерных морфологических признаков: образование нефрагментирующегося мицелия, наличие спор на воздушном и/или субстратном мицелии, величина и количество спор в цепочках [12].
По частоте встречаемости (84%) и долевому участию (94.6%) в комплексе мицелиальных прокариот доминировали представители рода Streptomyces, что согласуется со многими литературными данными [2]. Олигоспоровые формы актиномицетов встречались с гораздо меньшей частотой (33%). Особенностью стрептомицетного комплекса грумусолей явилось доминирование видов, образующих различные пигменты (представителей секций и серий) [1]: Cinereus Violaceus (40%), Helvolo-Flavus Helvolus (20%) и небольшая доля неокрашенных видов: серии Cinereus Achromogenes (11.7%), что очевидно связано с необходимостью защиты клеток стрептомицетов от интенсивной инсоляции.
Для антибиотического скрининга отобрали 26 фенотипически различных стрептомицетов, которые наращивали в погруженных культурах и затем тестировали с помощью двойной репортерной системы. Изолят 3IZ-6 не только ингибировал рост штамма E. coli ΔtolC JW5503, трансформированного плазмидой pDualrep2, но и инициировал образование им флуоресцентного белка, что свидетельствует о наличии в КЖ штамма 3IZ-6 ингибиторов синтеза белка (рис. S3 ). Поэтому дальнейшая работа была сфокусирована на изучении данного изолята и синтезируемого им метаболита.
При помощи твердофазной экстракции КЖ штамма 3IZ-6 разделили на отдельные ацетонитриловые фракции. Наибольшей антибиотической активностью в отношении репортерной системы E. coli dtolC JW5503 pDualrep2 обладала фракция, полученная экстракцией 50%-ным раствором ацетонитрила в воде. Постановка реакции синтеза белка в бесклеточной системе показала, что выделенный образец подавляет синтез белка при содержании ниже минимальной ингибирующей концентрации (рис. S4 ), что позволяет рассматривать аппарат синтеза белка как его основную мишень. Разведения 1 : 10 и 1 : 100 активной фракции штамма 3IZ-6 полностью подавляют in vitro трансляцию, как и положительный контроль – 50 мкг/мл эритромицина.
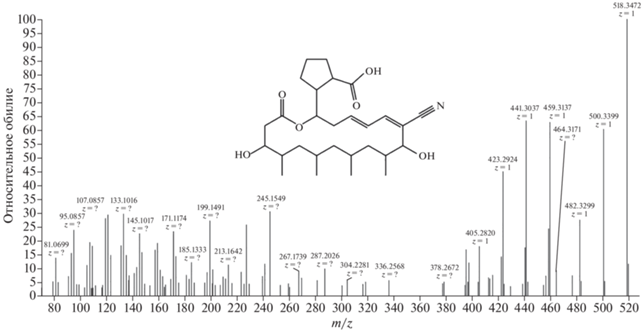
Поскольку метаболит, образуемый штаммом 3IZ-6, оказал однозначное влияние на процесс биосинтеза белка, его было решено протестировать с помощью toe-print анализа для выявления стадии трансляции, на которую он воздействует (рис. S5 ). Остановка рибосомы произошла на треониновом кодоне в А-сайте рибосомы. Такую активность может демонстрировать известный ингибитор треонил-тРНК-синтетазы – боррелидин [19]. Присутствие боррелидина в образце 3IZ-6 подтверждено при помощи масс-спектрометрии (рис. 1).
Боррелидин – уникальный по структуре 18-членный нитрилсодержащий поликетидный макролактон с антибактериальной [11], антимикотической [15], антималярийной [24] и противовирусной активностью [20]. Боррелидин может воздействовать на раковые клетки, благодаря способности подавлять ангиогенез [21], индуцировать апоптоз и ингибировать треонил-тРНК-синтетазу [16]. Несмотря на широкий потенциал клинического действия, боррелидин пока не нашел широкого применения в медицинской практике из-за цитотоксичности в отношении здоровых клеток.
Для установления таксономического положения штамма 3IZ-6 использовали полифазный таксономический подход, включающий анализ комплекса как генетических, так и фенотипических признаков. Сравнение нуклеотидной последовательности фрагмента гена 16S рРНК штамма 3IZ-6 с последовательностями типовых представителей видов рода Streptomyces из базы данных GenBank выявило, что ближайшими видами со 100% сходством являются S. rochei DSM 40231T и S. mutabilis DSM 40169T. На филогенетическом древе они образуют вместе с 3IZ-6 отдельную кладу с высоким уровнем бутстрап-поддержки (рис. 2). По морфологическим и физиолого-биохимическим признакам эти виды очень близки, поэтому для их разграничения необходим полногеномный анализ. По культуральным признакам (цвету и текстуре воздушного мицелия на ISP-средах) штамм 3IZ-6 ближе к типовому S. rochei DSM 40231T (табл. 2, рис. 3). Среди представителей вида S. rochei продуценты боррелидина обнаруживались неоднократно [11, 29, 31], есть данные о получении ацетилборрелидина В из культуры S. mutabilis [17]. Способность к синтезу данного антибиотика не ограничена строго определенным таксоном. Среди продуцентов боррелидина встречаются представители родов Streptomyces и Nocardiopsis, изолированные из различных местообитаний, включая эконишы с повышенной соленостью: океанические осадки, морские моллюски, мангровые отложения, засоленные почвы [10, 11, 18, 20, 23]. Предполагаем, что выделенный из грумисолей побережья оз. Кинерет продуцент боррелидина 3IZ-6 принадлежит к виду S. rochei.
Рис. 2.
Филогенетическое положение штамма 3IZ-6 и наиболее близких ему генетически типовых штаммов стрептомицетов, на основании NJ-анализа нуклеотидных последовательностей фрагмента гена 16S рРНК (в скобках указаны номера доступа последовательностей в GenBank). Указаны значения бутстрэп-анализа выше 60%. Масштаб соответствует одной замене на каждые 100 нуклеотидов. Знаком (*) отмечены ветви, также полученные с помощью ML-метода. Штамм Nocardiopsis lucentensis DSM 44048 выбран как референсный организм, не принадлежащий к роду Streptomyces. Штаммы, у которых показана способность продуцировать боррелидин, отмечены В.
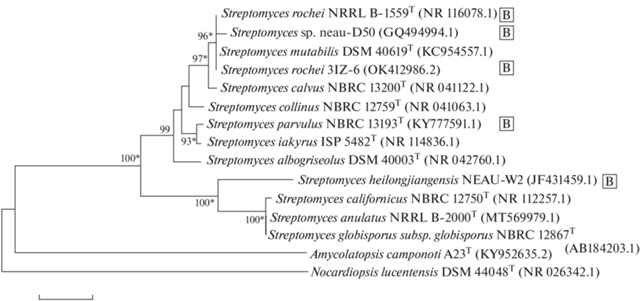
Таблица 2.
Культуральные, морфологические и физиологические признаки штамма 3IZ-6 и филогенетически близких видов стрептомицетов
| Фенотипический признак | 3IZ-6 | S. rochei DSM 40231T | S. mutabilis DSM 40169T |
|---|---|---|---|
| Культуральные | |||
| Цвет воздушного мицелия* | Серый* | Серый* | Светло-серый** |
| Цвет субстратного мицелия** | Бесцветный* | От бесцветного до серо-бурого | От желтовато-зеленого до серовато-фиолетового |
| Образование меланоидного пигмента** | Не образует | Не образует | Не образует |
| Морфологические | |||
| Форма цепочек спор | Крючки, петли, короткие спирали (RA)*** | Спиральные (S) | Крючки, петли, короткие спирали (RA) |
| Поверхность спор | Гладкая | Гладкая | Гладкая |
| Физиологические | |||
| Максимальная концентрация NaCl, % | 6 | 5 | 8 |
| Диапазон рН | 5–9 | Нет | 6–10 |
| Диапазон температур, °С | 4–45 | Нет | 25–40 |
| Оптимальная температура, °С | 38 | 30 | 37 |
| Биохимические | |||
| Гидролиз казеина | + | Нет | + |
| Гидролиз крахмала | + | Нет | + |
| Гидролиз КМЦ | + | Нет | Нет |
| Утилизирует углеводы | Арабиноза, галактоза, глюкоза, лактоза, мальтоза, маннит, манноза, рамноза, фруктоза | Глюкоза, рамноза, фруктоза | Арабиноза, глюкоза, маннитол, рамноза |
| Не использует углеводы | Инозитол, ксилоза, раффиноза, сахароза, сорбитол | Арабиноза, раффиноза, сахароза, ксилоза | Сорбитол |
| Чувствителен к антибиотикам, мкг | Str (300), Carb (25), Kan (30), Tet (30), PB (300) | Нет | Нет |
| Устойчив к антибиотикам, мкг | Ctx (30), Amx (20), Rif (5)**** | Нет | Нет |
* На плотных средах ISP 2–ISP 5. ** На ISP 6. *** Форма спороносных гиф описана на ISP 3 на 14 сут роста при 28°С (рис. 3). **** Str (стрептомицин), Carb (карбенициллин), Kan (канамицин), Tet (тетрациклин), PB (полимиксин В), Ctx (цефотаксим), Amx (амоксициллин), Rif (рифампицин).
Ранее отмечено, что боррелидин может быть использован в защите растений для борьбы с Phytophthora sojae – возбудителем фитофтороза и стеблевой гнили сои (Glycine max) [15], а также против грибов Pythium sp. и Phytophthora sp., поражающих ряд важных сельскохозяйственных культур [14]. Результаты настоящих исследований показали способность штамма S. rochei 3IZ-6 подавлять рост почвообитающих фитопатогенных грибов Fusarium solani, F. sambucinum, Botrytis cinerea (рис. S6 ), вызывающих болезни у многих хозяйственно ценных видов растений.
В отношении фитопатогенов Bipolaris sorokinianа, F. proliferatum, F. сulmorum, F. oxysporum, Alternaria alternatа не выявлено угнетающего действия агаровых блоков с культурой S. rochei 3IZ-6, но отмечено умеренное угнетение роста сапротрофного гриба Trichoderma sp. (13 мм). Установлено, что S. rochei 3IZ-6 способен подавлять рост некоторых фитопатогенных бактерий. Наиболее значительным было угнетение роста Curtobacterium flaccumfaciens G29r4 (40 мм). Данный фитопатоген может вызывать бактериальное увядание фасоли (Phaseolus spp.), гороха (Pisum sativum), сои и некоторых других бобовых культур. Рядом международных комиссий по карантину и защите растений возбудитель C. flaccumfaciens pv. flaccumfaciens включен в число карантинных объектов (https://www.eppo.int).
Фитотоксичность боррелидина впервые отмечена у S. scabies, но его угнетающее действие было на порядок ниже, чем такстомина А [13]. Оценка фитотоксического действия S. rochei 3IZ-6 показала, что водорастворимые метаболиты изолята снижают всхожесть обработанных семян пшеницы на 15, длину корней проростков – на 52, высоту побега – на 46, биомассу – на 48% по сравнению с растениями, не подвергнутыми обработке (табл. 3). Поскольку степень фитотоксичности S. rochei 3IZ-6 варьировала в зависимости от условий культивирования и состава питательной среды, теоретически представляется возможным подобрать оптимальные параметры, обеспечивающие желаемую гербицидную активность данной культуры.
Таблица 3.
Всхожесть и морфометрические показатели проростков в зависимости от обработки семян КЖ S. rochei 3IZ-6
| Вариант | Длина корня, мм | Высота побега, мм | Биомасса в.-с., г |
Всхожесть, % | |
|---|---|---|---|---|---|
| Контроль (без обработки) | 89.78 ± 8.83* | 35.5 ± 4.13 | 0.25 ± 0.01 | 87 ± 3.83 | |
| КЖ, полученная на ISP 3 | Нативная | 43.13 ± 4.03** | 19.07 ± 3.04** | 0.13 ± 0.01** | 72 ± 5.66** |
| 1 : 10 | 69.13 ± 7.56** | 29.48 ± 3.76 | 0.21 ± 0.03** | 84 ± 5.66 | |
| КЖ, полученная на среде Гаузе 1 | Нативная | 71.88 ± 7.03** | 32.15 ± 3.28 | 0.20 ± 0.02** | 87 ± 6.0 |
| 1 : 10 | 94.16 ± 10.28 | 45.04 ± 6.88 | 0.26 ± 0.02 | 93 ± 3.83 | |
ЗАКЛЮЧЕНИЕ
Из грумусолей, сформированных в специфических условиях, связанных с закономерным сезонным чередованием продолжительных сухих и коротких влажных периодов, с использованием селективного приема получено 26 изолятов бактерий рода Streptomyces. В результате проведения антибиотического скрининга выделенных культур стрептомицетов выявлен штамм S. rochei 3IZ-6, содержащий, по данным репортерной флуоресцентной системы, ингибитор белкового синтеза, который с помощью постановки реакции in vitro трансляции, toe-print анализа и масс-спектрометрии идентифицирован как боррелидин. Антибиотик боррелидин и его дериваты в настоящее время интенсивно изучаются в связи с разработкой новых противораковых средств. Особый интерес представляет способность боррелидина ингибировать активность фермента треонил-тРНК-синтетазы, принимающего участие в синтезе белка. Исследования почвенного изолята S. rochei 3IZ-6 в качестве нового продуцента боррелидина является приоритетным направлением.
Вместе с тем в чистых культурах S. rochei 3IZ-6 продемонстрировал угнетающее действие в отношении почвообитающих фитопатогенных грибов F. solani, F. sambucinum, B. cinerea и бактерии C. flaccumfaciens, имеющих широких круг растений-хозяев из числа сельскохозяйственных культур. Так, перечисленные возбудители отличаются высокой вредоносностью в отношении зернобобовых, тыквенных, томата, перца и ряда других овощных и полевых культур, возделываемых в разнообразных почвенных условиях.
Наряду с антифитопатогенным действием, в лабораторных условиях установлена выраженная фитотоксичность водорастворимых метаболитов S. rochei 3IZ-6, в связи с чем целесообразно проведение исследований, связанных с разработкой на его основе препарата гербицидного действия. Представленные в работе данные свидетельствуют о перспективности использования выделенного из грумусоли побережья оз. Кинерет изолята в защите растений от фитопатогенов и сорняков.
Список литературы
Гаузе Г.Ф., Преображенская Т.П., Свешникова М.А., Терехова Л.П., Максимова Т.С. Определитель актиномицетов: роды Streptomyces, Streptoverticillium, Chainia. М.: Наука, 1983. 248 с.
Звягинцев Д.Г., Зенова Г.М. Экология актиномицетов. М.: ГЕОС, 2001. 256 с.
Кожевникова И.А., Швейкина В.И. Моделирование колебаний уровня озера Кинерет // Водные ресурсы. 2014. Т. 41. № 6. С. 565–572.
Озиранский Ю.С., Кольмакова Е.Г., Марголина И.Л. Интегрированное управление ограниченными водными ресурсами в целях устойчивого водообеспечения аридных регионов (опыт государства Израиль // Аридные экосистемы. 2014. Т. 20. № 4(61). С. 57–65.
Станчева Й. Атлас болезней сельскохозяйственных культур. София-М.: Пенсофт, 2005. 175 с.
Шапиро М.Б. Почвы Израиля // Почвоведение. 2006. № 11. С. 1300–1307.
Alferova V.A., Maviza T.P., Biryukov M.V., Zakalyukina Y.V., Lukianov D.A., Skvortsov D.A., Osterman I.A. Biological evaluation and spectral characterization of a novel tetracenomycin X congener // Biochimie. 2022. V. 192. P. 63–71. https://doi.org/10.1016/j.biochi.2021.09.014
Atlas R.M. Handbook of microbiological media. CRC Press, 2004. 2056 р.
Baranova A.A., Chistov A.A., Tyurin A.P., Prokhorenko I.A., Korshun V.A., Biryukov M.V., Zakalyukina Y.V. Chemical ecology of streptomyces albidoflavus strain a10 associated with carpenter ant camponotus vagus // Microorganisms. 2020. V. 8. № 12. P. 1948.
Belimov A.A., Dietz K.-J. Effect of associative bacteria on element composition of barley seedlings grown in solution culture at toxic cadmium concentrations // Microbiol. Res. 2000. V. 155. № 2. P. 113–121. https://doi.org/10.1016/S0944-5013(00)80046-4
Berger J., Jampolsky L.M., Goldberg M.W. Borrelidin, a new antibiotic with antiborrelia activity and penicillin enhancement properties // Arch. Biochem. 1949. V. 22. № 3. P. 476–478.
Bergey’s Manual of systematic bacteriology. V. 5. The Actinobacteria. Part A. / Eds. M. Goodfellow et al. N.Y.: Springer, 2012. 2083 p.
Cao Z., Khodakaramian G., Arakawa K., Kinashi H. Isolation of borrelidin as a phytotoxic compound from a potato pathogenic Streptomyces strain // Biosci. Biotechnol. Biochem. 2012. V. 76. № 2. P. 353–357. https://doi.org/10.1271/bbb.110799
Chen Y.-Y., Chen P.-C., Tsay T.-T. The biocontrol efficacy and antibiotic activity of Streptomyces plicatus on the oomycete Phytophthora capsici // Biol. Control. 2016. V. 98. C. 34–42. https://doi.org/10.1016/j.biocontrol.2016.02.011.
Gao Y.-M., Gao Y.M., Wang X.J., Zhang J., Li M., Liu C.X., An J., Xiang W. S. Borrelidin, a potent antifungal agent: insight into the antifungal mechanism against Phytophthora sojae // J. Agric. Food Chem. 2012. V. № 39. P. 9874–9881. https://doi.org/10.1021/jf302857x
Habibi D., Ogloff N., Jalili R. B., Yost A., Weng A.P., Ghahar, A., Ong C.J. Borrelidin, a small molecule nitrile-containing macrolide inhibitor of threonyl-tRNA synthetase, is a potent inducer of apoptosis in acute lymphoblastic leukemia // Invest New Drugs. 2012. V. 30. № 4. P. 1361–1370. https://doi.org/10.1007/s10637-011-9700-y
Hamed A., Abdel-Razek A.S., Frese M., Wibberg D., El-Haddad A.F., Ibrahim T.M., Kalinowski J. et al. N-Acetylborrelidin B: a new bioactive metabolite from Streptomyces mutabilis sp. MII // Z Naturforsch C. 2018. V. 73. № 1–2. P. 49–57. https://doi.org/10.1515/znc-2017-0140
Hazan N., Stein M., Agnon A., Marco S., Nadel D., Negendank J. F., Neev D. The late Quaternary limnological history of Lake Kinneret (Sea of Galilee), Israel // Quat. Res. 2005. V. 63. № 1. P. 60–77. https://doi.org/10.1016/j.yqres.2004.09.004
Li M., Zhang J., Liu C., Fang B., Wang X., Xiang W. Identification of borrelidin binding site on threonyl-tRNA synthetase // BBRC. 2014. V. 451. № 4. P. 485–490. https://doi.org/10.1016/j.bbrc.2014.07.100
Lumb M., Macey P.E., Spyvee J., Whitmarsh J.M., Wright R.D. Isolation of Vivomycin and Borrelidin, Two Antibiotics with Anti-Viral Activity, from a Species of Streptomyces (C2989) // Nature. 1965. V. 206. № 4981. P. 263–265. https://doi.org/10.1038/206263a0
Olano C., Moss S J., Braña A.F., Sheridan R.M., Math V., Weston A.J., Salas J.A. Biosynthesis of the angiogenesis inhibitor borrelidin by Streptomyces parvulus Tü4055: insights into nitrile formation† // Mol. Microbiol. 2004. V. 52. № 6. P. 1745–1756. https://doi.org/10.1111/j.1365-2958.2004.04090.x
Orelle C., Carlson S., Kaushal B., Almutairi M.M., Liu H., Ochabowicz A., Mankin A.S. Tools for characterizing bacterial protein synthesis inhibitors // Antimicrob. Agents Chemother. 2013. V. 57. № 12. P. 5994–6004. http://aac.asm.org/content/57/12/5994
Osterman I.A., Komarova E.S., Shiryaev D.I., Korniltsev I.A., Khven I.M., Lukyanov D.A., Dontsova O.A. Sorting Out Antibiotics’ Mechanisms of Action: a Double Fluorescent Protein Reporter for High-Throughput Screening of Ribosome and DNA Biosynthesis Inhibitors // Antimicrob. Agents Chemother. 2016. V. 60. № 12. P. 7481–7489. https://doi.org/10.1128/AAC.02117-16
Otoguro K., Ui H., Ishiyama A., Kobayashi M., Togashi H., Takahashi Y., Masuma R. et al. In Vitro and in Vivo Antimalarial Activities of a Non-glycosidic 18-Membered Macrolide Antibiotic, Borrelidin, against Drug-resistant Strains of Plasmodia // J. Antibiot. 2003. V. 56. № 8. P. 727–729. https://doi.org/10.7164/antibiotics.56.727
Rai R.V., Bai J.A. Natural Products from Actinomycetes: Diversity, Ecology and Drug Discovery. Mysore, Karnataka, India, 2022. 512 p. https://doi.org/10.1007/978-981-16-6132-7
Shiriaev D.I., Sofronova A.A., Berdnikovich E.A., Lukianov D.A., Komarova E.S., Marina V.I., Dontsova O.A. Nybomycin inhibits both fluoroquinolone-sensitive and fluoroquinolone-resistant Escherichia coli DNA gyrase // Antimicrob. Agents Chemother. 2021. V. 65 № 5. P. e00777-20. https://doi.org/10.1128/AAC.00777-20
Shirling E.B., Gottlieb D. Methods for characterization of Streptomyces species // Int. J. Syst. Bact. 1966. V. 16. № 3. P. 313–340.
Singer A. The Soils of Israel. Berlin, Heidelberg: Springer, 2007. 306 p.https://doi.org/10.1007/978-3-540-71734-8
Sun J., Shao J., Sun C., Song Y., Li Q., Lu L., Ju J. Borrelidins F–I, cytotoxic and cell migration inhibiting agents from mangrove-derived Streptomyces rochei SCSIO ZJ89 // Bioorg. Med. Chem. 2018. V. 26 № 8. P. 1488–1494. https://doi.org/10.1016/j.bmc.2018.01.010
Volynkina I.A., Zakalyukina Y.V., Alferova V.A., Belik A.R., Yagoda D.K., Nikandrova A.A., Buyuklyan Y.A. et al. Mechanism-Based Approach to New Antibiotic Producers Screening among Actinomycetes in the Course of the Citizen Science Project // Antibiotics. 2022. V. 9. № 11. P. 1198. https://doi.org/10.20944/preprints202208.0132.v1
Yu M., Li Y., Banakar S. P., Liu L., Shao C., Li Z., Wang C. New metabolites from the co-culture of marine-derived actinomycete Streptomyces rochei MB037 and fungus Rhinocladiella similis 35 // Front. Microbiol. 2019. V. 10. P. 915. https://doi.org/10.3389/fmicb.2019.00915
Zakalyukina Y.V., Osterman I.A., Wolf J., Neumann-Schaal M., Nouioui I., Biryukov M.V. Amycolatopsis camponoti sp. nov., new tetracenomycin-producing actinomycete isolated from carpenter ant Camponotus vagus // Antonie van Leeuwenhoek. 2022. V. 115. № 4. P. 533–544. https://doi.org/10.1007/s10482-022-01716-w
Zakalyukina Y.V., Zaytsev A.R., Biryukov M.V. Study of Cellulose-Destroying Activity of Actinobacteria Associated with Ants // Moscow Univ. Biol. Sci. Bull. 2021. V. 76. № 1. P. 20-27. https://doi.org/10.3103/S0096392521010065
European Soil Data Centre [Электронный ресурс]. URL: https://esdac.jrc.ec.europa.eu/images/Eudasm/Asia/ images/maps/download/IL3002_SO.jpg
Дополнительные материалы
- скачать ESМ.docx
- Приложение 1. Fig.1. - Fig.7.