Почвоведение, 2023, № 6, стр. 715-729
Микробиологические показатели дерново-подзолистой почвы и ее ризосферы в полувековом полевом опыте с применением разных систем удобрения
М. В. Семенов a, *, Н. А. Ксенофонтова a, Д. А. Никитин a, А. К. Тхакахова a, С. М. Лукин b
a Почвенный институт им. В.В. Докучаева
119017 Москва, Пыжевский пер., 7, стр. 2, Россия
b Всероссийский научно-исследовательский институт органических удобрений и торфа – филиал
“Верхневолжский ФАНЦ”
601390 Владимирская обл., Судогодский р-н, Вяткино, Прянишникова ул., 2, Россия
* E-mail: mikhail.v.semenov@gmail.com
Поступила в редакцию 06.10.2022
После доработки 30.12.2022
Принята к публикации 09.01.2023
- EDN: FPEBGH
- DOI: 10.31857/S0032180X22601220
Аннотация
Изучено влияние разных систем удобрения на количественные показатели различных групп микроорганизмов внекорневой агродерново-подзолистой почвы (Umbric Albic Retisol (Aric)) и ризосферы картофеля и ячменя. Исследование проводили на базе длительного полевого опыта, в котором с 1968 г. применяются минеральная (NPK), органическая (навоз) и органо-минеральная (NPK + навоз) системы удобрения. Внесение органических удобрений на 25–100% повышало содержание углерода микробной биомассы (Смик) в почве и ризосфере по сравнению с почвой без удобрений, а применение минеральных удобрений, наоборот, снижало на 10–30%. Базальное дыхание и дыхательный коэффициент (qСО2) увеличивались в ряду: без удобрений < NPK < NPK + навоз < навоз. Численность копий генов бактерий, архей и грибов существенно, в 1.5–2.5 раза, повышалась в условиях применения органических удобрений и снижалась в 2–2.5 раза под воздействием NPK. Соотношение грибы/бактерии по методу люминесцентной микроскопии изменялось от 32 до 100, а по результатам количественной ПЦР – от 0.10 до 0.92, при этом наименьшие значения были характерны для вариантов с внесением NPK, а наибольшие – с навозом. Таким образом, в целях поддержания стабильности системы почва–микроорганизмы–растение применяемые дозы минеральных удобрений должны компенсироваться внесением свежего органического вещества.
ВВЕДЕНИЕ
Современная стратегия интенсификации земледелия предусматривает формирование не только высокопродуктивных, но и одновременно стабильных агроценозов, устойчивых к изменениям климата и антропогенным стрессам. Традиционно одним из обязательных компонентов интенсификации земледелия является применение удобрений, как правило, в повышенных дозах [6]. Почва является олиготрофной средой, в которой подавляющая часть микроорганизмов (95–99%) большую часть времени обитает в условиях дефицита субстрата и находится в неактивном состоянии [33]. Систематическое применение минеральных и органических удобрений приводит к эвтрофикации почвы – искусственному обогащению почвенной среды легкодоступными субстратами и биофильными элементами [9, 17, 18, 42, 53]. В этом случае большая часть микроорганизмов переходит в активное состояние, поэтому эвтрофикация почвы является важнейшим агроэкологическим фактором модуляции почвенного микробиома [29, 45, 47].
Применение физиологически кислых минеральных и органических удобрений сопровождается значительными сдвигами pH почвы – главного фактора, определяющего таксономическое разнообразие почвенного микробиома [20, 25, 34, 38, 44]. Внесение азота повышает численность нитрификаторов и денитрификаторов [45], а также меняет метаболический потенциал микробиома по разложению разных компонентов почвенного органического вещества [43, 53]. С органическими удобрениями в почву привносится большое количество доступного органического вещества, макро- и микроэлементов, а также экзогенная микрофлора, что также отражается на прокариотном и грибном сообществах почвы [30, 36, 46, 53]. В целом минеральная система удобрения может приводить к сокращению микробной биомассы и микробного разнообразия [17, 28, 38, 45, 57], а органическая система удобрения – к повышению этих показателей [28, 37, 45].
Отрицательные последствия минеральных удобрений на микробное сообщество могут быть устранены внесением в почву свежего органического вещества с навозом, компостом или с растительной биомассой (солома, сидераты и др.), как это предусматривается органо-минеральной системой удобрения [17, 54]. Однако подавляющее большинство исследований по влиянию систем удобрения на микробные сообщества почвы проводится для минеральных и органических систем по отдельности [15, 22, 37, 54]. При этом редко рассматриваются легкие по гранулометрическому составу почвы, на которых внесение органического вещества приобретает особую значимость для поддержания плодородия [5, 7].
Почвенным микроорганизмам принадлежит ключевая роль в процессах включения секвестрированного органического вещества в почвенного органического вещества [19]. В этой связи возрастает важность микробиологических индикаторов секвестрации углерода почвой, одним из которых является отношение грибы/бактерии [14, 40]. Преобладание микобиоты и высокие значения отношения грибы/бактерии выявляют в почвах с повышенной секвестрационной способностью и более низкими значениями C/N [40, 48, 49]. Уменьшение отношения грибы/бактерии связывают со снижением секвестрационной способности почв [40].
При длительном внесении удобрений в почву поступает гораздо больше субстрата, чем от корней растений [12, 45]. В результате микробиом ризосферы растений может переходить на преимущественное потребление питательных веществ, поступающих с удобрениями [12], что приводит к ослаблению растительно-микробных взаимодействий [32]. В связи с этим, агрогенная эвтрофикация может существенно изменять состав, разнообразие и функциональную активность микробных сообществ ризосферы растений [3, 12, 38, 45, 47]. Поскольку ризосферный микробиом играет важную роль в росте, развитии и здоровье растений [4, 16, 41], исследование влияния систем удобрения на микробиологические показатели необходимо проводить не только во внекорневой почве, но и в ризосфере сельскохозяйственных культур.
Цель исследования – изучение влияния минеральной, органической и органо-минеральной систем удобрения на биомассу и численность разных групп микроорганизмов во внекорневой супесчаной агродерново-подзолистой почве и в ризосфере сельскохозяйственных культур. Предположили, что органические удобрения будут увеличивать, а минеральные удобрения уменьшать биомассу, численность клеток и соотношение грибы/бактерии, как в почве, так и ризосфере сельскохозяйственных культур (ячмень, картофель).
ОБЪЕКТЫ И МЕТОДЫ
Почва. Исследования проводили на базе длительного полевого опыта, заложенного в 1968 г., Всероссийского научно-исследовательского института органических удобрений и торфа (ВНИИО-У) – филиале ФГБНУ “Верхневолжский ФАНЦ” в Судогодском районе Владимирской области (56°3′16″ N, 40°29′28″ E) с разными системами удобрения. Почва – агродерново-подзолистая супесчаная (Umbric Albic Retisol (Aric)). Культуры севооборота: однолетний люпин – озимая пшеница – картофель – ячмень. Изучали 4 системы удобрения: 1) без удобрений, 2) минеральная система удобрения (N100P50K120), 3) органо-минеральная система удобрения (навоз 10 т/га + + N50P25K60) и 4) органическая система удобрения (навоз 20 т/га).
Почвенные образцы для микробиологических и молекулярно-биологических анализов отбирали общепринятыми способами с соблюдением требований по контролю микробиологической контаминации. Вначале вырезали монолит почвы в междурядье (“внекорневая почва”) размером 5 × 5 × 10 см. Из него отбирали смешанный образец почвы. Затем вырезали почвенный монолит с вегетирующим растением и отделяли крупные комки почвы. После обнажения корневой системы стряхивали присоединенную к корням массу почвы – ризосферу. Для выявления динамики и влияния физиологической стадии растений на ризосферный микробиом отбор образцов проводили дважды: 1) в третьей декаде июня, что соответствует началу колошения ячменя и началу бутонизации картофеля, 2) в начале августа (фаза молочной спелости ячменя и начало клубнеобразования картофеля). Всего отобрали 72 образца ризосферы и внекорневой почвы. Образцы всех вариантов отбирали в трехкратной повторности. Образцы почвы для определения микробной биомассы хранили в стерильных пакетах в течение месяца в холодильнике при температуре +4°С, для молекулярно-генетических анализов – в морозильной камере при –70°С. Для определения химических свойств почв использовали воздушно-сухие образцы.
Все почвенные образцы индексировали по схеме растение–ниша–система удобрений–срок отбора. Использовали следующие индексы для вида культуры: W – ячмень, P – картофель, ниши: B – почва, R – ризосфера, системы удобрений: N – без удобрений, M – минеральные удобрения, O – органические удобрения, X – органо-минеральные удобрения, срока отбора: 1 – июнь, 2 – август.
Химические свойства почвы. Содержание органического углерода (Сорг) и общего азота (Nобщ) в почве определяли на автоматическом HCNS-анализаторе Leco 932 (США). Величины водного pH почвы измеряли потенциометрическим способом при соотношении почва : вода, равном 1 : 2.5. Содержание подвижных соединений фосфора и калия определяли по методу Кирсанова в вытяжке 0.2 M HCl.
Определение углерода микробной биомассы, базального дыхания и метаболического коэффициента. Углерод микробной биомассы (Смик) определяли с помощью метода субстрат-индуцированного дыхания (СИД) [1]. К навеске почвы добавляли водный раствор глюкозы и через 3.5–5 ч после инкубации при 22°С измеряли концентрацию СО2 в газовой фазе на газовом хроматографе Кристал Люкс 4000М (Россия). Скорость СИД выражали в мкл С–СО2/(г почвы ч). Углерод микробной биомассы рассчитывали по формуле:
Базальное дыхание (БД) определяли как СИД, только вместо раствора глюкозы в почву добавляли воду. Время инкубации флаконов с почвой составляло 24 ч. Скорость БД выражали в мкг С–СО2/(г почвы ч).
Удельное дыхание микробной биомассы (микробный метаболический коэффициент, qCO2) рассчитывали как отношение скорости базального дыхания к микробной биомассе: БД/Смик = = qCO2 (мкг С–СО2/(мг Смик ч)).
Биомассу прокариот оценивали с помощью метода люминесцентной микроскопии с применением флуоресцентного красителя акридина оранжевого (микроскоп Биомед 5 ПР ЛЮМ (Россия)) при увеличении 1000× с масляной иммерсией [8]. Десорбцию клеток с почвы проводили при помощи ультразвуковой установки УЗДН-1 (2 мин, сила тока 0.40 А, частота 22 кГц). Число клеток прокариот на 1 г субстрата рассчитывали по формуле:
Биомассу грибов определяли методом люминесцентной микроскопии с применением флуоресцентного красителя калькофлуора белого [8]. Учет спор и длины мицелия осуществляли на люминесцентном микроскопе Биомед 5 ПР ЛЮМ (Россия) при увеличении 400×. Десорбцию клеток с почвы проводили при помощи вортекса MSV-3500 (Латвия) при скорости 3500 об./мин в течение 10 мин. Количество грибных спор на 1 г субстрата рассчитывали по формуле:
Экстракция тотальной ДНК из почвы и количественная ПЦР. Тотальную ДНК выделяли с помощью набора DNeasy PowerSoil ProKit (Qiagen, Германия) и гомогенизатора Precellys 24 (Bertin Technologies, Франция) при скорости 6500 об./мин (40 с). Количественную оценку содержания рибосомальных генов микроорганизмов осуществляли методом полимеразной цепной реакции (ПЦР) в реальном времени. Для амплификации целевых участков ДНК разных групп микроорганизмов использовали следующие праймеры: Eub338/Eub518 – для бактерий, arc915f/arc1059r – для архей, ITS1f/5.8 S – для грибов [45]. Проводили калибровку зависимости интенсивности флуоресценции от логарифма концентрации ДНК стандартных растворов, по которой определяли численность копий генов в образцах с помощью программного обеспечения CFX Manager. В качестве контроля для бактерий использовали растворы клонированных фрагментов рибосомального оперона Escherichia coli, для архей – штамма FG-07 Halobacterium salinarum, для грибов – Saccharomyces cerevisiae Meyen 1 B-D1606. Реакцию проводили по следующему протоколу: 1) 95°C – 3 мин, 2) денатурация двухцепочечной ДНК при 95°C – 10 с, 3) отжиг праймеров на матрице при 50°C – 10 с, 4) удлинение цепи ДНК при 72°C – 20 с, 5) считывание значений флуоресценции, 49-кратное повторение этапов 2‒5. Анализ кривых плавления проводили для проверки размера амплифицированных продуктов. ПЦР проводили для трех повторностей образца с пересчетом на средние значения содержания копий генов.
Статистический анализ данных и визуализацию экспериментальных значений проводили с помощью R 4.2.1. Соответствие экспериментальных данных нормальному распределению проверяли критерием Шапиро–Уилка (p > 0.05). Для оценки различий между средними значениями разных вариантов эксперимента проводили дисперсионный анализ методом One-Way ANOVA с проверкой нормальности распределения ошибок, гомогенности дисперсий и идентичности размера выборок. Поправку на множественные сравнения делали с помощью post-hoc – теста Тьюки. Тесноту и достоверность связей между химическими и микробиологическими свойствами почв оценивали с помощью коэффициента корреляции Пирсона. В качестве поправки на множественные сравнения применяли поправку Холма–Бонферрони. Для многомерного анализа данных использовали метод главных компонент.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Химические свойства почвы. Значения pН образцов агродерново-подзолистой почвы находились в диапазоне от 4.96 до 7.07 (табл. 1). В почве с внесением органических удобрений величины pH были выше по сравнению с другими вариантами. Отмечалось увеличение pH в образцах второго срока отбора под ячменем во внекорневой почве и в ризосфере. Содержание органического углерода (Сорг) варьировало в диапазоне от 0.6 до 1.26%, увеличиваясь в ряду: без удобрений < NPK < < NPK + навоз < навоз. Содержание общего азота в почве вариантов находилось в пределах от 0.07% в варианте без удобрений до 0.12% в варианте с внесением органических удобрений. Отношение C/N в почве вариантов варьировало в диапазоне от 8.2 до 11.9. Наименьшие значения C/N соответствовали образцам с минеральной системой удобрения, наибольшие – с органической системой. Вне зависимости от системы удобрения, в ризосфере сельскохозяйственных культур отмечалось снижение содержания ${\text{NO}}_{3}^{ - }$ и увеличение содержания ${\text{NH}}_{4}^{ + }$ по сравнению с внекорневой почвой. Внесение удобрений для всех систем приводило к увеличению содержания подвижного калия и фосфора в 2–4 раза по сравнению с почвой без удобрений.
Таблица 1.
Основные химические свойства почвы внекорневой зоны и ризосферы
| Индекс образца | ${\text{p}}{{{\text{H}}}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ | Сорг | Nобщ | С/N | ${\text{NO}}_{3}^{ - }$ | ${\text{NH}}_{4}^{ + }$ | P2О5подв | K2Оподв |
|---|---|---|---|---|---|---|---|---|
| % | мкг/г | |||||||
| PBN1 | 5.74 | 0.61 | 0.07 | 9.2 | 52.5 | 8.2 | 31.0 | 68.9 |
| PBM1 | 5.17 | 0.71 | 0.09 | 8.2 | 55.0 | 28.4 | 123.0 | 312.3 |
| PBO1 | 5.86 | 1.11 | 0.11 | 10.6 | 23.4 | 14.7 | 165.0 | 303.9 |
| PBX1 | 5.65 | 0.82 | 0.08 | 10.0 | 27.5 | 9.0 | 130.0 | 223.5 |
| PRN1 | 5.97 | 0.66 | 0.07 | 9.7 | 3.2 | 12.2 | 30.0 | 143.6 |
| PRM1 | 5.35 | 0.81 | 0.09 | 8.5 | 11.2 | 17.4 | 82.0 | 194.9 |
| PRO1 | 6.28 | 1.23 | 0.12 | 11.5 | 6.8 | 26.8 | 158.0 | 323.1 |
| PRX1 | 5.71 | 0.89 | 0.09 | 10.2 | 3.5 | 17.1 | 99.0 | 205.1 |
| WBN1 | 6.12 | 0.64 | 0.07 | 10.6 | 2.8 | 6.7 | 46.0 | 71.8 |
| WBM1 | 5.05 | 0.73 | 0.09 | 9.5 | 24.0 | 25.6 | 129.0 | 257.7 |
| WBO1 | 6.11 | 1.12 | 0.11 | 9.7 | 4.6 | 9.4 | 125.0 | 183.8 |
| WBX1 | 5.80 | 0.81 | 0.08 | 8.6 | 5.4 | 6.1 | 150.0 | 192.6 |
| WRN1 | 6.30 | 0.70 | 0.07 | 11.5 | 3.7 | 13.9 | 39.0 | 212.5 |
| WRM1 | 5.53 | 0.80 | 0.09 | 9.9 | 6.6 | 28.1 | 153.0 | 291.3 |
| WRO1 | 6.35 | 1.26 | 0.12 | 10.9 | 4.0 | 11.7 | 121.5 | 297.2 |
| WRX1 | 5.89 | 0.93 | 0.09 | 8.7 | 7.8 | 26.5 | 121.0 | 398.7 |
| PBN2 | 6.00 | 0.60 | 0.07 | 9.3 | 52.5 | 8.2 | 31.0 | 68.9 |
| PBM2 | 5.25 | 0.69 | 0.08 | 8.6 | 55.0 | 28.4 | 123.0 | 312.3 |
| PBO2 | 5.90 | 1.13 | 0.10 | 11.4 | 23.4 | 14.7 | 165.0 | 303.9 |
| PBX2 | 5.95 | 0.81 | 0.08 | 9.8 | 27.5 | 9.0 | 130.0 | 223.5 |
| PRN2 | 6.25 | 0.71 | 0.07 | 9.8 | 3.2 | 12.2 | 30.0 | 143.6 |
| PRM2 | 5.43 | 0.78 | 0.09 | 8.8 | 11.2 | 17.4 | 82.0 | 194.9 |
| PRO2 | 6.24 | 1.23 | 0.10 | 11.9 | 6.8 | 26.8 | 158.0 | 323.1 |
| PRX2 | 6.11 | 0.91 | 0.09 | 10.4 | 3.5 | 17.1 | 99.0 | 205.1 |
| WBN2 | 6.32 | 0.63 | 0.07 | 9.8 | 2.8 | 6.7 | 46.0 | 71.8 |
| WBM2 | 4.96 | 0.72 | 0.08 | 8.7 | 24.0 | 25.6 | 129.0 | 257.6 |
| WBO2 | 6.89 | 1.13 | 0.11 | 10.3 | 4.6 | 9.4 | 125.0 | 183.8 |
| WBX2 | 5.88 | 0.79 | 0.08 | 9.8 | 5.4 | 6.1 | 150.0 | 192.6 |
| WRN2 | 6.41 | 0.67 | 0.07 | 10.0 | 3.7 | 13.9 | 39.0 | 212.5 |
| WRM2 | 5.30 | 0.75 | 0.09 | 8.7 | 6.6 | 28.1 | 153.0 | 291.3 |
| WRO2 | 7.07 | 1.24 | 0.12 | 10.7 | 4.0 | 11.7 | 121.5 | 297.2 |
| WRX2 | 5.94 | 0.88 | 0.09 | 10.2 | 7.8 | 26.5 | 121.0 | 398.7 |
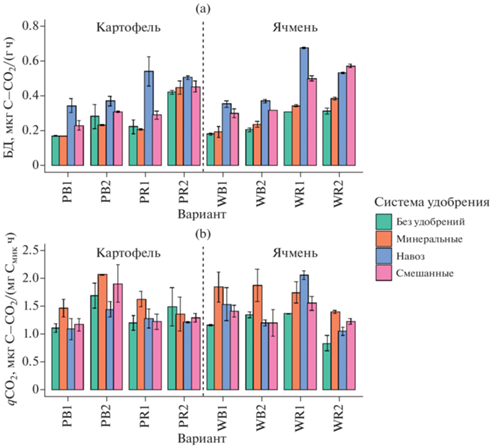
Углерод микробной биомассы (Смик). Содержание Смик варьировало от 104 до 509 мкг/г почвы (рис. 1а). Отмечался существенный рост на 25–100% значений Смик в образцах с внесением органических удобрений. Длительное внесение минеральных удобрений, напротив, приводило к снижению Смик на 20–48% по сравнению с неудобренным контролем. Содержание углерода микробной биомассы при смешанной системе удобрения было выше, чем при минеральной системе, но ниже, чем при органической, занимая промежуточное положение. В ризосфере картофеля и ячменя наблюдался рост в 1.3–1.6 раз микробной биомассы по сравнению с внекорневой почвой, при этом ризосферный эффект был особенно значим на второй срок отбора. Определяющими факторами содержания углерода микробной биомассы были экологическая ниша (F = 364, p < 0.0001) и система удобрения (F = = 129, p < 0.0001). Отношение Смик/Сорг находилось в диапазоне от 1.4 до 5.7%, с максимумом в ризосфере под ячменем (рис. 1b).
Рис. 1.
Углерод микробной биомассы (a) и его доля в общем органическом углероде (b) почвы. Здесь и далее: культуры: W – ячмень, P – картофель, ниши: B – почва, R – ризосфера, срока отбора: 1 – июнь, 2 – август.
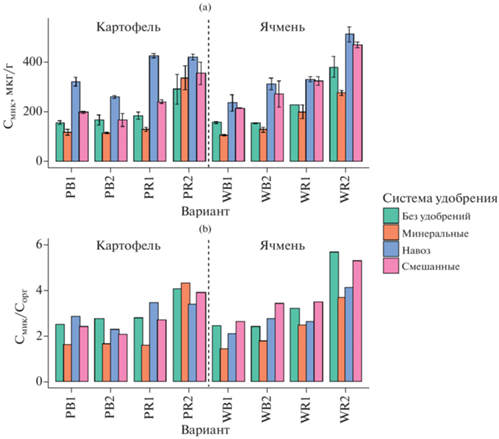
Влияние минеральных удобрений на углерод микробной биомассы зависит от многих факторов, прежде всего, от рН [28, 57]. В мета-анализе на основе 107 выборок 64 долгосрочных (в среднем 37 лет) полевых испытаний было показано, что при значениях рН почвы <5.0 внесение минеральных удобрений негативно влияло на Смик [28]. В настоящем исследовании применение минеральных удобрений понижало рН до 4.96–5.30, что в условиях кислых почв может служить основной причиной уменьшения содержания углерода микробной биомассы (Смик). Для других типов почв с кислой реакцией среды также наблюдался негативный эффект минеральных удобрений на Смик [10, 13, 29, 39, 45].
В предыдущих исследованиях отмечалось, что внесение органических удобрений приводит к росту значений Смик в 1.5–2.5 раза [7, 10, 39, 45]. Данный эффект вызван активацией и ростом потенциально активных либо покоящихся почвенных микроорганизмов при поступлении свежего органического вещества, в то время как большинство привнесенных с навозом экзогенных микроорганизмов погибает спустя несколько недель [21, 39, 46, 56].
В отличие от предыдущих исследований [29, 45], принадлежность к разной экологической нише (внекорневая почва или ризосфера) оказывала даже большее влияние на распределение углерода микробной биомассы, чем система удобрения. Это вызвано тем, что в настоящем исследовании дозы минеральных и органических удобрений были в среднем в 2 раза ниже, чем в предыдущих работах. Кроме того, площадь экспериментальных делянок в данном эксперименте была значительно больше, чем в упомянутых исследованиях, что не позволяло провести идентичное и равномерное распределение удобрений по всей поверхности участков. Как следствие, создавались участки с повышенными и пониженными дозами удобрений, что приводило к неравномерному влиянию удобрений на микробиом почвы и ризосферы на разных участках полей. В результате этого ризосферный эффект оказывался очень сильным даже при длительном внесении удобрений в почву.
Структура микробной биомассы. Биомасса прокариот составляла от 1.38 до 5.56 мкг/г почвы, а численность их клеток – от 5.60 × 108 до 2.37 × 109 кл./г почвы соответственно (табл. S1 ). Минимальные значения биомассы и численности прокариот выявлены в почве без удобрений под ячменем, а максимальные – в ризосфере картофеля с органо-минеральными удобрениями. Доля мицелия актиномицетов в биомассе прокариот варьировала от 4% в ризосфере ячменя с органо-минеральными удобрениями до 30% в почве с органическими удобрениями под картофелем. Биомасса прокариот была представлена преимущественно одноклеточными формами. Длина актиномицетных гиф коррелировала с его долей в биомассе прокариот и составляла от 3.14 до 31.33 м/г почвы.
Биомасса грибов варьировала в диапазоне от 65 до 474 мкг/г почвы (табл. S2 ). Минимальные значения грибной биомассы выявлены в почве с минеральными удобрениями, а максимальные – в ризосфере ячменя с органическими удобрениями. Доля мицелия – активного компонента грибной биомассы – варьировала от 12 до 81%. Наименьшая длина грибных гиф (14.5 м/г почвы) выявлена в почве с минеральными удобрениями, а наибольшая (193.6 м/г почвы) отмечена в ризосфере с органическими удобрениями под ячменем. Все показатели, характеризующие биомассу грибов, повышались ко второму сроку отбора. При внесении минеральных удобрений отмечалось уменьшение биомассы грибов и длины мицелия, а при органической системе удобрения происходило увеличение этих показателей. Во всех образцах ризосферы биомасса грибов была больше по сравнению с внекорневой почвой. Численность одноклеточных грибных пропагул (спор и дрожжей) в образцах составляла 105–106 кл./г почвы. Большая часть (85–100%) пропагул микобиоты представлена мелкими формами 2–3 мкм, а численность крупных пропагул не превышала 103 кл./г почвы.
Базальное дыхание и дыхательный коэффициент qCO2. Интенсивность БД варьировала от 0.17 до 0.67 мкг С–СО2/(г ч) (рис. 2a). Наибольшие значения БД отмечались в ризосфере картофеля и ячменя с внесением органических удобрений для обоих сроков отбора. Высокие величины БД были характерны для образцов со смешанной системой удобрения. Наименьшие значения БД отмечались во внекорневой почве и в ризосфере картофеля и ячменя без удобрений. Факторами, определяющими интенсивность базального дыхания, были ниша (F = 412, p < 0.0001) и система удобрений (F = 159, p < 0.0001).
В ризосфере БД было в 1.3–1.6 раз больше, чем во внекорневых зонах почвы. Органические удобрения существенно (до 2.5 раз) повышали БД по сравнению с другими системами удобрения, особенно в первый срок отбора. Для обоих сроков отбора образцов отмечено повышение БД в ряду: без удобрений < NPK < NPK + навоз < навоз. В образцах ризосферы второго срока отбора с применением органической и смешанной систем удобрения отмечалось увеличение интенсивности БД по сравнению с первым сроком отбора.
Система удобрения зачастую является решающим фактором, определяющим микробиологическую активность пахотной почвы [15, 56]. Данные, полученные в исследовании, коррелируют с ранее опубликованными работами для дерново-подзолистых почв [2, 7] и серых почв [45]. Однако в некоторых исследованиях было отмечено положительное влияние минеральных удобрений на интенсивность БД [26, 31]. Поскольку БД и Смик коррелируют друг с другом, влияние минеральных удобрений на активность БД определяется, прежде всего, их воздействием на микробную биомассу [3, 13].
Величины коэффициента qCO2 находились в пределах от 0.83 до 2.05 в зависимости от варианта (рис. 2b). Значения qCO2 возрастали в образцах с внесением минеральных и органических удобрений по сравнению с контролем. Метаболический коэффициент был больше в первом сроке отбора по сравнению со вторым. Также можно отметить увеличение метаболического коэффициента в ризосфере ячменя. Значения коэффициента qCO2 определялись в основном совместным влиянием срока отбора и вида сельскохозяйственной культуры (F = 66, p < 0.0001) и нишей (F = 72, p < < 0.0001).
Численность копий генов бактерий варьировала от 1.3 × 109 до 3.3 × 1010 копий генов/г почвы (рис. 3a). Внесение минеральных удобрений резко снижало численность копий генов в 1.5–2.5 раза, а использование смешанной или органической систем, наоборот, существенно повышало в 2–2.5 раза количество бактериальных генов в почве. Этот результат подтверждается рядом исследований [24, 27, 45]. Срок отбора также был важным фактором, определяющим содержание генов бактерий. В образцах, отобранных в июне, количество бактериальных генов было меньше, чем в августе. Количество копий генов бактерий было больше в ризосфере по сравнению с внекорневой почвой. Такой результат закономерен, поскольку прикорневая зона является одной из главных “горячих точек” развития почвенных микроорганизмов [4, 33, 45]. В то же время в ризосфере ячменя численность бактериальных генов была значительно выше, чем в ризосфере картофеля. Факторами, оказывающими максимальное влияние на количество копий генов бактерий, были ниша (F = 220, p < 0.0001) и система удобрения (F = 173, p < 0.0001).
Рис. 3.
Численность генов микроорганизмов в почве методом количественной ПЦР (копий генов/г): бактерии (a), археи (b).
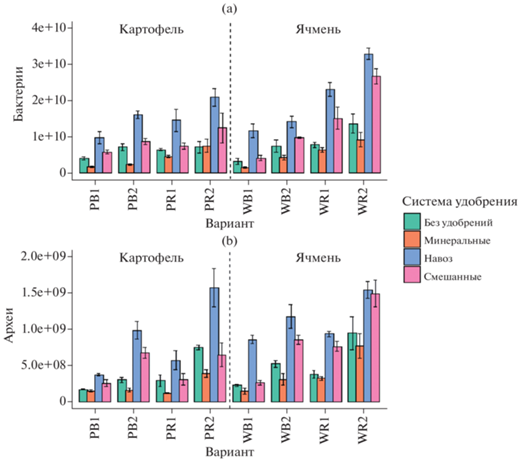
Схожая закономерность отмечена для архей, численность копий генов которых варьировала в диапазоне от 1.8 × 108 до 1.6 × 109 копий генов/г почвы, с ростом численности во второй срок отбора (рис. 3b). Удобрения также оказывали существенное влияние на увеличение численности архей. Наименьшие значения копий генов архей были выявлены при минеральной системе удобрения и без удобрений ((1.7–9.5) × 108 копий генов/г почвы), наибольшие – при органической системе удобрения. Данное явление может быть связано с тем, что преобладающие в почве археи (Thaumarchaeota) осуществляют олиготрофную стратегию и обычно развиваются в условиях дефицита аммония [9, 51]. В ризосфере количество копий генов архей было в 2–4 раза больше, чем во внекорневой почве, что подчеркивает важность ризосферного эффекта для данной группы прокариот [35]. Определяющими факторами для содержания архейных генов в исследуемых образцах были удобрения (F = 110, p < 0.0001) и срок отбора (F = 222, p < 0.0001).
В целом для обоих сроков отбора характерна тенденция к увеличению значений численности копий генов 16S рРНК бактерий и архей в ряду: NPK < без удобрений < NPK + навоз < навоз. Таким образом, минеральные удобрения существенно угнетают, а органические удобрения стимулируют развитие прокариот в исследованных почвах. Аналогичная тенденция показана в других работах [10, 21, 45].
Численность копий рибосомальных генов ITS рРНК грибов варьировала от 6.0 × 108 до 1.6 × 1010 копий генов/г почвы (рис. 4a), что на 1–2 порядка меньшее, чем для агрочерноземов Ставропольского края и серых лесных почв юга Московской области [11]. Наименьшие значения численности генов ITS рРНК выявлены для вариантов без удобрений и с минеральными удобрениями во внекорневой почве. В целом влияние минеральных удобрений на количество копий генов грибов разнонаправлено: в некоторых исследованиях отмечается положительный эффект [50], в других – отрицательный или нейтральный [24]. Это вызвано тем, что изменение pH влияет на грибы в меньшей степени, чем на бактерии [44]. Наибольшие значения численности генов ITS рРНК выявлены в вариантах с внесением органических и органо-минеральных удобрений. Отмечено увеличение численности грибов при внесении органических удобрений, поскольку они являются одним из ведущих факторов, способствующих росту микобиоты [23, 47, 55]. Для грибов было сложно проследить закономерность распределения генов в системе почва–ризосфера. Однако отмечался значительный рост (от 13 до 26 раз) численности генов грибов в ризосфере ячменя, отобранной в августе, где значения были на порядок больше по сравнению с другими вариантами. Определяющими факторами были ниша отбора (F = 49, p < 0.0001) и ее комбинация со сроком отбора (F = 38, p < 0.0001).
Рис. 4.
Численность генов микроорганизмов в почве методом количественной ПЦР (копий генов/г): грибы (a), соотношение грибы/бактерии (b).
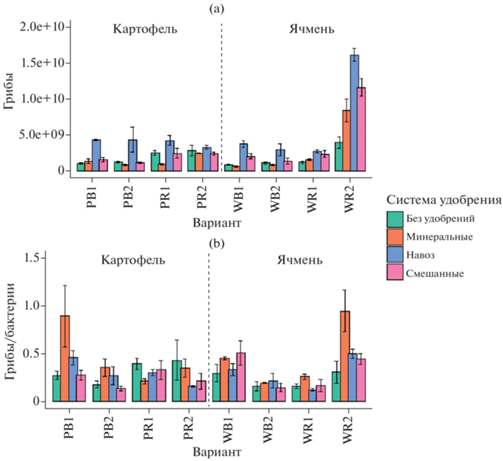
Для обоих сроков отбора характерна тенденция к увеличению значений численности копий генов ITS рРНК грибов в ряду: NPK < без удобрений < NPK + навоз < навоз. Таким образом, минеральные удобрения существенно угнетают, а органические – стимулируют развитие грибов в агродерново-подзодистой почве.
Соотношение грибов и бактерии. По результатам люминесцентной микроскопии в микробной биомассе разноудобренной агродерново-подзолистой почве доминировали грибы, доля которых колебалась от 97% для внекорневой зоны почвы с минеральными удобрениями до 99% в ризосфере с органическими удобрениями. Соотношение грибы/бактерии по методу люминесцентной микроскопии варьировало от 32 до 110. По результатам количественной ПЦР соотношение грибы/бактерии варьировало в диапазоне от 0.10 до 0.92 (рис. 4b). В большинстве случаев отмечался рост соотношения в вариантах с внесением минеральных удобрений, особенно для второго срока отбора образцов. Фактором, в наибольшей степени определяющим соотношение грибы/бактерии, была комбинация срока отбора и ниши (F = 39, p < 0.0001).
Таким образом, по двум примененным методам (люминесцентная микроскопия и количественная ПЦР) получены сильно отличающиеся значения соотношений грибы/бактерии в почвах. В первую очередь это обусловлено тем, что в отличие от метода люминесцентной микроскопии количественная ПЦР не отражает информацию о количестве клеток и биомассе микроорганизмов [10]. Для разных таксонов содержание рибосомальных генов неодинаково и может варьировать в диапазоне от 1 до 16 [10]. Кроме того, за счет мицелиального строения в клетках грибов содержится гораздо меньше ДНК на единицу биомассы по сравнению с прокариотами [11].
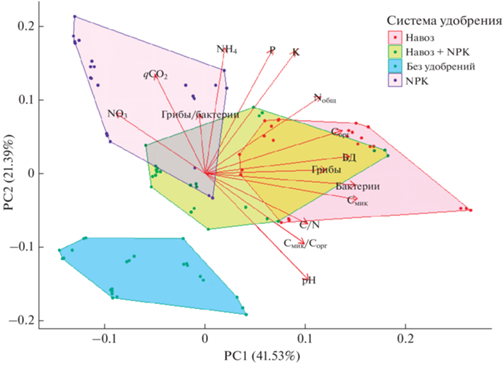
Матрица корреляций между химическими и биологическими свойствами почвы. В матрицу включены коэффициенты корреляций со значением р < 0.05 (рис. 5). Отношение Смик/Сорг отрицательно коррелировало с qCO2 (r = –0.55), что характерно для многих сельскохозяйственных почв [13]. Интенсивность БД характеризовалась высокой положительной корреляцией с такими показателями, как Смик/Сорг (r = 0.58), Смик (r = 0.85), количество копий генов архей (r = 0.70), бактерий (r = 0.81) и грибов (r = 0.55). Вероятно, влияние минеральных удобрений на БД определяется посредством их воздействия на микробную биомассу [13, 26]. Получена положительная корреляция Сорг с С/N (r = 0.59), Смик (r = 0.65) и БД (r = 0.72). Количество копий генов архей положительно коррелировало со значениями рН (r = 0.63) и Смик (r = 0.78). Численность бактерий положительно коррелировала с рН (r = 0.65), С/N (r = 0.52), Смик (r = 0.84), Смик/Сорг (r = 0.57) и археями (r = 0.88), а количество копий генов грибов также характеризовалось положительной корреляцией с Смик/Сорг (r = = 0.56), Смик (r = 0.71), количеством копий генов архей (r = 0.67) и бактерий (r = 0.81). Таким образом, хотя численность копий генов микроорганизмов не тождественна Смик, эти показатели характеризуются высокой положительно корреляцией, и поэтому численность генов прокариот и грибов может служить эффективным дополнительным микробиологическим индикатором состояния почв и ризосферы растений [10, 52].
Рис. 5.
Матрица корреляций между химическими и микробиологическими свойствами почв. Примечание: числами указаны коэффициенты корреляции. Значения указаны только для коэффициентов корреляция с p < 0.05.
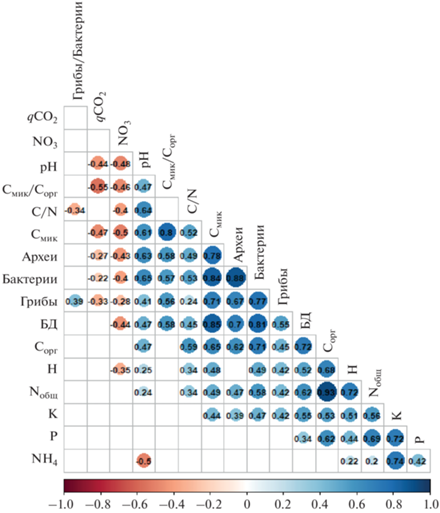
Отрицательная корреляция обнаружена между численностью копий генов архей и содержанием ${\text{NO}}_{3}^{ - }$ (r = –0.43), а также между БД и количеством ${\text{NO}}_{3}^{ - }$ (r = –0.44). Кроме того, высокая отрицательная корреляция наблюдалась для qCO2 с отношением Смик/Сорг (r = –0.55) и qCO2 с Смик (r = –0.47). Ингибирующее действие нитратного азота на развитие архей может быть связано с тем, что доминантной группой среди них являются представители филума Thaumarchaeota, рост которых происходит в олиготрофных условиях [51]. Также необходимо отметить, что в случае окисления аммония археи и бактерии становятся конкурентами за азот.
Метод главных компонент. На основе анализа химических и микробиологических показателей агродерново-подзолистой почвы проанализированные варианты были разделены на 4 непересекающихся кластера (рис. 6). Варианты с органо-минеральной системой удобрения оказались промежуточными между двумя другими кластерами с минеральными и органическими удобрениями. Выявлено, что внесение минеральных удобрений приводит к росту метаболического коэффициента (qCO2) и соотношения грибы/бактерии. Внесение органических удобрений положительно сказывалось на таких показателях, как Сорг, БД, Смик, количество копий генов бактерий и грибов. Полученные результаты подтверждает выводы предыдущих исследований [9, 13, 15, 45, 47]. Таким образом, система удобрения является ключевым фактором, воздействующим на химические и микробиологические показатели, как в почве, так и в ризосфере сельскохозяйственных растений.
ЗАКЛЮЧЕНИЕ
Система удобрения оказывает ведущую роль в формировании микробиома агродерново-подзолистой почвы, отражаясь практически на всех его характеристиках, как во внекорневой почве, так и в ризосфере сельскохозяйственных растений. Органическая система удобрений способствует увеличению размеров микробиома и оптимизации его функционального статуса, придавая системе почва–микроорганизмы–растение повышенную стабильность за счет комфортных эколого-трофических условий для почвенных микроорганизмов. Минеральные удобрения, даже в умеренных дозах, напротив, уменьшали в почве содержание углерода микробной биомассы, базального дыхания, численности копий генов всех микроорганизмов. Поэтому биологизация земледелия с обязательным внесением в почву навоза является необходимым условием повышения микробиологической активности почвы и устранения негативных рисков, создаваемых минеральными удобрениями. Сочетание классических экофизиологических параметров с молекулярно-генетическими методами позволяет дать всестороннюю характеристику состояния почвенного микробиома и оценить его отклик на агрогенные факторы.
Список литературы
Ананьева Н.Д., Сусьян Е.А., Гавриленко Е.Г. Особенности определения углерода микробной биомассы почвы методом субстрат-индуцированного дыхания // Почвоведение. 2011. № 11. С. 1327–1333.
Ананьева Н.Д., Полянская Л.М., Стольникова Е.В., Звягинцев Д.Г. Соотношение биомассы грибов и бактерий в профиле лесных почв. Известия Российской академии наук. Серия биологическая // 2010. № 3. С. 308–317.
Благодатская Е.В., Семенов М.В., Якушев А.В. Активность и биомасса почвенных микроорганизмов в изменяющихся условиях окружающей среды. М.: Товарищество научных изданий КМК. 2016. 243 с.
Евдокимов И.В. Динамика ризосферного эффекта в почве // Почвоведение. 2013. № 6. С. 715–724. https://doi.org/10.7868/S0032180X13060026
Когут Б.М., Яшин М.А., Семенов В.М., Авдеева Т.Н., Маркина Л.Г., Лукин С.М., Тарасов С.И. Распределение трансформированного органического вещества в структурных отдельностях дерново-подзолистой супесчаной почвы // Почвоведение. 2016. № 1. С. 52–52. https://doi.org/10.7868/S0032180X1601007X
Кудеяров В.Н., Семенов В.М. Проблемы агрохимии и современное состояние химизации сельскохозяйственного производства в Российской Федерации // Агрохимия. 2014. № 10. С. 3–17.
Лукин С.М., Золкина Е.И., Марчук Е.В. Влияние длительного применения удобрений на продуктивность севооборота, содержание и качественный состав органического вещества почвы // Плодородие. 2021. Т. 3. № 120. С. 93–98. https://doi.org/10.25680/S19948603.2021.120.18
Полянская Л.М., Лукин С.М., Звягинцев Д.Г. Изменение состава микробной биомассы при окультуривании // Почвоведение. 1997. № 2. С. 206–212.
Семенов В.М., Лебедева Т.Н., Зинякова Н.Б., Соколов Д.А., Семенов М.В. Эвтрофикация пахотной почвы: сравнительное влияние минеральной и органической систем удобрения // Почвоведение. 2023. № 1. С. 58–73. https://doi.org/10.31857/S0032180X22600676
Семенов М.В., Никитин Д.А., Степанов А.Л., Семенов В.М. Структура бактериальных и грибных сообществ ризосферного и внекорневого локусов серой лесной почвы // Почвоведение. 2019. № 3. С. 355–369. https://doi.org/10.1134/S0032180X19010131
Семенов М.В. Метабаркодинг и метагеномика в почвенно-экологических исследованиях: успехи, проблемы и возможности // Журн. общей биол. 2019. Т. 80. № 6. С. 403–417. https://doi.org/10.1134/S004445961906006X
Ai C., Liang G., Sun J., Wang X., He P., Zhou W., He X. Reduced dependence of rhizosphere microbiome on plant-derived carbon in 32-year long-term inorganic and organic fertilized soils // Soil Biol. Biochem. 2015. V. 80. P. 70–78. https://doi.org/10.1016/j.soilbio.2014.09.028
Ashraf M.N., Hu C., Wu L., Duan Y., Zhang W., Aziz T., Cai A., Abrar M.M., Xu M. Soil and microbial biomass stoichiometry regulate soil organic carbon and nitrogen mineralization in rice-wheat rotation subjected to long-term fertilization // J. Soils Sediments. 2020. V. 20. P. 3103–3113. https://doi.org/10.1007/s11368-020-02642-y
Bailey V.L., Smith J.L., Bolton H., Jr. Fungal-to-bacterial ratios in soils investigated for enhanced C sequestration // Soil Biol. Biochem. 2002. V. 34. P. 997–1007. https://doi.org/10.1016/S0038-0717(02)00033-0
Bebber D.P., Richards. V.R. A meta-analysis of the effect of organic and mineral fertilizers on soil microbial diversity // Appl. Soil Ecol. 2022. V. 175. P. 104450. https://doi.org/10.1016/j.apsoil.2022.104450
Berendsen R.L., Pieterse C.M., Bakker P.A. The rhizosphere microbiome and plant health // Trends in plant science. 2012. V. 17. P. 478–486. https://doi.org/10.1016/j.tplants.2012.04.001
Brar B.S., Singh J., Singh G., Kaur G. Effects of long term application of inorganic and organic fertilizers on soil organic carbon and physical properties in maize–wheat rotation // Agronomy. 2015. V. 5. P. 220–238. https://doi.org/10.3390/agronomy5020220
Carvalheiro L.G., Biesmeijer J.C., Franzén M., Aguirre-Gutiérrez J., Garibaldi L.A., Helm A., Michez D., Pöyry J., Reemer M., Schweiger O., Leon van den B., WallisDeVries M.F., Kunin W.E. Soil eutrophication shaped the composition of pollinator assemblages during the past century // Ecography. 2020. V. 43. P. 209–221. https://doi.org/10.1111/ecog.04656
Chenu C., Angers D.A., Barré P., Derrien D., Arrouays D., Balesdent J. Increasing organic stocks in agricultural soils: Knowledge gaps and potential Innovations // Soil Tillage Res. 2019. V. 188. P. 41–52. https://doi.org/10.1016/j.still.2018.04.011
Dang P., Li C., Lu C., Zhang M., Huang T., Wan C., Wang H., Chen Y., Qin X., Liao Y., Siddique K.H.M. Effect of fertilizer management on the soil bacterial community in agroecosystems across the globe // Agriculture, Ecosystems and Environment. 2022. V. 326. P. 107795. https://doi.org/10.1016/j.agee.2021.107795
Diacono M., Montemurro F. Long-term effects of organic amendments on soil fertility. A review // Agronomy for Sustain. Development. 2010. V. 30. P. 401–422. https://doi.org/10.1007/978-94-007-0394-0_34
Dincă L.C., Grenni P., Onet C., Onet A. Fertilization and soil microbial community: a review // Appl. Sci. 2022. V. 12. P. 1198. https://doi.org/10.3390/app12031198
Ding J., Jiang X., Guan D., Zhao B., Ma M., Zhou B., Cao F., Yang X., Li L., Li J. Influence of inorganic fertilizer and organic manure application on fungal communities in a long-term field experiment of Chinese Mollisols // Appl. Soil Ecol. 2017. V. 111. P. 114–122. https://doi.org/10.1016/j.apsoil.2016.12.003
Dong W.Y., Zhang X.Y., Dai X.Q., Fu X.L., Yang F.T., Liu X.Y., Schaeffer S. Changes in soil microbial community composition in response to fertilization of paddy soils in subtropical China // Appl. Soil Ecol. 2014. V.84. P. 140–147. https://doi.org/10.1016/j.apsoil.2014.06.007
Fierer N. Embracing the unknown: disentangling the complexities of the soil microbiome // Nature Rev. Microbiol. 2017. V. 15. P. 579–590. https://doi.org/10.1038/nrmicro.2017.87
Ge G., Li Z., Fan F., Chu G., Hou Z., Liang Y. Soil biological activity and their seasonal variations in response to long-term application of organic and inorganic fertilizers // Plant and Soil. 2010. V. 326. P. 31–44. https://doi.org/10.1007/s11104-009-0186-8
Ge Y., Zhang J.B., Zhang L.M., Yang M., He J.Z. Long-term fertilization regimes affect bacterial community structure and diversity of an agricultural soil in northern China // J. Soils Sediments. 2008. V. 8. P. 43–50. https://doi.org/10.1065/jss2008.01.270
Geisseler D., Scow K.M. Long-term effects of mineral fertilizers on soil microorganisms – A review // Soil Biol. Biochem. 2014. V. 75. P. 54–63. https://doi.org/10.1016/j.soilbio.2014.03.023
Guo Z. Fertilization regime has a greater effect on soil microbial community structure than crop rotation and growth stage in an agroecosystems // Appl. Soil Ecol. 2020. V. 149. P. 103510. https://doi.org/10.1016/j.apsoil.2020.103510
Hartmann M., Frey B., Mayer J., Mäder P., Widmer F. Distinct soil microbial diversity under long-term organic and conventional farming // ISME J. 2015. V. 9. P. 1177–1194. https://doi.org/10.1038/ismej.2014.210
Hu J., Lin X., Wang J., Dai J., Chen R., Zhang J., Wong M.H. Microbial functional diversity, metabolic quotient, and invertase activity of a sandy loam soil as affected by long-term application of organic amendment and mineral fertilizer // J. Soils Sediments. 2011. V. 11. P. 271–280. https://doi.org/10.1007/s11368-010-0308-1
Huang R., McGrath S.P., Hirsch P.R., Clark I.M., Storkey J., Wu L., Zhou J., Liang Y. Plant–microbe networks in soil are weakened by century-long use of inorganic fertilizers // Microb. Biotechnol. 2019. V. 12. P. 1464–1475. https://doi.org/10.1111/1751-7915.13487
Kuzyakov Y., Blagodatskaya E. Microbial hotspots and hot moments in soil: concept & review // Soil Biol. Biochem. 2015. V. 83. P. 184–199. https://doi.org/10.1016/j.soilbio.2015.01.025
Lauber C.L., Hamady M., Knight R., Fierer N. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale // Appl. Environ. Microbiol. 2009. V. 75(15). P. 5111–5120. https://doi.org/10.1128/AEM.00335-09
Lazcano C., Gómez–Brandón M., Revilla P., Domínguez J. Short-term effects of organic and inorganic fertilizers on soil microbial community structure and function // Biology Fertility Soils. 2013. V. 49. P. 723–733. https://doi.org/10.1007/s00374-012-0761-7
Liu L., Li C., Zhu S., Xu Y., Li H., Zheng X., Shi R. Combined application of organic and inorganic nitrogen fertilizers affects soil prokaryotic communities compositions // Agronomy.2020. V. 10. P. 132. https://doi.org/10.3390/agronomy10010132
Liu S., Wang J., Pu S., Blagodatskaya E., Kuzyakov Y., Razavi B. Impact of manure on soil biochemical properties: a global synthesis // Sci. Total Environ. 2020. P. 141003. https://doi.org/10.1016/j.scitotenv.2020.141003
Luan H., Gao W., Huang S., Tang J., Li M., Zhang H., Masiliūnas D. 2020. Substitution of manure for chemical fertilizer affects soil microbial community diversity structure and function in greenhouse vegetable production systems // PLoS One. V. 15. P. e0214041. https://doi.org/10.1371/journal.pone.0214041
Ma Q., Wen, Y., Wang D., Sun X., Hill P.W., Macdonald A., Chadwick D.R., Wu L., Jones D.L. Farmyard manure applications stimulate soil carbon and nitrogen cycling by boosting microbial biomass rather than changing its community composition // Soil Biol. Biochem. 2020. V. 144. P. 107760. https://doi.org/10.1016/j.soilbio.2020.107760
Malik A.A., Chowdhury S., Schlager V., Oliver A., Puissant J., Vazquez P.G., Jehmlich N., Bergen M., Griffiths R.I., Gleixner G. Gleixner G. Soil fungal: bacterial ratios are linked to altered carbon cycling // Frontiers in Microbiology. 2016. V. 7. P. 1247. https://doi.org/10.3389/fmicb.2016.01247
Mendes R., Garbeva P., Raaijmakers J.M. The rhizosphere microbiome: significance of plant beneficial plant pathogenic and human pathogenic microorganisms // FEMS Microbiol. Rev. 2013. V. 37. P. 634–663. https://doi.org/10.1111/1574-6976.12028
Pöyry J., Carvalheiro L.G., Heikkinen R.K., Kühn I., Kuussaari M., Schweiger O., van Bodegom P.M., Valtonen A, Franzén M. The effects of soil eutrophication propagate to higher trophic levels // Global Ecol. Biogeography. 2017. V. 26. P. 18–30. https://doi.org/10.1111/geb.12521
Ramirez K.S., Lauber C.L., Knight R., Bradford M.A., Fierer N. Consistent effects of nitrogen fertilization on soil bacterial communities in contrasting systems // Ecology. 2010. V. 91. P. 3463–3470. https://doi.org/10.1890/10-0426.1
Rousk J., Bååth E., Brookes P.C., Lauber C.L., Lozupone C., Caporaso J.G., et al. Soil bacterial and fungal communities across a pH gradient in an arable soil // ISME J. 2010. V. 4. P. 1340–1351. https://doi.org/10.1038/ismej.2010.58
Semenov M.V., Krasnov G.S., Semenov V.M., van Bruggen. A.H. Long-term fertilization rather than plant species shapes rhizosphere and bulk soil prokaryotic communities in agroecosystems // Appl. Soil Ecol. 2020. V. 154. P. 103641. https://doi.org/10.1016/j.apsoil.2020.103641
Semenov M.V., Krasnov G.S., Semenov V.M., Ksenofontova N., Zinyakova N.B., van Bruggen A.H. Does fresh farmyard manure introduce surviving microbes into soil or activate soil-borne microbiota? // J. Environ. Management. 2021. V. 294. P. 113018. https://doi.org/10.1016/j.jenvman.2021.113018
Semenov M.V., Krasnov G.S., Semenov V.M., van Bruggen A. Mineral and Organic Fertilizers Distinctly Affect Fungal Communities in the Crop Rhizosphere // J. Fungi. 2022. V. 8. P. 251. https://doi.org/10.3390/jof8030251
Six J., Frey S.D., Thiet R.K., Batten K.M. Bacterial and fungal contributions to carbon sequestration in agroecosystems // Soil Sci. Soc. Am. J. 2006. V. 70. P. 555–569. https://doi.org/10.2136/sssaj2004.0347
Soares M., Rousk J. Microbial growth and carbon use efficiency in soil: Links to fungal-bacterial dominance, SOC-quality and stoichiometry // Soil Biol. Biochem. 2019. V. 131. P. 195–205. https://doi.org/10.1016/j.soilbio.2019.01.010
Toljander J.F., Santos-González J.C.,Tehler A., Finlay R.D. Community analysis of arbuscular mycorrhizal fungi and bacteria in the maize mycorrhizosphere in a long-term fertilization trial // FEMS Microbiol. Ecol. 2008. V. 65. P. 323–338. https://doi.org// j.1574-6941.2008.00512.xhttps://doi.org/10.1111/j.1574-6941.2008.00512.x10.1111
Valentine D.L. Adaptations to energy stress dictate the ecology and evolution of the Archaea // Nature Rev. Microbiol. 2007. V. 5. P. 316–323. https://doi.org/10.1038/nrmicro1619
van Overbeek L., Van Elsas J.D. Effects of plant genotype and growth stage on the structure of bacterial communities associated with potato (Solanum tuberosum L.) // FEMS Microbiol. Ecol. 2008. V. 64. P. 283–296. https://doi.org/ 6941.2008.00469.xhttps://doi.org/10.1111/j.1574-6941.2008.00469.x10.1111/j.1574
Wang L., Yang F.E.Y., Yuan J., Raza W., Huang Q., Shen Q. Long-term application of bioorganic fertilizers improved soil biochemical properties and microbial communities of an apple orchard soil // Frontiers in Microbiology. 2016. V. 7. P. 1893. https://doi.org/10.3389/fmicb.2016.01893
Wu J., Sha C., Wang M., Ye C., Li P., Huang S. Effect of organic fertilizer on soil bacteria in maize fields // Land. 2021. V. 10. P. 328. https://doi.org/10.3390/land10030328
Xiang X., Liu J., Zhang J., Li D., Xu C., Kuzyakov Y. Divergence in fungal abundance and community structure between soils under long-term mineral and organic fertilization // Soil Till. Res. 2020. V. 196. P. 104491. https://doi.org/10.1016/j.still.2019.104491
Zhang X., Dong, W., Dai X., Schaeffer S., Yang F., Radosevich M., Xu L., Liu X., Sun X. Responses of absolute and specific soil enzyme activities to long term additions of organic and mineral fertilizer // Sci. Total Environ. 2015. V. 536. P. 59–67. https://doi.org/10.1016/j.scitotenv.2015.07.043
Zhou Z., Wang C., Luo Y. Meta-analysis of the impacts of global change factors on soil microbial diversity and functionality // Nature Commun. 2020. V. 11. P. 1–10. https://doi.org/10.1038/s41467-020-16881-7
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Таблица S1. Структура биомассы прокариот.
Таблица S2. Структура биомассы грибов.