Агрохимия, 2019, № 1, стр. 66-70
ВЛИЯНИЕ ЗАСОЛЕНИЯ НА УСТЬИЧНУЮ ПРОВОДИМОСТЬ И КОЛИЧЕСТВО АКВАПОРИНОВ В КЛЕТКАХ ЛИСТЬЕВ ЯЧМЕНЯ
Д. С. Веселов 1, *, Г. В. Шарипова 1, Г. Р. Ахиярова 1, Р. С. Иванов 1, Г. Р. Кудоярова 1
1 Уфимский Институт биологии УФИЦ РАН
450054 Уфа, просп. Октября, 69, Россия
* E-mail: veselov@anrb.ru
Поступила в редакцию 18.04.2018
После доработки 12.10.2018
Принята к публикации 15.05.2018
Аннотация
Исследовано участие аквапоринов в закрытии устьиц растений ячменя при засолении у растений двух контрастных по солеустойчивости сортов ячменя – Прерия и Михайловский, выращенных в аквакультуре. Засоление вызывали добавлением в питательную среду хлорида натрия до конечной концентрации 100 мМ. Для детекции аквапоринов и фитогормона абсцизовой кислоты (АБК) использовали метод иммуногистохимической локализации. Наблюдали снижение уровня аквапоринов в листьях в ответ на засоление на фоне повышения уровня АБК. Сделано предположение о том, что снижение уровня аквапоринов должно было привести к уменьшению притока воды к клеткам листа и, соответственно, индуцировать синтез АБК в клетках мезофилла. Обсуждаются особенности скорости закрытия устьиц растений двух контрастных по солеустойчивости сортов ячменя.
ВВЕДЕНИЕ
Движение устьиц – один из важных механизмов, от которого зависит приспособление растений к изменению условий окружающей среды и их выживание. Поверхность листа покрыта кутикулой, которая отличается низкой проницаемостью для диффузии веществ, поэтому газообмен между листом и окружающей средой происходит в основном через открытые устьица. Через них в лист поступает необходимый для фотосинтеза углекислый газ и происходит испарение воды, которая поступает из корней вместе с растворенными в ней элементами минерального питания растений.
В условиях дефицита воды закрытие устьиц ограничивает транспирационные потери и способствует поддержанию оводненности тканей растений. Движение устьиц происходит благодаря изменению тургора замыкающих клеток устьиц. Поддерживается тургор клеток за счет накопления в них осмотически активных веществ (ионов, сахаров и органических кислот). Основное внимание исследователей было направлено на процесс активного поглощения и выброса осмотиков из клетки как механизму регуляции движения устьиц. Однако недавние исследования показали, что закрытие устьиц может происходить в результате активного снижения притока воды в листья за счет уменьшения способности тканей листа проводить воду [1]. Проведение воды тканями растений зависит от присутствия и активности в мембранах клеток водных каналов – аквапоринов [2].
Цель работы – выявление участия аквапоринов в закрытии устьиц растений ячменя при засолении. В лаборатории физиологии растений Уфимского института биологии РАН совместно с Wieland Fricke (университет в Дублине) было показано быстрое закрытие устьиц при добавлении в питательных раствор хлорида натрия до конечной концентрации 100 мМ [3, 4]. Также были выявлены особенности скорости закрытия устьиц растений 2‑х контрастных по солеустойчивости сортов ячменя – Прерия и Михайловский [5]. В лаборатории имеются специфические антитела против аквапоринов клеточных мембран растений ячменя, полученные от проф. Sakakibara из университета Окаямы (Япония). Разработан метод иммуногистохимической локализации аквапоринов [6]. Этот подход был использован в данной работе.
МЕТОДИКА ИССЛЕДОВАНИЯ
Выращивание растений и оценка показателей водного обмена. Семена ячменя (Hordeum vulgare L., сорта Михайловский и Прерия) проращивали на водопроводной воде в темноте при комнатной температуре. Через 1 сут половину проклюнувшихся проростков перенесли на 10%-ный раствор Хогланда–Арнона и выращивали при температуре 27 ± 3°С и 16-часовой продолжительности светового дня. На 7-е сут от момента посева семян у проростков удаляли зерновку и помещали растения на 50%-ный раствор полной питательной смеси Хогланда–Арнона (контроль). В этот питательный раствор половины растений добавляли хлорид натрия до концентрации 100 мМ.
Транспирацию оценивали гравиметрически – по потере веса стаканчиком с 50 мл питательного раствора и 10-ю проростками. Стаканчик закрывали алюминиевой фольгой с отверстием для проростков для предотвращения испарения воды с поверхности питательного раствора. Вес стаканчиков определяли каждые 15 мин и по разнице в весе судили об интенсивности транспирации.
Иммуногистохимическая локализация аквапоринов и АБК. Через 30 или 60 мин после воздействия высечки листьев ячменя (0.3–0.5 мм) фиксировали в 4%-ном растворе карбодиимида (Sigma, Япония). Дегидратацию образцов проводили в серии разведений этанола (30, 50, 70, 80, 96%). Затем их заключали в гидрофильную метакрилатную смолу JB-4 (Electron Microscopy Sciences, США). Гистологические срезы толщиной 1.5 мкм готовили с помощью ротационного микротома (HM 325, “MICROM Laborgerate”, Германия). Иммунолокализацию осуществляли, как описано ранее [7]. Срезы обрабатывали в течение 30 мин в 0.1 М фосфатном буфере (рН 7.3), содержавшим 0.2% желатина и 0.05% Твина-20 (ФЖТ). Далее на срезы наносили по 20 мкл сыворотки кролика, содержавшей антитела против аквапоринов или АБК, разведенной в ФЖТ в соотношении 1 : 50. Срезы прикрывали полосками парафильма и инкубировали во влажной камере при комнатной температуре в течение 2 ч. После инкубации срезы промывали трижды по 10 мин 0.1 М фосфатным буфером, содержавшим Твин-20 в конечной концентрации 0.05% (ФТ). Затем на каждый срез помещали 20 мкл меченных коллоидным золотом иммуноглобулинов козы против антител кролика (“Aurion”, Голландия), разведенных в ФЖТ в соотношении 1 : 30. Срезы покрывали кусочками парафильма и инкубировали в течение 1 ч во влажной камере при комнатной температуре. Затем их промывали 3 раза по 10 мин в ФТ и ополаскивали дистиллированной водой. После высушивания срезы в течение 20 мин обрабатывали препаратом серебра для усиления окрашивания в соответствии с рекомендацией производителя (“Aurion”, Голландия). В качестве контроля специфичности окрашивания служили образцы тканей, обработанные неиммунной сывороткой кролика (не содержавшей антител к цитокининам). Препараты анализировали с помощью светового микроскопа Axio Imager.A1 (“CarlZeiss Jena”, Германия), оборудованного цифровой камерой AxioCam MRc5 (“CarlZeiss Jena”). Сыворотки, содержащие антитела к аквапоринам семейства HvPIP2, были любезно предоставлены Maki Katsuhara (Group of Molecular and Functional Plant Biology, Institute of Plant Science and Resources, Okayama University, 20-1, Chuo-2-chome, Kurashiki, Okayama, 710-0046 Japan).
Было проведено 3 независимых эксперимента по 3–4 биологических повторностей в каждом. На диаграммах представлены средние величины со стандартными ошибками (SE). Для расчетов использовали стандартные пакеты программы Excel.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
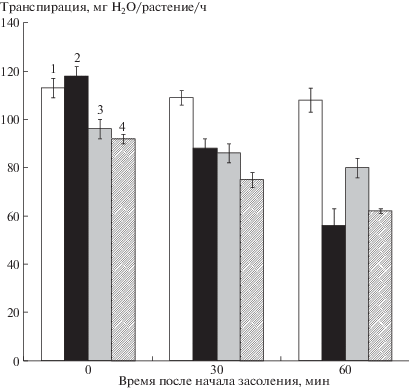
Анализ результатов оценки влияния засоления на уровень транспирации показал, что уже через 30 мин происходило снижение скорости потери воды листьями на 10 и 20% по сравнению с контролем у растений сортов Прерия и Михайловский соответственно (рис. 1). Через 1 ч уменьшение транспирации было более заметным: она снизилась у растений сортов Прерия и Михайловский на 50 и 20% по сравнению с контролем соответственно. Через 1 ч после начала действия засоления снижение транспирации было более значительным у растений сорта Прерия, что соответствовало ранее полученным данным о более выраженной транспирационной реакциии растений этого сорта на дефицит воды, вызванный засолением [5]. Эта реакция была связана с более сильным снижением способности устьиц проводить пары воды, что говорит о большей степени их закрытия. Появление ионов хлорида натрия в питательном растворе уменьшало доступность воды для растений. При этом снижение устьичной проводимости было адаптивной реакцией, которая снижала транспирационные потери и защищала растения от обезвоживания.
Рис. 1.
Влияние засоления на транспирацию растений ячменя: 1 – сорт Прерия (контроль), 2 – сорт Прерия (опыт), 3 – сорт Михайловский (контроль), 4 – сорт Михайловский (опыт).
Представляло интерес выяснить, связано ли снижение транспирации с уменьшением способности аквапоринов проводить воду. Для того чтобы ответить на этот вопрос, была проведена иммуногистохимическая детекция локализации аквапоринов в листьях растений ячменя с помощью специфических антител к аквапоринам.
Показано, что окрашивание на HvPIP2;2-аквапорины проявлялось в основном по периферии клеток, что соответствовало известной локализации PIP2-аквапоринов в клеточных мембранах. Яркое окрашивание было заметно в области клеток обкладки сосудов (рис. 2а). Эти результаты соответствовали сведениям о повышенном уровне аквапоринов там, где происходит наиболее интенсивный поток воды через клеточную мембрану. Поскольку по сосудам в лист поступает вода из корней, присутствие аквапоринов в мембранах клеток обкладки сосудистых пучков не должно вызывать удивление. Также было заметно повышенное содержание аквапоринов в мембранах плазмолеммы ряда клеток колленхимы, которые тянутся от сосудистых пучков к поверхности листа. Очевидно, по этим клеткам идет поток воды, которая испаряется листьями.
Рис. 2.
Иммуногистохимическая локализация HvPIP2;2-аквапоринов в листьях растений ячменя сорта Прерия в контроле (а) и на фоне засоления (б): 1 – эпидермис, 2 – устьица, 3 – мезофилл, 4 – ксилема, 5 – флоэма, 6 – клетки обкладки сосудистого пучка, 7 – колленхима. Линейка – 100 мкм.
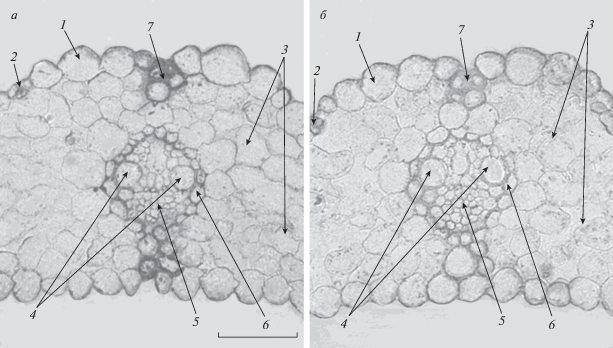
Представляет интерес то, что добавление хлорида натрия в питательный раствор снижало интенсивность окрашивания клеток на срезах листьев, что указывало на уменьшение содержания HvPIP2;2-аквапоринов под влиянием засоления (рис. 2б). Этот эффект более ярко проявлялся у растений сорта Прерия, и по этой причине на рисунке приведены результаты иммуногистохимической локализации аквапоринов именно этого сорта. На рис. 3 показаны усредненные результаты количественной оценки интенсивности окрашивания на аквапорины в области сосудов с помощью программы ImageJ. Видно, что в норме (в отсутствие засоления) интенсивность окрашивания срезов листьев в области сосудов на аквапорины была больше у растений сорта Прерия, что соответствовало исходно более высокому уровню транспирации у растений этого сорта (рис. 1).
Рис. 3.
Интенсивность окрашивания на HvPIP2;2-аквапорины сосудистых пучков листьев растений ячменя сортов Прерия и Михайловский: 1 – контроль, 2 – через 30 мин после добавления хлорида натрия в питательную среду. Условные единицы: за 100% принято максимальное окрашивание, 0 – минимальное.
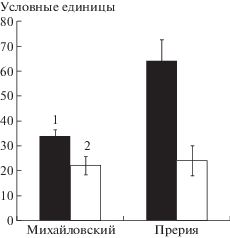
Добавление хлорида натрия почти в 3 раза снижало уровень окрашивания на аквапорины у растений сорта Прерия и только в 1.5 раза – у растений сорта Михайловский. Степень снижения содержания аквапоринов также соответствовала степени уменьшения транспирации у растений этих сортов (более заметное снижение транспирации – у сорта Прерия).
Было высказано предположение [1], что снижение гидравлической проводимости на пути воды от сосудов через мезофилл листа может способствовать закрытию устьиц. В данных опытах не был изучен вклад аквапоринов в изменение гидравлической и устьичной проводимости. Полученные авторами результаты свидетельствовали о том, что снижение содержания аквапоринов в ответ на засоление действительно происходит и может способствовать закрытию устьиц.
Представляло интерес оценить изменение содержания гормона абсцизовой кислоты (АБК) в клетках листьев при засолении. Более яркий эффект был выявлен у растений сорта Прерия (как и в случае иммуногистохимического окрашивания на аквапорины) (рис. 4). По этой причине на рис. 4 показаны результаты иммуногистохимической локализации аквапоринов именно этого сорта. Видно увеличение интенсивности окрашивания на АБК периферии клеток мезофилла под влиянием засоления, что соответствует полученным ранее данным [8]. Важно, что в области сосудов увеличение содержания АБК было менее заметным, чем в области клеток мезофилла. Известно, что источником АБК в листьях растений может быть повышение интенсивности их синтеза в корнях или самих листьях. Более заметное увеличение окрашивания клеток мезофилла по сравнению с клетками сосудов указывало на то, что при данной постановке опыта накопление АБК при засолении, скорее всего, было связано с синтезом этого гормона в самих листьях. Известно, что стимулом для синтеза АБК является снижение оводненности клеток [9]. Снижение содержания аквапоринов, выявленное авторами при воздействии засоления, должно было привести к снижению притока воды к клеткам листа, что могло индуцировать синтез АБК в клетках мезофилла.
ЗАКЛЮЧЕНИЕ
Эффект снижения транспирации на фоне добавления хлорида натрия в питательный раствор был сильнее выражен в растениях ячменя сорта Прерия по сравнению с сортом Михайловский. Иммунное окрашивание на аквапорины Hv PIP2;2 выявило снижение их содержания под влиянием засоления, более заметное у растений сорта Прерия, что соответствовало более выраженной устьичной реакции растений этого сорта. Результаты иммуногистохимической локализации показали увеличение содержания АБК в листьях под влиянием засоления, что могло быть связано с уменьшением притока воды из-за снижения в этих условиях экспрессии аквапоринов.
Работа выполнена на оборудовании ЦКП “Агидель”.
Список литературы
Pantin F., Monnet F., Jannaud D., Costa J.M., Renaud J., Muller B., Simonneau T., Genty B. The dual effect of abscisic acid on stomata // New Phytol. 2013. V. 197. P. 65–72.
Maurel C., Verdoucq L., Luu D.T., Santoni V. Plant aquaporins: membrane channels with multiple integrated functions // Annual Rev. Plant Physiol. 2008. V. 59. P. 595–624.
Fricke W., Akhiyarova G., Veselov D., Kudoyarova G. Rapid and tissue-specific changes in ABA and in growth rate in response to salinity in barley leaves // J. Exp. Bot. 2004. V. 55. P. 1115–1123.
Fricke W., Wei W., Richardson A., Wojciechowski T., Volkov V., Akhiyarova G., Veselov D., Kudoyarova G., Alexandersson E., Kjellbom P.O., Miller A., Schreiber L. The short-term growth response to salt of the developing barley leaf // J. Exp. Bot. 2006. V. 57. P. 1079–1095.
Veselov D.S., Sharipova G.V., Veselov S.U., Kudoyarova G.R. The effects of NaCl treatment on water relations, growth and ABA content in barley cultivars differing in drought tolerance // J. Plant Grow Regul. 2008. V. 27. P. 380–386.
Sharipova G., Veselov D., Kudsoyarova G., Fricke W., Dodd I., Katsuhara M., Furuichi T., Ivanov I., Veselov S. Exogenous application of abscisic acid (ABA) increases root and cell hydraulic conductivity and abundance of some aquaporin isoforms in the ABA deficient barley mutant Az34 // Ann. Bot. 2016. V. 118. № 4. P. 777–785.
Веселов С.Ю., Вальке Р., Ван Онкелен Х., Кудоярова Г.Р. Содержание и локализация цитокининов в листьях исходных и трансгенных растений табака // Физиология растений. 1999. Т. 46. № 1. С. 326–335.
Ахиярова Г.Р., Фрике В., Веселов Д.С., Кудояро-ва Г.Р., Веселов С.Ю. Накопление и распределение АБК в тканях листа и устьичная проводимость при водном стрессе, индуцированном засолением // Цитология. 2006. Т. 48. № 11. С. 918–924.
Zabadal T.J. A water potential threshold for the increase of abscisic acid in leaves // Plant Physiol. 1974. V. 53. P. 125–127.
Дополнительные материалы отсутствуют.