Агрохимия, 2019, № 5, стр. 21-28
РОЛЬ ПОЛИФУНКЦИОНАЛЬНЫХ РЕГУЛЯТОРОВ РОСТА РАСТЕНИЙ В ПРЕОДОЛЕНИИ ГЕРБИЦИДНОГО СТРЕССА
М. М. Наумов 1, Т. В. Зимина 1, Е. И. Хрюкина 1, Т. А. Рябчинская 1, *
1 Всероссийский научно-исследовательский институт защиты растений
396030 Рамонский р-н, Воронежская обл., п. ВНИИСС, 92, Россия
* E-mail: biometod@mail.ru
Поступила в редакцию 30.05.2018
После доработки 10.09.2018
Принята к публикации 10.02.2019
Аннотация
Обсуждается проблема гербицидного стресса культурных растений и пути ее решения. Показано, что высокую эффективность в преодолении стрессовых состояний имеют полифункциональные биологические регуляторы роста растений. Рассмотрены биохимические и физиологические аспекты устойчивости растений к неблагоприятным факторам среды, в том числе к фитотоксическому действию гербицидов, а также механизмы действия регуляторов роста растений в качестве биологических антидотов. На примере ряда препаратов данной группы показана высокая эффективность их использования для смягчения действия гербицидов на основные сельскохозяйственные культуры, позволяющая повышать продуктивность растений до 30% и более в сравнении с самостоятельным использованием химических гербицидов.
ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ СТРЕССОВЫХ СОСТОЯНИЙ РАСТЕНИЙ
Растения, как живые организмы, развиваются в тесной взаимосвязи с окружающей средой и в зависимости от ее состояния адекватно реагируют на любые изменения ситуации. При резком превышении уровня экологического преферендума в растениях, как и у всех живых существ, возникает в той или иной степени стресс. В настоящее время большинство фитофизиологов и биохимиков рассматривает данное состояние как часть защитной реакции организма в неблагоприятных условиях среды, которая представляет собой формирование или мобилизацию механизмов специализированной адаптации [1–3]. По теории И.А. Тарчевского [2], биологический смысл стрессовых реакций состоит, прежде всего, в активизации системы передачи сигнала о стрессовом воздействии в геном, который формирует физиолого-биохимический ответ организма, имеющий у разных видов растений как сходные, так и различные особенности.
Стресс растений может быть вызван как биотическими (поражение возбудителями заболеваний, повреждение фитофагами), так и абиотическими или антропогенными (неблагоприятные метеорологические условия различной силы воздействия, недостаток или избыток питательных элементов, токсическое воздействие пестицидов и тяжелых металлов, радиационное поражение и т.п.) факторами. Из химических пестицидов наиболее сильное отрицательное влияние на культурные растения, вплоть до гибели, оказывают гербицидные препараты.
Последствия стресса на биохимическом и физиологическом уровнях проявляются в изменении баланса фитогормонов, а также подавлении фотосинтетических процессов, что в целом приводит к изменению физиологического состояния растений и проявлению симптомов страдания: снижение тургора тканей, интенсивности окраски листьев, появление некрозных областей и других признаков, которые вызываются катаболическими внутриклеточными реакциями. После такой резкой внутренней перестройки растений наступает фаза адаптации, в которой организм перестраивает свой биохимизм для преодоления стрессового состояния и возвращения гомеостаза [4]. Часть продуктов катаболизма может выступать в качестве элиситоров, которые запускают цепи сигнальных биохимических систем растений, приводящих к улучшению их физиологического состояния. Установлено, что ответные реакции растительных организмов на повреждающие действия ксенобиотиками идентичны тем механизмам, которые обеспечивают устойчивость растений к патогенам [3–7]. Глубокая перестройка внутри клеток растений на этом этапе осуществляется за счет адаптационных механизмов, основанных на конкурентных отношениях между органами за физиологически активные и питательные вещества. В частности, эти механизмы позволяют растениям в условиях стресса формировать минимальное количество генеративных органов, которые могут быть в этих условиях обеспечены необходимыми для созревания веществами. За счет этого, при сильном стрессовом воздействии часто наблюдают снижение продуктивности растений. Благодаря оттоку пластических веществ из старых нижних листьев, сохраняется жизнеспособность молодых листьев и побегов. На популяционном уровне механизм противостояния стрессу позволяет осуществлять естественный отбор более резистентных и вызывать гибель нежизнеспособных особей. При сильном и пролонгированном стрессе в условиях возрастания его давления природные защитные силы организма истощаются, разрушаются клеточные структуры, и процессы катаболизма в клетках преобладают над биосинтетическими. Разрушаются хлоропласты, накапливаются токсические продукты метаболизма, и растения необратимо теряют жизнеспособность. Таким образом, стресс растений является интегральным ответом на повреждающее действие, направленным на их выживание за счет мобилизации и формирования защитных систем [8, 9].
Согласно теории И.А. Тарчевского [2], изменения в метаболизме, физиологических реакциях и ростовых процессах при стрессах прежде всего связаны с экспрессией генов, за счет чего происходит распознавание стрессора на клеточном уровне, после чего наступает активизация сигнальных путей. Поступающий в геном сигнал вызывает индукцию или ингибирование синтеза тех или иных белков. Во время переключения обмена веществ на новый стрессовый режим интегрируются и вступают в действие резервные возможности организма. Важнейшим механизмом стрессоустойчивости растений является также гормональная регуляция метаболизма. В условиях действия стрессовых факторов, как правило, тормозится рост растений за счет снижения содержания гормонов роста; возрастает количество ингибиторов, в частности, абсцизовой кислоты, этилена, жасмоновой кислоты, которые часто называют стрессовыми гормонами. Все эти процессы замедляют обмен веществ, в результате чего, растение экономит энергетические запасы и получает возможность направить их на поддержание структур клетки [10].
При любом негативном воздействии в клетках растений значительно повышается содержание активных форм кислорода (АФК) – синглетного кислорода, супероксид анион-радикала, пероксида водорода и др., обладающих чрезвычайно высокой реакционной способностью, что приводит к окислительному стрессу. Эти формы образуются и при нормальном метаболизме растений, но длительное и интенсивное воздействие негативных факторов приводит к их переизбытку. Чаще всего действие АФК проявляется в некротических поражениях тканей. Однако установлено, что роль этих молекул двойственна. Клетки растений могут использовать АФК в качестве элиситоров, вторичных мессенджеров, которые помогают им анализировать внешние воздействия и внутренние сигналы [11, 12]. В клетках, подвергшихся стрессу, накапливаются различные метаболиты, в частности, аминокислота пролин [1, 13]. При действии на растения пестицидов обычно отмечают усиление энергии дыхания, снижение интенсивности фотосинтеза и активности ферментов, угнетение синтеза хлорофилла, изменение соотношения форм растворимых сахаров и азотных соединений, торможение синтеза белков. Степень развития данных процессов зависит от дозировки пестицида. При использовании низких дозировок эти процессы нивелируются защитными системами растений, и происходит активизация их жизнедеятельности, за счет чего продуктивность растений может увеличиться [14].
Устойчивость растений к повреждающему действию пестицидов зависит от анатомо-морфологических и физиологических особенностей вида, условий произрастания, типа почвы, и в большей степени – от обеспеченности их влагой, что чаще всего определяет характер их ответных реакций. При неблагоприятных условиях для жизнедеятельности растений границы возможного стимулирующего действия пестицидов сужаются. Многими исследователями при стрессах отмечена индукция комплексной системной устойчивости растений [2, 15].
Был отмечен стимулирующий эффект обработки гербицидами (бетанал Прогресс ОФ, КЭ + + карибу, СП) сахарной свеклы в фазе 2-х пар настоящих листьев в 2008 г. в условиях достаточной обеспеченности растений влагой. В результате было показано увеличение урожайности корнеплодов относительно контрольного варианта (ручной прополки) на 4 т/га или на 15.7% [16]. Слабый стресс на фоне хорошего физиологического состояния растений является при этом своеобразным сигналом, позволяющим растениям быстро адаптироваться к негативному действию гербицида и индуцировать процессы, которые в итоге приводят к существенному увеличению продуктивности растений. Аналогичное стимулирующее действие гербицидов (бетанал 22, КЭ + лонтрел-300, ВР + миура, КЭ) на растения сахарной свеклы наблюдали в оптимальных условиях развития культуры в 2017 г., которое проявилось в пролонгированном усилении иммунного статуса растений через 2 мес. после обработки (табл. 1). В условиях данного года обработка гербицидами позволила активизировать защитные силы растений и послужила своеобразным элиситором, индуцировавшим достоверное увеличение продуктивности культуры относительно контроля на 2.9 т/га. Новый регулятор роста стивин, разработанный во ВНИИЗР на основе растительных компонентов, в этом опыте увеличил урожайность корнеплодов на 6.4 т/га (на 5.3%).
Таблица 1.
Иммуностимулирующее действие обработок растений сахарной свеклы гербицидами и регулятором роста стивин в условиях высокой влагообеспеченности растений (2017 г.)
| Вариант (мл/га) | Церкоспороз | Септориоз | Фомоз | |||
|---|---|---|---|---|---|---|
| развитие | распро-страненность | развитие | распро-страненность | развитие | распро-страненность | |
| % | ||||||
| Контроль (ручная прополка) | 18.5 | 55.0 | 10.4 | 27.5 | 16.5 | 44.2 |
| Комплекс гербицидов (бетанал 22, лонтрел-300, миура) | 8.1 | 32.5 | 6.5 | 24.2 | 8.1 | 28.3 |
| Комплекс гербицидов + cтивин, 80 мл/га | 7.5 | 26.7 | 8.9 | 32.5 | 6.7 | 20.8 |
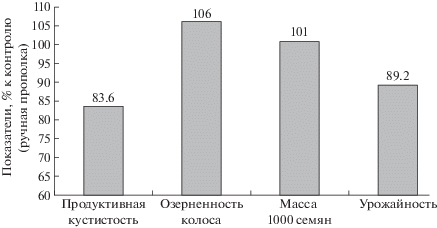
В опыте на яровом ячмене при применении гербицида пришанс СЭ самостоятельно и в смеси с биологическим регулятором роста стивин в фазе кущения, в условиях некоторого положительного действия слабого гербицидного стресса на растения (стимуляции фотосинтеза и ростовых процессов в фазе начала колошения) дальнейшее действие негативных факторов среды (засухи) способствовало пролонгированному проявлению гербицидного стресса в отношении формирования полноценных продуктивных колосьев. При самостоятельном применении гербицида наблюдали существенное снижение продуктивной кустистости (на 16.4%) и урожайности (на 10.8%) по сравнению с контролем (рис. 1). В этих условиях использование совместно с гербицидом биологического регулятора роста стивин позволило увеличить урожайность культуры относительно применения одного гербицида на 16.5%.
ГЕРБИЦИДНЫЙ СТРЕСС И ПРОБЛЕМА ЕГО ПРЕОДОЛЕНИЯ
В настоящее время в условиях глобального потепления, неустойчивости климатических характеристик, увеличения частоты возникновения засушливых периодов проблема преодоления стрессовых состояний растений становится значительно более острой.
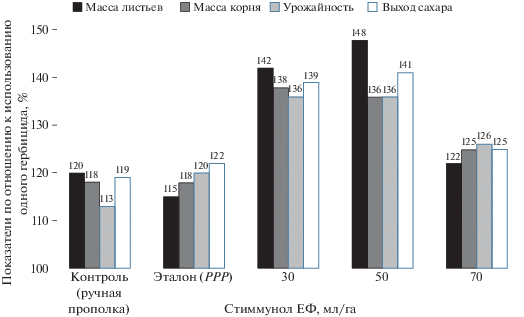
Потери урожая сельскохозяйственных культур в результате гербицидного стресса могут достигать 35–50%, которые наблюдают, как правило, при комплексном воздействии ряда негативных факторов среды [17, 18]. Не всегда негативное действие гербицидного стресса проявляется непосредственно сразу после обработки растений. Зачастую при внешнем отсутствии признаков страдания его негативное влияние может сказаться на более поздних фазах развития, особенно в том случае, когда растения испытывают в этих фазах дополнительный абиотический стресс, чаще всего в условиях засухи. Например, в 2014 г. наблюдали сильный пролонгированный гербицидный стресс растений сахарной свеклы в условиях действия негативных погодных факторов (в июле–августе – до 40°С при сильном дефиците влаги). Наблюдения за состоянием растений после обработки гербицидом бетанал 22 показали, что видимых признаков фитотоксичного действия препарата непосредственно после обработки не проявилось. Через 2 нед при оценке активности фотосинтетических процессов по содержанию хлорофилла в листьях не было выявлено достоверных различий между данным показателем в вариантах опыта: в контроле с ручной прополкой и на фоне гербицида содержание хлорофилла составило 492 и 487 ед. Однако через 2 мес. после обработки в растениях были установлены существенные изменения фотосинтетической активности: содержание хлорофилла в листьях в варианте ручной прополки было достоверно (на 46 ед. или на 12%) больше, чем в контроле на гербицидном фоне, что могло свидетельствовать о глубинном отдаленном негативном действии гербицида на растения [19]. В итоге растения, не подвергшиеся обработке гербицидом (вариант ручной прополки), имели на 20% более мощную вегетативную массу, на 18% – более высокую массу корнеплодов и на 0.5% – существенно бóльшую сахаристость (рис. 2). В дальнейшем отмечали параллельное влияние на ростовые процессы, что выражалось в снижении темпов нарастания массы листьев и корнеплодов.
Рис. 2.
Эффективность действия стиммунола ЕФ в различных нормах расхода при применении совместно с гербицидом бетанал 22 на сахарной свекле.
Обработка растений гербицидом оказывает определенное ингибирующее действие на иммунный статус растений. Например, имеются сведения об отрицательном действии отдельных гербицидов бетанальной группы на устойчивость всходов сахарной свеклы к корнееду [20–22].
Проблема снижения гербицидного стресса растений решается при использовании специальных химических антидотов, связывающих и блокирующих поступление гербицидов в культурные растения, способствующих их разложению в тканях, стимулирующих процессы метаболизма и т.п. Синтез таких антидотов достаточно сложен и существенно удорожает стоимость пестицидов. Кроме того, большинство антидотов обладают высокой избирательностью к гербицидам, видам растений, условиям применения. Антидоты широкого спектра действия практически отсутствуют.
Выходом из создавшейся ситуации является применение в качестве своеобразных антидотов полифункциональных регуляторов роста растений (РРР). Антистрессовые свойства данных средств обусловлены функционированием глубинных и тонких естественных регуляторных механизмов воздействия на растения, затрагивающих генетический аппарат клеток, биохимические процессы и гормональную регуляцию. Среди эффектов, определяющих их положительное действие на сельскохозяйственные культуры, наиболее важными для поддержания высокой продуктивности растений в условиях гербицидного стресса являются: увеличение всхожести семян (при применении почвенных гербицидов), усиление фотосинтетических процессов, приводящих к накоплению пластических веществ в генеративных органах (увеличению массы семян, корнеплодов и клубней), ускорение и усиление ростовых процессов (повышение продуктивной кустистости, вегетативной массы), усиление устойчивости растений к фитопатогенам, улучшение качественных показателей выращиваемой продукции (увеличение содержания полезных веществ – витаминов, сахаров, белков и др.). Таким образом, механизм действия РРР принципиально отличается от защитных свойств химических антидотов. При этом разные эффекты действия РРР на поздних фазах развития, за счет системного влияния могут программироваться при использовании данных средств на более ранних фазах развития растений. В принципе антидотный эффект полифункциональных регуляторов роста можно отнести к компенсационному, когда ущерб, вызванный негативным действием пестицидов, перекрывается за счет стимуляции комплекса адаптивных реакций растений.
Антистрессовые и антидотные свойства были открыты у некоторых биофунгицидов и РРР: препаратов гумми, фитоспорин, планриз, стифун, крезацин, фэтил, рифтал, эпин и др. [7, 23–28], Разработаны технологии применения таких стрессопротекторов на многих сельскохозяйственных культурах [3, 7, 29, 30].
Во ВНИИЗР в течение ряда лет проводят исследования по совместному использованию в системах защиты различных сельскохозяйственных культур гербицидов, агрохимикатов и регуляторов роста растений. При этом оценивали антидотное действие различных полифункциональных регуляторов роста растений (табл. 2). Адаптогенный эффект полифункциональных РРР в значительной мере зависит от степени гербицидного стресса, наличия других стрессовых факторов и регламентов применения. Например, на примере использования стиммунола ЕФ на сахарной свекле видно, что антидотный эффект в разных ситуациях варьировал от 7.2 до 36.0%. Чем выше был оказываемый на растения многофакторный прессинг, тем сильнее проявлялось действие препарата в качестве антидепрессанта.
Таблица 2.
Эффективность полифункциональных регуляторов роста растений при использовании в качестве антидотов совместно с гербицидами (результаты полевых и производственных испытаний ВНИИЗР)
| Культура | Наименования препаратов гербицидов | Препараты в качестве антидотов | Антидотный эффект (увеличение урожайности относительно применения только одних гербицидов) | |
|---|---|---|---|---|
| ц/га | % | |||
| Озимая пшеница | Пришанс, СЭ Шанстар, ВДГ | Иммуноцитофит, ТАБ | 2.5 | 10.0 |
| Стиммунол ЕФ, Ж | 3.8 | 15.2 | ||
| Балерина, СЭ | Стиммунол ЕФ, Ж | 4.1 | 10.0 | |
| Яровой ячмень | Пришанс, СЭ Шанстар, ВДГ | Иммуноцитофит, ТАБ. | 1.7 | 8.2 |
| Стиммунол ЕФ, Ж | 2.0 | 9.6 | ||
| Шансюген, ВЭ Пришанс, СЭ | Иммуноцитофит, ТАБ | 2.3 | 8.1 | |
| Стиммунол ЕФ, Ж | 2.4 | 8.5 | ||
| Пришанс, СЭ | Стивин, Ж | 2.9 | 14.2 | |
| Озимая рожь | Гранстар Про, ВДГ | Альбит, ТПС | 3.6 | 16.7 |
| Овес | Гранстар Про, ВДГ | Альбит, ТПС | 4.1 | 7.5 |
| Картофель | Гербитокс, ВР Квикстеп, МКЭ | Иммуноцитофит, ТАБ. | 22.9 | 12.9 |
| Стиммунол ЕФ, Ж | 27.0 | 15.2 | ||
| Мелафен, ВР | 20.9 | 11.8 | ||
| Клетошанс, КЭ | Иммуноцитофит, Т. | 8.0 | 12.3 | |
| Стиммунол ЕФ, Ж | 9.0 | 13.8 | ||
| Мивал Агро, ТАБ. | 7.0 | 10.7 | ||
| Шантус, ВДГ Агрошанс, ВК Зенкошанс, КС Сильвошанс, Ж | Иммуноцитофит, ТАБ | 18.3 | 17.7 | |
| Стиммунол ЕФ, Ж | 26.1 | 27.0 | ||
| Кукуруза | Фенизан, ВР | Стиммунол ЕФ, Ж | 11.3 | 25.1 |
| Сахарная свекла | Бетанал 22, КЭ Лонтрел-300, ВР Миура, КЭ | Стивин, Ж | 64.0 | 5.3 |
| Бетанал 22, КЭ Селект, КЭ Карибу, СП Лонтрел-300 | Альбит, ТПС | 43.3 | 19.0 | |
| Бетанал Прогресс ОФ, КЭ | Альбит, ТПС | 65.1 | 28.5 | |
| Бифор 22, КЭ Кари-Макс, СП | Стиммунол ЕФ, Ж | 73.0 | 17.1 | |
| Бетанал макс Про, МД Кари-Макс, СП Бетанал 22, КЭ Агрон, ВР Легион, КЭ | Стиммунол ЕФ, Ж | 41.2 | 7.2 | |
| Бетанал 22, КЭ | Стиммунол ЕФ, Ж | 128.0 | 36.0 | |
| Подсолнечник | Суперстар, ВДГ | Стиммунол ЕФ, Ж | 2.2 | 11.8 |
| Соя | Хармони, СТС Базагран, ВР | Стиммунол ЕФ, Ж | 2.7 | 10.3 |
Положительное влияние РРР в качестве антидота существенно зависит от его нормы расхода. Например, при обработке вегетирующих растений препаратом альбит в дозировке 40 мл/га совместно с гербицидом бетанальной группы увеличение урожая сахарной свеклы относительно использования гербицида без антидота составило 22%, и эффект достигался за счет увеличения средней массы корнеплода. При расходе биопрепарата 30 мл/га в большей степени отмечали стимуляцию избыточного роста вегетативной массы растений, чем корнеплодов, что привело к отсутствию антидотного эффекта [16].
Препарат стиммунол ЕФ наибольший антистрессовый эффект при совместном применении с гербицидом проявлял в нормах расхода 30–50 мл/га, более высокая дозировка (70 мл/га) существенно снижала его антидотное действие (рис. 2) [19].
При обработке сои в фазе 5-ти настоящих листьев совместно с гербицидами (базагран, ВР + + центурион, КЭ) биопрепарат стиммунол ЕФ усилил устойчивость растений к гербицидному стрессу. Снижение поврежденности листьев ожогами в этом случае составляло 63% по отношению к обработке одним гербицидом, что позволило повысить прибавку урожая до 41% по сравнению с использованием биостимулятора в отсутствие гербицидного стресса (22%) [31, 32].
Важным вопросом при применении РРР для преодоления гербицидного стресса является также срок их применения и установление оптимальной кратности обработки. Например, технология возделывания сахарной свеклы предусматривает использование почвенных гербицидов, а также 3–4 обработки вегетирующих растений послевсходовыми гербицидами при каждой волне появления сорных растений в период от фазы вилочки до смыкания растений в рядках. Поскольку принцип действия полифункциональных РРР существенно отличается от химических антидотов, нет необходимости добавлять биоантидоты при каждой химической обработке. Исследования на примере альбита показали, что использование его в фазе до 2-х пар настоящих листьев нецелесообразно, поскольку в данный период влагообеспеченность растений обычно достаточная, и запас жизненных сил для сопротивления гербицидному стрессу у растений велик. При обработке альбитом в данный срок антидотный эффект (наличие прибавки урожая) отсутствовал [16]. Избыточное внесение РРР при многократных обработках может вызвать десенсибилизацию иммунной системы растений и привести к увеличению пораженности заболеваниями, а в результате сопряженности всех биохимических и физиологических реакций и участия в общем метаболизме гормональной системы может быть нарушен баланс гормонов в ущерб продуктивности растений. В частности, на примере оценки влияния альбита на увеличение средней массы корнеплода, установлено, что максимальный ее прирост (16.9%) отмечен при применении препарата совместно с гербицидом в фазе смыкания растений в рядках, поскольку именно в этой фазе начинается активное формирование корнеплодов. На основании результатов трехлетних исследований установлено, что оптимальным сроком применения регулятора роста альбит (30 мл/га) в системе защиты культуры от вредных организмов является фаза смыкания растений в рядках. При этом антидотный эффект в годы, различавшиеся по воздействию неблагоприятных погодных факторов, был сходным – 23.1–29.9% прибавки урожая [16].
Вопрос кратности применения РРР в качестве антидотов изучен еще недостаточно, но на многих примерах показано, что даже при однократном использовании РРР в системах защиты сельскохозяйственных культур от сорняков антидотный эффект может быть очень значительным (до 30% и более).
ЗАКЛЮЧЕНИЕ
В настоящее время применение гербицидов на сельскохозяйственных культурах в интенсивных агротехнологиях является неотъемлемым элементом современных систем защиты растений от сорняков. Однако характер их влияния на культурные растения находится в значительной зависимости от комплекса биотических и абиотических факторов, определяющих физиологическое состояние культуры. При этом интенсивность фитотоксического действия гербицидов на защищаемые растения варьирует от положительного до ощутимо негативного эффектов в самых различных биохимических и физиологических аспектах. В целях преодоления возможных отрицательных последствий применения гербицидов на продуктивность защищаемых растений очень важную роль могут играть экологически безопасные полифункциональные регуляторы роста растений, позволяющие за счет комплекса положительных эффектов действия нивелировать возможный ущерб.
Характер пролонгированного антидотного действия полифункциональных регуляторов роста в химизированных системах защиты сельскохозяйственных культур очень тесно связан с используемой дозировкой, сроками применения и физиологическим состоянием растений, определяемым в значительной мере погодными факторами среды. Разработка оптимизированных регламентов применения препаратов данной группы позволит значительно снизить потенциальные риски химической защиты сельскохозяйственных культур от сорных растений.
Список литературы
Кузнецов В.В., Шевякова Н.И. Пролин при стрессе: биологическая роль, метаболизм и регуляция // Физиология растений. 1999. Т. 46. Вып. 2. С. 305–320.
Тарчевский И.А. Сигнальные системы клеток растений. М.: Наука, 2002. 294 с.
Тютерев С.Л. Физиолого-биохимические основы управления стрессоустойчивостью растений в адаптивном растениеводстве // Вестн. защиты растений. 2000. № 1. С. 11–34.
Тарчевский И.А. Катаболизм и стресс растений. М.: Наука, 1993. 83 с.
Аверьянов А.А., Лапикова В.П. Взаимодействие сахаров с гидроксильным радикалом в связи с фунгитоксичностью выделений листьев // Биохимия. 1989. Т. 54. № 10. С. 1646–1651.
Тютерев С.Л. Научные основы индуцированной устойчивости растений. СПб.: Наука, 2002. 328 с.
Шакирова Ф.М. Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция. Уфа: Гилем, 2001. 160 с.
Гродзинский Д.М. Надежность растительных систем. Киев: Наук. думка, 1983. 368 с.
Хочачка П., Сомеро Дж. Биохимическая адаптация. М.: Мир, 1988. 568 с.
Колупаев Ю.Е., Карпец Ю.В. Участие растворимых углеводов и низкомолекулярных соединений азота в адаптивных реакциях растений // Вicтн. Харкiв. нац. аграрн. унiверситету. Сер. бiол. 2010. Вип. 2(20). С. 36–53.
Полесская О.Г. Растительная клетка и активные формы кислорода / Под ред. Ермакова И.П. М.: КДУ, 2007. 140 с.
Bhattacharjee S. Reactive oxygen species and oxidative burst: Roles in stress, senescence and signal transduction in plants // Current Sci. 2005. V. 89. № 7. P. 1113–1121.
Шевякова Н.И., Бакулина Е.А., Кузнецов Вл.В. Антиоксидантная роль пролина у галофита хрустальной травки при действии засоления и параквата, инициирующих окислительный стресс // Физиология растений. 2009. Т. 56. № 5. С. 736–742.
Богдарина А.А. Физиологические основы действия инсектицидов на растение. М.: Сельхозиздат, 1961. 191 с.
Neumann D., Nover L., Parthier B. Heat shock and other stress response systems of plants // Biol. Zentralblatt. 1989. V. 108. № 6. P. 1–156.
Рябчинская Т.А., Харченко Г.Л., Саранцева Н.А., Бобрешова И.Ю., Злотников А.К. Преодоление пестицидного стресса с помощью полифункционального препарата Альбит // Сахарная свекла. 2012. № 5. С. 23–28.
Игнатенко В.А. Выбор пестицидов для сои: здесь нельзя ошибаться // Поле Августа. 2005. № 4. С. 5–6.
Parker C. Herbicide antidotes – A Review // Pest. Sci. 1983. V. 14. P. 40–48.
Рябчинская Т.А., Бобрешова И.Ю., Харченко Г.Л., Саранцева Н.А. Снятие гербицидного стресса при использовании биостимулятора Стиммунол ЕФ // Cахарная свекла. 2015. № 4. С. 24–27.
Дворянкин Е.А. Концепция снижения токсичности гербицидов на растения культуры // Сахарная свекла. 2006. № 1. С. 12–15.
Матвейчук П.В. Продуктивность сахарной свеклы в зависимости от норм и способов применения новых гербицидов бетанальной группы: Автореф. дис. … канд. с.-х. наук. Рамонь, 2008. 25 с.
Титов В.Н. Интегрированная защита сахарной свеклы от сорной растительности: Автореф. дис. … канд. с.-х. наук. Рамонь, 2008. 22 с.
Вакуленко В.В. Эпин-Экстра, Циркон и Силиплант повысят качество урожая // Защита и карантин растений. 2017. № 3. С. 34–35.
Ларионов Г.И. Универсальные препараты в современном сельскохозяйственном производстве // Биологические препараты растительного происхождения и их применение в технологии возделывания сельскохозяйственных культур. Новосибирск: Изд-во ИЦиГ СО РАН, 2004. С. 70–72.
Лухменев В.П. Эффективность современных иммуностимуляторов неспецифического антистрессового действия // Отчет по НИР за 2001–2003 гг. Оренбург: Изд-во ОГАУ, 2004. 52 с.
Лучник Н.А. Испытание гумата “Плодородие” в регионах // Агрохим. вестн. 2002. № 1. С. 2–3.
Рябчинская Т.А., Харченко Г.Л., Бобрешова И.Ю., Саранцева Н.А. Повышение продуктивности и адаптивных свойств сельскохозяйственных культур при использовании регулятора роста Стиммунол ЕФ // Биологическая защита растений – основа стабилизации агроэкосистем: Мат-лы Международ. научн.-практ. конф. “Инновационные технологии применения биологических средств защиты растений в производстве органической сельскохозяйственной продукции”, 16–18 сентября, 2014 г. Краснодар, 2014. Вып. 8. С. 327–330.
Рябчинская Т.А., Харченко Г.Л., Бобрешова И.Ю., Саранцева Н.А. Снижение пестицидного стресса у растений при использовании полифункциональных регуляторов роста // Trends of modern Science – 2015: Мaterials of the XI international scientific and practical conference. May 30–June 7. 2015. V. 20. Agriculture Veterinary medicine. Sheffield: Science and Education LTD, 2015. Р. 20–23.
Технология использования антистрессовых регуляторов роста и биофунгицидов совместно с протравителями семян и гербицидами на зерновых культурах (рекомендации) / Под ред. Усманова У.Г. 2-е изд. доп. Уфа: Гилем, 2005. 51 с.
Эффективность гербицидов и фунгицидов при совместном применении с антистрессовыми регуляторами роста на зерновых культурах (опыт и рекомендации) / Под ред. Усманова У.Г. Уфа: Гилем, 2003. 80 с.
Бобрешова И.Ю., Саранцева Н.А. Эффективность Стиммунола ЕФ при обработке растений сои // Сахарная свекла. 2014. № 6. С. 31–36.
Рябчинская Т.А., Харченко Г.Л., Бобрешова И.Ю. Саранцева Н.А. Многокомпонентные полифункциональные биостимуляторы роста и развития растений (на примере биопрепарата Стиммунол ЕФ). Воронеж, 2015. 82 с.
Дополнительные материалы отсутствуют.