Агрохимия, 2019, № 5, стр. 35-47
ИННОВАЦИОННЫЙ ПОДХОД В СОЗДАНИИ ПРОТРАВИТЕЛЕЙ С АНТИДОТНЫМ ДЕЙСТВИЕМ ПРОТИВ ПОЧВЕННЫХ ОСТАТКОВ ГЕРБИЦИДОВ СУЛЬФОНИЛМОЧЕВИННОГО РЯДА
Ю. Я. Спиридонов 1, О. А. Чичварина 1, Г. С. Босак 1, О. Ю. Селютина 2, Н. Д. Поляков 2, А. И. Варламова 3, О. Ю. Федоровский 4, Н. Д. Чкаников 4, С. С. Халиков 4, *
1 Всероссийский научно-исследовательский институт фитопатологии
143050 Московская обл., Одинцовский р-н, р.п. Большие Вяземы, ул. Институт, влад. 5, Россия
2 Институт химической кинетики и горения им. В.В. Воеводского СО РАН
630090 Новосибирск, ул. Институтская, 3, Россия
3 Всероссийский научно-исследовательский институт фундаментальной
и прикладной паразитологии животных и растений имени К.И. Скрябина РАН
117218 Москва, ул. Б. Черемушкинская, 28, Россия
4 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
* E-mail: salavatkhalikov@mail.ru
Поступила в редакцию 26.08.2018
После доработки 27.09.2018
Принята к публикации 10.02.2019
Аннотация
Применение гербицидов для получения высоких урожаев сельскохозяйственных культур позволяет решать не только проблемы обеспечения населения Земли необходимой пищей, но и регулирует численность сорняков. Однако при бесконтрольном использовании современных гербицидов, обладающих высокой эффективностью, возникают не только экологические проблемы, но и экономические, а именно, некоторые клубневые культуры не могут расти и давать урожай при наличии остатков гербицидов в почве. Для снятия токсического действия таких гербицидов предложено использование антидотов. В работе представлены результаты многолетних исследований по разработке протравителей с включением в их состав известных и оригинальных антидотов из различных классов органических соединений, а также изучение острой токсичности предлагаемых протравителей и их проникновение в обрабатываемые семена.
ВВЕДЕНИЕ
Весьма актуальной проблемой современного сельского хозяйства является увеличение урожайности культур для обеспечения потребностей бурно растущего населения Земли. Для решения этой проблемы привлекают разработки новых высокоурожайных сортов, использование удобрений и пестицидов, а также применение современной техники возделывания культур.
Одним из основных факторов, негативно воздействующих на урожайность культур, являются сорняки, из-за которых ежегодные потери в мире составляют ≈10–15% от достижимого урожая. Поэтому вполне обосновано широкомасштабное применение гербицидов в решении проблем обеспечения населения земли продуктами питания (мировое потребление гербицидов составляет 47.5% от 2 млн т пестицидов, применяемых каждый год) [1].
Однако есть и огромные проблемы из-за такого массового использования гербицидов. Прежде всего, это эрозия и засоление почв из-за обильного использования ирригационных систем, истощение водоносных горизонтов, потери лесных угодий и загрязнения почв из-за чрезмерного использования гербицидов [2].
Другой проблемой массового применения гербицидов является засоренность почв их остатками, которые не только создают экологические проблемы для ближайшего будущего, но и негативно воздействуют на культуру, которая запланирована по планам севооборота. Это особенно актуально в случае посева корнеплодов (сахарной свеклы, картофеля и пр.) [3], чувствительных к остаткам гербицидов.
Областью наших научных интересов является разработка комплексных протравителей с добавлением антидотов, которые защищают семя, проростки и само культурное растение от почвенных остатков гербицида. Эти исследования приобретают особую актуальность, т.к. систематическое применение гербицидов привело в России к загрязнению их остатками до 22% почв, что составляет >17 млн га [3].
В основу наших исследований входит разработка средств защиты растений на наноразмерном уровне [4], позволяющем разрабатывать общие принципы развития исследований, новых наноматериалов, методов, технических средств и нанотехнологий. Именно эти методы и технологии будут способствовать улучшению препаратативных форм пестицидов, которые должны отвечать трем основным критериям – эффективности, экономичности и экологической безопасности для окружающей среды.
МЕТОДИКА ИССЛЕДОВАНИЯ
Для приготовления инновационных препаратов-протравителей была использована разработанная нами технология жидкофазного многокомпонентного суспендирования фунгицидов, инсектицидов, регуляторов роста и антидотов в водном растворе формообразующих компонентов (натриевая соль карбоксиметилцеллюлозы (Na-КМЦ), эмульгатора и ПАВ) [5].
В состав препаративных форм протравителей были включены такие фунгициды как тебуконазол, имазалил, прохлораз, инсектициды (имидаклоприд, тиурам), а также ряд известных антидотов, используемых в смеси с гербицидами в период вегетации (нафталевый ангидрид, фурилазол, изоксадифен-этил). Полученные препараты в виде суспензионных концентратов были оценены по физико-химическим и технологическим параметрам и наиболее эффективные были переданы на биологические испытания.
Для выявления антидотного действия этих препаратов проводили их биологические исследования в почвах, содержащих остатки гербицида зингер (метсульфурон-метил). Выбранные суспензионные концентраты были использованы для обработки семян культурных растений (кукурузы, рапса, сахарной свеклы), которые высевали в почву, загрязненную гербицидом зингер. Проведенные биологические испытания показали, что использование протравителей позволило не только полностью устранить токсическое действие остатков метсульфурон-метила в количестве 0.3 г/га, но и добиться стимуляции роста надземной массы культурных растений.
Методом ядерного магнитного резонанса исследована проникающая способность компонентов протравителя в семена рапса и кукурузы, а также влияние природных мембраномодифицирующих добавок (сапонина глицирризиновой кислоты и полисахарида арабиногалактана) на эффективность проникновения.
Для приготовления комплексных протравителей в качестве фунгицидов были выбраны следующие:
– тебуконазол с содержанием 97% (RS)-1р-хлорфенил-4,4-диметил-3-(1H-1,2,4-триазол-1-ил-метил) пентан-3-ила – эффективный системный фунгицид для обработки семян зерновых культур в борьбе с фитопатогенами, передающимися с семенами. Относится к триазолам 3-го поколения. Проявляет системное действие. Хорошо растворяется в органических растворителях, плохо в воде. Не гидролизуется при рН от 4.0 до 9.0, умеренно опасный [6];
– тирам с содержанием 98% тетраметилтиурамдисульфида применяется в сельском хозяйстве (в том числе в смеси с другими действующими веществами) для борьбы с заболеваниями растений. Кристаллическое вещество белого или кремового (желтовато-серого) цвета без запаха. Не растворим в воде, хорошо растворяется в хлороформе, ацетоне, хуже в спирте, эфире. Соединение химически стойкое, не разрушается в щелочной и кислой средах. Устойчив к воздействию высоких температур. Вещество устойчиво к воздействию факторов внешней среды и относится к стойким пестицидам, разлагающимся до нетоксичных компонентов в биологических средах в течение 0.2–2 лет [7];
– прохлораз с содержанием 98% N-пропил-N-[2-(2,4,6-трихлорфенокси)этил]имидазол-1-карбоксамида – контактный и системный фунгицид класса имидазолов с защитным и искореняющим действием. Используется против широкого диапазона заболеваний. Сдерживает фузариоз колоса на 50% при обработке после появления признаков болезни. При 2-кратной обработке эффективен против аскохитоза и серой гнили. Золотисто-коричневая жидкость. Затвердевает при охлаждении, образует комплексы с ионами ряда металлов. При pH 5.0–7.0 (22°C) не разлагается в течение 30 сут. В дозе 12 мг/кг значительно ингибирует процессы аммонификации в почве, 3-й класс опасности [6];
– имазалил с содержанием 98% (±)-1-(β-аллилокси-2,4-дихлорфенилэтил) имидазола – системный фунгицид класса имидазолов. Стабилен к гидролизу в щелочах и разбавленных кислотах в отсутствии света, умеренно опасный. Вещество ингибирует биосинтез стерина в мембранах клеток фитопатогенов, подавляя деметилирование в положении 14 ланостерина или 24 – метилендигидроланостерина. Имеются данные о разрыве мембран грибов [6].
В качестве антидотов в составе комплексных протравителей были использованы:
– 1,8-нафталевый ангидрид с содержанием 97% ангидрида нафталин-1,8-дикарбоновой кислоты, слабоокрашенные кристаллы. Растворим в органических растворителях, слабо растворим в неполярных. Почти не растворим в воде. Не гигроскопичен. При рН = 7.0 стабилен, в кислой среде подвергается разложению до нафталевой кислоты [8];
– фурилазол с содержанием 97% (RS)-3-дихлорацетил-5-(2-фуранил)-2,2-диметил-1,3-оксазолидина. Светло-коричневый порошок, т. пл. 96.6–97.6°С. Давление пара (25°С) – 0.884 Па (66.3 × 10–3 мм рт. ст.). Растворимость в воде (20°С) – 0.0197 г/л [9];
– изоксадифен-этил с содержанием 95% этилового эфира-4,5-дигидро-5,5-дифенил-изоксазол-3-карбоновой кислоты было получено по методике [10] реакцией конденсации 11-дифенилэтилена с этиловым эфиром нитроуксусной кислоты в присутствии бициклического амидина 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU) в качестве катализатора. Белое твердое вещество. Имеет слабый запах. Растворим в ацетоне, метаноле, н-гептане, п-ксилене, этилацетате. Гидролитически и термически стабилен. Температура плавления 86–87°C. Растворимость в воде (20°C) – 1.06 мг/л. Давление паров (20°C) – 2.2 × 10–6 Па. [11].
В наших работах для улучшения растворимости плохо растворимых действующих веществ (ДВ) использовали технологию их твердофазной механохимической модификации с водорастворимыми полимерами [13]. Учитывая низкоплавкость выбранных в работе ДВ фунгицидов, такой вариант был исключен и использована технология механохимического суспендирования в жидкой среде, позволяющей снимать локальные температурные изменения [5].
С учетом выше указанных особенностей исходных компонентов были изучены, оптимизированы и получены препаративные формы в виде суспензионного концентрата (СК) и суспоэмульсии (СЭ). Для приготовления препаративных форм протравителей были использованы общепринятые растворители и вспомогательные вещества (стабилизаторы суспензий и эмульсий, ПАВы, полимеры и пр.) [5, 12].
В качестве примеров приготовления суспензионных форм протравителей приводим прописи приготовления базовых препаратов с использованием выше указанных фунгицидов и инсектицидов.
Получение суспензионной композиции (препарат 1611) на основе тебуконазола (ТБК) и тирама (ТМТД). В металлический барабан (объем 0.8 л) валковой мельницы LE-101 загрузили последовательно 530 г шаров (диаметр металлических шаров 12–18 мм), 52 г 2%-ного водного раствора полимера (Na-КМЦ), 3.0 г Твин-40 (неионогенный ПАВ), 20.0 г антифриза (пропиленгликоль). В полученную массу при перемешивании добавили 1.25 г ТБК, 20.0 г ТМТД. Затем суспензию перемешивали в течение 2 ч при скорости вращения барабана 50–60 об./мин. Выгрузили 75 г (выход 80%) подвижной суспензии следующего состава (табл. 1).
Таблица 1.
Состав исследованных препаратов
| Компонент | Содержание, г | Содержание, % |
|---|---|---|
| Суспензионный препарат 1611 | ||
| ТБК | 1.25 | 1.3 |
| ТМТД | 20.0 | 21.0 |
| ПАВ (Твин 60) | 3.0 | 3.1 |
| Пропиленгликоль | 20.0 | 21.0 |
| Na-КМЦ | 1.04 | 1.1 |
| Дистиллированная вода | 51.0 | 52.5 |
| Всего | 95.0 | |
| Суспензионный препарат 2011 | ||
| ТБК | 1.25 | 1.3 |
| ТМТД | 20.0 | 21.0 |
| ИКП | 20.0 | 21.0 |
| ПАВ (Твин 60) | 3.0 | 3.1 |
| Пропиленгликоль | 20.0 | 21.0 |
| Na-КМЦ | 0.64 | 0.7 |
| Дистиллированная вода | 31.3 | 31.9 |
| Всего | 95.0 | |
| Суспоэмульсионный препарат 2111 | ||
| ТБК | 1.5 | 1.35 |
| ИКП | 20.0 | 18.0 |
| ИМЗ | 10.0 | 9.0 |
| ПХР | 2.5 | 2.25 |
| ПАВ (Твин 60) | 3.0 | 2.7 |
| Пропиленгликоль | 20.0 | 18.0 |
| Na-КМЦ | 0.9 | 0.8 |
| Дистиллированная вода | 42.1 | 37.9 |
| Циклогексанон | 10.0 | 9.0 |
| Всего | 110 | |
Стабильная суспензия (препарат 1611) имеет следующий состав основных компонентов: ТБК – 1.3%, ТМТД – 21.0%.
Получение суспензионной композиции (препарат 2011) на основе имидаклоприда (ИКП), тебуконазола (ТБК) и тирама (ТМТД). В металлический барабан (объем 0.8 л) валковой мельницы LE-101 загрузили последовательно 530 г шаров (диаметр металлических шаров 12–18 мм), 32 г 2%-ного водного раствора полимера (Na-КМЦ), 3.0 г Твин-40 (неионогенный ПАВ), 20.0 г антифриза (пропиленгликоль). В полученную массу при перемешивании добавили 20.0 г ТМТД, 20.0 г ИКП, 1.25 г ТБК и продолжили механообработку в течение 2 ч при скорости вращения барабана 50–60 об./мин. Выгрузили 86 г (выход 90%) подвижной суспензии следующего состава (табл. 1).
Стабильная суспензия (препарат 2011) имеет следующий состав основных компонентов: ТБК – 1.3%, ТМТД – 21.0%, ИКП – 21.0%.
Получение суспоэмульсионной композиции (препарат 2111) на основе прохлораза (ПХР), имазалила (ИМЗ), тебуконазола (ТБК) и имидаклоприда (ИКП). В металлический барабан (объем 0.8 л) валковой мельницы LE-101 загрузили последовательно 530 г шаров (диаметр металлических шаров 12–18 мм), 43 г 2%-ного водного раствора полимера (Na-КМЦ), 3.0 г Твин-40 (неионогенный ПАВ), 20.0 г антифриза (пропиленгликоль), 10 г циклогексанона. В полученную массу при перемешивании добавили 1.5 г ТБК, 20.0 г ИКП, 10 г ИМЗ, 2.5 г ПХР и продолжили механообработку в течение 2 ч при скорости вращения барабана 50–60 об./мин. Выгрузили 85 г (выход 77%) подвижной темно-серой суспоэмульсии следующего состава (табл. 1).
Стабильная суспоэмульсия (препарат 2111) имеет следующий состав основных компонентов: ТБК – 1.35%, прохлораз – 2.25%, имазалил – 9%, ИКП – 18%.
Исследование острой токсичности базовых препаратов. Для базовых препаратов (препарат 1611, препарат 2011, препарат 2111) были изучены параметры острой токсичности в лаборатории экспериментальной терапии, виварий ВНИИП им. К.И. Скрябина. При этом были получены следующие результаты:
– препарат 1611, согласно общепринятой гигиенической классификации (ГОСТ 12.1.007-76), по степени воздействия на организм белых мышей относится к III классу опасности – вещества умеренно опасные. ЛД50 препарата 1611 при введении в желудок белым мышам составляет 2.0 мл/кг;
– с учетом установленных величин ЛД50, согласно ГОСТ 12.1.007-76, препарат 2011 по степени воздействия на организм белых мышей относится к III классу опасности – вещества умеренно опасные. ЛД50 препарата 2011 при введении в желудок белым мышам составляет 1.0 мл/кг;
– с учетом полученных величин ЛД50, согласно общепринятой гигиенической классификации (ГОСТ 12.1.007-76), препарат 2111 по степени воздействия на организм белых мышей относится к III классу опасности – вещества умеренно опасные. ЛД50 препарата 2011 при введении в желудок белым мышам составила 1.05 мл/кг.
Эти данные по острой токсичности позволяют судить о перспективности использования полученных нами базовых суспензионных препаратов для создания многокомпонентных протравителей с включением исследованных антидотов.
Биологические испытания. Для изучения антидотного действия выбранных антидотов в составе протравителя была использована следующая схема исследования:
1 – каждый из отмеченных антидотов готовили в виде суспензионных и эмульсионных форм. Количество антидота варьировалось от 1 до 100 г/л;
2 – комплексные антидотные протравители на основе выше указанных фунгицидов и инсектицидов готовили в виде суспензионного концентрата с добавлением соответствующих количеств антидотов из п. 1;
3 – антидотную активность комплексных препаратов (фунгицидов, инсектицидов, регуляторов роста растений (РРР), антидотов) определяли после обработки ими семян кукурузы сорта Краснодарский 291 АМВ, семян кукурузы гибрида Астерин, семян рапса сорта Мерано, семян рапса сорта Ратник и семян сахарной свеклы сорта Кариока.
Обработку почвы гербицидом зингер, СП (60% метсульфурон-метила) проводили в дозах 0.5, 1.0 и 2.5 г/га. Посев обработанных семян в загрязненную почву и учет надземной массы тест-растений проводили в лаборатории искусственного климата (ЛИК) в условиях, описанных в работе [5].
Исследования проникновения компонентов протравителя в зерно. Изучение процессов проникновения компонентов препаратов 1611, 2011 и 2111 проводили по следующей схеме:
1 – исследование проникновения компонентов препаратов 2011 и 2111 в зерна кукурузы и рапса методом ядерного магнитного резонанса (ЯМР). 1Н ЯМР спектры в растворах регистрировали на спектрометре фирмы “Брукер” AVHD-500 на частоте 500 МГц. В качестве растворителя для смывки препарата с поверхности зерна и экстракции, а также для ЯМР-измерений использовали ацетон-Д6 (Aldrich, 99.8%). Содержание всех компонентов измеряли после 3-х сут проращивания во влажной атмосфере как путем смывки с поверхности зерна, так и путем экстракции после смывки и помола;
2 – модификация суспензий препаратов 1611, 2011 и 2111 добавкой мембранотропной составляющей (глицирризиновая кислота (ГК) и полисахарид арабиногалактан (АГ)) в концентрациях 0.1 и 1% с последующим исследованием проникновения (пункт 1);
3 – предварительная обработка зерна мембранотропными веществами (ГК и АГ) в концентрациях 0.1% и 1% с последующим исследованием проникновения компонентов (пункт 1);
4 – исследование проникновения “чистых” веществ (ФА, ТБК, ИКП, ИМЗ, ПХР) в семена рапса и кукурузы при проращивании в отсутствии и в присутствии мембранотропных добавок (ГК и АГ, а также КМЦ). Была исследована способность данных комплексантов усиливать проницаемость зерна, а также их прилипание к поверхности. Приготовление образцов проводили по схеме: ДВ в соответствующих количествах (фунгициды по 5 мг/мл и антидоты по 2.5 мг/мл) добавляли в водные растворы ГК, АГ и Na-КМЦ, с последующим перемешиванием в ультразвуковой ванне в течение 30 мин. Для обработки зерна брали 1 мл полученной суспензии на 15 г зерна. После обработки зерно проращивали в течение 3-х сут во влажной атмосфере (в чашке Петри) при 25°С. После этого производили смывку ацетоном с поверхности. После просушки зерно измельчали и проникшие внутрь зерна вещества экстрагировали ацетоном в течение 1 сут. Экстракт центрифугировали для удаления осадка и анализировали методом ЯМР.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Учитывая полученные результаты использования 1,8-нафталевого ангидрида (НА) в составе копрангов для детоксикации гербицидов различных химических типов, в том числе сульфонилмочевин [3], в приготовленные базовые композиции был добавлен НА в норме 1–50 г/л. Биологические исследования проводили в условиях, описанных в работе [5]. При этом оценивали влияние препаратов на всхожесть семян ярового рапса сорта Труженик, яровой пшеницы сорта Энгелина и кукурузы сорта Каскад, а также их антидотное действие путем изучения их биологической активности в почвах, содержащих остатки гербицида (метсульфурон-метила) в дозах 0.1, 0.2 и 0.3 г/га (такие остаточные количества чаще всего отмечают на практике через 1 год после его применения). По итогам исследований композиций с НА было установлено, что эти композиции для предпосевной обработки семян имели следующие преимущества:
– обладали комплексным действием, а именно, проявляли свойства фунгицида, регулятора роста растений и антидота против остатков гербицида в почве;
– действовали более эффективно, чем известные фунгициды (например, раксил, КС), а также обладали антидотным действием, не свойственным известным протравителям семян, что, вероятно, объясняется синергизмом включенных в композицию компонентов;
– значительно повышали всхожесть семян рапса, яровой пшеницы и кукурузы, повышение энергии прорастания достигала 15, 28 и 30% соответственно. При этом биомасса культурного растения (ярового рапса) увеличивалась на 11.7%.
Добавление в эти базовые композиции антидота фурилазол проводили из расчета 12.5, 25.0, 50.0, 75.0 и 100 г фурилазола (ФА)/т семян. Испытания на антидотную активность на семенах кукурузы сортов Каскад и Краснодарский 370МВ проводили на почвах, загрязненных остатками гербицида зингер, СП в дозах от 2.5 до 5.0 г/га [14]. Результаты исследования на семенах кукурузы сорта Каскад показали, что:
– композиции, содержащие ФА, обладали большей антидотной активностью, чем таковые с НА;
– с увеличением содержания ФА с 12.5 до 50 г/т антидотная активность увеличивалась до 22% при содержании в почве остатков гербицида 5.0 г/га;
– дальнейшее увеличение содержания ФА в протравителе до 100 г/т приводило к незначительному увеличению антидотного действия (25.4%) при содержании в почве остатков гербицида в количестве 2.5 г/га.
Аналогичную тенденцию наблюдали и при проведении испытаний на семенах кукурузы сорта Краснодарский 370МВ, а именно, усиление антидотного действия ФА до 43% при увеличении его содержания в составе протравителя от 12.5 до 100%. По итогам исследований было установлено, что избыток ФА не столь существенно увеличил антидотный эффект после его концентрации в композиции 50.0–75.0 г/т. Поэтому было рекомендовано использование ФА в рецептуре протравителя в количестве 5.0–7.5% [14].
Использование в составе базовых композиций антидота изоксадифен-этила (ИДЭ) в норме от 1 до 100 г/л и анализ антидотной активности 2-х типов препаративных форм композиций (суспензионной и эмульсионной) на почвах, загрязненных гербицидом зингер, СП в дозах 0.5, 1.0 и 2.5 г/га, на семенах кукурузы гибрида Астерин и семенах рапса сорта Мерано показал, что [15]:
1 – суспензионная форма композиции с ИДЭ была более эффективна, чем эмульсионная форма;
2 – при норме 100 г ИДЭ/л в суспензии проявилась наибольшая активность (снижение массы тест-растений кукурузы составило 37%).
С учетом высокой эффективности суспензионных форм, были приготовлены композиции с добавлением ИДЭ в нормах 10, 25, 50, 100 и 200 г/л и использованы для протравливания семян кукурузы сорта Краснодарский, семян рапса сорта Ратник и семян сахарной свеклы сорта Кариока в условиях ЛИК. По результатам испытаний на семенах кукурузы сорта Краснодарский установлено, что комплексный протравитель, содержаний ИДЭ в норме от 50 до 200 г/л снимал фитотоксическое действие гербицида зингер (при его остатке в почве 2.5 г/га) от 27 до 50%. Также обнаружено, что увеличение нормы расхода ИДЭ с 100 до 200 г/л не приводило к усилению антидотного действия. Кроме того, выявлены стимулирующие в сравнении с контролем (вода) свойства ИДЭ. Наибольший стимулирующий эффект наблюдали для композиции, содержащей 100 г/л антидота ИДЭ, выражающийся в 25.3% (по сравнению с контролем-вода) и 3.5% (по сравнению со стандартом – комплексным протравителем без ИДЭ). Следовательно, оптимальной нормой применения ИДЭ в комплексном протравителе определена норма 100 г/л.
Аналогично были испытаны суспензионные протравители с содержанием ИДЭ в нормах 10–100 г/л на семенах рапса сорта Ратник. Результаты испытаний показали, что лишь композиция с нормой 100 г/л показала антидотный эффект (54.5%) по сравнению с гербицидным контролем, а все остальные композиции с нормой ИДЭ от 10 до 50 г/л обладали стимулирующим действием в почвах, не обработанных гербицидом. Стимулирующий эффект проявлялся от 11.1 до 44.4%.
Испытания суспензионных форм протравителя с ИДЭ на семенах сахарной свеклы сорта Кариока в норме 10–100 г/л показали, что композиции с ИДЭ не обладали антидотным действием. Однако все композиции проявили высокую стимулирующую активность на почвах, не обработанных гербицидом, – от 51.1 до 100%.
Наряду с известными антидотами (НА, ФА, ИДЭ), был изучен и оригинальный антидот ФМ-4, полученный при взаимодействии гидрохлорида этилового эфира 2-гидрокси-3,3,3-трифторметил-2-(4-метиламинофенил)-пропионовой кислоты с пара-хлорфенилизоцианатом в присутствии пиридина в растворе дихлорметана при температуре 20–25°С [16]. Соединение ФМ-4 представляет собой белое кристаллическое вещество с Тпл = 121–123°С, хорошо растворимо в спирте, ацетоне, хлороформе, диметилсульфоксиде и плохо в воде, стабильно при хранении при 20–25°С.
Антидотную активность соединения ФМ-4 выявляли путем приготовления рабочих растворов с добавлением ПАВ (тренд 90) и прилипателя (Na-КМЦ) с содержанием ФМ-4 в количествах 50, 100 и 200 г/л. Испытания проводили на посевах кукурузы сорта Краснодарский 291 АМВ в условиях ЛИК в феврале-марте 2018 г. на почвах, загрязненных гербицидом зингер, СП в дозе 2.5 г/га. Результаты испытаний представлены в табл. 2, в которой отрицательные величины означают стимуляцию роста, рассчитанную по формуле:
где В – снижение массы тест-растений относительно контроля, А – масса тест-растений в опытном варианте, K – масса тест-растений в контрольном варианте.Таблица 2.
Изучение антидотной активности соединения ФМ-4 в посевах кукурузы сорта Краснодарский 291 АМВ на почвах с содержанием гербицида зингер, СП в дозе 2.5 г/га
| Антидот (норма, г/л) | Доза гербицида зингер, СП, г/га | Надземная масса тест-растений (среднее), г | Снижение массы тест-растений, % к контролю | Антидотная активность, % |
|---|---|---|---|---|
| ФМ-4 (50) | – | 10.7 | –23.0 | – |
| 2.5 | 5.3 | 39.1 | 10.3 | |
| ФМ-4 (100) | – | 8.3 | 4.6 | – |
| 2.5 | 5.4 | 37.9 | 11.5 | |
| ФМ-4 (200) | – | 11.8 | –35.6 | – |
| 2.5 | 5.8 | 33.3 | 16.1 | |
| Контроль (зингер, СП) |
2.5 | 4.4 | 49.4 | – |
| Контроль (вода) | – | 8.7 | 0 | – |
Примечание. Отрицательные величины – стимуляция роста растений. То же в табл. 3, 4.
Анализ данных табл. 2 показал, что:
– выбранный тест (семена кукурузы) был объективным на выявление антидотной активности новых соединений;
– антидотная активность ФМ-4 при возрастании нормы от 50 до 200 г/л увеличивалась с 10.3 до 16.1%;
– ФМ-4 на незагрязненной остатками гербицида почве обладал высокими стимулирующими свойствами, увеличивая биомассу растений до 35.6%.
Для приготовления комплексных протравителей с включением в их состав ФМ-4 и проведения их испытаний к базовой композиции препарата 1611 добавляли ФМ-4 с расчетом получения протравителей с содержанием 1, 10 и 25 г/л. Испытания протравителей на антидотную активность проводили на семенах рапса сорта Ратник и семенах сахарной свеклы сорта Кариока на почве, загрязенной гербицидом зингер, СП в дозе 0.5 г/га в условиях ЛИК. Полученные данные представлены в табл. 3, 4.
Таблица 3.
Изучение антидотной активности комплексного препарата 1611 с добавлением соединения ФМ-4 в посевах рапса сорта Ратник на почвах, загрязненных остатками гербицида зингер, СП в дозе 0.5 г/га
| Состав протравителя, норма расхода ФМ-4, г/л | Доза гербицида зингер, СП, г/га | Надземная масса тест-растений (среднее), г | Снижение массы тест-растений, % к контролю |
|---|---|---|---|
| ТБК, ТМТД, ФМ-4, 1 г/л | – | 3.0 | –11.1 |
| 0.5 | 1.5 | 44.4 | |
| ТБК, ТМТД, ФМ-4, 10 г/л | – | 3.6 | –33.3 |
| 0.5 | 0.9 | 66.7 | |
| ТБК, ТМТД, ФМ-4, 25 г/л | – | 3.8 | –40.7 |
| 0.5 | 1.4 | 48.1 | |
| ТБК, ТМТД, 0 г/л – эталон | – | 3.1 | –14.8 |
| 0.5 | 1.2 | 55.6 | |
| Контроль (зингер, СП) | 0.5 | 1.6 | 40.7 |
| Контроль (вода) | – | 2.7 | 0 |
Таблица 4.
Изучение антидотной активности комплексного препарата 1611 с добавлением ФМ-4 в посевах семян сахарной свеклы сорта Кариока на почвах, загрязненных остатками гербицида зингер, СП в дозе 0.5 г/га
| Состав протравителя, норма расхода ФМ-4, г/л | Доза гербицида зингер, СП, г/га | Надземная масса тест-растений (среднее), г | Снижение массы тест-растений, % к контролю |
|---|---|---|---|
| ТБК, ТМТД, ФМ-4, 1 г/л | – | 4.4 | 2.2 |
| 0.5 | 0.3 | 93.3 | |
| ТБК, ТМТД, ФМ-4, 10 г/л | – | 6.2 | –37.8 |
| 0.5 | 0.7 | 84.4 | |
| ТБК, ТМТД, ФМ-4, 25 г/л | – | 7.1 | –57.8 |
| 0.5 | 0.7 | 84.4 | |
| ТБК, ТМТД, 0 г/л (эталон) | – | 7.1 | –57.8 |
| 0.5 | 0.7 | 84.4 | |
| Контроль (зингер, СП) | 0.5 | 0.5 | 88.9 |
| Контроль (вода) | – | 4.5 | 0 |
Анализ данных табл. 3 позволил сделать следующие выводы:
Таблица 5.
Проникновение действующих компонентов и антидотов из суспензии на основе препарата 2011 в семена рапса и кукурузы после проращивания в течение 3-х сут, %
| Культура | Проникновение действующих компонентов и антидотов, % | |||||
|---|---|---|---|---|---|---|
| ТБК | ТМТД | ИКП | ФА | ФМ-4 | ИДЭ | |
| Рапс | 57 | 0 | 34 | 0 | 11 | 8 |
| Кукуруза | 80 | 0 | 59 | 40 | 42 | 0 |
Примечание. Приведены средние показатели в 3-х сериях измерений с погрешностью 20%. То же в табл. 6, 7.
– комплексный протравитель на основе препарата 1611 с добавлением соединения ФМ-4 при норме его применения от 1 до 25 г/л не обладал ожидаемыми антидотными свойствами на загрязненной гербицидом почве в посевах рапса сорта Ратник;
– комплексный препарат 1611, как при индивидуальном применении, так и с добавлением ФМ-4, на незагрязенном гербицидом фоне обладал высокими стимулирующими свойствами (до 40.7%).
По данным табл. 4 можно сделать следующие выводы:
Таблица 6.
Проникновение действующих компонентов и антидотов из суспензии препарата 2111 с добавлением антидотов в семена рапса и кукурузы после проращивания в течение 3-х сут
| Культура | Проникновение действующих компонентов и антидотов, % | |||||
|---|---|---|---|---|---|---|
| ТБК | ИМЗ | ПХР | ИКП | ФА | ФМ-4 | |
| Рапс | 81 | 91 | 56 | 29 | 49 | 47 |
| Кукуруза | 76 | 92 | 75 | 48 | 39 | 0 |
– комплексный протравитель на основе препарата 1611 с добавлением соединения ФМ-4 не обладал антидотными свойствами на загрязненной гербицидом почве в посевах сахарной свеклы сорта Кариока;
– препарат проявлял меньшие стимулирующие свойства в посевах сахарной свеклы по сравнению с эталоном (препаратом 1611);
– стимулирующие свойства комплексного препарата в посевах сахарной свеклы уступали таковым в посевах рапса.
Метод ЯМР является мощным аналитическим инструментом, позволяющим с высокой достоверностью определять содержание активных компонентов в экстрактах растений, а также в смывках с поверхности зерна. Ранее эффективность метода ЯМР была продемонстрирована на примере исследования проникновения антидота нафталевого ангидрида в семена ячменя и пшеницы [17, 18]. В качестве примера на рис. 1 приведен протонный ЯМР-спектр экстракта из семян рапса, обработанных суспензией препарата 2111 с добавлением антидота ФА, после проращивания в течение 3 сут и смывки с поверхности остатков протравителя. Показано, что каждый компонент протравителя имел свой неповторимый спектр (подобно отпечатку пальца), что позволило надежно идентифицировать его в смеси.
Рис. 1.
Протонный ЯМР-спектр экстракта из семян рапса, обработанного суспензией препарата 2111 с добавлением антидота ФА. Сверху приведены спектры индивидуальных компонентов суспензии, растворитель – ацетон-Д6.
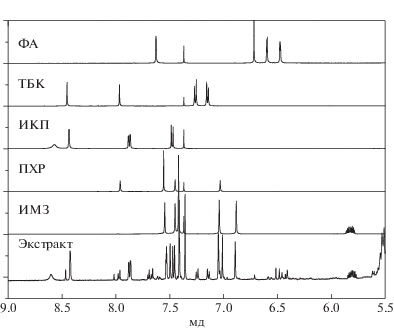
Исследования суспензии препарата 2011 с добавлением антидотов (ФА, ФМ-4, ИДЭ) позволили изучить проникновение в семена и компонентов, и антидотов (табл. 5). По результатам анализа данных табл. 5 можно сделать следующие выводы:
– действующие вещества протравителя проникали в семена кукурузы более эффективно, чем в семена рапса;
– наилучшей проникающей способностью обладал фунгицид ТБК;
– антидот ФА обладал хорошей проницаемостью в семена кукурузы, однако он не проникал в семена рапса, и можно ожидать соответствующего снижения антидотной активности ФА на засоренной почве в посадках рапса;
– фунгицид ТМТД не проникал в семена кукурузы и рапса.
Исследования суспензии препарата 2111 представлены в табл. 6. По результатам анализа данных можно сделать следующие выводы:
– для суспензии на основе препарата 2111 и антидотов отмечено хорошее проникновение всех компонентов в семена кукурузы и рапса, за исключением антидота ФМ-4, который не был обнаружен в экстракте из семян кукурузы;
– наилучшей проникающей способностью обладали ТБК и ИМЗ.
Анализ влияния мембранотропных добавок (глицирризиновая кислота (ГК), полисахарид арабиногалактан (АГ)) на проникновение компонентов из суспензии препарата 2011 с антидотами осуществляли в разных режимах:
1 – модификация суспензий добавкой мембранотропной составляющей в концентрациях 0.1 и 1% с последующим исследованием проникновения по ранее описанной методике;
2 – предварительная обработка зерна мембранотропными веществами (ГК и АГ) в концентрациях 0.1 и 1% с последующим исследованием проникновения действующих веществ по той же схеме. Результаты анализа проникновения компонентов суспензии (препарат 2011 + антидоты) в присутствие АГ представлены в табл. 7. По результатам анализа данных сделаны следующие выводы:
Таблица 7.
Проникновение компонентов суспензии 2011 в присутствии комплексанта АГ в семена рапса и кукурузы после проращивания в течение 3-х сут
| Культура | Комплексант | Проникновение компонентов, % | ||||
|---|---|---|---|---|---|---|
| ТБК | ТМТД | ИКП | ФА | ФМ-4 | ||
| Рапс | –* | 57 | 0 | 34 | 0 | 11 |
| 1% АГ | 81 | 0 | 80 | 0 | – | |
| 0.1% АГ** | 92 | 0 | – | – | 33 | |
| 1% АГ** | 90 | 0 | 40 | 23 | 20 | |
| Кукуруза | –* | 80 | 0 | 59 | 40 | 42 |
| 1% АГ | 85 | 0 | 69 | 100 | 35 | |
| 0.1% АГ** | 80 | 0 | 75 | – | 55 | |
| 1% АГ** | 86 | 0 | 75 | 85 | – | |
– АГ значительно усиливал проникновение ТБК в семена рапса. Предварительная обработка дала лучший эффект, чем просто добавка АГ в суспензию. Концентрация АГ 0.1% работала не хуже, чем 1%;
– эффект АГ на проникновение ТБК в семена кукурузы был, но менее выраженный;
– обнаружено положительное влияние АГ на проникновение ИКП, ФА и ФМ-4.
Результаты анализа проникновения компонентов суспензии (препарат 2011 + антидоты) в присутствие ГК представлены в табл. 8. По результатам анализа данных сделаны следующие выводы:
Таблица 8.
Проникновение компонентов суспензии препарата 2011 в присутствии комплексанта ГК в семена рапса и кукурузы после проращивания в течение 3-х сут
| Культура | Комплексант | Проникновение компонентов, % | ||||
|---|---|---|---|---|---|---|
| ТБК | ТМТД | ИКП | ФА | ФМ-4 | ||
| Рапс | –* | 57 | 0 | 34 | 0 | 11 |
| 0.1% ГК | 85 | 0 | 68 | 12 | – | |
| 0.1% ГК** | 80 | 0 | 30 | 26 | 11 | |
| 1% ГК** | 85 | 0 | 30 | – | – | |
| Кукуруза | –* | 80 | 0 | 59 | 40 | 42 |
| 0.1% ГК | 80 | 0 | 60 | 50 | 36 | |
| 0.1% ГК** | 80 | 0 | 60 | 50 | – | |
| 1% ГК** | 80 | 0 | 60 | 50 | – | |
– ГК значительно усиливала проникновение ТБК в семена рапса. Предварительная обработка дала такой же эффект, как добавка ГК в суспензию. Концентрация ГК 0.1% работает не хуже, чем 1%;
– эффект ГК на проникновение ТБК в семена кукурузы отсутствовал;
– обнаружено положительное влияние ГК на проникновение ИКП и ФА в семена рапса, эффект на кукурузе отсутствовал.
Анализ влияния комплексантов (ГК и АГ) на проникновение компонентов из суспензии препарата 2111 с антидотами осуществляли с добавкой 1% АГ или 0.1% ГК с последующим исследованием проникновения по ранее описанной схеме. По результатам анализа обнаружено, что ни АГ, ни ГК не оказывали влияния на проникновение пестицидов в семена рапса и кукурузы. Полагаем, что отсутствие эффекта было связано с наличием органического растворителя циклогексанона (10%) в составе препарата 2111. В то же время влияние комплексантов было обнаружено для антидота ФА и антидота ФМ-4 на семенах кукурузы (рис. 2).
Рис. 2.
Содержание (мольная доля) антидотов ФА и ФМ-4 в экстрактах из семян рапса (а) и кукурузы (б), обработанных суспензией препарата 2111 с добавлением антидотов в отсутствие и в присутствии арабиногалактана (1%) и глицирризиновой кислоты (0.1%); погрешность измерений 20%.
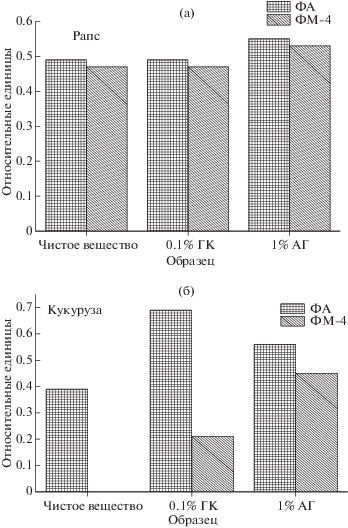
Анализ полученных результатов показал, что наибольшее влияние на прилипание действующих веществ оказывала добавка арабиногалактана. Общее количество вещества оценивали по суммарному содержанию (смывка с поверхности + + экстракт). Необходимо отметить, что ряд действующих веществ (ИМЗ, ПХР и антидот ФА) вообще не проникали в зерно в чистом виде. Однако они обнаружены в зерне в значительных количествах при протравливании суспензиями с добавкой ГК, АГ и Na-КМЦ. Причиной усиления проникающей способности компонентов протравителя в семена зерновых культур могут являться как установленная мембранотропная активность АГ и ГК [19–21], так и способность данных природных соединений усиливать растворимость малорастворимых органических веществ за счет образования т.н. комплексов включения [22–25].
Таким образом, глицирризиновая кислота (природный сапонин из корня солодки) и арабиногалактан (природный полисахарид из древесины лиственницы) в концентрации 0.1% могут быть использованы в качестве модифицирующих добавок в протравители семян зерновых культур для улучшения прилипания и проникновения действующих веществ.
ЗАКЛЮЧЕНИЕ
Разработаны препаративные формы комплексных протравителей в виде суспензионных и эмульсионных концентратов с содержанием в своем составе как фунгицидов так и антидотов. Препараты позволяют контролировать токсическое воздействие почвенных остатков гербицидов на рост и развитие кукурузы, рапса, сои и сахарной свеклы.
Биологические испытания этих составов показали, что их антидотная активность зависела как от типа препаративной формы, так и от природы антидота и нормы применения.
Измерения проникающей способности компонентов протравителя 2011 в семена рапса и кукурузы показали, что антидоты ФА и ФМ-4 эффективно (≈40%) проникают в семена кукурузы. Следов антидота ИДЭ в экстракте из семян кукурузы обнаружено не было. Проникновение антидотов в семена рапса составило 10 ± 2% для ФМ-4 и ИДЭ, и 0% – для ФА. Показано, что введение мембраномодифицирующих добавок в суспензию (полисахарида арабиногалактана и растительного сапонина глицирризина) в количестве 0.1–1% существенно усиливало проникновение действующих компонентов протравителя.
Список литературы
Gupta P.K. Pesticide Exposure // Ind. Sci. Toxicol. 2004. V. 198. P. 83–90.
Ware G.W., Whitacre D.M. The Pesticide Book. 6th Ed. Willoughby, Ohio (USA): Meister Media Worldwide, 2004. 526 p.
Спиридонов Ю.Я., Хохлов П.С., Шестаков В.Г. Антидоты гербицидов // Агрохимия. 2009. № 4. С. 81–91.
Захаренко В.А. Тенденции развития нанофитосанитарии в защите растений // Защита и карантин растений. 2009. № 5. С. 13–17.
Халиков С.С., Чкаников Н.Д., Спиридонов Ю.Я., Глинушкин А.П. Новый препарат для предпосевной обработки семян с комплексной защитой от болезней и остатков гербицидов в почве // Агрохимия. 2016. № 6. С. 39–45.
Голышин Н.М. Фунгициды. М.: Колос, 1993. 319 с.
Мельников Н.Н., Новожилов К.В., Белан С.Р. Справочник. Пестициды и регуляторы роста растений. М. Химия, 1995. 284 с.
Чкаников Д.И., Макеев А.М. Влияние антидота 1,8-нафталевого ангидрида на фитотоксичность и скорость метаболизма 2,4-дихлорфеноксиуксусной кислоты и хлорсульфурона в растениях // Физиология растений. 1991. Т. 38. Вып. 2. С. 290–297.
Mehrsheikh A. Synthesis of 13C- and 14C-labelled 3-(dichloroacetyl)-5-(2-furanyl)-2,2-dimethyloxazolidine // J. Labell. Comp. Radiopharm. 1996. V. 38. P. 631–636.
Cremonesi G., Croce P.D., Fontana F., Fiorelli C., La Rosa C. Stereoselective synthesis of β,ε-dihydroxy-α-amino acids by ring opening of 4,5-dihydroisoxazolyl derivatives // Tetrahedron: Asymmetry. 2008. № 19. P. 2850–2855.
Измерение концентраций изоксадифен-этила в воздухе рабочей зоны и смывах с кожных покровов операторов методом капиллярной газожидкостной хроматографии. Метод. указ-я. МУК 4.1.2406-08.
Власенко Н.Г., Бурлакова С.В., Халиков С.С., Федоровский О.Ю., Чкаников Н.Д. Флороксан как потенциальный компонент комплексных протравителей зерновых культур // Агрохимия. 2017. № 7. С. 49–54.
Халиков С.С., Теплякова О.И., Власенко Н.Г., Халиков М.С., Евсеенко В.И., Душкин А.В. Применение арабиногалактана для улучшения технологических и биологических свойств протравителей зерновых культур // Химия в интересах устойчивого развития. 2015. Т. 23. № 5. С. 591–599.
Халиков С.С., Голубев А.С., Чкаников Н.Д., Коротов Н.А., Спиридонов Ю.Я. Инновационные протравители с антидотным действием // Агрохимия. 2017. № 4. С. 22–25.
Спиридонов Ю. Я., Чичварина О. А., Сиган А.Л., Чкаников Н.Д., Халиков С.С. Особенность антидотного действия этилового эфира 5,5-дифенил 4,5-дигидро-изоксазол-3-карбоновой кислоты (изоксадифен-этила) в составе почвенного протравителя // Усп. совр. естествознания. 2018. № 10. С. 79–84.
Пат. РФ по заявке № 2017125487/04, A01N25/32, C07C 275/30 (2017) “Производное диарилмочевины (этиловый эфир 2-{4-[3-(4-хлорфенил)-1-метил-уреидо]-фенил}-2-гидрокси-3,3,3-трифторпропионовой кислоты) обладающее антидотной активностью по отношению к производным сульфонилмочевин на рапсе и кукурузе” // Решение о выдаче патента от 27.07.2018 г.
Selyutina O.Y., Apanasenko I.E., Khalikov S.S., Polyakov N.E. Natural poly- and oligosaccharides as novel delivery systems for plant protection compounds // J. Agric. Food Chem. 2017. V. 65(31). P. 6582–6587.
Селютина О.Ю., Халиков С.С., Поляков Н.Э. Сравнение проникновения компонентов протравителя методом ядерного магнитного резонанса // Агрохимия. 2017. № 4. С. 90–93.
Selyutina O.Y., Apanasenko I.E., Shilov A.G., Khalikov S.S., Polyakov N.E. Effect of natural polysaccharides and oligosaccharides on the permeability of cell membranes // Rus. Chem. Bul. 2017. V. 66 (1). P. 129–135.
Selyutina O.Y., Apanasenko I.E., Polyakov N.E. Membrane-modifying activity of glycyrrhizic acid // Rus. Chem. Bul. 2017. V. 64 (7). P. 1555–1559.
Selyutina O.Y., Apanasenko I.E., Kim A.V., Shelepova E.A., Khalikov S.S., Polyakov N.E. Spectroscopic and molecular dynamics characterization of glycyrrhizin membrane-modifying activity // Colloid. Surfaces. B. Biointerfac. 2016. V. 147. P. 459–466.
Apanasenko I.E., Selyutina O.Yu., Polyakov N.E., Suntsova L.P., Meteleva E.S., Dushkin A.V., Vachali P., Bernstein P.S. Solubilization and stabilization of macular carotenoids by water soluble oligosaccharides and polysaccharides // Arch. Biochem. Biophys. 2015. V. 572. P. 58–65.
Chistyachenko Y.S., Meteleva E.S., Pakharukova M.Y., Katokhin A.V., Khvostov M.V., Varlamova A.I., Glamazdin I.I., Khalikov S.S., Polyakov N.E., Arkhipov I.A., Tolstikova T.G., Mordvinov V.A., Dushkin A.V., Lya-khov N.Z. Physicochemical and pharmacological study of the newly synthesized complex of albendazole and polysaccharide arabinogalactan from larch wood // Curr. Drug. Delivery. 2015. V. 12. P. 477–490.
Polyakov N.E., Khan V.K., Taraban M.B., Leshina T.V. Complex of calcium receptor blocker nifedipine with glycyrrhizic acid // J. Phys. Chem. B. 2008. V. 112. P. 4435–4440.
Polyakov N.E., Leshina T.V., Salakhutdinov N.F., Kispert L.D. Host-guest complexes of carotenoids with beta-glycyrrhizic acid // J. Phys. Chem. B. 2006. V. 110. P. 6991–6998.
Дополнительные материалы отсутствуют.


