Агрохимия, 2019, № 6, стр. 18-26
ФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ ПОВЫШЕНИЯ ТОЛЕРАНТНОСТИ ВИНОГРАДА К КОРНЕВОЙ ФИЛЛОКСЕРЕ
Р. Э. Казахмедов *
Дагестанская селекционная опытная станция виноградарства и овощеводства –
филиал Северо-Кавказского федерального научного центра садоводства, виноградарства, виноделия
368601 Дербент, ул. Вавилова 9, Россия
* E-mail: kre_05@mail.ru
Поступила в редакцию 09.11.2018
После доработки 15.12.2018
Принята к публикации 11.03.2019
Аннотация
Для разработки физиологических основ и агроэкономически целесообразных способов применения физиологически активных соединений для увеличения срока эксплуатации корнесобственных насаждений винограда в зоне сплошного заражения филлоксерой на модельных растениях винограда сортов Агадаи (Vitis vinifera L., восприимчивый к корневой филлоксере), Первенец Магарача (Vitis vinifera L., толерантный, контроль), подвойный сорт Кобер 5ББ (Berlandieri × Riparia, устойчивый, эталон) изучали влияние физиологически активных соединений (ФАС) цитокининового (ФАС-1), ауксинового (ФАС-2) действия и трофического (ФАС-3) характера. При обработке листовой поверхности впервые на винограде выявлен морфофизиологический эффект применения ФАС, способствующий полному восстановлению корней при удалении всей корневой системы. Установлено, что исследованные препараты цитокининового и ауксинового действия обладали эффектом, который влиял на усиление развития и закладки новых элементов корневой системы. Заражение филлоксерой модельных растений значительно изменяло биохимический состав корней винограда, характер изменений зависел от биологических особенностей сортов. Общим для изученных сортов следует признать значительное снижение содержания аминокислот и повышение содержания углеводов и фенольных соединений в корнях. Устойчивый к корневой форме филлоксеры подвойный сорт Кобер 5ББ отличался очень высоким содержанием фенолкарбоновых кислот, а также углеводов и органических кислот в листьях. Толерантность (выносливость) сортов винограда к корневой филлоксере возможно следует объяснять тем, что (в отличие от устойчивых сортов) питание филлоксеры у них происходит на корнях, так же, как у восприимчивых сортов, однако биохимические особенности элементов корневой системы данных сортов и связанная с ними возможная высокая скорость синтетических процессов способствуют еще на ранних стадиях повреждения филлоксерой формированию защитного слоя перидермы, что препятствует проникновению патогенной микрофлоры в более глубокие слои тканей корневой системы. Результаты лабораторных и полевых исследований позволили заключить, что физиологические методы повышения толерантности к корневой форме филлоксеры при применении ФАС гормонального и трофического характера могут быть эффективными для увеличения срока эксплуатации корнесобственных насаждений винограда и рентабельности его производства.
ВВЕДЕНИЕ
Виноградная филлоксера (Dactylosphaera vitifoliae) – вид насекомых из семейства Phylloxeridae. Исходная область распространения – Северная Америка. В конце XIX века филлоксера была завезена в Европу, где ее появление нанесло серьезный ущерб виноградарству, поскольку европейские сорта винограда не были устойчивы к вредителю. Филлоксера вызвала одну из страшных катастроф в истории земледелия – уничтожила за 20–30 лет в XIX веке ~6 млн га виноградников [1, 2]. Несмотря на усилия по решению данной проблемы в течение продолжительного времени она остается актуальной [1, 3–8].
Известно, что переход на привитую культуру винограда также не решил проблему, т.к. выявились некоторые негативные последствия при эксплуатации привитых насаждений. Недостатки привитой культуры – высокая изреженность насаждений к началу плодоношения, подверженность кустов бактериальному раку и хлорозу, задержка созревания урожая, снижение качества виноматериалов, значительные материальные затраты для восстановления насаждений после экстремально низких температур – свидетельствуют, что проблема полностью не решена. Более того, отмечено появление в последние десятилетия более агрессивных биотипов филлоксеры [9, 10].
Полагаем, что привитое растение винограда, как система, состоящая из 2-х подсистем, менее устойчива, считаем, что система привитой культуры (подвой + привой) была вынужденной мерой, удовлетворявшей практику виноградарства на определенном (критическом) этапе исторического развития отрасли. Следовательно, привитая культура не панацея, а компромисс. Она никак не могла повысить устойчивость виноградного растения как единой биологической системы в целом, и в этом смысле корнесобственная культура винограда более адаптивна и целесообразна, но при условии генетической толерантности и физиологической иммунности генотипов, особенно в современных, меняющихся климатических условиях.
Сегодня известны различные методы борьбы и снижения вредоносности филлоксеры – истребительные, агротехнические, карантинные, селекционные. Однако главная цель заключается не в использовании термина “борьба” при разработке способов повышения продуктивности и срока эксплуатации зараженных филлоксерой насаждений винограда, а в ориентировании на “сосуществование винограда с филлоксерой” прежде всего потому, что специализация филлоксеры так глубока, и чтобы уничтожить вредителя, приходится вредить самому растению. Наш основной подход к решению проблемы был сформирован еще в 1880 г.: “цель … в установлении равновесия между новым развитием корневой системы растения и повреждениями, наносимыми филлоксерой, т.е. уничтожение достаточного количества вредителя с тем, чтобы корневая система процветала и давала бы вознаграждающую затраты продукцию” (цит. по [5]).
В этой связи полагаем, что разработка методов повышения физиологической устойчивости и способности растений винограда противостоять воздействию вредителя и соответственно сохранять продуктивность, качество урожая в условиях сплошного заражения им, также актуальна, экономически целесообразна и позволит повысить экологическую безопасность возделывания винограда.
Успехи физиологии растений в изучении гормональных особенностей растительного организма и биохимиков в синтезе новых отечественных, перспективных, экологически безопасных физиологически активных соединений открывают новые возможности для гормональной регуляции важнейших физиологических процессов в растениях, в т.ч. для повышения физиологического иммунитета к вредителям и болезням [11–14]. В последнее время также предлагают методы контроля численности филлоксеры и других насекомых-фитофагов с помощью энтомопатогенных грибов [7, 8]. Однако очень слабая устойчивость микробиологических препаратов к ультрафиолетовому облучению ставит под сомнение эффективность их использования и будет ограничивать их применение на виноградниках. Кроме того, данные препараты не зарегистрированы на территории Российской Федерации. В то же время следует признать перспективность их применения как дополнение к физиологическим методам борьбы с филлоксерой.
На основе анализа литературных источников и собственных экспериментальных исследований (1987–2012 гг.), были выделены перспективные физиологически активные соединения гормональной природы и трофического характера для решения данной проблемы. Изучено их влияние на развитие корневой системы корнесобственных модельных растений в лабораторных, вегетационных опытах и на агробиологические показатели угнетенных филлоксерой, корнесобственных плодоносящих растений в полевых опытах при обработке этими препаратами листовой поверхности вегетирующих растений [15–20]. Установлено, что обработка листовой поверхности растений винограда растворами физиологически активных соединений (ФАС) оказывала морфофизиологический эффект на элементы корневой системы [18], способствовала изменению биохимического состава корней [20].
Результаты исследований, направленных на изучение физиологических, биохимических и гормональных реакций растений винограда и защитных механизмов в ответ на заражение филлоксерой [21–27] фрагментарны, не позволяют иметь целостное представление о явлении, а работы, раскрывающие возможность экзогенного контроля этих процессов (в т.ч. гормонального и трофического) для повышения физиологической устойчивости к корневой форме филлоксеры, отсутствуют.
Цель работы – разработка физиологических основ и агроэкономически целесообразных способов применения ФАС для увеличения срока эксплуатации корнесобственных насаждений винограда в зоне сплошного заражения филлоксерой.
МЕТОДИКА ИССЛЕДОВАНИЯ
На экспериментально-производственной базе ДСОСВиО (филиала СКФНЦСВВ) исследование проводили в лабораторных, вегетационных и полевых опытах [26, 28, 29]. На всех опытных участках применяли все необходимые агротехнические и защитные мероприятия от болезней и вредителей (кроме филлоксеры) согласно принятому плану их проведения на станции. Лабораторные исследования выполняли на базе лаборатории биотехнологии, физиологии и агротехники винограда ДСОСВиО и ЦКП “Приборно-аналитический” СКФНЦСВВ. Определяли морфо-анатомические, биохимические, гормональные особенности корневой системы опытных растений под влиянием ФАС. Полевые исследования проводили на экспериментальной базе ДСОСВиО. Математическую обработку данных осуществляли по [29] с применением программ Exsel и Straz.
Объект исследования – модельные растения винограда сортов Агадаи (Vitis vinifera L., восприимчивый к корневой филлоксере), Первенец Магарача (Vitis vinifera L., толерантный, контроль), подвойный сорт Кобер 5ББ (Berlandieri × Riparia, устойчивый, эталон). Изучали влияние ФАС цитокининового (ФАС-1), ауксинового (ФАС-2) действия и трофического (ФАС-3) характера. Состав и регламенты применения всех ФАС являются интеллектуальной собственностью автора, находятся на стадии патентования и в настоящей работе не обсуждаются. Модельные растения (рис. 1) получали в лабораторных условиях укоренением 3–4-глазковых черенков в воде без применения ауксинов. При достижении растениями длины побегов 20–25 см и формировании 3–4-х зрелых листьев производили предварительную выборку опытных растений по однородности морфологического развития и наличия у растений развитых полярных органов – верхушки побега и корневой системы. За 1–2 сут до некорневой обработки раствором ФАС модельные растения высаживали в предварительно подготовленный и обеззараженный песок для прохождения адаптации. Ослабленные после перемещения в песок модельные растения удаляли. Перед высадкой модельных растений в песок производили измерение количества и длины корней каждого модельного растения, их этикетирование с присвоением номера. Корневую систему у растений удаляли. Повторность трехкратная (по 30 растений). Некорневую обработку листовой поверхности опытных растений производили опрыскиванием один раз, не допуская стекания раствора ФАС в песок. Опытные модельные растения выращивали на песке с внесением NPK (НФК 2 г/л при поливе через 1 сут при норме расхода 100 мл/сосуд). На 30-е сут после начала опыта определяли количество, длину, соотношение корней.
Рис. 1.
Модельные корнесобственные растения винограда, полученные в лабораторных условиях укоренением 3–4-глазковых черенков в воде без применения ауксинов до (а) и после (б) удаления корней.

Для определения содержания эндогенных биологически активных веществ (БАВ) модельные растения высаживали на опытный участок. Заражение филлоксерой проводили дважды: в 3-й декаде июля и августа путем внесения под растения в рядах, поочередно с разных сторон, сильно зараженных галлами молодых листьев растений сорта Бианка, возделываемых без защиты от листовой филлоксеры. Анализ содержания БАВ в лаборатории ЦКП “Приборно-аналитический” СКФНЦСВВ производили в 1-й декаде сентября в образцах живого растительного материала.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Предполагали, что экзогенное влияние гормональных и трофических факторов на стволовые клетки корневой системы с непрерывным ростом (в т.ч. винограда) позволит воздействовать на их деление, рост, активность, что могло способствовать разрастанию и закладке новых элементов корневой системы особенно в неблагоприятных стрессовых условиях, в т.ч. после повреждения корневой филлоксерой.
На основании результатов лабораторных исследований и вегетационных опытов впервые на винограде выявлен морфофизиологический эффект применения ФАС гормонального действия в виде некорневой подкормки вегетирующих растений, способствовавший полному восстановлению корней при удалении всей корневой системы (рис. 2а, б). Побеги модельных растений с удаленной корневой системой теряли тургор на 3-и сут опыта, на 5-е сут листья теряли хлорофилл и начинали опадать, к 10-м сут полностью высыхали. Иное отмечали при обработке листьев растворами ФАС. Модельные растения, обработанные растворами ФАС, несмотря на некоторое пожелтение листьев, сохраняли тургор в первые сутки после обработки и точку роста побега, а начиная с 15-х сут восстанавливали рост. Положительное действие цитокининового препарата ФАС-1 на физиологическое состояние модельных растений было более выражено, чем препарата ауксинового действия ФАС-2.
Рис. 2.
Количество и длина корней модельных растений винограда сорта Агадаи, обработанных растворами ФАС-1 и ФАС-2 после предварительного полного удаления корневой системы (а) и вид корневой системы обработанных (ФАС-1, ФАС-2) и необработанных (контроль) модельных растений с предварительно удаленной корневой системой (б) на 30-е сут после применения ФАС.
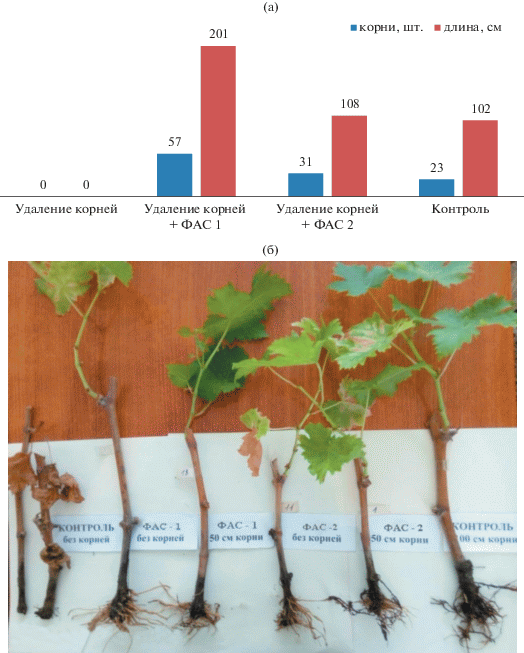
Анализ развития корневой системы через 30 сут после закладки опыта показал, что обработка препаратом ФАС-1 листовой поверхности модельных растений с удаленной корневой системой способствовала дополнительной закладке и формированию новых корней, при этом их количество превышало число корней модельных растений контрольного варианта (без удаления корней) почти в 2 раза. Влияние препарата ФАС-1 на формирование новых корней и процесс регенерации корневой системы также было выражено сильнее, чем препарата ФАС-2.
Таким образом, исследование подтвердило результаты ранее проведенных исследований [24] о том, что препараты ФАС-1 и ФАС-2 обладают эффектом, который выражается в их морфофизиологическом влиянии на развитие корневой системы при обработке листовой поверхности вегетирующих растений.
Исследование показало, что совместное применение ФАС цитокининового, ауксинового и трофического действия оказывало синергическое влияние на формирование корневой системы и выражалось в значительном увеличении числа формирующихся корней и их длины (табл. 1). Важно отметить, что при этом усиливалось развитие боковых корней, что могло повысить адаптивность винограда к стрессовым условиям, в т.ч. при заражении и угнетении корневой филлоксерой.
Таблица 1.
Влияние ФАС на формирование корней винограда сорта Первенец Магарача
| Вариант | Количество корней, шт. | Длина корней, см | ||
|---|---|---|---|---|
| всего | боковые | всего | боковые | |
| Контроль без обработки | 32 | 7 | 302 | 29 |
| ФАС (1 + 2 + 3) | 115 | 37 | 1480 | 797 |
Учитывая также, что развитие корневой системы и стебля растения взаимосвязаны и регулируются его гормональной системой через взаимоотношения и взаимодействия органов, исследовали реакцию растений на применение перспективных ФАС в зависимости от степени развития корней и побегов и их соотношения.
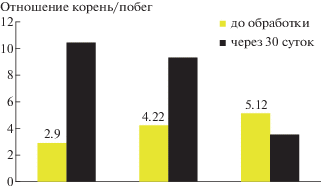
Установлено, что положительное влияние ФАС гормонального действия, в частности, ФАС-1 цитокининовой природы, было тем сильнее выражено, чем было меньше соотношение длины корень : побег вегетирующих модельных растений (рис. 3). Этот факт имел важное практическое значение, т.к. свидетельствовал о перспективности применения ФАС на растениях с поврежденной филлоксерой корневой системой, а также о возможности профилактических обработок плодоносящих растений винограда на фоне филлоксеры при первых признаках угнетения вегетативного роста растений.
Рис. 3.
Соотношение длины корень : побег модельных корнесобственных растений винограда сорта Агадаи до обработки и на 30-е сут после обработки цитокининовым препаратом ФАС-1.
Была выдвинута гипотеза, что гормональные и биохимические особенности корневой системы устойчивых к корневой форме филлоксеры сортов винограда позволяют тканям их корней после повреждения филлоксерой формировать защитный слой из опробковевших клеток, который является барьером для патогенной микрофлоры почвы, которая является основной причиной гниения и отмирания корней [26]. Также отмечено, что количество моно- и дисахаров в корнях винограда вторичного строения находится в обратной корреляционной связи с устойчивостью и является фактором, обусловливающим энергетический обмен и интенсивность развития филлоксеры, и может служить показателем восприимчивости видов, сортов и форм к данному вредителю. Согласно фенольной теории филлоксероустойчивости винограда (Я.И. Принц, А.В. Благовещенский), филлоксера не может питаться на сортах, содержащих много фенолов, т.к. у нее в этих условиях происходит инактивация протеолитического фермента слюны. Исследования [21] показали, что фенолов было больше всего в растениях самого неустойчивого к филлоксере сорта Саперави.
В этой связи была изучена принципиальная возможность влияния на развитие корневой системы винограда методом физиологического (гормонального) воздействия через листовую поверхность побегов винограда, и создания таким образом о соотношения гормонов и БАВ в элементах корневой системы, характерного устойчивым к корневой форме филлоксеры сортам винограда. В вегетационном опыте было изучено содержание фитогормонов и биологически активных веществ в корневой системе различавшихся по устойчивости к корневой филлоксере сортов на фоне искусственного заражения филлоксерой и обработке раствором ФАС. Установлено, что чем устойчивее сорт к корневой форме филлоксеры, тем больше было содержание аминокислот и меньше содержание углеводов и фенолкарбоновых кислот в элементах корневой системы растений. Предположили, что биохимическая основа толерантности (сорт Первенец Магарача) и устойчивости (сорт Кобер 5 ББ) винограда к филлоксере имеет различную природу. Результаты изучения содержания БАВ в контрольных вариантах изученных сортов в настоящем исследовании подтвердили данную гипотезу (табл. 2).
Таблица 2.
Биохимический состав листьев и корней винограда
| Сорт | Вариант | Листья | Корни | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Аминокислоты, мг/кг | Органические кислоты, г/дм3 | Фенолкарбоновые кислоты, мг/кг | Углеводы, г/кг | ИУК, мг/кг | АБК, мг/кг | Аминокислоты, мг/кг | Углеводы, г/кг | Фенолкарбоновые кислоты мг/кг | ||
| Агадаи | Контроль без обработки | 330 | 12.4 | 756 | 38.7 | 5.3 | 5.0 | 42.1 | 1.91 | 38.4 |
| ФАС | – | – | – | – | 6.6 | 1.2 | 48.9 | 0.88 | 9.2 | |
| Филлоксера | – | – | – | – | 2.1 | 2.8 | 5.6 | 18.7 | 90.6 | |
| Филлоксера + ФАС | – | – | – | – | 4.1 | 1.0 | 20.8 | 15.4 | 91.0 | |
| Первенец Магарача | Контроль без обработки | 389 | 14.1 | 1630 | 59.2 | 9.3 | 5.0 | 525 | 0.91 | 21.9 |
| Филлоксера | 15.4 | 6.7 | 86.3 | 1.77 | 61.4 | |||||
| Кобер 5ББ | Эталон | 121 | 17.1 | 5190 | 69.6 | 8.2 | 3.8 | 19.8 | 1.03 | 15.2 |
Таблица 3.
Продуктивность молодых корнесобственных растений сорта Агадаи, зараженных филлоксерой (4-й год вегетации)
| Вариант | Число гроздей, шт. | Масса грозди, г | Урожай, кг/куст | Массовая концентрация сахаров, г/дм3 | Прирост куста, см |
|---|---|---|---|---|---|
| Контроль без обработки | 0 | – | – | – | 227 |
| ФАС (1 + 2 + 3) | 19.5 | 256 | 5.0 | 193 | 529 |
| Эталон сорт Первенец Магарача | 15.7 | 272 | 4.3 | 206 | 1780 |
Показано, что заражение филлоксерой модельных растений значительно изменяло биохимический состав корней винограда, а характер изменений зависел от биологических особенностей сорта. В частности, у восприимчивого сорта Агадаи снижалось содержание ИУК, АБК (почти в 2 раза), аминокислот (в 7 раз) и значительно повышалось содержание углеводов (в 9 раз) и фенольных соединений (в 2.3 раза). Значительное снижение содержания аминокислот (в 6 раз) у толерантного сорта Первенец Магарача наблюдали на фоне существенного повышения содержания ИУК (почти в 3 раза), фенольных соединений (в 3 раза), а также умеренного повышения содержания углеводов (почти в 2 раза) и АБК (на 34%). Однако общим для изученных сортов следует признать значительное снижение содержания аминокислот и повышение содержания углеводов и фенольных соединений на фоне заражения филлоксерой. Особо следует отметить, что обработка ФАС на фоне филлоксеры способствовала повышению содержания аминокислот в корневой системе восприимчивого сорта Агадаи в 3.7 раза, что нам кажется важным, за счет увеличения именно тех аминокислот (пролина, треонина, серина, аланина), которые в большем количестве были представлены у толерантного сорта Первенец Магарача.
Представляло значительный теоретический интерес определение содержания БАВ в листьях сортов винограда, различающихся по устойчивости к корневой и листовой формам филлоксеры. В литературе отмечено, что в период цветения контрастно проявляется зависимость: чем устойчивее растение к филлоксере и патогенной микрофлоре, тем больше содержание легкорастворимых белков в листьях [30]. Также предполагается, что чем больше развивается галлов и сильнее заражение листьев, тем выше устойчивость корней к корневой филлоксере. В настоящем исследовании установлено, что устойчивый к корневой форме филлоксеры подвойный сорт Кобер 5ББ отличался очень высоким содержанием фенолкарбоновых кислот, а также углеводов и органических кислот и более низким содержанием аминокислот в листьях, чем восприимчивый и толерантный сорта. Поэтому не представилось возможным сделать однозначный вывод о роли аминокислот и белковых соединений в устойчивости к филлоксере. Однако можно предположить, что устойчивость подвойного сорта Кобер 5 ББ к корневой филлоксере определялась не устойчивостью к вредителю непосредственно корневой системы в силу каких-либо причин, в том числе и биохимических, а предпочтением паразита преимущественно питаться на листьях, богатых пластическими веществами первичного синтеза. В то же время суммарное содержание аминокислот в корнях толерантного сорта было значительно больше, чем восприимчивого и устойчивого сортов.
В этой связи считаем важным отметить, что содержание БАВ в листьях и корнях изученных сортов винограда имело противоположную тенденцию: чем устойчивее сорт к корневой филлоксере, тем больше было содержание БАВ первичного синтеза в листьях и наоборот.
Результаты лабораторных и вегетационных опытов были апробированы на корнесобственных молодых и угнетенных филлоксерой растениях восприимчивого сорта Агадаи. Показано, что обработка листовой поверхности вегетирующих растений раствором ФАС позволила молодым корнесобственным растениям достичь начала плодоношения на 4-й год вегетации на фоне филлоксеры, когда как без применения ФАС растения контрольного варианта не вступали в плодоношение (табл. 3).
Также было показано, что обработка растворами ФАС угнетенных филлоксерой плодоносящих растений усиливала вегетативный рост и повышала урожай ягод с куста почти в 2 раза (рис. 4). Это может восстановить зараженные и угнетенные филлоксерой плодоносящие корнесобственные насаждения винограда.
ЗАКЛЮЧЕНИЕ
Таким образом, обработка листовой поверхности вегетирующих растений винограда физиологически активными соединениями цитокининового и ауксинового действия оказывала влияние на развитие корней, усиливала закладку и развитие новых элементов корневой системы, изменяла их биохимический состав. Указанные морфофизиологический и биохимический эффекты предполагают возможность повышения толерантности винограда к корневой филлоксере.
Устойчивость сортов винограда, в т.ч. подвойных, близкая к абсолютной, возможно, объясняется предпочтением паразита преимущественно питаться на богатых продуктами фотосинтеза листьях, практически не повреждая корневую систему, и, следовательно, не создавая возможность патогенным микроорганизмам почвы проникать в ткани корней и индуцировать процесс гниения. Толерантность (выносливость) винограда к корневой форме филлоксеры можно объяснять тем, что (в отличие от устойчивых сортов), питание филлоксеры у них происходит на корнях, так же, как у восприимчивых сортов, однако биохимические особенности элементов корневой системы данных сортов и связанная с ними возможная высокая скорость синтетических процессов, способствуют еще на ранних стадиях повреждения филлоксерой формированию защитного слоя перидермы, что не допускает проникновения патогенной микрофлоры в более глубокие ткани элементов корневой системы. Именно эти явления, вероятно, позволяют толерантным сортам противостоять гниению корней и выдерживать корневую филлоксеру в полевых условиях.
Усиление вегетативного роста, повышение урожая корнесобственных растений винограда, угнетенных филлоксерой, достижение начала плодоношения молодыми корнесобственными растениями винограда на фоне раннего заражения филлоксерой при обработке листовой поверхности растений растворами ФАС гормонального и трофического действия, а также результаты лабораторных исследований позволили заключить, что физиологические методы повышения толерантности к корневой форме филлоксеры могут служить эффективным средством увеличения срока эксплуатации корнесобственных насаждений винограда и рентабельности его производства.
Список литературы
Кискин П.Х. Филлоксера. Кишинев, 1977. 204 с.
Campbell C. Phylloxera: How wine was saved for the world. L.: HarperCollins Publishers, 2004. 256 p.
Топалэ Ш.Г., Даду К.Я. Филлоксера – проблема мирового виноградарства // Виноделие и виноградарство. 2007. № 5. С. 15–18.
Nora C., Lawo A., Georg J.F., Weingart B., Schuhmacher R., Fornecka A. The volatile metabolome of grapevine roots: First insights into the metabolic response upon phylloxera attack // Plant Physiol. Biochem. 2011. V. 49. P. 1059–1063.
Далмассо М. Борьба с филлоксерой в Европе // Филлоксера (сб. перевод. зарубеж. работ). Кишинев, 1959. С. 5–41.
Иванова А.Н., Ивахненко Т.З. Эффективность регуляторов роста и их смесей в борьбе с филлоксерой в условиях винсовхоза “Бештау” // Науч. тр. Ставропол. СХИ. 1982. Т. 3. Вып. 45. С. 3−7.
Штерншис М.В., Малярчук А.А., Гулий В.В. Изучение энтомопатогенного гриба M. anisopliae как биологического ресурса для биоконтроля насекомых-фитофагов // Вестн. Томск. гос. ун-та. 2008. № 313. С. 232–236.
Kirchmair M., Huber L., Porten M., Rainer J., Strasser H. Metarhizium anisopliae apotennial agent for the control of grape philloxsera // Biokontrol. 2004. V. 49. № 3. C. 295–303.
Granett J., Timper P., Lider L.A. Grape phylloxera (Daktulosphaira vitifoliae) (Homoptera: Phylloxeridae) biotypes in California // J. Econ. Entomol. 1985. V. 78. P. 1463–1467.
Forneck A., Walker M.A., Blaich R. Ecological and genetic aspects of grape phylloxera Daktulosphaira vitifoliae (Hemiptera: Phylloxeridae) performance on rootstock hosts // Biol. Entomol. Res. 2001. V. 91. P. 445–451.
Дерфлинг К. Гормоны растений. Системный подход. М.: Мир, 1985. 303 с.
Полевой В.В. Физиология растений. М.: Высш. шк., 1989. 464 с.
Зубкова Н.Ф. Цитодеф – регулятор роста растений цитокининового действия // Тез. докл. VI Международ. конф. “Регуляторы роста и развития в биотехнологиях”. М., 2001. С. 94.
Жирмунская Н.М., Приходько Н.В., Овсянникова Т.В., Шаповалов А.А. Новый регулятор роста этамон – стимулятор роста корневой системы // Агрохимия. 1991. № 11. С. 98–105.
Казахмедов Р.Э., Агаханов А.Х., Халифатов М.С., Ремиханова Т.Ф. Регуляторы роста на виноградниках Дагестана // Виноделие и виноградарство. 2008. № 3. С. 44–45.
Казахмедов Р.Э. Физиологические основы применения регуляторов роста на семенных сортах винограда Vitis vinifera L. // Виноделие и виноградарство. 2013. № 2. С. 36–37.
Казахмедов Р.Э.,Тагирбекова Э.А. Филлоксера и физиологически активные соединения: от идеи к результатам // Плодоводство и виноградарство Юга России. 2013. № 22(4). С. 122–126.
Казахмедов Р.Э., Шихсефиев А.Т. Влияние физиологически активных соединений на развитие элементов корневой системы модельных растений винограда // Проблемы развития АПК региона. 2015. № 3. С. 40–43.
Казахмедов Р.Э. Физиологические методы повышения устойчивости винограда к филлоксере // Виноделие и виноградарство. 2015. № 2. С. 48–51.
Казахмедов Р.Э., Шихсефиев А.Т. Биохимическая основа толерантности винограда и гормональная регуляция физиологической устойчивости к филлоксере // Проблемы развития АПК региона. 2016. № 4. С. 22–25.
Зотов В.В. Особенности биохимических процессов в корнях винограда, пораженных филлоксерой // Биохимия плодов и овощей. Иммунитет и покой картофеля, плодов и овощей. М.: Наука, 1964. С. 118–129.
Schaefer H. Metabolite differences between Phylloxera root galls and healthy grapevine roots // Wein Wissenschaft. 1985. V. 40. P. 219–227.
Kellow A.V., Sedgley M., Van Heeswijck R. Interaction between Vitis vinifera and grape phylloxera: changes in root tissue during nodosity formation // Ann. Bot. London. 2004. V. 93. P. 581–590.
Hofmann J., El Ashry A.E.N., Anwar S., Erban A., Kopka J., Grundler F. Metabolic reveals local and systemic responses of host plants to nematode parasitism // Plant J. 2010. V. 62. P. 1058–1071.
Du Y.-P., Zheng Q.-L., Zhai H., Jiang E.-S., Wang Z.-Y. Selectivity of Phylloxera viticola Fitch (Homoptera: Phylloxeridae) to grape with different resistance and the identification of grape root volatiles // Acta. Entomol. Sinica. 2009. V. 52. P. 537–543.
Недов П.Н. Иммунитет винограда к филлоксере и возбудителям гниения корней // Кишинев: Штиинца, 1977. 171 с.
Денисова Т.В. Биохимическая характеристика филлоксероустойчивости винограда: Aвтореф. дис. … канд. биол. наук. М., 1965. 25 с.
Простосердов Н.Н. Технологическая характеристика винограда и продуктов его переработки: Увология // Ампелография СССР. М., 1946. Т. 1. С. 401–468.
Доспехов Б.А. Методика полевого опыта. М.: Агропромиздат, 1985. 351 с.
Рудышин С.В. Легкорастворимые белки листьев винограда в связи с фазами вегетации и устойчивостью к филлоксере: Автореф. дис. … канд. биол. наук. Ялта, 1983. 20 с.
Дополнительные материалы отсутствуют.



