Агрохимия, 2019, № 8, стр. 52-59
ВЛИЯНИЕ ЗАСОЛЕНИЯ НА РОСТ И ГОРМОНАЛЬНЫЙ СТАТУС КОРНЕЙ ПРОРОСТКОВ ЯЧМЕНЯ И РИСА
А. Р. Лубянова 1, М. В. Безрукова 1, Ф. М. Шакирова 1, *
1 Институт биохимии и генетики УФИЦ РАН
450054 Уфа, просп. Октября, 71, лит. 1е, Россия
* E-mail: shakirova@anrb.ru
Поступила в редакцию 22.08.2018
После доработки 29.10.2018
Принята к публикации 13.05.2019
Аннотация
Исследовали влияние обработки 28 нМ агглютинином зародыша пшеницы (АЗП) в течение 24 ч на гормональный баланс и митотическую активность клеток корней проростков ячменя и риса в условиях 2%-ного натрий-хлоридного засоления и в пост-стрессовый период. Предобработка АЗП до воздействия засоления вызывала накопление ИУК, цитокининов, уменьшала уровень АБК, оказывала защитное действие на деление меристематических клеток корней проростков ячменя и риса. Обработка АЗП после воздействия стресса вызывала увеличение содержания ИУК и цитокининов, а также ускоряла репарацию роста клеток корней проростков ячменя и риса.
ВВЕДЕНИЕ
Глобальное потепление и опустынивание приводит к увеличению засоления пахотных земель. На сегодняшний день по всему миру насчитывается ≈7% засоленных почв. Стрессовые факторы среды, включая засоление, существенно тормозят рост растений, а также снижают продуктивность и качество сельскохозяйственной продукции. На сегодняшний день актуальны исследования защитных стратегий таких важных для продовольственной безопасности растений, как пшеница, рис, ячмень. В регуляции стресс-устойчивости растений на молекулярном уровне участвуют геном, транскриптом, протеом и метаболом [1]. Многие растительные белки, в том числе рецепторы фитогормонов, нуждаются в гликозилировании для правильного процесса сворачивания полипептидной цепи в определенную пространственную структуру (фолдинга) и их эффективного функционирования [2]. В то же время в растениях присутствуют лектины – белки, способные специфично, нековалентно и обратимо взаимодействовать с углеводами [3]. Лектины выполняют широкий спектр разнообразных функций в растениях, в том числе вовлекаются в регуляцию стресс-устойчивости [4–10].
Известно, что лектины злаков характеризуются гомологией до 90%. Агглютинин зародыша пшеницы (АЗП) – белковый димер с молекулярной массой 36 000 Да, состоящий из 2-х идентичных нековалентно связанных субъединиц с молекулярной массой 18 000 Да. Интересно, что АЗП, а также лектины ячменя и овса обладают специфичностью к N-ацетил-D-глюкозамину, имеют одинаковую субъединичную структуру и молекулярную массу и иммунологически неотличимы от АЗП, что и позволяет рассматривать АЗП в качестве типичного представителя лектинов злаков [3, 4, 11]. В то же время лектин риса, сходный по молекулярной массе и аминокислотному составу с другими лектинами семейства злаковых, отличается от них субъединичной структурой [3]. Лектин риса, 90% субъединиц которого проявляются в виде двух полипептидов – 8000 и 10 000 Да, имеет сходство с АЗП по углеводсвязывающей специфичности, при этом степень иммунологического сродства у лектина риса меньше, чем такового у лектина ячменя [3, 11].
Биотические и абиотические стрессовые факторы вызывают в вегетирующих растениях пшеницы обратимое накопление АЗП, которому предшествует увеличение содержания АБК [12, 13]. АЗП не только является активным участником АБК-контролируемых реакций растений пшеницы в ответ на стрессовые воздействия, но и экскретируется в область апикальной меристемы корней [12, 14]. Выделившийся наружу АЗП может способствовать сохранению митотического потенциала корневых клеток при стрессе и возобновлению интенсивного деления клеток апикальной меристемы корней в пост-стрессовый период. Действительно, полученные данные свидетельствуют об эффективности обработки АЗП в снижении уровня повреждающего действия на митотическую активность апикальной меристемы корней в условиях засоления, гипотермии, присутствия ацетата кадмия [4, 13–15]. Обнаружено, что стресс-индуцированное увеличение содержания АЗП и экскреция данного лектина из корней в наружную среду может предохранять ризосферу растений пшеницы, ослабленных вследствие воздействий стрессовых факторов, от возможной почвенной инфекции, а также привлекать к корневой системе полезные бактерии, продуцирующие ростстимулирующие гормоны или индуцирующие их накопление в растениях [16, 17]. Известно, что АЗП относится к характерным белкам пшеницы в ходе всего онтогенеза, в связи с чем, неудивительно, что в различных тканях как семян, так и интактных растений, обнаруживается пул запасных лектиновых мРНК и предшественников АЗП [18]. Другие фитолектины, в частности, конканавалин А и фитогемагглютинин, выделенные из растений Canavalia ensiformis (L.) DC. и Phaseolus vulgaris L. соответственно, также характеризуются митогенной активностью [19, 20].
Высокая гомология лектинов у эволюционно близких пшенице видов злаков, таких как ячмень и рис [3], позволила предположить, что АЗП способен проявлять защитный эффект на деление клеток корней не только пшеницы [13], но и близких ей видов злаков, а именно, риса и ячменя, лектины которых, как выше было упомянуто, характеризуются гомологией с АЗП.
Цель работы – исследование влияния экзогенной обработки АЗП на гормональный статус и деление клеток апикальной меристемы корней проростков риса и ячменя, подвергнутых натрий-хлоридному засолению.
МЕТОДИКА ИССЛЕДОВАНИЯ
В качестве объекта использовали проростки ячменя Hordeum vulgare L. сорта Первенец и риса Oryza sativa L. сорта Новатор. Для этого семена ячменя после стерилизации 96%-ным этанолом проращивали 3-е сут в кюветах на фильтровальной бумаге, смоченной водопроводной водой, при 21–23°С, 16-часовом фотопериоде и освещенности 270 мкМ/(м2 с) ФАР. Семена риса предварительно 2 ч выдерживали в горячей воде при 55°С, после чего проращивали их в течение 4-х сут, полностью затопив семена водой.
С целью исследования защитного эффекта АЗП на растения ячменя и риса, подвергнутых засолению, использовали две постановки опытов: 1–3-суточные проростки ячменя или 2–4-суточные проростки риса, изолированные от эндосперма, перекладывали корнями на раствор 2%-ной сахарозы в присутствии или отсутствие 28 нМ АЗП на 24 ч, после чего растения переносили на 7 ч на смесь 2%-ной сахарозы и 2%-ного NaCl, затем после отмывки от соли 4–5-суточные проростки ячменя и риса переносили на раствор 2%-ной сахарозы еще на 24 ч; 2–4-суточные проростки ячменя и 5-суточные проростки риса перекладывали корнями на смесь 2%-ного NaCl и 2%-ной сахарозы на 7 ч, после отмывки корней от соли проростки на 24 ч перекладывали на раствор, содержащий 28 нМ АЗП, приготовленный на 2%-ной сахарозе, после чего 5-суточные проростки ячменя и 6-суточные проростки риса перекладывали на раствор 2%-ной сахарозы еще на 24 ч.
Для подсчета митотического индекса (МИ) апикальную часть корней проростков вместе с корневым чехликом фиксировали в смеси уксусной кислоты с этанолом (в соотношении объем : объем = 1 : 3) в течение 1.5 ч. После фиксации растительный материал отмывали водопроводной водой и обрабатывали в течение 1 ч смесью 5%-ной пектиназы (EC 3.2.1.15) (ICN, USA) и 5%-ной целлюлазы (EC 3.2.1.4) (ICN, USA) при 37°С. Каждый вариант 3–5 независимых опытов содержал не менее 40 проростков. Давленые препараты окрашивали ацетокармином, приготовленном на 45%-ной уксусной кислоте. Используя микроскоп AxioImager M1 (“Carl Zeiss”, Германия), оснащенный объективом N-Achroplan 63×/0.85 M27, подсчитывали МИ клеток апикальной корневой меристемы как сумму клеток апикальной корневой меристемы в стадии профазы, метафазы, анафазы и телофазы, выраженную в доле (%) от общего числа подсчитанных клеток [14], анализируя по 5000 клеток в каждом варианте. Документацию изображения осуществляли с использованием микроскопической цветной камеры AxioCam HSс и программного обеспечения Axio Vision 4.7 для управления камерой и микроскопом (“Carl Zeiss”).
Концентрацию свободных форм ИУК, АБК и цитокининов определяли методом иммуноанализа. Для этого навеску, состоящую из 10–15 проростков, растирали в жидком азоте и экстрагировали фитогормоны 80%-ным этанолом 16 ч при 4°С. После центрифугирования в течение 10 мин при 18 000 g супернатант упаривали в токе воздуха до водного остатка, в аликвоте которого определяли суммарное содержание иммунореактивных к анти-зеатинрибозидной сыворотке форм цитокининов. Из оставшегося водного остатка экстрагировали серным эфиром индолилуксусную и абсцизовую кислоты, метилировали их диазометаном и после упаривания сухой остаток растворяли в 80%-ном этаноле, в аликвоте которого определяли количество ИУК и АБК. Последовательность ступеней иммуноанализа фитогормонов описана ранее [21].
Результаты обрабатывали статистически, используя стандартное отклонение и t-тест. Разницу считали достоверной при P ≤ 0.05. На рисунках представлены средние арифметические 3–4-х независимых опытов, каждый из которых проведен в 2–3-х биологических повторностях, и стандартные ошибки средних величин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
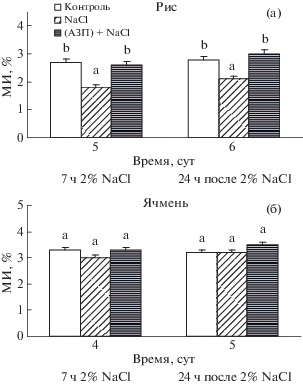
Ранее нами было выявлено, что обработка 28 нМ АЗП в течение 1 сут вызывает транзиторное накопление АБК, ИУК и цитокининов и активацию деления клеток апикальной меристемы корней риса и ячменя [22]. В настоящей работе провели анализ влияния защитного эффекта экзогенного АЗП на гормональный статус и рост клеток корней риса и ячменя делением в условиях засоления (рис. 1). Показано, что воздействие 2%-ным NaCl в течение 7 ч вызвало торможение ростовых процессов в большей степени у риса в сравнении с ячменем. Например, МИ в корнях растений риса при действии хлорида натрия снизился на 30, ячменя – на 10%, что вполне закономерно, поскольку ячмень более устойчив к засолению, чем рис [23]. В то же время предобработка АЗП проростков риса и ячменя предотвратила повреждающее действие засоления на деление клеток апикальной меристемы корней. МИ клеток корней этих растений в условиях стресса оставался на уровне контроля, а в проростках ячменя 1 сут спустя после удаления соли из среды даже несколько превышал его (рис. 1б). Таким образом, предобработка АЗП проростков исследованных культур оказывала защитный эффект на митотическую активность клеток апикальной меристемы корней в условиях засоления, сопоставимый с таковым для растений пшеницы [13], что в свою очередь позволило предполагать наличие не только у АЗП, но и лектинов ячменя и риса свойств регуляторов роста.
Рис. 1.
Эффект предобработки АЗП на МИ проростков риса (а) и ячменя (б) при 7-часовом засолении и через 1 сут после воздействия 2%-ным NaCl. Представлены средние и их стандартные отклонения. Достоверно различающиеся между собой величины каждого показателя (при Р ≤ 0.05) обозначены разными буквами. То же на рис. 3.
Ключевая роль в регуляции формирования защитных реакций растений при засолении отводится гормональной системе [24]. В основе защитного действия предобработки АЗП на рост клеток корней пшеницы при стрессе и в пост-стрессовый период также лежит его способность активно влиять на состояние гормональной системы растений [22, 25]. Вероятно, это происходит вследствие способности лектинов взаимодействовать с фитогормонами [26] и изменять их концентрацию и/или активность. Анализ содержания в одних и те же растениях ИУК, цитокининов и АБК позволил получить комплексную картину изменений в состоянии гормональной системы проростков ячменя и риса.
В предобработанных АЗП проростках пшеницы содержание АБК транзиторно увеличивалось [25]. Поскольку АБК участвует в регуляции стрессовых программ, можно было предполагать, что предобработанные АЗП растения становятся пред-адаптированными к последующему воздействию стресса. Действительно, АЗП-предобработанные растения характеризовались большей устойчивостью к повреждающему действию стрессора на митотический индекс корней проростков в сравнении с растениями, необработанными лектином (рис. 1).
Засоление приводило к транзиторному увеличению в корнях проростков риса и ячменя содержания АБК с максимумом через 2–3 ч (рис. 2а, г) и уменьшению содержания ИУК (рис. 2б, д), обладающей, как известно, ярко выраженным ростстимулирующим свойством, что в конечном счете привело к торможению деления клеток апикальной меристемы корней (рис. 1). Вместе с тем корни предобработанных АЗП проростков ячменя и риса при воздействии 2%-ного хлорида натрия в целом характеризовались поддержанием концентрации ИУК на уровне, близком контрольным вариантам.
Рис. 2.
Влияние предобработки АЗП на динамику содержания АБК (а, г), ИУК (б, д) и цитокининов (в, е) в корнях 5‑суточных проростков риса (а, б, в) и 4-суточных проростков ячменя (г, д, е) в ходе воздействия 2%-ным NaCl. Представлены средние и их стандартные отклонения, звездочкой отмечены отличия от контроля, достоверные при P ≤ 0.05. То же на рис. 4.
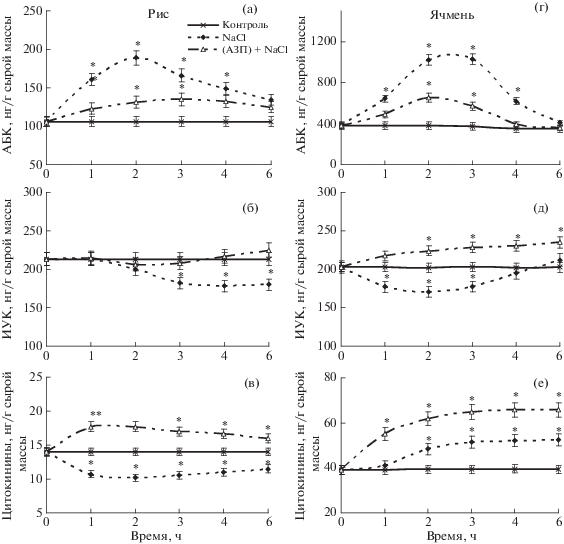
Иммуноанализ выявил снижение содержания цитокининов в корнях растений риса (рис. 2в), подвергнутых воздействию засоления. Подобную реакцию наблюдали ранее у растений пшеницы [13]. В то же время в корнях проростков ячменя, напротив, отмечено постепенное накопление цитокининов в ответ на засоление (рис. 2е), что, по-видимому, связано с реализацией механизма солеустойчивости ячменя. Важно отметить способность предобработки АЗП оказывать на проростки исследованных злаковых культур предадаптирующий эффект к последующему воздействию стресса, о чем свидетельствовали полученные сведения об увеличении содержания цитокининов в корнях растений как риса, так и ячменя, подвергнутых засолению (рис. 2в, е).
Известно, что цитокинины увеличивают стрессоустойчивость растений, важный вклад в реализацию защитного действия цитокининов вносит их способность индуцировать экспрессию генов ряда стрессовых белков, задействованных в формировании защитных реакций растений к стрессовым факторам среды разной природы [27, 28]. Кроме повышения содержания гормонов-активаторов роста ИУК и цитокининов, особенно в случае слабо чувствительного к NaCl ячменя, предобработанные АЗП и подвергнутые кратковременному засолению проростки характеризовались заметно меньшим уровнем стресс-индуцированного накопления АБК (рис. 2а, г).
Отмеченные изменения в состоянии гормональной системы привели к нормализации под влиянием предобработки АЗП показателей роста клеток корней риса и ячменя как во время действия стресса, так и после удаления соли из среды. Интересно отметить, что АЗП оказывал стимулирующее действие на МИ клеток корней ячменя после удаления NaCl (рис. 1б), что, по-видимому, было связано с отмеченными изменениями в гормональном балансе в сторону накопления фитогормонов-активаторов роста.
Опыты по экзогенной обработке проростков пшеницы 28 нМ АЗП в период после воздействия стресса, которые можно рассматривать как моделирующие действие эндогенного и экскретируемого в наружную среду лектина, показали ускорение репарации митотической активности клеток апикальной меристемы корней пшеницы по сравнению с необработанными [25]. Такая ситуация возможна и для растений риса и ячменя, перенесших стрессовое воздействие. Действительно, обработка подвергнутых кратковременному 7-часовому действию NaCl проростков риса (рис. 3а) и ячменя (рис. 3б) раствором АЗП ускоряла восстановление митотической активности клеток кончиков корней практически в той же мере, что и проростков пшеницы [25]. Следует отметить, что корни риса также оказались более чувствительными к действию соли, чем таковые ячменя: корни ячменя спустя 1 сут после обработки АЗП отличались восстановлением деления клеток апикальной меристемы в условиях засоления, тогда как полного восстановления деления клеток кончиков корней риса не наблюдали.
Рис. 3.
Эффект засоления и последующей 24-часовой обработки АЗП, а также через 1 сут после воздействия лектина на МИ проростков риса (а) и ячменя (б).
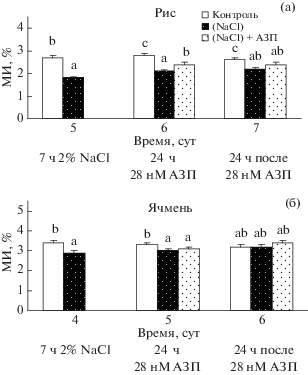
Способность предобработки АЗП предотвращать стресс-индуцированное торможение деления клеток корней проростков риса и ячменя, а также восстанавливать его после удаления стрессора из среды свидетельствовало об участии этого лектина в реакциях устойчивости растений. Можно предположить, что лектины риса и ячменя оказывают на “родственные” растительные объекты схожее действие, но это предположение требует дальнейшей экспериментальной проверки.
Поскольку интенсивность ростовых процессов растений находится под контролем фитогормонов, далее исследовали влияние засоления и последующей обработки АЗП на состояние гормональной системы корней проростков риса и ячменя. Следует отметить, что концентрация ростстимулирующих фитогормонов (ИУК и цитокининов) в корнях проростков риса после воздействия 2% NaCl постепенно возвращалась к контрольному уровню, а в корнях ячменя заметно превышала контроль. Обработка растений АЗП в период после действия стресса способствовала дополнительному накоплению ИУК и цитокининов (рис. 4б, в, д, е) в корнях проростков риса и ячменя по сравнению с необработанными АЗП и подвергшимися воздействию засоления проростками. Исследованные ростстимулирующие эндогенные фитогормоны вносили свой вклад в АЗП – опосредованное восстановление митотической активности меристематических клеток корней ячменя и риса после воздействия засоления (рис. 3).
Рис. 4.
Влияние обработки АЗП на динамику содержания АБК (а, г), ИУК (б, д) и цитокининов (в, е) в корнях 5-суточных проростков риса (а, б, в) и 4-суточных проростков ячменя (г, д, е) после воздействия 2%-ным NaCl.
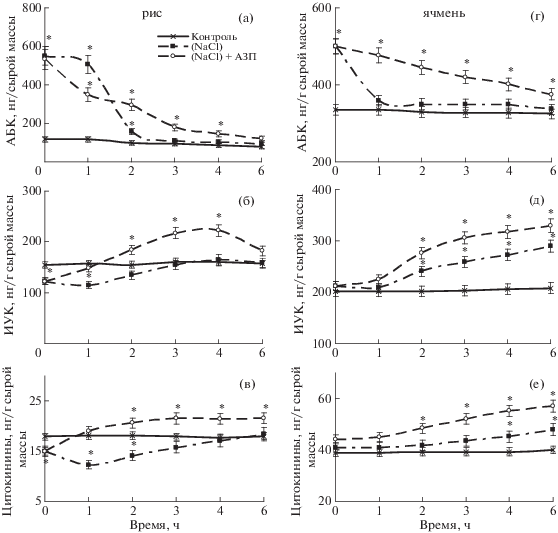
Что касается АБК, то содержание этого фитогормона в корнях ячменя возвращалось к норме в течение 1 ч (рис. 4г), в корнях риса – в течение 2-х ч после окончания воздействия засоления (рис. 4а). В ходе обработки 28 нМ АЗП в пост-стрессовый период количество АБК в корнях проростков риса и ячменя плавно возвращалось к контрольному уровню, по крайней мере в течение 6 ч обработки лектином (рис. 4а, г). Важно отметить, что АБК совместно с другими фитогормонами, включая гормоны-активаторы ростовых процессов, вовлекаются в индуцирование антистрессовых программ растений [24], что в свою очередь позволяет поддерживать рост клеток корней делением на уровне близком к контролю.
Сравнительная оценка защитного действия лектина пшеницы на деление клеток корней проростков ячменя и риса выявила способность АЗП поддерживать количество делящихся меристематических клеток корней до и после воздействия засоления на контрольном или близком к контролю уровне. Такой эффект, вероятно, был обусловлен тем, что ячмень и рис являются эволюционно близкими пшенице видами, а их лектины и АЗП обладают высокой степенью гомологии. Полученные результаты позволили заключить, что некоторое стимулирование деления клеток близкородственных видов растений в стрессовых условиях является характерным свойством для фитолектинов. Обработка корней проростков риса и ячменя АЗП как до воздействия засоления, так и после стресса сопровождалась повышением содержания ИУК и цитокининов в их корнях по сравнению с необработанными этим лектином растениями при засолении.
Таким образом, полученные результаты наряду с ранее опубликованными данными [29–32] подтвердили тесное взаимодействие лектиновой и гормональной систем в регуляции роста растений не только в норме, но и при стрессе.
ЗАКЛЮЧЕНИЕ
Способность агглютинина зародыша пшеницы (АЗП) активно воздействовать на состояние гормональной системы таких злаковых растений как рис и ячмень до воздействия засоления и в пост-стрессовый период вносит важный вклад в реализацию его рострегулирующего и антистрессового действия не только на растения пшеницы, но и другие злаки.
Список литературы
Soda N., Wallace S., Karan R. Omics study for abiotic stress responses in plants // Advanc. Plants Agricult. Res. 2015. V. 2. № 1. P. 1–6. 00037.https://doi.org/10.15406/ apar.2015.02.00037
Lannoo N., Van Damme E J.M. N-glycans: The making of a varied toolbox // Plant Sci. 2015. V. 239. P. 67–83. https://doi.org/10.1016/j.plantsci.2015.06.023
Peumans W.J. Biochemistry, cell-biology, physiology, biosynthesis and function of gramineae lectins. Proefschift… Leuven: Katholike univ., Lab. voor Pflatenbiochemie, 1984. 211 p.
Шакирова Ф.М., Безрукова М.В. Современные представления о предполагаемых функциях лектинов растений // Журн. общ. биол. 2007. Т. 68. № 2. С. 98–114.
Бабоша А.В. Индивидуальные лектины и устойчивость растений к патогенным организмам и абиотическим стрессам // Биохимия. 2008. Т. 73. Вып. 7. С. 1007–1022.
De Hoff P.L., Brill L.M., Hirsch A.M. Plant lectins: The ties that bind in root symbiosis and plant defense // Mol. Gen. Genom. 2009. V. 282. P. 1–15.
Тимофеева O.A., Невмержицкая Ю.Ю., Мифтахова И.Г., Стробыкинa А.С., Михайлов A.Л., Стробыкина И.Ю., Миронов В.Ф. Производные дитерпеноида стевиола регулируют рост и повышают морозоустойчивость озимой пшеницы // Докл. АН. 2010. Т. 435. № 2. С. 282–285.
Kovalchuk N.V., Melnykova N.M., Musatenko L.I. Role of phytolectin in the life cycle of plants // Biopolymer. Cell. 2012. V. 28. № 3. P. 171–180.
Kumar D., Shekhar S., Bisht S., Kumar V., Varma A., Kumar M. Ectopic overexpression of lectin in transgenic Brassica juncea plants exhibit resistance to fungal phytopathogen and showed alleviation to salt and drought stress // Bioengin. Biomed. Sci. 2015. V. 5. P. 1000147–1000147. https://doi.org/10.4172/2155-9538.1000147
Van Holle S., Van Damme E.J.M. Signaling through plant lectins: modulation of plant immunity and beyond // Biochem. Soc. Transact. 2018. V. 46. P. 217–233. https://doi.org/10.1042/BST20170371
Van Damme E.J.M., Peumans W.J., Barre A., Rougé P. Plant lectins: a composite of several distinct families of structurally and evolutionary related proteins with diverse biological roles // Critic. Rev. Plant Sci. 1998. V. 17. P. 575–692.https://doi.org/10.1080/07352689891304276
Cammue B.P.A., Broekaert W.F., Kellens J.T.C., Raikhel N.V., Peumans W.J. Stress-induced accumulation of wheat germ agglutinin and abscisic acid in roots of wheat seedlings // Plant Physiol. 1989. V. 91. P. 1432–1435.
Кильдибекова А.Р., Безрукова М.В., Авальбаев А.М., Фатхутдинова Р.А., Шакирова Ф.М. Механизмы защитного действия агглютинина зародыша пшеницы на рост клеток корней проростков пшеницы при засолении // Цитология. 2004. Т. 46. № 4. С. 312–316.
Безрукова М.В., Фатхутдинова Р.А., Шакирова Ф.М. Защитное действие агглютинина зародыша пшеницы на протекание митоза в корнях проростков Triticum aestivum при воздействии кадмия // Физиология растений. 2016. Т. 63. № 3. С. 382–389. https://doi.org/10.7868/S0015330316030027
Безрукова М.В., Лубянова А.Р., Гималов Ф.Р., Шакирова Ф.М. Участие агглютинина зародыша пшеницы в формировании устойчивости растений к гипотермии // Агрохимия. 2012. № 4. С. 37–42.
Антонюк Е.П., Евсеева Н.В. Лектин пшеницы как фактор растительно-микробной коммуникации и белок стрессового ответа // Микробиология. 2006. Т. 75. № 4. С. 544–549.
Zhang J., Liu J., Meng L., Ma Z., Tang X., Cao Y., Sun L. Isolation and characterization of plant growth-promoting rhizobacteria from wheat roots by wheat germ agglutinin labeled with fluorescein isothiocyanate // J. Microbiol. 2012. V. 50. № 2. P. 191–198.https://doi.org/10.1007/s12275-012-1472-3
Шакирова Ф.М., Безрукова М.В., Авальбаев А.М., Фатхутдинова Р.А. Механизмы регуляции накопления лектина в проростках пшеницы при засолении // Физиология растений. 2003. Т. 50. № 3. С. 341–345.
Rudiger H., Gabius H.-J. Plant lectins: occurrence, biochemistry, functions and applications // Glycoconjg. J. 2001. V. 18. P. 589–613.
Sharon N. Lectins: carbohydrate-specific reagents and biological recognition molecules // J. Biol. Chem. 2007. V. 282. P. 2753–2764. https://doi.org/10.1074/JBC.X600004200
Shakirova F.M., Sakhabutdinova A.R., Bezrukova M.V., Fatkhutdinova R.A., Fatkhutdinova D.R. Changes in the hormonal status of wheat seedlings induced by salicylic acid and salinity // Plant Sci. 2003. V. 164. № 3. P. 317–322. https://doi.org/10.1016/S0168-9452(02)00415-6
Безрукова М.В., Лубянова А.Р., Фатхутдинова Р.А. Участие лектинов пшеницы и фасоли в регуляции деления клеток апикальной меристемы корней разных видов растений // Физиология растений. 2011. Т. 58. № 1. С. 144–151.
Ngara R., Ndimba R., Jensen J.B., Jensen O.N., Ndimb B. Identification and profiling of salinitystress-responsive proteins in Sorghum bicolor seedlings // J. Proteomics. 2012. V. 75. P. 4139–4150. https://doi.org/10.1016/j.jprot.2012.05.038
Ryu H., Cho Y. Plant hormones in salt stress tolerance // J. Plant Biol. 2015. V. 58. P. 147–155. https://doi.org/10.1007/s12374-015-0103-z
Безрукова М.В., Кильдибекова А.Р., Авальбаев А.М., Шакирова Ф.М. Участие агглютинина зародыша пшеницы в регуляции деления клеток апикальной меристемы корней проростков // Цитология. 2004. Т. 46. № 1. С. 35–38.
Bogoeva V., Ivanov I., Kulina H., Russev G., Atanasova L. A novel cytokinin-binding property of mistletoe lectin I from Viscum album // Biotechnol. Exp. 2013. V. 27. № 1. P. 3583–3585. https://doi.org/10.5504/BBEQ.2012.0116
Tran L., Shinozaki K., Yamaguchi-Shinozaki K. Role of cytokinin responsive two-component system in ABA and osmotic stress signalings // Plant Signal. Behavior. 2010. V. 5. № 2. P. 148–150. https://doi.org/10.4161/psb.5.2.10411
Веселов Д.С., Кудоярова Г.Р., Кудрякова Н.В., Кузнецов В.В. Роль цитокининов в стресс-устойчивости растений // Физиология растений. 2017. V. 64. № 1. Р. 19–32.
Shakirova F.M., Avalbaev A.M., Bezrukova M.V., Gimalov F.R. Induction of wheat germ agglutinin synthesis by abscisic and gibberellic acids in roots of wheat seedlings // Plant Growth Regul. 2001. V. 33. P. 111–115.
Авальбаев А.М., Безрукова М.В., Шакирова Ф.М. Множественная гормональная регуляция содержания лектина в корнях проростков пшеницы // Физиология растений. 2001. Т. 48. С. 718–722.
Безрукова М.В., Авальбаев А.М., Кильдибекова А.Р., Фатхутдинова Р.А., Шакирова Ф.М. Взаимодействие лектина пшеницы и 24-эпибрассинолида в регуляции деления клеток корней пшеницы // Докл. АН. 2002. Т. 387. С. 276–278.
Шакирова Ф.М., Безрукова М.В., Авальбаев А.М., Гималов Ф.Р. Стимуляция экспрессии гена агглютинина зародыша пшеницы в корнях проростков под влиянием 24-эпибрассинолида // Физиология растений. 2002. Т. 49. С. 253–256.
Дополнительные материалы отсутствуют.


