Агрохимия, 2019, № 8, стр. 60-69
ВЛИЯНИЕ ЗАГРЯЗНЕНИЯ ПОЧВ ЦИНКОМ НА ЯЧМЕНЬ СОРТА ЗАЗЕРСКИЙ 85 И ЕГО СЕМЕННОЕ ПОТОМСТВО
Д. В. Васильев 1, *, В. С. Анисимов 1, Л. Н. Анисимова 1, Л. М. Фригидова 1, Р. А. Фригидов 1
1 Всероссийский научно-исследовательский институт радиологии и агроэкологии
249032 Калужская обл., Обнинск, Киевское шоссе, 109 км, Россия
* E-mail: treworqwert@mail.ru
Поступила в редакцию 28.08.2018
После доработки 13.12.2018
Принята к публикации 13.05.2019
Аннотация
Показано, что влияние цинка на растения ячменя и его семенное потомство зависело от типа и агрохимических свойств почв. Внесение цинка в почвы в виде водорастворимых соединений приводило к изменению его биологической доступности и транслокации в растения ячменя. Растения начинали испытывать стресс на дерново-подзолистых почвах при содержании металла 100 мг/кг воздушно-сухой почвы, на торфяной почве – 250, и черноземе – 500 мг/кг. Поскольку цинк является необходимым для нормального развития растений микроэлементом, то его содержание в почве, не превышающее величину ОДК более чем в 1–2 раза, способствовало увеличению всхожести семенного потомства ячменя. При более высоких концентрациях в почве цинк негативно влиял на семенное потомство.
ВВЕДЕНИЕ
Оптимальное обеспечение растений биогенными микроэлементами и, в частности, цинком способствует получению высоких урожаев. Однако цинк, участвуя во многих жизненно важных процессах, таких как углеводный и белковый обмен, окислительные процессы, синтез ДНК, РНК, хлорофилла, в то же время относится к веществам 1-го класса опасности, способным быстро накапливаться в окружающей среде [1–3]. Дефицит цинка нарушает формирование генеративных органов, образование семян, приводит к недостаточному развитию и хлорозу листьев [4–6]. Избыток цинка угнетает рост и развитие растений, снижает их урожайность и качество семян, вызывает некроз [7–9]. Таким образом, как недостаток, так и избыток цинка в почвах может стать лимитирующим фактором, определяющим урожайность сельскохозяйственных растений и качество их семенного потомства. И если для легких биогенных химических элементов размах оптимальных или безвредных концентраций очень широк, то для цинка, как микроэлемента, он крайне узок. Поэтому выявление оптимальных и максимально допустимых концентраций цинка в окружающей среде является актуальной задачей.
Цель работы – определение критических уровней (содержания) загрязнения 3-х разных типов почв цинком и выявление закономерностей формирования токсических и мутагенных эффектов в растениях ячменя сорта Зазерский-85.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследование проводили в контролируемых условиях вегетационных опытов (относительная влажность воздуха 60–70%, влажность почвы 60% ПВ, температура 20–25°С).
В качестве тест-объекта использовали ячмень (Hordeum vulgare L.) сорта Зазерский-85, который выращивали на 3-х разных типах почв (согласно классификации) [10, 11]: дерново-подзолистой супесчаной окультуренной (Albic Retisol Loamic, Ochric, Жуковский р-н, Калужская обл.), черноземе типичном тяжелосуглинистом (Haplic Chernozem Loamic, Pachic, Медвенский р-н, Курская обл.), торфяной болотной низинной (Sapric Histosol, Спас-Деменский р-н, Калужская обл.).
Агрохимические показатели почв определяли общепринятыми методами [12, 13]: pHKCl (${\text{p}}{{{\text{H}}}_{{{{{\text{Н }}}_{{\text{2}}}}{\text{О }}}}}$) – потенциометрическим методом в суспензии почвы в 1 М растворе KCl (дистиллированной воде) при соотношении твердой и жидкой фаз 1 : 2.5, содержание гумуса – по методу Тюрина, гидролитическую кислотность – по Каппену, сумму поглощенных оснований – по Каппену–Гильковицу, содержание подвижных форм P2O5 и K2O – по Чирикову.
В почву перед посевом вносили водный раствор нитрата цинка (табл. 1), после чего добавляли питательные элементы в виде водных растворов солей (KH2PO4, K2SO4) из расчета P100K100. Количество внесенного азота в вариантах опыта, включая контрольный, корректировали с помощью азотнокислого аммония до содержания N = = 1 г/вегетационный сосуд.
Таблица 1.
Количество цинка, внесенного в почвы опыта в виде водного раствора нитрата
| Внесено цинка, мг/кг воздушно-сухой почвы | Соответствие классификации кислых и слабокислых почв по содержанию и степени загрязнения цинком, мг/кг воздушно-сухой почвы [14] | ||
|---|---|---|---|
| Дерново-подзолистая почва | Чернозем | Торфяная болотная низинная почва | |
| 50 | 50 | Среднее содержание | |
| 100 | 100 | Повышенное содержание | |
| 150 | Высокое содержание | ||
| 250 | 250 | 250 | Среднее загрязнение |
| 500 | 500 | Высокое загрязнение | |
| 750 | |||
| 1000 | Очень высокое загрязнение | ||
Семена проращивали в чашках Петри и на 3-и сут высаживали в пластиковые вегетационные сосуды объемом 5 дм3, содержащие 5 кг исследованной почвы (в пересчете на абсолютно сухую массу), в количестве 25 шт./сосуд. Повторность пятикратная.
Концентрацию цинка в растениях, содержание подвижных форм и валовое количество элемента в почвах определяли в соответствии с общепринятой методикой [15]. Содержание подвижных форм цинка определяли экстракцией с помощью ацетатно-аммонийного буфера (ААБ) при pH 4.8. Содержание кислоторастворимых форм определяли с помощью вытяжки 1 M HCl, общее количество цинка – экстракцией 7 M HNO3 при кипячении в присутствии H2O2. Содержание свободного пролина в растениях определяли с помощью кислого нингидринового реактива [16].
Коэффициент биологического накопления цинка (КНZn) рассчитывали как отношение содержания элементов в сухой биомассе растений к содержанию их в почве (подвижной – КНZn подв и кислоторастворимой – КНZn кисл).
Оценку состояния растений при загрязнении почв цинком проводили во время сбора урожая. Измеряли массу соломы одного растения, среднюю высоту растений и массу 1000 семян.
Оценку последействия цинка на качество полученного урожая проводили по показателям всхожести семян, митотической активности и цитогенетической поврежденности клеток корневой меристемы проростков.
Для этого семена проращивали в термостате при температуре 21°С в чашках Петри на смоченной дистиллированной водой фильтровальной бумаге. Всхожесть семян определяли на 7-е сут после начала проращивания.
Для фиксации клеток в первом митозе брали проросшие семена с корнями длиной 1–1.5 см, которые фиксировали в ацетоалкоголе (1 : 3). Окрашивание давленых препаратов проводили ацетоорсеином.
В готовых препаратах определяли число клеток с цитогенетическими нарушениями (анализировали все ана–телофазные клетки, в среднем 3–6 тыс. ана-телофаз в варианте). Клетки со сложными неподдающимися распознаванию аберрациями из анализа исключали. Важно отметить, что данным ана-телофазным методом регистрируются нарушения, возникшие в период от образования гамет до созревания и сбора семян. Это связано с тем, что индуцированные на вегетативной стадии (до цветения) хромосомные перестройки элиминируются в мейозе за исключением нерегистрируемых этим методом симметричных инверсий и транслокаций.
Митотическую активность клеток корневой меристемы проростков оценивали с помощью митотического индекса (в %). Для этого в препаратах подсчитывали число митозов и общее число клеток. Митотический индекс (MI) рассчитывали по формуле:
где: P – количество клеток корневой меристемы на стадии профазы, М – количество клеток корневой меристемы на стадии метафазы, А – количество клеток корневой меристемы на стадии анафазы, Т – количество клеток корневой меристемы на стадии телофазы, I – количество клеток корневой меристемы на стадии интерфазы [17].Статистическую обработку полученных результатов проводили в редакторе MS Excel, используя методы вариационной статистики. Оптимальный объем выборки, нужный для получения оценок изученных параметров с фиксированной относительной погрешностью при заданной доверительной вероятности, определяли методом статистического анализа эмпирических распределений [18]. Для каждого варианта просматривали не менее 10–30 препаратов, в которых анализировали все ана-телофазные клетки (3700–9041 ана-телофаз в варианте опыта). Всего в эксперименте было проанализировано 334 препарата для 16 вариантов.
Все данные экспериментов проверяли на наличие выбросов, которые из дальнейшего рассмотрения исключали. Наличие достоверных отличий результатов оценивали по t-критерию Стьюдента.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Биологическая эффективность цинка зависит не только от его концентрации в почве, но и от доступности для растений [19]. В свою очередь доступность цинка определяется степенью его подвижности, зависящей от эдафических свойств почв [8, 20–23]. Повышенная кислотность, невысокое содержание гумуса и обменных катионов, малая степень насыщенности основаниями дерново-подзолистой почвы должны способствовать большей подвижности цинка (табл. 2). Чернозем и торфяная почва, напротив, должны обладать более высокой буферностью по отношению к цинку, поскольку благодаря высокому содержанию органического вещества в них образуются устойчивые цинкорганические соединения.
Таблица 2.
Агрохимические свойства почв опыта
| Показатель | Почва | ||
|---|---|---|---|
| Дерново-подзолистая супесчаная окультуренная | Чернозем типичный тяжелосуглинистый | Торфяная болотная низинная | |
| Полная влагоемкость, % | 35.5 ± 0.7 | 345 ± 3 | |
| Гумус, % | 1.7 ± 0.1 | 4.32 ± 0.08 | 13.8* |
| pHKCl | 5.19 ± 0.01 | 5.49 ± 0.01 | 5.13 ± 0.03 |
| ${\text{p}}{{{\text{H}}}_{{{{{\text{Н }}}_{{\text{2}}}}{\text{О }}}}}$ | 5.55 ± 0.02 | 6.23 ± 0.02 | Не определяли |
| Hг, мг-экв/100 г почвы | 1.08 ± 0.05 | 3.17 ± 0.01 | 45.2 ± 1.2 |
| Емкость катионного обмена, мг-экв/100 г почвы | 9.3 ± 1.2 | 34.4 ± 0.2 | 62.0 ± 1.0 |
| Обменный K2O, мг/кг (по Масловой) | 77.7 ± 1.3 | 124 ± 2 | 373 ± 4 |
| Подвижный P2O5, мг/кг (по Чирикову) | 20.4 ± 1.2 | 120 ± 1 | 7.48 ± 0.23 |
Но чтобы говорить о доступности цинка для растений также нужно учитывать соотношения в почве его трех форм [15, 24]: доступной для растений подвижной формы (водорастворимые, способные к обмену, (непрочносвязанные) соединения), потенциально доступной (кислоторастворимые соединения, извлекаемые при помощи группового реагента 1 M HCl (или 1 M HNO3)), недоступной (прочносвязанные с органическими и неорганическими компонентами почвы соединения, не извлекаемые с помощью вышеперечисленных групповых реагентов).
Чем больше водорастворимых (непрочносвязанных), способных к обмену соединений Zn в почве, тем выше его подвижность и биологическая доступность.
Доля кислоторастворимого Zn от общего количества металла в контрольных почвах была значительно больше, чем доступного: 0.21 (чернозем) ≈ 0.24 (дерново-подзолистая почва) < 0.53 (торфяная), а доля подвижного Zn от общего количества элемента увеличивалась в ряду: чернозем слабовыщелоченный (0.025) < торфяная (0.04) < дерново-подзолистая (0.05) (табл. 3).
Таблица 3.
Показатели транслокации цинка из почвы в растения
| Доза Zn, мг/кг | Массовая концентрация извлекаемых форм нахождения Zn в почве, мг/кг | КНZn подв | КНZn кисл | |||
|---|---|---|---|---|---|---|
| подвижная (1 M AcONH4, pH 4.8 – вытяжка) | кислоторастворимая (1 М HCl – вытяжка) | солома | семена (зерно) | солома | семена (зерно) | |
| Дерново-подзолистая почва | ||||||
| К* | 1.4 ± 0.5 | 7.3 ± 0.2 | 26 ± 10 | 54 ± 19 | 5.2 ± 0.9 | 10.6 ± 0.6 |
| 25 | 13.0 ± 6.3 | 22.1 ± 0.2 | 12.9 ± 6.4 | 8.8 ± 4.3 | 7.6 ± 0.7 | 5.1 ± 0.1 |
| 50 | 19.0 ± 1.1 | 38.8 ± 0.1 | 18.8 ± 2.2 | 9.2 ± 3.4 | 9.2 ± 0.9 | 4.5 ± 1.7 |
| 100 | 43.0 ± 1.1 | 75.5 ± 3.0 | 16.8 ± 1.5 | 4.4 ± 0.3 | 9.5 ± 0.9 | 2.5 ± 0.2 |
| 150 | 93.4 ± 5.4 | 147 ± 13 | 8.4 ± 0.5 | 2.4 ± 0.1 | 5.4 ± 0.5 | 1.5 ± 0.1 |
| 225 | 104 ± 31 | 185 ± 3 | 7.5 ± 2.3 | 1.9 ± 0.6 | 4.2 ± 0.4 | 1.1 ± 0.1 |
| Чернозем типичный тяжелосуглинистый | ||||||
| К | 1.05 ± 0.3 | 9.0 ± 2.8 | 15.4 ± 8.2 | 24 ± 11 | 1.8 ± 1.0 | 2.8 ± 1.4 |
| 50 | 13.7 ± 0.6 | 36.5 ± 2.0 | 10.1 ± 2.0 | 4.8 ± 0.6 | 3.8 ± 0.8 | 1.8 ± 0.2 |
| 100 | 27.8 ± 0.3 | 74.1 ± 3.0 | 8.4 ± 2.6 | 2.9 ± 0.6 | 3.2 ± 1.0 | 1.1 ± 0.2 |
| 250 | 86.1 ± 0.7 | 166 ± 2 | 6.0 ± 0.3 | 1.3 ± 0.3 | 3.1 ± 0.2 | 0.7 ± 0.1 |
| 500 | 183 ± 19 | 387 ± 41 | 5.5 ± 0.7 | 0.9 ± 0.1 | 2.6 ± 0.4 | 0.4 ± 0.1 |
| 750 | 272 ± 43 | 592 ± 14 | 9.0 ± 1.6 | 1.0 ± 0.2 | 4.2 ± 0.4 | 0.5 ± 0.1 |
| Болотная торфяная низинная | ||||||
| К | 1.4 ± 0.2 | 18.3 ± 1.2 | 19.6 ± 3.5 | 52 ± 13 | 1.4 ± 0.2 | 3.7 ± 0.8 |
| 250 | 30.5 ± 1.0 | 167 ± 2 | 3.8 ± 0.2 | 3.0 ± 0.1 | 0.7 ± 0.03 | 0.5 ± 0.01 |
| 500 | 64.8 ± 8.7 | 302 ± 6 | 2.3 ± 0.3 | 1.6 ± 0.2 | 0.5 ± 0.03 | 0.3 ± 0.01 |
| 1000 | 116 ± 1 | 539 ± 18 | 2.2 ± 0.2 | 0.9 ± 0.2 | 0.5 ± 0.04 | 0.2 ± 0.03 |
* К – контроль без загрязнения. То же на рис. 2.
Внесение Zn в почвы в виде водорастворимых соединений вело к увеличению его подвижности и соответственно к усилению его перехода в растения, что видно из результатов. При внесении возрастающих количеств Zn в почвы доля подвижных (водорастворимых обменных и непрочносвязанных) форм элемента возрастала асимптотически до 0.45 (дерново-подзолистая почва), 0.32 (чернозем) и 0.14 (торфяная почва). Также возрастала и доля кислоторастворимых форм элемента, но в значительно меньшей степени: дерново-подзолистая почва – в 1.8 раза, чернозем – в 1.7 раза, торфяная – в 1.1 раза. Таким образом, подвижность Zn определялась не только свойствами почв, но и динамическим равновесием между его различными формами [19].
Анализ интенсивности перехода цинка из почвы в растения показал, что наибольшие величины коэффициентов накопления (КН) цинка в вегетативных органах и семенах ячменя наблюдали на дерново-подзолистой почве. При этом КНZn подв в контролях были значительно больше, чем в вариантах, где был внесен нитрат цинка (за исключением КНZn кисл в соломе на дерново-подзолистой почве и черноземе). В последующем с ростом концентрации металла в почве коэффициенты накопления значительно не изменялись, что свидетельствовало об устойчивости эффекта в данном диапазоне концентраций Zn [25, 26]. Это объясняется тем, что даже небольшое увеличение концентрации цинка в почве способно активировать защитные механизмы растений [25]. Это могут быть как внешние механизмы защиты, включающие в себя иммобилизацию металлов в клеточной стенке, выделение хелатирующих лигандов, формирование редокс-барьеров на плазматической мембране, создание рН-барьера на плазмалемме [27, 28], так и внутренние механизмы (задерживание тяжелых металлов в корнях или за пределами метаболически важных органов и структур, снижение активности избыточных ионов, перевод их в физиологически инертные формы, создание альтернативных реакций обмена, менее чувствительных к действию тяжелых металлов) [3, 29].
Известно, что накопление цинка ячменем в нормальных условиях происходит преимущественно в генеративных органах (в отличие от пшеницы и овса) [5, 30]. Но данное исследование показало (табл. 3), что как только концентрации цинка в почве превышали фоновый уровень, базипетальная направленность накопления цинка менялась на противоположную ей акропетальную.
Таким образом, даже небольшое повышение концентрации цинка в почве способно изменять его биофильность, и поскольку при избытке Zn потребность в нем, как биологически важном микроэлементе, уменьшается, то защитные механизмы препятствуют поступлению цинка в растения и прежде всего в наиболее важные для сохранения популяции генеративные органы.
При каких концентрациях цинка в почве растения начинают испытывать стресс, можно узнать, изучив процесс накопления растениями специфических соединений – маркеров стресса. Одним из таких веществ является аминокислота пролин – пирролидин-α-карбоновая кислота. Значительное увеличение концентрации пролина при действии тяжелых металлов и других абиотических факторов считается универсальной реакцией растений на стресс [31, 32]. Было установлено, что накопление свободного пролина в изученных растениях зависело от типа почв и концентрации цинка (рис. 1).
Рис. 1.
Накопление свободного пролина в листьях растений ячменя. *Отличие от контроля статистически значимо. То же на рис. 2, 4, 5.

На дерново-подзолистых почвах статистически значимое увеличение содержания свободного пролина в листьях ячменя наблюдали уже при повышенном содержании металла в почвах (что соответствовало 70–100 мг Zn/кг почвы по классификации [14]). В растениях, выращенных на торфяной почве, статистически значимое накопление свободного пролина начиналось при среднем загрязнении (250 мг/кг), на черноземе – при высоком загрязнении почв цинком (500 мг/кг).
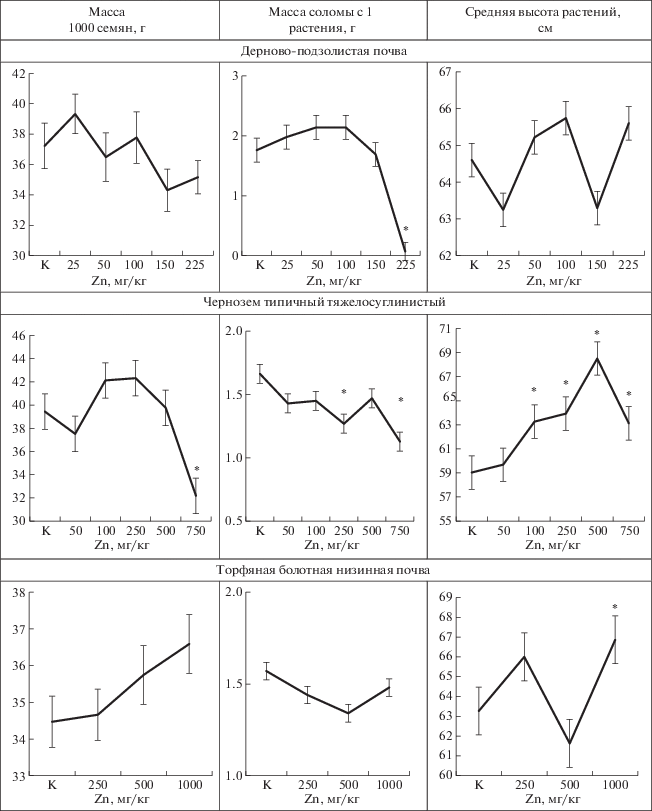
Стресс может не сразу сказываться на морфологических показателях ячменя. Например, статистически значимое снижение массы соломы растений, выросших на дерново-подзолистой почве (рис. 2), появлялось только при концентрации металла 225 мг/кг (согласно классификации [14], при среднем уровне загрязнения). У растений, выросших на черноземе, масса 1000 семян начинала статистически значимо снижаться при концентрации цинка 750 мг/кг, масса соломы – при 500 мг/кг, что соответствовало высокому уровню загрязнения почвы.
При этом повышенное содержание цинка в почвах было способно оказывать и статистически значимую стимуляцию роста стебля растений: на черноземе – при 100–750 мг Zn/кг, на торфяной болотной низинной почве – при концентрации 1000 мг Zn /кг.
О надежности защиты растений от избытка цинка в почве можно судить по его влиянию на потомство растений, которое является гарантом стабильности популяции. Поскольку степень воздействия металла на семенное потомство значительно меньше, чем на материнские растения, то наибольшая вероятность обнаружить биологические эффекты неблагоприятного влияния цинка имеются на чувствительном к стрессовым воздействиям клеточном уровне. Для этого были проведены цитогенетические исследования образовательных тканей – меристем, от способности которых сохранять нормальные темпы размножения клеток и стабильность клеточного состава зависит устойчивость растений к действию тяжелых металлов и других неблагоприятных факторов.
Благодаря цитогенетическому анализу было обнаружено статистически значимое (p < 0.05) увеличение числа хромосомных аберраций в корневой меристеме проростков семян ячменя, выросшего на черноземе и дерново-подзолистой почве с высокими концентрациями цинка (в 4–7 раз превышающими ОДК [33] и массовой концентрации цинка в семенах >180 мг/кг). На торфяной болотной низинной почве статистически значимого увеличения частоты цитогенетических нарушений выявлено не было (рис. 3).
Рис. 3.
Частота и спектр цитогенетических нарушений в корневой меристеме проростков семян ячменя; отличие от контроля статистически значимо: *p < 5%, **p < 1%.
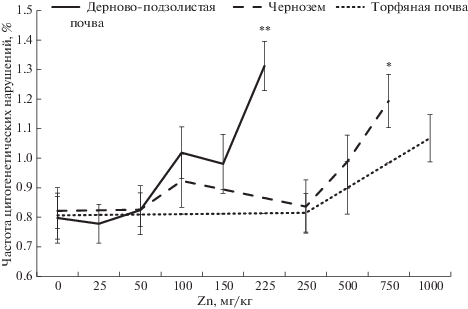
Необходимо отметить, что рост цитогенетических нарушений в семенах, полученных на дерново-подзолистых почвах, начинался при значительно меньших концентрациях цинка, чем в семенах, полученных на черноземе или торфяной почве, что было связано с большей доступностью металла для растений.
Устойчивость растений к действию повреждающих агентов во многом определялась способностью меристем сохранять постоянство клеточного состава и поддерживать нормальные темпы клеточного деления. Тяжелые металлы и, в частности, цинк способны снижать митотическую активность клеток [34–36]. В настоящем исследовании статистически значимое снижение митотической активности было обнаружено только в проростках ячменя, выросшего на дерново-подзолистой почве, в которую было внесено 250 мг Zn/кг (в форме нитрата), что соответствовало среднему уровню загрязнения [14] (рис. 4). На других почвах митотическая активность статистически значимо не изменялась.
Рис. 4.
Митотическая активность клеток корневой меристемы проростков семян ячменя, выращенного на почвах, загрязненных нитратом цинка.

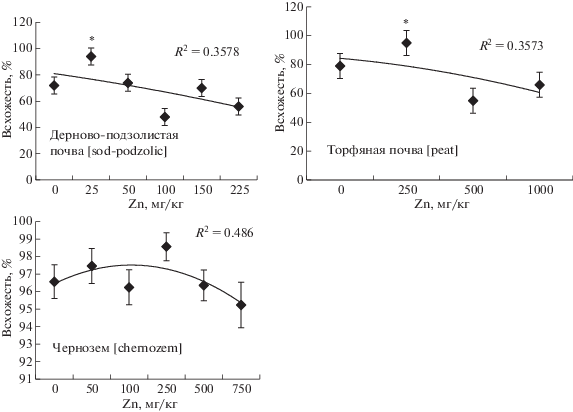
Еще одним из эффектов воздействия тяжелых металлов на семенное потомство растений является снижение их всхожести [37]. В настоящем исследовании было установлено, что всхожесть семян ячменя, выросшего на почвах, загрязненных нитратом цинка, имела тенденцию к немонотонному снижению (r = 0.51–0.59) по мере роста концентрации металла на всех 3-х типах почв (рис. 5). Однако при небольших концентрациях цинка в почвах (в зависимости от типа последних – в диапазоне 25–250 мг/кг воздушно-сухой массы) всхожесть семян увеличивалась. Для семян ячменя, выросшего на дерново-подзолистой и торфяной почве это увеличение было статистически значимым. Повышение всхожести семян ячменя, выросшего на почвах с низким уровнем загрязнения, объясняется потребностью растений в цинке, как важном микроэлементе, оказывающем влияние на формирование генеративных органов и семян [20, 38]. Токсичным цинк становится, только превысив определенный для каждого вида растений критический уровень [20], который наиболее низок для дерново-подзолистой почвы в связи с высокой его доступностью для растений.
ЗАКЛЮЧЕНИЕ
Показано, что степень влияния цинка на качество семенного потомства зависела от типа и агрохимических свойств почв. При этом внесение Zn в виде водорастворимых соединений приводило к увеличению его подвижности в почвах и соответственно к усилению его транслокации в растения. Даже небольшое изменение концентрации цинка в почве было способно изменять его биологическую доступность и пути накопления в растениях.
Растения испытывали стресс на дерново-подзолистых почвах уже при повышенном содержании металла – 100 мг Zn/кг почвы, на торфяной почве и черноземе, соответственно при среднем (250 мг Zn/кг) и высоком (500 мг Zn/кг) загрязнении почвы.
Стрессовое воздействие цинка сказывалось на морфологических показателях ячменя, снижая массу соломы или массу 1000 семян или, наоборот, стимулируя рост стебля растений.
Загрязнение почвы цинком (в зависимости от типа почвы это было низкое или среднее загрязнение, соответствующее превышению в 4–9 раз ОДК) было способно оказывать негативное влияние на семенное потомство ячменя, увеличивая частоту цитогенетических нарушений в корневой меристеме проростков, снижая митотическую активность клеток корневой меристемы и всхожесть семян.
Поскольку цинк является важным микроэлементом, необходимым для растений, он мог также положительно влиять на всхожесть семян ячменя, выращенного на почвах с повышенным содержанием цинка, не превышающим ОДК более чем в 1–2 раза).
Список литературы
ГОСТ 17.4.1.02-83 Охрана почв. Классификация химических веществ для контроля загрязнения. Ростехрегулирование. М., 2003. С. 1–5.
Ориентировочно-допустимые концентрации (ОДК) химических веществ в почве. Гигиенические нормативы ГН 2.1.7.2042-06. Госкомсанэпиднадзор России. М., 2006. С. 42–44.
Ильин В.Б. Тяжелые металлы в системе почва–растение. Новосибирск: Наука, СО, 1991. 151 с.
Гэлстон А., Девис П., Сэттер Р. Жизнь зеленого растения: Пер. с англ. М.: Мир, 1983. 552 с.
Башкин В.Н., Касимов Н.С. Биогеохимия. М.: Научный мир, 2004. 648 с.
Renu P. Mineral nutrition of plants / Ed. Bahadur B. Plant biology and biotechnology: V. 1. Plant diversity, organization, function and improvement. Springer India, 2015. P. 469–568. https://doi.org/10.1007/978-81-322-2286-6_20
Воскресенская О.Л., Чернавина И.А., Аксенова В.А. Влияние избытка цинка в среде произрастания на поглощение металлов растениями овса // Физиология устойчивости растений Нечерноземной зоны РСФСР. М., 1987. С. 34–41.
Кабата-Пендиас А., Пендиас Х. Микроэлементы в почвах и растениях. М.: Мир, 1989. 439 с.
Макарова В.Г., Цыганов А.Р., Кирюшин В.А., Коновалов О.В., Вильдфлуш И.Р., Мажайский Ю.А., Персикова Т.Ф., Желязко В.И. Экологические и медико-социальные аспекты охраны природной среды и здоровья населения. Минск: БИТ “Хата”, 2002. 114 с.
Классификация и диагностика почв СССР. М.: Колос, 1977. 221 с.
World reference base for soil resources. 2nd ed. World Soil Resources Reports № 103. Rome: FAO, 2006. 132 p.https://doi.org/10.5281/ZENODO.1060635
Агрохимические методы исследования почв. М.: Наука, 1975. 656 с.
Практикум по агрохимии / Под ред. Минеева В.Г. М.: Изд-во МГУ, 2001. 689 с.
Обухов А.И., Лепнева О.М. Биогеохимия тяжелых металлов в городской среде // Почвоведение. 1989. № 5. С. 65–73.
Методические указания по определению тяжелых металлов в почвах сельхозугодий и продукции растениеводства. М.: ЦИНАО, 1992. 61 с.
Bates L., Waldren R.P., Teare I.D. Rapid determination of free proline for water-stress studies // Plant and Soil. 1973. V. 39. P. 205–207.
Практикум по цитологии растений / Под ред. Паушевой З.П. М.: Колос, 1980. 304 с.
Гераськин С.А., Фесенко С.В., Черняева Л.Г., Санжарова Н.И. Статистические методы анализа эмпирических распределений коэффициентов накопления радионуклидов растениями // Сел.-хоз. биол. 1994. № 1. С. 130–137.
Elsokkary I.H., Låg., J. Distribution of different fractions of Cd, Pb, Zn and Cu in industrially polluted and non-polluted soils of Odda region, Norway // Acta Agric. Scand. 1978. V. 23. P. 262–268.
Siedlecka A. Some aspects of interactions between heavy metals and plant mineral nutrients // Acta Soc. Bot. Pol. 1995. V. 64. P. 65–272.
Алексеев Ю.В. Тяжелые металлы в почвах и растениях. Л.: Агропромиздат, ЛО, 1987. 142 с.
Васильевская В.Д. Устойчивость почв к антропогенным воздействиям // Почвенно-экологический мониторинг и охрана почв / Под ред. Орлова Д.С., Васильевской В.Д. М.: Изд-во МГУ, 1994. С. 61–79.
Анисимов В.С., Санжарова Н.И., Анисимова Л.Н., Гераськин С.А., Дикарев Д.В., Фригидова Л.М., Фригидов Р.А., Белова Н.В. Оценка миграционной способности и фитотоксичности Zn в системе почва–растение // Агрохимия. 2013. № 1. С. 64–74.
Химия тяжелых металлов, мышьяка и молибдена в почвах / Под ред. Зырина Н.Г., Садовниковой Л.К. М.: Изд-во МГУ, 1985. 208 с.
Baker A.J.M. Accumulators and excluders – Strategies in the response of plants to heavy metals // J. Plant Nutr. 1981. V. 3. P. 643–654.
Фригидов Р.А., Фригидова Л.М., Анисимов В.С., Санжарова Н.И., Анисимова Л.Н., Дикарев Д.В. Оценка критических уровней содержания Zn в выщелоченном черноземе с использованием тест-растений ячменя и кормовых бобов // Агрохимия. 2017. № 3. С. 69–78.
Antonovics J., Bradshow A.D., Turner R.G. Heavy metal tolerance in plants // Adv. Ecol. Res. 1971. V. 7. P. 2–86.
Taylor G.J. Exclusion of metals from the symplasm: a possible mechanism of metal tolerance in higher plants // J. Plant Nutr. 1987. V. 10. № 9(16). P. 1213–1222.
Титов А.Ф., Таланова В.В., Казнина Н.М. Физиологические основы устойчивости растений к тяжелым металлам: уч. пособ. Петрозаводск: Карел. НЦ РАН, 2011. 77 с.
Соколов О.А., Черников В.А. Экологическая безопасность и устойчивое развитие. Кн. 1. Атлас распределения тяжелых металлов в объектах окружающей среды. Пущино: ОНТИ ПНЦ РАН, 1999. 164 с.
Stewart G.R., Larhar F. Accumulation of amino acids and related compounds in relation to environmental stress // Biochem. Plant V. 5 / Eds. Stumpf P.K., Conn E.E. N.Y.: Academic, 1980. P. 609–635.
Alia Saradhi P.P. Proline accumulation under heavy metal stress // J. Plant Physiol. 1991. V. 138. P. 554–558.
ГН 2.1.7.2511-09 “Ориентировочно-допустимые концентрации (ОДК) химических веществ в почве”. М., 2009. С. 1–6.
Гуральчук Ж.З. Эколого-физиологические аспекты действия цинка на растения // Регуляция минерального питания и продуктивность растений. Киев: Hayк. думка, 1991. С. 102–127.
Ciri A.K., Singh O.P., Sanyai R. Comparative effects of chronic treatment with certain metals on cell division // Cytologia. 1984. V. 49. № 3. P. 659–665.
Kocik H., Wojciechomka B., Ligutinska A. Investigation on the cytotoxic influences of zinc on Allium cepa roots // Acta Soc. Bot. Pol. 1982. V. 51. № 1. P. 3–9.
Munzuroglu O., Geckil H. Effects of metals on seed germination, root elongation and coleoptile and hypocotyl growth in Triticum aestivum and Cucumis sativus // Arch. Environ. Contam. Toxicol. 2002. V. 43. P. 203–213.
Lindsay W.L. Zinc in soils and plant nutrition // Adv. Agron. 1972. V. 24. 147 p.
Дополнительные материалы отсутствуют.