Агрохимия, 2019, № 9, стр. 60-66
ДИНАМИКА СОДЕРЖАНИЯ ФИТОГОРМОНОВ В ПОЧКАХ ВОЗОБНОВЛЕНИЯ ПИОНА УКЛОНЯЮЩЕГОСЯ ПРИ ИХ ВВЕДЕНИИ В КУЛЬТУРУ in vitro
А. А. Зарипова *
Южно-Уральский ботанический сад-институт Уфимского федерального исследовательского центра РАН
450080 Уфа, ул. Менделеева, 195, корп. 3, Россия
* E-mail: zaripova.al@mail.ru
Поступила в редакцию 23.07.2018
После доработки 06.11.2018
Принята к публикации 10.04.2019
Аннотация
Исследовано содержание эндогенных гормонов в почках Paeonia anomala L. в годичном цикле развития. Установлена взаимосвязь роста и развития боковых почек в культуре in vitro, их расположения на побеге и соотношения фитогормонов при инокуляции, что необходимо учитывать при разработке клонального микроразмножения редкого вида. Представление об уровне эндогенных фитогормонов позволяет регулировать развитие эксплантов in vitro путем изменения концентрации и соотношения экзогенных регуляторов роста.
ВВЕДЕНИЕ
Биотехнологические методы, базирующиеся на культивировании растений in vitro, все шире применяют в работе по сохранению биоразнообразия растительных ресурсов. Одним из способов охраны редких видов растений, в том числе пиона уклоняющегося (Paeonia anomala L.), внесенного в “Красную книгу Республики Башкортостан” [1], является введение их в культуру in vitro с перспективой размножения, создания генетических банков на основе пересадочных культур и последующей реинтродукцией в места естественного обитания.
На развитие эксплантов in vitro влияют компоненты питательной среды, в том числе концентрация и соотношение гормонов. Хорошо известно, что фитогормоны и регуляторы роста оказывают влияние на рост и дифференциацию в культуре in vitro. Формообразовательные процессы в культуре ткани очень часто зависят от уровня эндогенных гормонов в исходных эксплантах [2–4]. Выявление и использование оптимального баланса эндогенных фитогормонов в эксплантах и экзогенных регуляторов роста в питательной среде позволяет управлять процессом морфогенеза in vitro [5].
Большинство исследователей для определения оптимального гормонального состава питательной среды как для стимуляции и активации пролиферации, так и для роста и развития эксплантов проверяют широкий диапазон концентраций и комбинаций фитогормонов. Поиск гормональных компонентов среды имеет случайный характер, поэтому подбор оптимальной концентрации регуляторов роста оказывается трудоемким.
Применение метода твердофазного иммуноферментного анализа (ИФА) растительных образцов позволяет предварительно проанализировать содержание эндогенных фитогормонов в экспланте, что дает возможность скорректировать соотношение их с экзогенными гормонами в составе питательной среды.
Накоплено достаточно много экспериментальных данных [6–8], свидетельствующих о том, что морфогенез в культуре in vitro определяется не только оптимальной концентрацией регуляторов роста при культивировании, но и физиологическим состоянием экспланта непосредственно перед инокуляцией на питательную среду. Известно, что физиологическое состояние экспланта играет определяющую роль в регенерационных процессах in vitro, в то же время разные части одного побега характеризуются различной способностью к морфогенезу [9].
Цель работы – изучение особенностей развития боковых почек пиона уклоняющегося и определение содержания фитогормонов в них перед введением в культуру in vitro.
МЕТОДИКА ИССЛЕДОВАНИЯ
Для введения в культуру in vitro использовали боковые почки, изолированные из почки возобновления пиона уклоняющегося. Исследование боковых почек проводили на разных стадиях формирования почки возобновления: в марте – до ее раскрытия, в мае – в начале отрастания побега, в августе и октябре – по окончании формирования.
Приготовление и стерилизацию питательных сред для культивирования тканей и органов P. anomala проводили согласно рекомендациям [10, 11]. Стерилизацию почек проводили с использованием 70%-ного раствора этанола 1–3 мин, 3%-ного раствора пероксида водорода 1–5 мин, 0.1%-ного раствора диацида 10–25 мин, 3 раза промывали стерильной водой. В асептических условиях под бинокулярной лупой МБС-10 препаровальной иглой и пинцетом удаляли почечные чешуи и отделяли экспланты.
Боковые почки культивировали на питательной среде по прописи Мурасиге и Скуга [12], дополненной регуляторами роста: 6-бензиламинопурином (БАП) в концентрации 0.1–3.0 мг/л, индолил-3-уксусной кислотой (ИУК) в концентрации 0.01–4.0 мг/л. Содержание агара в питательной среде составляло 0.7%, pH среды 5.6–5.8.
Растения культивировали в биологических пробирках при люминесцентном освещении 10 000 лк, при 16-часовом фотопериоде, температуре 26°С и относительной влажности воздуха 70%.
Определение концентрации фитогормонов в боковых почках проводили по методике иммуноферментного анализа, разработанной Кудояровой с соавторами [13–15], позволяющей повысить точность экспериментов за счет высокой специфичности отношения антител к фитогормонам.
Для определения содержания гормонов в тканях растительный материал гомогенизировали и экстрагировали 80%-ным этанолом. Спиртовой экстракт отделяли центрифугированием и упаривали до водного остатка.
Цитокинины, содержащиеся в аликвоте водного остатка, концентрировали на картридже С-18. Картридж С-18 уравновешивали дистиллированной водой. Водный остаток, предварительно осветленный центрифугированием, наносили на колонку, которую затем промывали 20 мл дистиллированной воды. Цитокинины элюировали 70%-ным спиртом, упаривали досуха.
Экстракцию АБК и ИУК из аликвоты водного остатка проводили по модифицированной схеме с уменьшением объема [16]. Водный остаток подкисляли до рН 2.0–3.0 1 н. раствором HCl, затем экстрагировали диэтиловым эфиром (дважды) в соотношении 1 : 5 (органическая фаза : водная фаза). Из объединенной органической фазы АБК и ИУК реэкстрагировали 1%-ным раствором гидрокарбоната натрия, взятым в соотношении 1 : 3 (водная фаза : органическая фаза). Органическую фазу отделяли и отбрасывали, а из водной (после подкисления до рН 2.0–3.0) вновь дважды извлекали гормоны диэтиловым эфиром и метилировали их диазометаном. Диазометан получали из нитрозометилмочевины. Для этого в колбу помещали 40%-ный раствор KОН и эфир в соотношении 1 : 3 и при постоянном помешивании на магнитной мешалке небольшими порциями прибавляли 3–5 г нитрозометилмочевины. Через 10 мин сливали раствор диазометана в эфире, который при комнатной температуре добавляли к образцам до сохранения устойчивого слабого пожелтения. После завершения реакции образцы упаривали досуха и непосредственно перед проведением иммуноферментного анализа растворяли в 100 мкл 80%-ного этанола.
Иммуноферментный анализ проводили в лунках полистиролового планшета (Castar). На первом этапе конъюгат гормона с белком сорбировали на твердой фазе (полистироле). Для этого предварительно разбавленный конъюгат в 0.05 М карбонатном буфере разливали по 200 мкл в каждую лунку и выдерживали в течение 2 ч при 37°С. После трехкратной промывки физиологическим раствором, содержащим 0.05% поверхностно активного вещества Tween-20 (ФТ) рН 6.8–7.0 (этот же раствор использовали на всех последующих стадиях промывки), в лунки вносили антисыворотку к гормону (по 100 мкл на лунку), разведенную физиологическим раствором, содержащим 0.5% бычьего сывороточного альбумина и 0.05% твина 20 (ФТО), вместе с раствором стандарта гормона или растительным экстрактом. Инкубировали при 37°С в течение 1 ч, затем промывали лунки раствором ФТ. Для определения количества сыворотки, прореагировавшей с сорбированными в лунках белковыми конъюгатами гормонов, использовали препарат антикроличьих бараньих антител, меченных пероксидазой. Этот препарат, разведенный в ФТО, разливали в лунки по 200 мкл и инкубировали 1 ч при 37°С, после окончания инкубации промывали ФТ. Количество иммуносорбированных антител определяли по цветной реакции субстрата (0.4 мг ортофенилендиамина/мл в 0.06 М фосфатном буфере рН 5.0, содержащем 0.006% пероксида водорода). Субстрат разливали по 200 мкл в каждую лунку планшета. Цветная реакция развивалась в течение 15–30 мин, затем ее останавливали 4 н. серной кислотой (по 50 мкл в лунку). Оптическую плотность измеряли на фотометре “Titertek-Uniskan” при длине волны 492 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При изучении строения почек P. anomala выявлено наличие вегетативных и генеративно-вегетативных (смешанных) почек возобновления, в которых заложены генеративный побег будущего года и боковые (пазушные) почки в пазухах покровных чешуй, т.е. почке возобновления P. anomala характерно внутрипочечное ветвление – формирование боковых почек на побеге в период его внутрипочечного роста.
Пазушные почки особенно хорошо различимы весной, когда почка возобновления развивается в побег (рис. 1).
Рис. 1.
Схема расположения боковых почек при отрастании почки возобновления Paeonia anomala L.: 1 – резервные боковые почки, выносящиеся на поверхность почвы, 2 – покровные чешуи, 3 – резервные боковые почки на подземной части стебля, 4 – боковые почки возобновления, 5 – спящие боковые почки (по Назаровой, 1983).
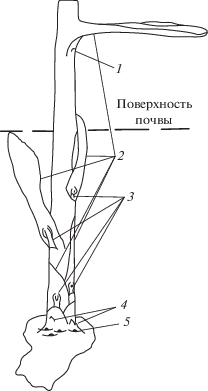
При введении боковых почек P. anomala в культуру in vitro экспланты различались по жизнеспособности, темпам роста и развития на начальных этапах культивирования. Полагаем, это связано с разнокачественностью боковых почек в пределах материнской почки возобновления. Жизнеспособность изолированных боковых почек уменьшалась в базипетальном направлении по оси почки возобновления (рис. 2).
Рис. 2.
Зависимость жизнеспособности боковых почек Paeonia anomala L. in vitro от их размеров и ярусного расположения.

Наименьшей жизнеспособностью в условиях культуры in vitro обладали более мелкие почки в пазухах нижних покровных чешуй – спящие. Резервные почки, наиболее крупные и дифференцированные, превосходили пазушные почки возобновления по интенсивности роста стебля, количеству листьев и жизнеспособности на начальных этапах культивирования. Различия в развитии между почками возобновления и резервными почками сглаживались вследствие действия экзогенных регуляторов роста, введенных в питательную среду.
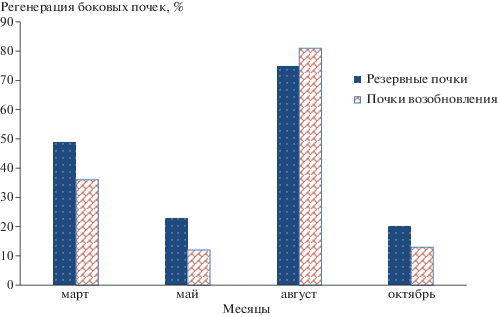
Изолирование боковых почек в культуру in vitro в различные сроки в течение года выявило различную регенерационную активность боковых почек: самая низкая – у почек, изолированных в мае, в период активного отрастания побегов и в октябре – при переходе от скрытого роста к покою. Некоторое повышение активности наблюдали у почек, изолированных в марте до начала отрастания побегов. Установлен активный рост почек in vitro в августе – в период окончания формирования почек возобновления (рис. 3). В этот период отмечена максимальная жизнеспособность почек. Несомненно, что это связано с физиологическим состоянием исходного растения в период, когда изолируется эксплант, с изменением биохимических ритмов метаболизма веществ, в том числе и фитогормонов, при прохождении растением периодов роста и покоя.
Рис. 3.
Регенерационная активность боковых почек Paeonia anomala L. in vitro, изолированных в разные сроки.
Учитывая большое значение баланса эндогенных фитогормонов в определении тотипотентности клеток, естественно предположить, что компетентность клеток к регенерации в значительной степени обусловлена количеством и соотношением эндогенных гормонов. Ответная реакция зависит не только от концентрации экзогенного гормона, введенного в питательную среду, но и от эндогенного содержания фитогормона в тканях растений и соотношения с другими группами гормонов. Поэтому, прежде чем подобрать оптимальные концентрации и соотношение фитогормонов в питательной среде для культивирования эксплантов, было интересно определить содержание эндогенных гормонов в боковых почках P. anomala в годичном цикле развития перед их введением в культуру in vitro.
Сравнение содержания фитогормонов в течение года позволило учесть уровень их в почках при инокуляции в определенный срок или выбрать оптимальное время изоляции боковых почек. Результаты иммуноферментного анализа экстрактов из почек по содержанию различных групп фитогормонов представлены на рис. 4. В боковых почках пиона уклоняющегося обнаружены вещества цитокининовой природы, индолил-3-уксусная кислота (ИУК) и абсцизовая кислота (АБК), содержание которых менялось в зависимости от времени года.
Рис. 4.
Динамика содержания эндогенных гормонов: а – в боковых почках возобновления, б – в резервных боковых почках Paeonia anomala L.
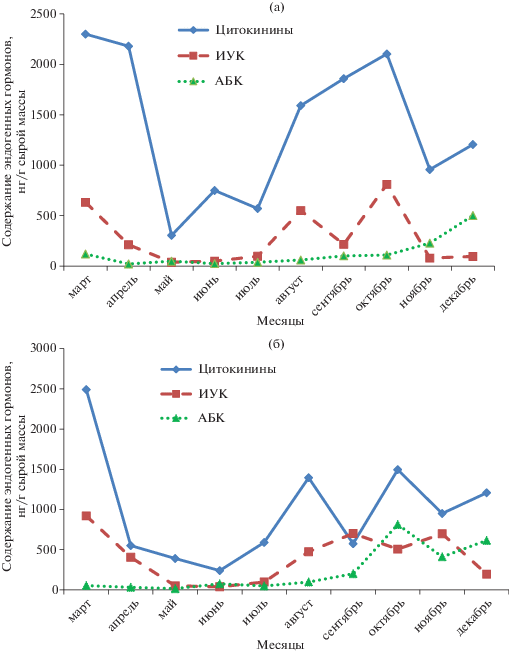
В весенние месяцы происходит распускание почек возобновления, активный рост однолетних побегов. Этот период связан с высокой активностью физиологических процессов, а также высокой морфогенетической потенцией почек. В марте обнаружено наиболее высокое содержание ауксина и цитокининов в боковых почках P. anomala.
В основе управления ростом и дифференциацией клеток и тканей лежит количественное соотношение фитогормонов – цитокининов и ауксинов. В апреле содержание цитокининов и ИУК резко уменьшалось и находилось на низком уровне вплоть до июня. Содержание гормонов было еще достаточно низким и в июле, увеличение их содержания наблюдали в августе, новый спад – в октябре–ноябре.
Известно, что в летне-осеннее время в растениях происходят процессы формирования и дифференциации почек, а ауксины играют роль стимуляторов этих процессов [17]. По нашим данным, боковые почки усиленно растут с июля по октябрь, накапливают питательные вещества, и именно в это время у них активизируются морфофизиологические процессы в условиях in vitro. В зимнее время содержание ауксинов пониженное, а содержание цитокининов повышается в период покоя.
Согласно полученным результатам, максимальный уровень содержания цитокининов в почках наблюдали в период покоя, минимальный – при их раскрытии. Необходимо отметить, что в данной работе использован метод определения суммарного содержания цитокининов, иммунореактивных в тест-системе с антителами к рибозиду зеатина. Этот подход позволяет определять не только свободный зеатин, но и связанные формы. Примененные методы экстракции ИУК и АБК позволили определять только свободные формы фитогормонов. Поэтому не исключено, что высокий уровень содержания цитокининов в покоящихся почках отражает накопление запасной формы гормона.
В литературе имеется материал, свидетельствующий об увеличении соержания АБК при воздействии на растения неблагоприятных факторов среды [18, 19]. Именно этому фитогормону отводят решающую роль в регуляции защитных реакций растительных организмов в ответ на стресс [20]. С наличием естественных ингибиторов связывают такие явления, как покой почек и других органов (например, запасающих) [21]. По нашим данным, содержание абсцизовой кислоты в тканях почек было сравнительно низким с апреля по ноябрь. Наибольшее ее содержание выявлено в период с декабря по март, и это согласовалось с тем, что в это время почки находятся в состоянии вынужденного покоя.
Высокое содержание ИУК и цитокининов, а также низкое содержание АБК в боковых почках пиона уклоняющегося приходилось на март и с августа по октябрь. Логично вводить в культуру in vitro боковые почки именно в эти периоды времени. Регенерационная активность боковых почек была наиболее низкой в мае, когда содержание цитокининов в них было минимальным, что подтверждает роль эндогенных гормонов в способности эксплантов к регенерации. Введение пазушных почек в августе позволило достичь минимума инфицированности (10% для резервных боковых почек и 14% для боковых почек возобновления) и максимума жизнеспособных и неинфицированных (75% для резервных боковых почек и 81% для боковых почек возобновления) эксплантов. Оптимальным временем для введения в культуру in vitro боковых почек является август, однако в августе содержание цитокининов и ауксинов было меньше, чем в марте и октябре, поэтому необходимо было дополнительное внесение в питательную среду экзогенных гормонов для индукции побегов – БАП 0.5–1.0 мг/л, ИУК 1.0 мг/л.
Таким образом, содержание гормонов в почках пиона уклоняющегося соответствовало периоду годичного цикла развития растения. Очевидно, что морфогенная активность почек, изолированных в разные периоды, связана с уровнем эндогенных фитогормонов. На основании полученных данных появилась возможность регулировать концентрации фитогормонов (в частности, цитокининов и ИУК), добавляемых в питательную среду, для культивирования боковых почек in vitro в соответствии с периодом развития P. anomala при изолировании эксплантов с донорных растений. Наибольшие рост и развитие эксплантов пиона уклоняющегося при введении в культуру отмечены для инокуляции почек, характеризующихся повышенным содержанием цитокининов, ауксина и низким содержанием АБК.
ЗАКЛЮЧЕНИЕ
С использованием метода твердофазного иммуноферментного анализа показано, что развитие эксплантов P. anomala при введении в культуру in vitro зависело от содержания эндогенных ауксина и цитокининов в почках перед инокуляцией и расположения их на побеге.
Учитывая соотношение основных фитогормонов P. anomala экспланты необходимо отбирать в тот период, когда им характерно максимальное содержание ЦК и ИУК и минимальное содержание АБК в свободной форме, а именно в марте и с августа по октябрь. Осведомленность об уровне эндогенных фитогормонов позволяет управлять развитием эксплантов in vitro путем изменения концентрации и соотношения экзогенных регуляторов роста в питательной среде.
Результаты проведенной работы расширяют представление о роли эндогенных фитогормонов в процессах роста и развития, могут служить основой для разработки эффективных методов размножения in vitro редкого вида растения P. anomala L. с применением экзогенных регуляторов роста.
Список литературы
Красная книга Республики Башкортостан: в 2 т. Т. 1. Растения и грибы / Под ред. Миркина Б.М. Уфа: МедиаПринт, 2011. 125 с.
Фоменко Т.И., Бердичевец Л.Г., Малюш М.К., Чумакова И.М. Влияние эндогенного и экзогенного действия гормонов на процесс каллусообразования и морфогенез у табака // Мат-лы регион. научн. конф. “Клеточные ядра растений – экспрессия и реконструкция”. Минск, 2001. С. 152–158.
Хмара К.А. Динамика содержания фитогормонов в каллусной ткани при индукции органогенеза in vitro зародышей Picea abies [L.] Karst. // Тр. Карел. НЦ РАН. 2011. № 3. С. 131–136.
Бычкова О.В., Ерещенко Д.В., Розова М.А. Сравнительная оценка использования зрелых и незрелых зародышей яровой твердой пшеницы в культуре in vitro // Acta Biol. Sibir. 2016. № 2 (2). С. 76–80.
Сельдимирова О.А., Круглова Н.Н., Зинатуллина А.Е. Роль фитогормонов в индукции каллусогенеза и регуляции путей морфогенеза каллуса злаков in vitro: обзор проблемы // Научн. результат. Физиология. 2017. Т. 3. № 1. С. 8–13.
Иванова А.Б. Современные аспекты изучения фитогормонов. Цитокинины // Цитология. 2001. № 6. С. 537–544.
Bajguz A., Piotrowska A. Conjugates of auxin and cytokinin // Phytochemistry. 2009. V. 70. № 8. P. 957–969.
Шейко Е.А. Гормональный комплекс растений как один из основополагающих факторов успешного введения в культуру in vitro // Электр. период. журн. “SCI-ARTICLE.RU”. 2013. № 1 (сентябрь). С. 7–14.
Кутас Е.Н., Малахова И.Н., Горецкая А.А. Регенерационный потенциал селекционных гибридов (сем. Vacciniceae S.F. Gray) в зависимости от типа экспланта / Изв. НАН Беларуси. 2011. № 1. С. 13–15.
Бутенко Р.Г. Культура изолированных тканей и физиология морфогенеза растений. М.: Наука, 1964. 272 с.
Калинин В.Ф., Сарнацкая В.В., Полищук В.Е. Методы культуры тканей в физиологии и биохимии растений. М.: Наук. думка, 1980. 488 с.
Murashige T., Scoog F.A. A revised medium for rapid growth and bioassays with tobacco tissue cultures // Physiol. Plant. 1962. V. 15. № 3. P. 473–497.
Кудоярова Г.Р., Веселов С.Ю., Еркеев М.И. Иммуноферментное определение содержания индолил-уксусной кислоты в семенах кукурузы с использованием меченых тел // Физиология растений. 1986. Т. 33. № 6. С. 1221–1227.
Кудоярова Г.Р., Веселов С.Ю., Каравайко Н.Н. Иммуноферментная тест-система для определения цитокининов // Физиология растений. 1989. Т. 37. № 1. С. 80–89.
Иммуноанализ регуляторов роста в решении проблем физиологии растений, растениеводства и биотехнологии / Под ред. Кудояровой Г.Р. Уфа: АН РБ, 2000. 223 с.
Veselov S.U., Kudoyarova G.R., Egutkin N.L., Gyuli-Zade V.Z., Mustafina A.R., Kof E.M. Modified solvent patitioning schemeproviding increased specificity and rapidity of immunoassay for IAA // Physiol. Plantarum. 1992. V. 86. P. 93–96.
Медведев С.С. Физиология растений. СПб.: Изд-во СПбГУ, 2004. 234 с.
Полевой В.В. Фитогормоны. Л.: Изд-во ЛГУ, 1982. 248 с.
Сельскохозяйственная биотехнология / Под ред. Шевелухи В.С. М.: Высш. шк., 2008. 710 с.
Шакирова Ф.М. Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция. Уфа: Гилем, 2001. 160 с.
Полевой В.В., Саламатова Т.С. Физиология роста и развития растений. Л.: Изд-во ЛГУ, 1991. 239 с.
Дополнительные материалы отсутствуют.


