Агрохимия, 2020, № 1, стр. 58-69
ПОТЕРИ Ca, Mg, K, Na, Fe И F ИЗ ОРОШАЕМОЙ ЛУГОВО-СЕРОЗЕМНОЙ ПОЧВЫ В РЕЗУЛЬТАТЕ МИГРАЦИИ. ЭМПИРИЧЕСКИЕ МОДЕЛИ ПРОЦЕССА ЭЛЮВИИРОВАНИЯ (ПО ДАННЫМ ЛАБОРАТОРНОГО ОПЫТА)
А. В. Литвинович 1, *, О. Ю. Павлова 1, А. В. Лаврищев 2, В. М. Буре 1, 3
1 Агрофизический научно-исследовательский институт
196600 С.-Петербург–Пушкин, шоссе Подбельского, 7, Россия
2 Санкт-Петербургский государственный аграрный университет
196601 С.-Петербург–Пушкин, Петербургское шоссе, 2, Россия
3 Санкт-Петербургский государственный университет
199034 С.-Петербург, Университетская наб., 7–9, Россия
* E-mail: avlavr@rambler.ru
Поступила в редакцию 31.01.2019
После доработки 12.04.2019
Принята к публикации 10.10.2019
Аннотация
Орошение лугово-сероземной супесчаной почвы сопровождалось вовлечением в миграционные потоки больших количеств щелочных и щелочно-земельных металлов. Запас подвижных катионов был весьма значителен. По способности к выщелачиванию их можно выстроить в следующий по убыванию ряд: Na > Ca > Mg > K. Средняя скорость вымывания для Ca и K составила: $v$ = –35.2, и –3.98 мг/л, для Na и Mg: $v$ = –16.1 и –1.16 мг/л соответственно. В результате многократного промывания почвы ни для одного из изученных катионов не удалось достичь полного удаления водорастворимых форм. Миграция железа не установлена. Потери фтора с промывной влагой были также весьма значительными. Средняя скорость потерь при его миграции составила: $v$ = –0.176 мг/л. Выявлена разной силы положительная связь между содержанием фтора и натрия, кальция, калия и магния в фильтратах. Разработаны эмпирические модели, адекватно описывающие процессы миграции щелочных, щелочноземельных металлов и фтора из лугово-сероземной почвы при промывании.
ВВЕДЕНИЕ
Нисходящая миграция растворенных веществ играет важную роль в формировании почв с промывным водным режимом. Масштаб миграции отдельных элементов весьма значителен, а аналитические исследования фиксируют обеднение верхней части профиля типоморфными элементами и основаниями.
Жидкая фаза почв является наиболее простой и доступной для изучения. Накоплен обширный объем первичной информации о составе почвенных растворов подзолистых, луговых, серых лесных и черноземных почв [1–7]. Прослежены изменения состава лизиметрических вод при вовлечении почв в хозяйственный оборот [8, 9]. Есть данные о составе жидкой фазы почв, испытывающих техногенное загрязнение [10, 11].
Земледельческое использование почв аридных регионов немыслимо без проведения ирригационных мероприятий. Орошение ведется по бороздам. Потери влаги при фильтрации достигают больших объемов. Вода в борозды подается непрерывно, без учета как фактической, так и плановой нормы оросительной влаги [12]. Например, на территории Ферганской долины (Узбекистан) при возделывании хлопчатника рекомендованная оросительная норма составляет 8000 м3/га при разовой норме полива от 700 до 900 м3 в начале вегетации, 800–1200 м3 – во время цветения и плодоношения и 650–800 м3 – во время созревания [12]. Фактический расход воды при однократном поливе достигает 1600–2000 м3 и более [13]. Это приводит к тому, что профиль орошаемых почв за сезон промачивается многократно, что дало основания А.А. Роде [14] классифицировать водный режим орошаемых почв Средней Азии как ирригационный, для которого характерно многократное и глубокое (сквозное и не сквозное) за сезон промачивание профиля.
Изучением жидкой фазы почв Средней Азии в разные годы занимались многие исследователи [15–21]. Эти работы посвящены в основном засоленным и гипсоносным почвам.
Материалы сопряженного изучения масштаба потерь щелочных, щелочноземельных металлов и фтора при орошении техногенно-загрязненных почв, используемых для возделывания хлопчатника, в литературе отсутствуют. Не разработаны математические модели, адекватно описывающие потери кальция, магния, калия, натрия и фтора в результате элювиирования.
Цель работы – в лабораторном опыте на колонках (воронках) установить миграционную способность железа, кальция, магния, калия, натрия и фтора при орошении хлопчатника в почве, испытывающей техногенное загрязнение фтором, и провести ранжирование отдельных элементов по их способности к миграции.
В задачи исследования входило:
– определить “фонд” способных к миграции катионов железа, кальция, магния, калия, натрия и фтора при многократном промывании почвы;
– разработать эмпирические модели, адекватно описывающие миграционные потери химических элементов при орошении; рассчитать среднюю скорость утраты оснований по мере увеличения объема просочившейся влаги;
– установить корреляционную связь межу количеством вымываемого фтора и потерей кальция, магния, калия, натрия.
МЕТОДИКА ИССЛЕДОВАНИЯ
Для проведения опыта на колонках почва была отобрана из пахотного слоя 0–25 см. Поле расположено на расстоянии 3.5 км от предприятия по производству аммофоса (г. Коканд, Узбекистан). В составе выбросов предприятия наибольшую угрозу представляют выбросы фтора.
Почва занята посевами хлопчатника. Физико-химическая характеристика почвы следующая: содержание частиц <0.01 мм – 15.7%, рН$_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}$ 8.1, гумус – 0.8%, валовое содержание фтора – 437 мг/кг почвы. Это соответствует данным, приведенным в работе [22] для карбонатных почв. Содержание водорастворимого фтора – 5.5 мг/кг почвы. Валовой химический состав почвы приведен в табл. 1.
Таблица 1.
Валовой химический состав лугово-сероземной почвы, %
| SiO2 | Al2O3 | Fe2O3 | CaO | MgO | MnO | Na2O | P2O5 | SO3 | K2O |
|---|---|---|---|---|---|---|---|---|---|
| 57.5 | 10.9 | 4.61 | 9.53 | 2.51 | 0.07 | 1.72 | 0.24 | <0.05 | 1.8 |
Перед набивкой в воронки почву высушивали и измельчали, пропуская сквозь сито с диаметром ячеек 1 мм. Масса почвы в воронке – 300 г. Высота почвенного слоя – 17 см. Плотность набивки – 1.0–1.1 г/см3. Для разового промывания использовали 125 мл дистиллированной воды. Всего проведено 24 промывания. Общий объем просочившейся влаги – 3 л. Промежуток времени между отдельными промачиваниями почвы – не более 1–2 сут. Повторность четырехкратная. В элюатах каждой промывки устанавливали концентрацию фтора, кальция, магния, калия, натрия и железа.
Фтор в промывных водах определяли, используя фтор-селективный электрод. Концентрацию металлов устанавливали на рентгенфлюоресцентном спектрофотометре. Данные определений обрабатывали статистически [23].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты изучения содержания химических элементов в промывных водах отдельных порций фильтратов сведены в табл. 2. Валовое содержание натрия в изученной почве в пересчете на Na2O составляло 1.72%. В почвах натрий присутствует в 3 основных формах: необменной, обменной и водорастворимой. Для натрия характерны сравнительно слабая роль биологического круговорота в ландшафтах и большая величина водной миграции [24].
Таблица 2.
Количество вымываемых элементов
| № промывания | Ca | Mg | Na | K | F |
|---|---|---|---|---|---|
| 1 | $\frac{{645 \pm 13}}{{80.6}}$ | $\frac{{460 \pm 10}}{{57.5}}$ | $\frac{{42\,500 \pm 11}}{{5300}}$ | $\frac{{216 \pm 5}}{{27.0}}$ | $\frac{{3.9 \pm 0.4}}{{0.49}}$ |
| 2 | $\frac{{635 \pm 12}}{{79.4}}$ | $\frac{{105 \pm 6}}{{13.1}}$ | $\frac{{2750 \pm 14}}{{344}}$ | $\frac{{92.3 \pm 2.5}}{{11.5}}$ | $\frac{{3.7 \pm 0.3}}{{0.46}}$ |
| 3 | $\frac{{660 \pm 16}}{{82.5}}$ | $\frac{{60 \pm 4}}{{7.5}}$ | $\frac{{690 \pm 11}}{{86.3}}$ | $\frac{{66.4 \pm 1.4}}{{8.3}}$ | $\frac{{3.7 \pm 0.4}}{{0.46}}$ |
| 4 | $\frac{{690 \pm 9}}{{86.3}}$ | $\frac{{29 \pm 2}}{{3.6}}$ | $\frac{{520 \pm 8}}{{65.0}}$ | $\frac{{41.1 \pm 1.2}}{{5.13}}$ | $\frac{{3.4 \pm 0.5}}{{0.43}}$ |
| 5 | $\frac{{795 \pm 12}}{{99.4}}$ | $\frac{{13 \pm 1}}{{1.6}}$ | $\frac{{240 \pm 6}}{{30.0}}$ | $\frac{{26.4 \pm 0.8}}{{3.3}}$ | $\frac{{3.8 \pm 0.5}}{{0.48}}$ |
| 6 | $\frac{{820 \pm 18}}{{103}}$ | $\frac{{5.5 \pm 0.8}}{{0.7}}$ | $\frac{{280 \pm 6}}{{35.0}}$ | $\frac{{18.3 \pm 0.9}}{{2.28}}$ | $\frac{{4.3 \pm 0.6}}{{0.54}}$ |
| 7 | $\frac{{595 \pm 12}}{{74.4}}$ | $\frac{{1.5 \pm 0.1}}{{0.2}}$ | $\frac{{165 \pm 7}}{{20.6}}$ | $\frac{{13.3 \pm 0.9}}{{1.66}}$ | $\frac{{3.3 \pm 0.8}}{{0.42}}$ |
| 8 | $\frac{{210 \pm 8}}{{26.3}}$ | $\frac{{0.29 \pm 0.03}}{{0.04}}$ | $\frac{{100 \pm 5}}{{12.5}}$ | $\frac{{10.5 \pm 0.2}}{{1.31}}$ | $\frac{{2.09 \pm 0.04}}{{0.26}}$ |
| 9 | $\frac{{43 \pm 6}}{{5.4}}$ | $\frac{{0.32 \pm 0.02}}{{0.04}}$ | $\frac{{162 \pm 5}}{{20.3}}$ | $\frac{{9.1 \pm 0.1}}{{1.14}}$ | $\frac{{2.00 \pm 0.03}}{{0.25}}$ |
| 10 | $\frac{{85 \pm 7}}{{10.6}}$ | $\frac{{1.35 \pm 0.04}}{{0.17}}$ | $\frac{{290 \pm 5}}{{36.3}}$ | $\frac{{25.7 \pm 0.4}}{{3.2}}$ | $\frac{{1.8 \pm 0.1}}{{0.23}}$ |
| 11 | $\frac{{40 \pm 5}}{{5.0}}$ | $\frac{{0.86 \pm 0.05}}{{0.11}}$ | $\frac{{210 \pm 4}}{{26.3}}$ | $\frac{{11.2 \pm 0.5}}{{1.4}}$ | $\frac{{1.61 \pm 0.04}}{{0.20}}$ |
| 12 | $\frac{{58 \pm 9}}{{7.3}}$ | $\frac{{1.2 \pm 0.1}}{{0.14}}$ | $\frac{{205 \pm 4}}{{26.2}}$ | $\frac{{7.06 \pm 0.09}}{{0.88}}$ | $\frac{{1.53 \pm 0.05}}{{0.18}}$ |
| 13 | $\frac{{38 \pm 5}}{{4.75}}$ | $\frac{{0.92 \pm 0.2}}{{0.12}}$ | $\frac{{174 \pm 5}}{{21.75}}$ | $\frac{{7.06 \pm 0.05}}{{0.88}}$ | $\frac{{1.52 \pm 0.01}}{{0.19}}$ |
| 14 | $\frac{{27 \pm 3}}{{3.4}}$ | $\frac{{0.81 \pm 0.09}}{{0.10}}$ | $\frac{{144 \pm 7}}{{18.0}}$ | $\frac{{11.6 \pm 0.1}}{{1.45}}$ | $\frac{{1.30 \pm 0.02}}{{0.16}}$ |
| 15 | $\frac{{22 \pm 2}}{{2.8}}$ | $\frac{{0.76 \pm 0.06}}{{0.095}}$ | $\frac{{132 \pm 6}}{{16.9}}$ | $\frac{{10.0 \pm 0.3}}{{1.26}}$ | $\frac{{1.02 \pm 0.03}}{{0.13}}$ |
| 16 | $\frac{{20 \pm 2}}{{2.5}}$ | $\frac{{0.68 \pm 0.05}}{{0.09}}$ | $\frac{{114 \pm 6}}{{14.3}}$ | $\frac{{14.5 \pm 0.5}}{{1.82}}$ | $\frac{{1.0 \pm 0.1}}{{0.13}}$ |
| 17 | $\frac{{20 \pm 2}}{{2.5}}$ | $\frac{{0.78 \pm 0.04}}{{0.098}}$ | $\frac{{78 \pm 1}}{{9.75}}$ | $\frac{{7.1 \pm 0.2}}{{0.88}}$ | $\frac{{0.98 \pm 0.01}}{{0.13}}$ |
| 18 | $\frac{{25 \pm 1}}{{3.1}}$ | $\frac{{0.85 \pm 0.06}}{{0.11}}$ | $\frac{{120 \pm 3}}{{15.0}}$ | $\frac{{9.6 \pm 1.0}}{{1.19}}$ | $\frac{{0.90 \pm 0.02}}{{0.11}}$ |
| 19 | $\frac{{56 \pm 4}}{{7.0}}$ | $\frac{{0.91 \pm 0.04}}{{0.11}}$ | $\frac{{80 \pm 3}}{{10.0}}$ | $\frac{{3.9 \pm 0.5}}{{0.49}}$ | $\frac{{0.85 \pm 0.03}}{{0.11}}$ |
| 20 | $\frac{{25 \pm 2}}{{3.1}}$ | $\frac{{0.82 \pm 0.05}}{{0.10}}$ | $\frac{{120 \pm 3}}{{15.0}}$ | $\frac{{5.8 \pm 0.4}}{{0.73}}$ | $\frac{{0.70 \pm 0.02}}{{0.09}}$ |
| 21 | $\frac{{22 \pm 1}}{{2.8}}$ | $\frac{{0.81 \pm 0.04}}{{0.10}}$ | $\frac{{90 \pm 5}}{{11.25}}$ | $\frac{{3.73 \pm 0.2}}{{0.47}}$ | $\frac{{0.51 \pm 0.01}}{{0.06}}$ |
| 22 | $\frac{{17 \pm 2}}{{2.1}}$ | $\frac{{0.70 \pm 0.05}}{{0.09}}$ | $\frac{{132 \pm 5}}{{16.5}}$ | $\frac{{3.32 \pm 0.02}}{{0.42}}$ | $\frac{{0.40 \pm 0.01}}{{0.05}}$ |
| 23 | $\frac{{19 \pm 1}}{{2.4}}$ | $\frac{{0.76 \pm 0.07}}{{0.095}}$ | $\frac{{90 \pm 6}}{{11.3}}$ | $\frac{{3.7 \pm 0.5}}{{0.47}}$ | $\frac{{0.36 \pm 0.05}}{{0.05}}$ |
| 24 | $\frac{{20 \pm 3}}{{2.5}}$ | $\frac{{0.82 \pm 0.04}}{{0.10}}$ | $\frac{{102 \pm 6}}{{12.75}}$ | $\frac{{4.6 \pm 0.4}}{{0.57}}$ | $\frac{{0.30 \pm 0.05}}{{0.04}}$ |
| Сумма, мг | 698 | 86.0 | 6190 | 77.8 | 5.7 |
В нашем исследовании натрий характеризовался наибольшей податливостью к вымыванию. В элюате первого промывания его концентрация составила 42.5 г/л. В промывных водах 2-го срока она снижалась в 15 раз. Всего за 2 промывания концентрация натрия в промывных водах уменьшилась более чем в 60 раз. По мере увеличения объема просочившейся влаги содержание натрия продолжало снижаться. В элюате последнего промывания его концентрация оставалась высокой и составила 102 мг/л. Следовательно, полного удаления водорастворимых форм этого элемента достичь не удалось. Всего за время проведения опыта было вымыто 6190 мг натрия.
Таким образом, “фонд” способных к миграции соединений натрия в изученной почве очень велик, а ведение поливного земледелия способствует перемещению больших масс этого элемента в нижележащие слои почвенного профиля.
Поскольку концентрация натрия в первые 2 срока промывания снижалась очень резко, экспоненциальной зависимости, чтобы описать динамику изменения содержания этого элемента в фильтратах во всем временнóм промежутке изучения, оказалось недостаточно. Построение эмпирических моделей пришлось начинать с 3-го срока. Причем последующее изменение концентрации натрия в промывных водах происходило также настолько резко, что экспоненциальную зависимость использовать все же пришлось.
Линейная эмпирическая модель динамики содержания Na в промывных водах имеет вид:
где t – сроки (условное время t > 2).Средняя скорость динамики содержания Na в промежутке от 3-го до 24-го промываний: ${{v}_{1}}$ = = ‒16.1 мг/л.
Эмпирическая модель (1.1) статистически значима на высоком уровне значимости 0.1% (статистика F принимает величину F = 19.6 при критической величине F(0.999, 1.20) = 14.8). Коэффициент детерминации R2 = 0.49. График модели (1.1) приведен на рис. 1.
Эмпирическую модель динамики содержания Na строили на основе многочлена 2-й степени и экспоненты:
где t – сроки (условное время t > 2).В начале данные динамики содержания Na логарифмировали и строили эмпирическую модель на основе многочлена 2-й степени, которая оказалась статистически значимой на высоком уровне значимости 0.01% (статистика F принимает величину F = 22.8 при критической величине F(0.9999, 2.19) = 15.5). Коэффициент детерминации R2 = 0.7.
Далее использовали экспоненту для построения эмпирической модели (1.2) динамики содержания Na. График модели (1.2) приведен на рис. 1.
Вторым по способности к миграции катионом в изученной почве являлся кальций. На сегодняшний день проведено значительное количество исследований по выявлению основных факторов, влияющих на потерю кальция из почв с фильтрующейся влагой атмосферных осадков [25–27]. Среди них наибольшую величину имеют следующие: степень насыщенности поглощающего комплекса почвы кальцием, наличие “свободных” (не прореагировавших) карбонатов, наличие гипса, гранулометрический состав почвы и гидрологические факторы (количество и интенсивность выпадения осадков, температура воздуха и почвы).
Миграционная способность кальция в почвах с промывным типом водного режима достаточно хорошо освещена в литературе. Установлены количественные потери этого элемента в почвах различных регионов мира. Подробная сводка этих публикаций приведена в работе [28].
Высокую подвижность кальция принято объяснять слабой способностью гумуса удерживать кальций [29] и большим ионным радиусом этого элемента, не позволяющим ему необменно закрепляться в почвах [30].
Валовое содержание кальция в изученной почве было очень велико. В составе почвы это 3-й по количеству химический элемент после кремния и железа. В пересчете на CaO его содержание составляло 9.53%.
Кальций – единственный из всех изученных катионов, концентрация которого в промывных водах в начальный период исследования увеличивалась. Рост содержания отмечен до 6-го срока эксперимента. В этом интервале его концентрация менялась от 635 до 820 мг/л. В водах 9-го промывания она уменьшилась до 43 мг/л и далее до конца эксперимента варьировала от 17 до 85 мг/л. Полного удаления водорастворимого кальция в опыте в результате многократного промачивания достичь не удалось. Суммарный объем вымытого кальция составил 698 мг, что в 8.8 раза меньше, чем натрия.
Линейная эмпирическая модель динамики содержания Ca в промывных водах имеет вид:
где t – сроки (условное время).Средняя скорость динамики содержания Ca во всем временнóм промежутке наблюдений: ${{v}_{2}}$ = = –35.2 мг/л.
Эмпирическая модель (2.1) статистически значима на высоком уровне значимости 0.01% (статистика F принимает величину F = 42.6 при критической величине F(0.9999, 1.22) = 22.4) коэффициент детерминации R2 = 0.65. График модели (2.1) приведен на рис. 2.
Эмпирическая модель динамики содержания Ca на основе многочлена 4-й степени представляет собой уравнение:
(2.2)
$\begin{gathered} {{y}_{{2.2}}} = {\text{exp}}(5.49 + 0.94t - 0.2{{t}^{2}} \\ + \;0.012{{t}^{3}} - 0.0002{{t}^{4}}), \\ \end{gathered} $Эмпирическая модель (2.2) статистически значима на высоком уровне значимости 0.01% (статистика F принимает величину F = 68.29 при критической величине F(0.9999, 4.19) = 10.75). Коэффициент детерминации R2 = 0.93. График модели (2.2) приведен на рис. 2.
В почве, выбранной для исследования, валовое содержание MgO в 3.8 раза меньше содержания CaO. Магний – это катион, преимущественно октаэдрического слоя, поэтому он трудно вытесняется из решетки минералов в сравнении с кальцием, который является поглощенным внутрислойным катионом. На путях миграции магния возникают 3 основных геохимических барьера:
1 – биогеохимический (поглощение живым веществом);
2 – силикатный (образование вторичных силикатов);
3 – сорбционный (поглощение коллоидами глин и гумуса) [24].
Способность к миграции магния под действием просачивающейся влаги уступает кальцию. Для кальция не выражен силикатный барьер и слабо проявляется сорбционный.
Исследование показало, что характер миграции магния в почве близок к характеру миграции натрия и существенно отличается от кальция. Бóльшая часть водорастворимого магния была удалена из почвы за 3 первых промывания. Уже в фильтрате 2-го промывания установлено резкое уменьшение (с 460 до 105 мг/л) его концентрации. В фильтратах с 13-го по 24-е промывание изменения содержания были незначительными и укладывались в диапазон 0.92–0.68 мг/л. Полного удаления этого элемента в результате многократного промывания достичь не удалось. Суммарный объем вымытого магния составил 85.9 мг. Это в 13.6 раза меньше, чем количество вымытого кальция.
Ввиду крайне сильного и резкого уменьшения содержания Mg за первый и второй условные сроки (содержание Mg уменьшилось за первые 2 промывания более чем в 7 раз) эмпирические модели содержания Mg строили для условных сроков t = 3, 4, …, 24, т.е. для условных сроков t > 2.
Линейная эмпирическая модель динамики содержания Mg в промывных водах имеет вид:
где t – сроки (условное время t > 2).Средняя скорость динамики вымывания Mg для условных сроков t = 3, 4 … 24; ${{v}_{3}}$ = –1.16 мг/л.
Эмпирическая модель (3.1) статистически значима на высоком уровне значимости 1% (статистика F принимает величину F = 8.667 при критической величине F(0.99, 1.20) = 8.095). Коэффициент детерминации R2 = 0.3. График модели (3.1) приведен на рис. 3.
Эмпирическую модель динамики содержания Mg строили на основе многочлена 2-й степени и экспоненты:
где t – сроки (условное время t > 2).В начале данные динамики содержания Mg логарифмировали и строили эмпирическую модель на основе многочлена 2-й степени, которая оказалась статистически значимой на высоком уровне значимости 0.01% (статистика F принимает величину F = 22.86 при критической величине F(0.9999, 2.19) = 15.5). Коэффициент детерминации R2 = 0.7.
Далее, для построения эмпирической модели (3.2) динамики содержания Mg использовали экспоненту. График модели (3.2) приведен на рис. 3.
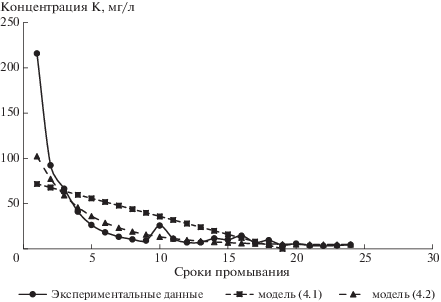
Валовое содержание K2O в изученной почве составляло 1.8%. Миграционная способность калия заметно уступала подвижности натрия и кальция. Катион калия энергично поглощается отрицательно заряженными коллоидами и прочно удерживается в адсорбируемом состоянии. Кроме того, калий входит в состав минерального скелета и в такой форме недоступен для вымывания.
Наиболее обогащенным калием оказались элюаты первого промывания (216 мг/л). В водах 2-го промачивания его концентрация уменьшилась до 92.3 мг/л. В процессе проведения эксперимента содержание калия в элюатах снижалось и к концу проведения опыта составляло 4.57 мг/л. Суммарный объем вымытого калия за весь период наблюдения составил 77.8 мг, что близко к количеству выщелачиваемого магния и в 79.5 и 8.97 раза меньше, чем объемы вымытого натрия и кальция соответственно.
Линейная эмпирическая модель динамики содержания K в промывных водах имеет вид:
где t – сроки (условное время).Средняя скорость динамики содержания K во всем временнóм промежутке наблюдений: ${{v}_{4}}$ = = –3.98 мг/л.
Эмпирическая модель (4.1) статистически значима на высоком уровне значимости 0.2% (статистика F принимает величину F = 13.4 при критической величине F(0.998, 1.22) = 12.28). Коэффициент детерминации R2 = 0.37. График модели (4.1) приведен на рис. 4.
Эмпирическую модель динамики содержания K строили на основе многочлена 2-й степени и экспоненты:
где t – сроки (условное время).В начале данные динамики содержания K логарифмировали и строили эмпирическую модель на основе многочлена 2-й степени, которая оказалась статистически значимой на высоком уровне значимости 0.01% (статистика F принимает величину F = 55.2 при критической величине F(0.9999, 2.21) = 14.7). Коэффициент детерминации R2 = 0.84.
Далее для построения эмпирической модели (4.2) динамики содержания калия использовали экспоненту. График модели (4.2) приведен на рис. 4.
Известно, что подвижность почвенного железа наиболее значительна в кислом интервале рН. Выбранная для исследования почва характеризовалась слабощелочной реакцией. Величина рН просачивающихся вод во всем временнóм промежутке изучения менялась незначительно, оставаясь в щелочном интервале 8.0–8.2 ед. рН. Именно этим следует объяснять то обстоятельство, что ни в одной из порций фильтрата не удалось установить наличие мигрирующего железа.
Накопление в почвах фтора происходит в результате оседания на них летучих выбросов предприятий химической и металлургической промышленности [31–33]. До 96% всех выбросов составляет фтористый водород. Существенным фактором, способствующим повышению содержания фтора в почвах сельскохозяйственного использования, является применение фторсодержащих удобрений и мелиорантов [31, 34, 35].
Фтор – активный металлоид, образующий со всеми элементами соединения различной растворимости. В результате происходит закрепление фтора почвенными компонентами. Весь фтор, содержащийся в почвах, можно разделить на следующие формы:
– силикатный, входящий в состав глинистых минералов;
– труднорастворимые аморфные соединения;
– водорастворимые минеральные соединения;
– органические и органо-минеральные соединения [36].
Тип почвы, ее гранулометрический состав, величина рН и концентрация фтора оказывают влияние на прочность фиксации этого элемента. В опыте [37] до 95% от внесенного количества фтора закреплялось тяжелым суглинком. Взаимодействие фтор-иона с глинистыми минералами проходит как прямое замещение фтор-ионов на легкодоступные OH–ионы внешних слоев минерала и как обмен в результате диффузии в кристаллическую решетку. Во втором случае прочность связи возрастает. Максимальную адсорбцию элемента отмечают в интервале рН 5.5–5.6. За пределами этого диапазона поглощение фтора ослабевает, особенно в щелочном интервале [38]. Вследствие невысокого содержания глинистых частиц и щелочной реакции выбранной для исследования почвы, по всей вероятности, удельный вес такого закрепления не велик.
Кальций способен осаждать фтор в составе труднорастворимого соединения CaF2. В модельном опыте [39] поглощение фторидов суспензией CaCO3 начиналось при концентрации фтора в растворе 4 × 10–4 моль/л. Существенно значимые количества фтора поглощались кальцитом при концентрации фтора >10–3 моль/л. В данном случае имела место хемосорбция. Происходил обмен фтора на ${\text{CO}}_{3}^{{ - 2}}$ с образованием CaF2. В том же опыте закрепление фтора глинистыми минералами, гидроокисью железа при щелочном рН снижалось. При снижении рН < 6.5 установлено увеличение поглощения фтора гумусовыми кислотами.
Роль кальция в закреплении фтор-иона в изученной почве в форме флюорита скорее всего была значительной. Однако само по себе образование флюорита уменьшало, но не могло до конца предохранить грунтовые воды от загрязнения, т.к. растворимость фтора в воде (2–8 мг/л) больше ПДК [40].
Результаты изучения миграции фтора свидетельствовали о значительной его подвижности в лугово-сероземной почве. В фильтрате первого промывания его концентрация составила 3.9 мг/л и к концу эксперимента снизилась до 0.3 мг/л. За 24 промывания полного удаления водорастворимого фтора не произошло. Лишь к 15-му промыванию концентрация фтора снизилась до величины, меньшей ПДК, установленной для 3-го климатического пояса (1.2 мг/л). Вероятно, в почвах существует динамическое равновесие между различными формами фтора.
Относительно плавное и постепенное снижение концентрации фтора в промывных водах дало возможность для адекватного описания процесса использовать многочлен 2-й степени.
Линейная эмпирическая модель динамики содержания фтора в промывных водах имеет вид:
где t – сроки (условное время).Средняя скорость динамики содержания фтора во всем временнóм промежутке наблюдений: ${{v}_{5}}$ = –0.176 мг/л.
Эмпирическая модель (5.1) статистически значима на высоком уровне значимости 0.01% (статистика F принимает величину F = 179.8 при критической величине F(0.9999, 1.22) = 22.4). Коэффициент детерминации R2 = 0.89. График модели (5.1) приведен на рис. 5.
Эмпирическая модель динамики содержания фтора на основе многочлена 2-й степени:
где t – сроки (условное время).Эмпирическая модель (5.2) статистически значима на высоком уровне значимости 0.01% (статистика F принимает величину F = 119 при критической величине F(0.9999, 2.21) = 14.7). Коэффициент детерминации R2 = 0.918. График модели (5.2) приведен на рис. 5.
В литературе имеются указания о влиянии гидрохимических факторов на вымывание фтора из почв. В работе [41] утверждали, что причину обогащения вод фтором следует искать не только в наличие в породах фторсодержащих минералов, но и в химическом составе вод. Например, в исследовании [42] установлена связь количества фтора в водах от соотношения солей натрия и кальция. В работе [43] показано, что в лабораторном опыте с фтором из почв вымывалось 20–40% содержащихся в них калия и натрия, но оставался кальций.
Высокая миграционная способность фтор-иона дает основание предположить, что привнесенные фториды вступают в соединения, в той или иной степени подверженные растворению. Способность фтор-содержащих минералов (соединений) разрушаться под действием высокоминерализованных щелочных вод установлена в работе [44].
Для выяснения этого вопроса проведен корреляционный анализ статистических связей между переходящими в фильтрат химическими элементами. Коэффициенты корреляции вычисляли попарно между содержаниями фтора и кальция, а также калия, натрия и магния. Расчеты показали, что между содержаниями фтора и кальция существует сильная положительная связь: r = 0.95. Корреляционная связь между содержаниями фтора и натриа, фтора и магния была слабой (r = = 0.36 и 0.45 соответственно). Связь между содержаниями фтора и калия – средняя положительная (r = 0.59). Все коэффициенты парной корреляции оказались положительными, что свидетельствовало о близком характере динамики показателей, соединенных в пары и согласованности рядов наблюдений. Можно предположить, что под действием просачивающейся влаги в первую очередь разрушаются соединения фтора с кальцием и калием и в меньшей степени – с натрием и магнием.
Построенные нелинейные эмпирические модели (1.2), (2.2), (3.2), (4.2), (5.2) позволили сделать вывод о том, что все проведенные эксперименты можно разбить на 3 группы:
в первую группу входит вариант с фтором. В этом варианте динамика изученного показателя имеет наиболее плавный и медленный характер среди всех остальных вариантов. Для адекватного описания динамики фтора достаточно использовать многочлен 2-й степени (модель (5.2));
во 2-ю группу входят варианты опыта с K и Са. В этих вариантах динамика изученных показателей имеет более резкий и быстрый характер. Для адекватного описания динамики недостаточно использовать алгебраические многочлены. Характер динамики изученных показателей таков, что необходимо использовать экспоненциальные зависимости (модели 4.2 и 2.2);
в 3-ю группу входят варианты с Na и Mg. В этих вариантах изученные показатели меняются наиболее резко и быстро. За 2 первых срока происходит значительное снижение изученных показателей. Для того, чтобы описать динамику во всем промежутке времени изучения, даже экспоненциальных зависимостей оказывается недостаточно. В связи с этим, построение эмпирических моделей приходится начинать с 3-го срока. При этом последующие изменения происходят также быстро. Это все же приводит к необходимости использовать экспоненциальные зависимости.
Древнеорошаемые почвы Средней Азии составляют основу “Золотого фонда” земель орошаемой зоны. Известно, что несмотря на невысокое содержание гумуса эти почвы имеют водопрочную микроструктуру, отличаются высокой буферностью, обладают слабощелочной или близко к нейтральной величиной рН. Им свойственна высокая биологическая активность [45]. В связи с этим возникает вопрос: как при таких масштабах миграции питательных веществ при орошении на протяжении более чем тысячелетнего срока ведения сельскохозяйственного производства этим почвам удается сохранить высокий уровень плодородия? Из литературы известна высокая способность N-NO3 и серы к перемещению в профиле с поливной влагой [46, 47]. При этом потери азота настолько значительны, что приводят к снижению урожая сельскохозяйственных культур и загрязнению источников водоснабжения [48].
Основной причиной высокого плодородия почв данного генезиса является систематический привнос с поливной влагой взвешенных наносов, водорастворимых питательных веществ и гумуса [49, 50]. По данным [49], ежегодно на поля в составе взвешенных наносов поступает (кг/га): CaCO3 – 2350, K2O – 485, P2O5 – 45, гумуса – 190 кг/га.
Таким образом, в орошаемых почвах проходят 2 противоположно направленных процесса: постоянный привнос на поверхность почвы питательных элементов и гумуса с поливной влагой и их выщелачивание в процессе орошения. В случае с техногенно-загрязненными почвами систематическое орошение не дает накапливаться в профиле значительного количества загрязняющих веществ [51]. Следовательно, поступающие с поливной влагой питательные элементы и гумус позволяют поддерживать высокий уровень плодородия орошаемых почв Средней Азии.
Кроме того, это также обусловлено более молодым возрастом древнеорошаемых почв. Их минеральная основа менее выветрена по сравнению с минеральной основой других типов почв пустынной зоны [52]. Последнее обстоятельство определяет повышенное содержание в них потенциальных резервов калия, фосфора, железа, микроэлементов.
ВЫВОДЫ
1. При орошении лугово-сероземной супесчаной почвы в миграционные потоки вовлекаются большие количества щелочных и щелочноземельных металлов. По способности к выщелачиванию их можно выстроить в следующий по убыванию ряд: Na > Ca > Mg > K. Средняя скорость вымывания для Ca и K во всем временнóм промежутке изучения составляла соответственно: $v$ = –35.2 и –3.98 мг/л; средняя скорость вымывания Na и Mg, начиная с 3-го по 24-й сроки составляла: $v$ = –16.1 и –1.16 мг/л соответственно.
2. В результате многократного промывания почвы ни для одного из изученных катионов не удалось достичь полного удаления водорастворимых форм изученных элементов. Запас подвижных катионов оказался весьма значителен. Миграции железа не установлено.
3. Потери фтора с промывной влагой также были весьма значительными. Средняя скорость потерь составляла: $v$ = –0.176 мг/л. Выявлена различной силы корреляционная связь между содержаниями фтора и натрия, кальция, калия и магния, содержавшихся в фильтратах.
4. Представлены эмпирические модели, адекватно описывающие процессы миграции щелочных, щелочноземельных металлов и фтора из лугово-сероземной почвы при промачивании.
Список литературы
Самойлова Е.Н. Луговые почвы лесостепи. М.: Изд-во МГУ, 1981. 284 с.
Скрынникова И.Н. Почвенные растворы южной части лесной зоны и их роль в современных процессах почвообразования // Современные почвенные процессы в лесной зоне Европейской части СССР. М., 1959. С. 50–169.
Быстрицкая Т.Л., Волкова В.В., Снакин В.В. Почвенные растворы черноземов и серых лесных почв. М.: Наука, 1981. 148 с.
Сеньков А.А. Гологенез степных почв (на примере Ишинской равнины). Новосибирск: Изд-во СО РАН, 2004. 152 с.
Синкевич З.А. Современные процессы в черноземах Молдавии. Кишинев, 1989. 214 с.
Шоба В.Н., Сеньков А.А. Равновесный состав и свойства растворов почв // Почвоведение. 2011. № 10. С. 1168–1177.
Кауричев И.С., Иванова Т.Н., Ноздрунова Е.М. О содержании низкомолекулярных органических кислот в составе водорастворимого органического вещества // Почвоведение. 1963. № 3. С. 27–35.
Суворов А.К. Миграция веществ в целинной и пахотной дерново-подзолистых суглинистых почвах: Дис. … канд. с.-х. наук. Л.–Пушкин, 1971. 145 с.
Чернов Д.В. Миграция водорастворимых веществ в дерново-подзолистых суглинистых пахотных почвах: Дис. …канд. с.-х. наук. Л.– Пушкин, 1985. 163 с.
Копцик Г.Н., Лукина Н.В., Смирнова И.Е. Влияние атмосферного промышленного загрязнения на состав почвенных растворов подзолов // Почвоведение. 2007. № 2. С. 223–234.
Лаврентьева Г.В., Круглов С.В., Анисимов В.С. Динамика катионного состава почвенного раствора известкованной дерново-подзолистой почвы при загрязнении Co и Cd и изменении рН // Почвоведение. 2008. № 9. С. 1092–1100.
Лактаев Т.Н. Полив хлопчатника. М.: Колос, 1978. 177 с.
Тахтамышев Г.Н. О расчете фактической нормы воды при поливах по бороздам // Научн. тр. СамаркандСХИ. Т. XXII. Сер. агрохим. Самарканд, 1971. С. 94–97.
Роде А.А. Водный режим и его типы // Почвоведение. 1956. № 4. С. 1–15.
Ковда В.А. Происхождение и режим засоленных почв. М.–Л.: Изд-во АН СССР, 1946. Т. 1. 573 с.
Минашина Н.Г., Шишов Л.Л., Гаврилова Г.К. Гажевые солончаки, почвенные растворы, генезис // Почвоведение. 2004. № 5. С. 18–26.
Молодцов В.А. Изменение состава поглощенных оснований при промывках солончаком в монолитах // Почвы крупнейших ирригационно-мелиоративных систем в хлопкосеющей зоне. М., 1975. С. 161–166.
Минашина Н.Г. Зависимость содержания и состава солей в почвенном растворе от влажности гипсоносной почвы // Почвоведение. 2005. № 7. С. 815–824.
Минашина Н.Г. Токсичные соли в почвенном растворе, их расчет и классификация почв по степени засоленности // Почвоведение. 1970. № 8. С. 92–106.
Зимовец Б.А. Экология и мелиорация почв сухостепной зоны. М., 1991. 249 с.
Шавригин М.И. Солевой режим почв и состав почвенных растворов центральной части Барабы // Тр. Почв. ин-та АН. 1954. Т. 42. С. 104–171.
Кабата-Пендиас А., Пендиас Х. Микроэлементы в почвах и растениях. М.: Мир, 1989. 280 с.
Буре В.М. Методология статистического анализа опытных данных. СПб.: Изд-во СПбГУ, 2007. 141 с.
Шеуджен А.Х. Биогеохимия. Майкоп, 2004. 1027 с.
Яковлева Л.В. Миграция оснований в дерново-подзолистых почвах Северо-Запада России. СПб., 2012. 106 с.
Литвинович А.В., Небольсина З.П. Продолжительность действия известковых мелиорантов в почвах и эффективность известкования // Агрохимия. 2012. № 10. С. 79–94.
Литвинович А.В., Лаврищев А.В., Буре В.М., Павлова О.Ю. Интенсивность миграции кальция из дерново-подзолистой супесчаной почвы, произвесткованной различными дозами мелиоранта (по данным модельного опыта) // Агрохимия. 2015. № 6. С. 84–89.
Шильников И.А., Аканова Н.И., Маренкова М.Г., Окорков В.В., Окоркова Л.А., Фенова О.А. Потери обменных катионов и подкисление почв при длительном применении удобрений // Научные основы предотвращения деградации почв (земель) и формирования систем воспроизводства их плодородия в адаптивно-ландшафтном земледелии. М., 2013. Т. 2. С. 351–386.
Бакина Л.Г. Роль фракций гумусовых веществ в почвенно-экологических процессах: Дис. … д-ра биол. наук. СПб., 2012. 399 с.
Горбунов Н.И., Юдина Л.Н., Зарубина Т.Г. Скорость нейтрализации кислот известью // Почвоведение. 1981. № 1. С. 150–156.
Литвинович А.В., Павлова О.Ю. Фтор в системе почва–растение при применении в сельском хозяйстве средств химизации и загрязнении объектов природной среды техногенными выбросами // Агрохимия. 2002. № 2. С. 66–76.
Weinstein L.H., Davison A. Fluorides in the environment. UK, 2004. 287 p.
Singh S.P., Tripathi S.K., Kumar V., Raha P. Monitoring of groundwater quality with respect to fluoride contamination around Hindalco industries LTD. Renukut, Sonbhadra district, Uttar Pradesh, India // Nat. Environ. Pollut. Technol. 2016. V. 15(2). P. 579–582.
Gautam R., Bhardwaj N., Saini Y. Fluoride accumulation by vegetable and crops grown in Nawa Tehsil of Nagaur district (Rajasthan, India) // J. Phytol. 2010. V. 2(2). P. 80–85.
Anshumali B.K., Bredman G. Fluoride in agricultural soil: a Review on its sources and toxicity to plants. global sustainability transitions: Impacts and innovations // Biohemie und Physiologie des Fluors. 2014. V. 3. P. 29–37.
Васяев Г.В., Шевченко А.С. Действие фторсодержащих удобрений на урожай растений и агрохимические свойства почвы // Записки ЛСХИ. 1974. Т. 218. С. 45–49.
Pickering W. The mobility of soluble tlucride in soils // Environ. Pollut. Ser. B. 1985. V. 9. № 4. P. 281–308.
Romo L.A., Roy R. Studies of the substitution of OH– by F– in relation to profile olevelopment in Illionis // Soil. Sci. Soc. Amer. J. 1980. V. 44. № 2. P. 44–55.
Farrah H., Slavek J., Pickering W.F. Fluoride sorption by soil components: Calcium carbonate, humus acid manganese dioxibe silica // Austral. J. Soil Res. 1985. V. 23. № 3. P. 429–439.
Дубровина И.В., Корнблюм Э.А. Природа поглощения почвами фтора удобрений и мелиорантов // Почвоведение. 1984. № 9. С. 23–34.
Посохов Е.В. По поводу статьи А.А. Алексеева “Фтор в акротермах” // Геохимия. 1957. № 4. С. 346–347.
Стрижова Г.П., Лисник Г.С., Крейдман Ж.Е. Исследование и использование почв Молдавии. Кишинев: Штиинца, 1977. 185 с.
Илькун Г.Н., Мотрук В.В. Накопление и передвижение фтористых соединений в почвах // Растения и промышленная среда. Мат-лы III научн. конф. Киев, 1976. С. 52–55.
Понкратова Г.П. Фтористый натрий. М.: Центр международных проектов ГКНТ, 1983. 87 с.
Розанов А.Н. Сероземы Средней Азии. М.: Изд-во АН СССР, 1951. 547 с.
Гаврилова Г.К., Парватов Е.Н. Динамика нитратов в почвах и грунтовых водах Ферганской опытной станции // Тр. СамаркандСХИ. 1978. Т. XXIV. С. 25–28.
Литвинович А.В., Павлова О.Ю., Осипов А.И. Содержание и запасы серы в техногенно-загрязненных почвах // Агрохимия. 1998. № 12. С. 64–70.
Литвинович А.В., Павлова О.Ю., Смирнов И.П., Сулейманов Т.И., Бойкова В.Н. Нитраты в источниках водоснабжения // Химизация сел. хоз-ва. 1992. № 1. С. 16–17.
Молодцов В.А. Ирригационные наносы оазисов долины р. Зеравшан и дельты р. Мургаб // Влияние орошения на почвы оазисов Средней Азии. М.: Изд-во АН СССР, 1963. С. 44–55.
Лагунова Е.П. Особенности гумусообразования в староорошаемых почвах Самаркандского оазиса // Почвоведение. 1959. № 2. С. 24–31.
Литвинович А.В. Процессы деградации хорошо окультуренных почв гумидных и аридных регионов в современных условиях: Дис. … д-ра с.-х. наук. СПб.: СПбГАУ, 2005. 280 с.
Аранбаев М.П., Гаипова А.Г. Минералогический и химический состав древне-оазисных почв пустынной зоны. Ашхабад: Ылым, 1980. 100 с.
Дополнительные материалы отсутствуют.