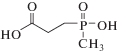Агрохимия, 2020, № 5, стр. 80-85
ОПТИМИЗАЦИЯ МЕТОДА ОПРЕДЕЛЕНИЯ ГЛЮФОСИНАТА АММОНИЯ И ЕГО МЕТАБОЛИТА В СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУРАХ С ПРИМЕНЕНИЕМ ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ С МАСС-СПЕКТРОМЕТРИЧЕСКИМ ДЕТЕКТИРОВАНИЕМ
В. В. Человечкова 1, 2, *, Н. С. Волосатова 1, 2
1 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург–Пушкин, ш. Подбельского, 3, Россия
2 ООО “Инновационный центр защиты растений”
196607 Санкт-Петербург–Пушкин, ул. Пушкинская, 20, лит. А, пом. 7-Н, Россия
* E-mail: vchelovechkova@mail.ru
Поступила в редакцию 28.10.2019
После доработки 15.11.2019
Принята к публикации 10.02.2020
Аннотация
Предложена методика определения глюфосината аммония (ГФА) и его метаболита 3-метилфосфино-пропионовой кислоты (МФПК) в ботве и клубнях картофеля, в зерне и соломе зерновых колосовых культур с применением высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием, после их извлечения из образцов органическим растворителем. Идентификация веществ проведена по времени удерживания, количественное определение – методом абсолютной калибровки. Избирательность метода обеспечена сочетанием условий подготовки проб и хроматографирования.
ВВЕДЕНИЕ
На сегодняшний день в мировой практике прослежена тенденция к снижению уровня пестицидных остатков в сельскохозяйственной продукции и окружающей среде, поскольку от этого напрямую зависит здоровье населения планеты и его сохранение.
Необходимость определения пестицидов в объектах со сложной матрицей выдвигает особые требования к селективности соответствующих анализов. Наибольшее распространение получили хроматографические методы – газожидкостная и высокоэффективная жидкостная хроматография. Для обнаружения следовых количеств пестицидов хорошо зарекомендовал себя масс-спектрометрический детектор [1]. Такой метод детектирования является наиболее чувствительным и селективным, а в некоторых случаях позволяет пренебречь стадией очистки экстрактов, что уменьшает потери аналита и сокращает трудо- и времязатраты на анализ.
Данная работа посвящена разработке метода определения глюфосината аммония (ГФА) и его метаболита – 3-метилфосфтно-пропионовой кислоты (МФПК) в ботве и клубнях картофеля, в зерне и соломе зерновых колосовых культур с применением высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием. Из более ранних методов известен метод определения с применением пластин “силуфол” и обнаружением этих веществ по реакции с нингидридом и методика дериватизации с применением газожидкостной хроматографии.
Глюфосинат аммония (рис. 1) – аммоний DL-гомоаланин-4-ил-(метил)-фосфинат, брутто формула – С5Н15N2О4Р, молекулярная масса – 198.2 D. Химически чистое вещество представляет собой кристаллический порошок со слабым специфическим запахом. Температура плавления – 215°C, коэффициент распределения в системе н-октанол–вода – Kow logP <0.1 (22°С), давление паров – <0.1 мПа. Растворимость (г/дм3, 20°С) в: воде – 1370, ацетоне – 0.16, этаноле – 0.65, этилацетате – 0.14, толуоле – 0.14, гексане – 0.2. В нормальных условиях, в щелочных и умеренно кислых средах вещество стабильно.
Глюфосинат аммония – не селективный, контактный десикант с ограниченной системностью, передвигающийся только внутри обработанных листьев. Используется для уничтожения однолетних и многолетних широколистных и злаковых сорняков в парах, посадках плодовых и цитрусовых культур, ягодных кустарников и на виноградниках, а также в посевах овощных культур при довсходовом применении препарата. В РФ для глюфосината аммония установлены следующие гигиенические нормативы (ГН 1.2.3539-18): картофель – 0.5, рапс (зерно) – 5.0, гречиха, просо, зерно хлебных злаков – 0.4 мг/кг. В воде и растениях подвержен разрушению с образованием метаболита – 3-метилфосфино-пропионовой кислоты (рис. 2).
Брутто формула 3-метилфосфино-пропионовой кислоты – С4Н9О4Р, молекулярная масса – 152.1 D. Представляет собой белый кристаллический порошок. Температура плавления – 288–291°С. Растворима в воде и метаноле.
Цель работы – разработка метода определения глюфосината аммония и его метаболита 3-метилфосфтно-пропионовой кислоты в ботве и клубнях картофеля, в зерне и соломе зерновых колосовых культур с применением высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием.
МЕТОДИКА ИССЛЕДОВАНИЯ
Пробу измельченной ботвы, клубней картофеля, зерна (5 г) или соломы (2 г) помещали в полипропиленовую центрифужную пробирку объемом 50 мл, добавляли 10 мл раствора соляной кислоты в метаноле, в соотношении 1:99, для соломы – 20 мл. Пробирку плотно закрывали, помещали в перемешивающее устройство на 15 мин, затем на 10 мин в центрифугу. После этого аликвоту экстракта 6 мл переносили в пробирки объемом 15 мл, содержащую 0.180 г PSA (Сорбент для твердофазной экстракции на основе силикагеля с привитыми пропиламинными группами (CH2)3NH2)), повторно помещали на 10 мин в перемешивающее устройство и затем центрифугировали в течение 10 мин при скорости 4000 об./мин. После отбирали 1 мл верхнего слоя и переносили в круглодонную колбу, упаривали на ротационном испарителе досуха. Сухой остаток растворяли в 1 мл 0.5%-ного раствора муравьиной кислоты в воде и 5 мкл вводили в хроматограф.
Инструментальная часть. Все испытания были выполнены на хромато-масс-спектрометре, Bruker EVOQ Cube производства фирмы Bruker, состоящем из высокоэффективного жидкостного хроматографа “Bruker Advanced UHPLC” и масс-спектрометра “Bruker модели EVOQ Cube”. Разделение компонентов проб проводили на аналитической колонке “Termo Acclaim RSLC” (100 × × 2.1) мм, 2.2 мкм. Температура колонки 40°С.
В качестве элюента использовали смесь метанола и 0.5%-ного раствора муравьиной кислоты в воде, пробы анализировали в различных градиентных режимах.
Пробы ботвы и клубней картофеля анализировали со скоростью потока элюента 0.15 мл/мин. Режим элюирования – изократический: фаза А – 0.5%-ная муравьиная кислота, фаза В – метанол в соотношении 99:1. Пробы зерна анализировали в том же режиме, что и картофель, но со скоростью потока элюента 0.3 мл/мин.
Режим элюирования – градиентный:
Пробы соломы анализировали в следующем режиме:
| Время, мин | % А | % В | Скорость потока элюента, см3/мин |
| 0 | 99 | 1 | 0.15 |
| 1.5 | 60 | 40 | 0.15 |
| 2.5 | 60 | 40 | 0.30 |
| 3.5 | 60 | 40 | 0.30 |
| 4.0 | 99 | 1 | 0.15 |
| 4.5 | 99 | 1 | 0.15 |
Масс-спектрометрические условия – ионный источник НESI (электроспрей): 1 – для ботвы и клубней картофеля. Напряжение на источнике 4200 V (отрицательная полярность), температура конуса 250°C, поток газа из конуса 20 дм3/мин, поток распыляющего газа 50 дм3/мин, температура осушающего газа 650°C, поток осушающего газа 40 дм3/мин. Режим сканирования: мониторинг заданных реакций (MRM) глюфосината аммония – 180 → 63, 180 → 85, 180 → 95 и 3-метилфосфино-пропионовой кислоты – 151 → 63, 151 → 107, 151 → 133; 2 – для проб зерна и соломы. Напряжение на источнике 5000 V (отрицательная полярность). Температура конуса 250°C, поток газа из конуса 20 дм3/мин, поток распыляющего газа 40 дм3/мин, температура осушающего газа 280°C, поток осушающего газа 40 дм3/мин. Режим сканирования: мониторинг заданных реакций (MRM) глюфосината аммония – 180 → 63, 180 → 85, 180 → 95 и 3-метилфосфино-пропионовой кислоты – 151 → 63, 151 → 107, 151 → 133 (рис. 3, 4).
Рис. 3.
Хроматограммы проб картофеля на содержание глюфосината аммония: (а) – стандартных растворов ГФА и МФПК, соответствующих содержанию в ботве картофеля по 0.025 мг/кг (предел обнаружения); (б) – контрольной пробы ботвы картофеля с внесением ГФА и МФПК по 0.025 мг/кг; (в) – стандартных растворов ГФА и МФПК, соответствующих содержанию в клубнях картофеля по 0.25 мг/кг (1/2 максимально допустимого уровня); (г) – контрольной пробы клубней с внесением ГФА и МФПК на уровне 0.25 мг/кг.
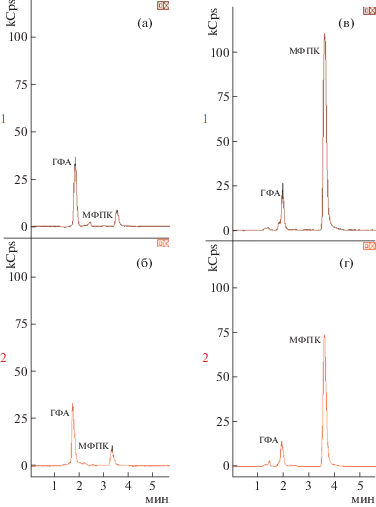
Рис. 4.
Хроматограммы проб зерна и соломы на содержание глюфосината аммония: (а) – стандартных растворов ГФА и МФПК, соответствующая содержанию в зерне 0.2 мг/кг (1/2 МДУ); (б) – контрольной пробы зерна с внесением ГФА и МФПК по 0.2 мг/кг (1/2 МДУ); (в) – стандартных растворов ГФА и МФПК, соответствующая их содержанию в соломе по 0.125 мг/кг (предел обнаружения); (г) – контрольной пробы соломы с внесением ГФА и МФПК на уровне 0.125 мг/кг (предел обнаружения).

РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
К более ранним методам определения относится метод, основанный на концентрировании водного экстракта, очистке и выделении ГФА на колонке с полисорбом и определении из аликвоты подготовленного экстракта хроматографией на пластинках “силуфол” с обнаружением по реакции с нингидрином [2].
Для клубней картофеля (диапазон 0.25–2.5 мг/кг) известен метод для определении ГФА и его метаболита МФПК по их дериватам с помощью капиллярной газожидкостной хроматографии с использованием термоионного детектора после экстракции веществ из образцов водой, очистки экстрактов на концентрирующих патронах для твердофазной экстракции с сильноосновным сорбентом с привитыми четвертичными аммониевыми группами, дериватизации веществ с помощью триметилортоацетата в кислой среде и последующей очистки полученных дериватов на концентрирующих патронах для твердофазной экстракции с гидрофильным слабокислым сорбентом с постоянной активностью [3].
Данные методики являются очень трудоемкими и требующими значительных количеств разнообразных реагентов и дополнительных операций в процессе пробоподготовки. Использование метода ВЭЖХ-МС позволяет анализировать пробы без предварительных модификаций.
В предложенном нами методе пробоподготовки проверяли такой параметр, как продолжительность экстракции. Установлено, что увеличение промежутка времени на стадии экстракции на извлечение искомых компонентов не влияет. В МУК 4.1.3343-16 [4] экстрагирование проводят в течение 1 ч на аппарате для встряхивания. Нами было установлено, что достаточно 10 мин на этой стадии, чтобы получить извлечение >80%.
В качестве экстрагента пробовали применять смесь муравьиной кислоты и метанола, однако в этом случае хроматографический профиль был более загрязнен посторонними пиками. Поэтому заменили в составе экстракционной смеси муравьиную кислоту на соляную, что привело к лучшему результату.
На этапе очистки в качестве сорбента использовали активированный уголь, силикагель, оксид алюминия, но наилучший результат по доле извлечения и чистоте профиля дал сорбент для твердофазной экстракции на основе силикагеля с привитыми пропиламинными группами (CH2)3NH2.
В процессе изучения хроматографического поведения ГФА и МФПК удалось добиться их совместного определения на наиболее широко применяемой для ВЭЖХ колонке, заполненной сорбентом с привитыми монофункциональными полярными группами C18. Разные масс-спектрометрические условия для анализа проб картофеля и зерновых, а также калибровка по матрицам связаны с необходимостью нивелирования матричного эффекта.
Таким образом, в результате совокупности подобранных этапов выделения, очистки и идентификации удалось добиться полноты извлечения исследованных веществ в диапазоне 80–91%, в зависимости от анализируемого объекта (табл. 1).
Таблица 1.
Объекты анализа, диапазоны определяемых концентраций, полнота извлечения глюфосината аммония и 3-метилфосфино-пропионовой кислоты (стандартное отклонение, доверительный интервал среднего результата для n = 20, Р = 0.95)
| Анализируемый объект | Предел количественного определения, мг/кг | Диапазон определяемых концентраций, мг/кг |
Полнота извлечения вещества, % | Стандартное отклонение, % | Доверительный интервал среднего результата, ± % |
|---|---|---|---|---|---|
| Глюфосинат аммония | |||||
| Ботва картофеля | 0.025 | От 0.025 до 0.2 включительно | 90.6 | 4.17 | 1.83 |
| Клубни картофеля | 0.025 | От 0.025 до 0.2 включительно | 91.3 | 5.87 | 2.57 |
| Зерно | 0.025 | От 0.025 до 0.2 включительно | 80.9 | 4.39 | 1.92 |
| Солома | 0.125 | От 0.125 до 1.0 включительно | 80.8 | 3.11 | 1.36 |
| 3-метилфосфино-пропионовая кислота | |||||
| Ботва картофеля | 0.025 | От 0.025 до 0.2 включительно | 94.1 | 6.18 | 2.71 |
| Клубни картофеля | 0.025 | От 0.025 до 0.2 включительно | 81.5 | 5.53 | 2.43 |
| Зерно | 0.025 | От 0.025 до 0.2 включительно | 82.0 | 4.05 | 1.77 |
| Солома | 0.125 | От 0.125 до 1.0 включительно | 86.7 | 3.36 | 1.47 |
ЗАКЛЮЧЕНИЕ
Таким образом, в результате исследования были подобраны оптимальные условия для совместного извлечения и количественного определения двух веществ – глюфосината аммония и его метаболита 3-метилфосфино-пропионовой кислоты в сельскохозяйственной продукции. Дополнительная очистка экстрактов проб позволила значительно продлить срок эксплуатации хроматографической колонки и значительно сократить временные затраты на подготовку к выполнению измерений.
Список литературы
Долженко В.И., Цибульская И.А., Комарова А.С., Черменская Т.Д. Определение остаточных количеств валифеналата в воде, почве, ботве и клубнях картофеля, винограде и виноградном соке, и его метаболитов (IR 5839 и PCBA) в воде и почве методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием. Метод. указ. (МУК 4.1.3410-16). М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2017. 20 с.
Новикова К.Ф., Калинин В.А., Гиренко Д.В., Борисов Г.С., Устинова Т.Н. Методические указания по определению микроколичеств пестицидов в продуктах питания, кормах и внешней среде (МУ № 6190-91). Сб. № 22. М.: Центр научно-технической информации, пропаганды и рекламы, 1994. 20 с.
Калинин В.А., Калинина Т.С. Определение остаточных количеств глюфосината аммония и его метаболита в клубнях картофеля методом капиллярной газожидкостной хроматографии (МУК 4.1.3205-14). М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2015. 26 с.
Корзун Т.А., Сухова В.Л., Добрева Н.И., Добрев С.Д., Джапаридзе М.Т. Измерение остаточного содержания глюфосината аммония и его метаболита 3-метилфосфино-пропионовой кислоты в семенах и масле подсолнечника, семенах и масле рапса, семенах гороха методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием (МУК 4.1.3343-16). М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2016. 19 с.
Дополнительные материалы отсутствуют.