Агрохимия, 2020, № 5, стр. 86-96
ПУТИ СНИЖЕНИЯ ФИТОТОКСИЧНОСТИ ОСТАТКОВ СУЛЬФОНИЛМОЧЕВИН В ПОЧВЕ С ПОМОЩЬЮ АНТИДОТОВ
Н. Д. Чкаников 1, *, Ю. Я. Спиридонов 2, С. С. Халиков 1, **, А. М. Музафаров 1
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
2 Всероссийский научно-исследовательский институт фитопатологии
143050 Московская обл., п/о Большие Вяземы, ул. Институт, влад. 5, Россия
* E-mail: nchkan@ineos.ac.ru
** E-mail: salavatkhalikov@mail.ru
Поступила в редакцию 22.12.2019
После доработки 24.01.2020
Принята к публикации 10.02.2020
Аннотация
В контексте проблемы снижения потерь урожая сельскохозяйственных культур от остатков в почве фитотоксичных гербицидов в обзоре комплексно рассмотрены взаимоотношения гербицидов с антидотами (сейфнерами, индукторами устойчивости растений). Дана характеристика сульфонилмочевиновых гербицидов, позволяющая оценить причины негативных проблем, возникающих при их использовании, и возможности их совместного применения с антидотами. Обобщены результаты последних исследований механизмов функционирования антидотов. Обсуждены результаты работ, направленных на создание эффективных комплексных протравителей для защиты посевов от остатков сульфонилмочевин, а также перспективы развития этого направления.
ВВЕДЕНИЕ
Современное индустриальное сельское хозяйство предполагает широкое использование химических средств защиты растений. Глобальный рынок агрохимикатов составляет около 60 млрд долларов в год и продолжает расти. Наибольшую долю рынка занимают гербициды: 40–60% в зависимости от доминирования тех или иных культур в различных частях света. В последние годы интенсивно росло производство биопрепаратов, однако их доля составляет всего 3–4% относительно химических средств защиты растений, причем чаще всего их применяют в сочетании с химическими средствами защиты [1, 2]. Таким образом, очевидно, что производство продуктов питания для широких слоев населения связано с массовым применением химических средств защиты растений, и альтернативы этому сегодня не существует. Необходимость использования гербицидов, кроме экономических причин напрямую связана с социальными требованиями снижения доли неквалифицированного тяжелого ручного труда.
Среди факторов, отрицательно влияющих на урожайность сельскохозяйственных культур в нашей стране, сорная растительность занимает первое место. Гербициды являются единственным реальным способом борьбы с сорняками в промышленных масштабах. При этом надо учитывать, что гербициды не обладают абсолютной избирательностью действия по отношению к сорнякам. Таким образом, существует проблема повышения избирательности действия гербицидов, заключающаяся в защите культурных растений от их токсического действия.
Остатки гербицидов в почве могут нанести непоправимый урон культуре, которая будет выращиваться на этом поле на следующий год и в некоторых случаях даже позже. Преодолеть это можно снижением концентрации фитотоксичных остатков гербицидов в почве (интенсификация разложения, сорбция), а также применением антидотов (сейфнеров, индукторов устойчивости), снимающих или снижающих токсическое воздействие гербицидов на культурное растение [3, 4].
В последние годы проблема загрязнения почвы остатками высоко активных гербицидов приобретает в нашей стране угрожающие масштабы. Проблема обостряется тем, что снижение урожая происходит незаметно, без видимых эффектов, не обнаруживая истинных причин происходящего. Преодолеть такое положение дел можно, повысив культуру применения гербицидов, а также используя специальные технологии защиты посевов от остатков гербицидов в почве. Одним из основных элементов таких технологий может быть использование антидотов (сейфнеров), защищающих посевы от действия фитотоксикантов. Механизмы функционирования антидотов не были ясны до последнего времени, их понимание связано с достижениями молекулярной биологии. К настоящему моменту накопилось, как нам кажется, достаточно материала, позволяющего предложить широкому кругу специалистов, имеющих отношение к агрохимии, комплексный анализ проблемы взаимоотношения антидотов с такими активными и широко использующимися гербицидами как сульфонилмочевины. Кроме того, авторы выносят на рассмотрение результаты своих исследований, направленных на поиск эффективных антидотов к сульфонилмочевинам.
АНТИДОТЫ ГЕРБИЦИДОВ, ИСТОРИЯ СОЗДАНИЯ, МЕХАНИЗМЫ ФУНКЦИОНИРОВАНИЯ, НАПРАВЛЕНИЯ ИСПОЛЬЗОВАНИЯ
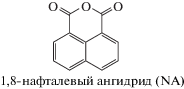
Впервые эффект защиты растений от гербицидов обнаружен в 1947 г. Отто Хоффманом, который показал, что растения томата, обработанные 2,4,6-Т (2,4,6-трихлорфеноксиуксусной кислотой) приобретали устойчивость к гербициду 2,4-Д (2,4-дихлорфенноксиуксусной кислоте) [5]. Дальнейшее изучение доказало, что обработка листьев 2,4-Д защищала растения при последующей обработке гербицидом группы карбаматов – препаратом барбан [6]. К сожалению, этот эффект не мог быть использован в практических целях, т.к. обработка 2,4-Д семян приводила к гибели растений, а опрыскивание посевов – к понижению активности гербицида в отношении целевой сорной растительности [7, 8]. Вместе с тем понимание задачи стимулировало целевой поиск соединений с антидотной активностью. В результате скрининга химических соединений в 1971 г. запатентован 1,8-нафталевый ангидрид (NA) (рис. 1) как средство, защищающее кукурузу от тиокарбаматных гербицидов при предпосевной обработке семян [9]. NA так и не появился на рынке, поскольку был вытеснен появившимся чуть позже антидотом дихлормидом (диаллиламид дихлоруксусной кислоты), применение которого в смесях с гербицидами при опрыскивании растений давало бóльший экономический эффект [10, 11]. Другой причиной называют некоторую фитотоксичность NA, которая проявлялась при хранении обработанных семян [12, 13]. Тем не менее, открытие NA стимулировало интенсивный индустриальный поиск соединений, способных повышать селективность гербицидов. В результате такие препараты были найдены. Интересно, что они принадлежали к различным классам химических соединений, не имевшим между собой структурного сходства. В основном отбирали соединения, защищающие зерновые культуры: кукурузу, рис, сорго. Причем, если на первом этапе предпочтение отдавали препаратам для предпосевной обработки семян, то в дальнейшем приоритет перешел к соединениям, подходящим для совместного применения при опрыскивании растений такими высокоактивными гербицидами как арилоксифеноксипропинаты, сульфонилмочевины, имидазолиноны, изоксазолиноны, циклогександионы и изоксалидиноны [11, 13–15]. При этом важно отметить, что одни и те же антидоты могут защищать от гербицидов с разным механизмом действия. В настоящее время является общепринятым, что антидоты (сейфнеры) активируют экспрессию генов, ответственных за защиту от ксенобиотиков, т.е. чужеродных биологическим организмам органических веществ. Растения, как правило, имеют 3 фазы детоксикации гербицидов: 1-я – окислительная дегидратация исходной молекулы с последующей конъюгацией на 2-й стадии с эндогенными субстратами. В некоторых случаях исходная молекула может миновать первую фазу и непосредственно войти во 2-ю фазу. В процессе 3-й фазы образовавшиеся метаболиты могут подвергаться дальнейшей конъюгации с образованием нерастворимых остатков, которые затем изолируются в вакуолях или связываются в биополимеры лигнина [16].
Реакции, происходящие на 1-й стадии детоксикации, направлены на образование в структуре ксенобиотика реакционноспособных функциональных групп, которые могут подвергаться дальнейшему метаболизму и детоксикации. Большинство реакций катализируются цитохром P450-зависимыми моно-оксигеназами (cytochrome P450 monooxygenases – P450s), которые используют для окисления молекулярный кислород. К наиболее общим цитохром P450-зависимым реакциям относятся гидроксилирование ароматического ядра или алкильных групп, включая окисление C-атома, присоединенного к атомам кислорода или азота, что в конечном счете приводит к деалкилированию. Естественно предположить, что эти же ферменты могут участвовать также в нормальном метаболизме растений. Действительно, существует около 50 подобных окислительных систем, использующихся растениями для метаболизма стирола, терпенов, изофлавоноидов, гибберилинов, абсцизовой кислоты, цитокининов, лигнина. Некоторые реакции фазы 1 катализируются пероксидазами, которые используют для окисления пероксид водорода. Таким путем окисляется, например, индолилуксусная кислота. Кроме того, важными процессами 1-й стадии являются восстановление и гидролиз карбоксилэстеразами [16]. Функционализация ксенобиотика позволяет перейти ко 2-й фазе – к реакциям конъюгации, в ходе которых созданная функциональная группа используется для конъюгации с другими молекулами такими, например, как моносахариды или трипептид глутатион (glutathione – GSH), являющимся важнейшим тиолом в клетке. Гликозилирование осуществляется уридиндифосфат-зависимыми гликозилтрансферазами (UDP – depended glycosyltransferases (UGTs)). Это семейство ферментов играет ключевую роль в биосинтезе гормонов растений и детоксикации токсинов, продуцируемых патогенами. Наиболее хорошо изученной группой ферментов, включенных в метаболизм гербицидов, являются глутатион-S-трансферазы (glutathione S-transferases – GSTs), которые катализируют конъюгацию тиола с электрофильным сайтом субстрата. Каталитический механизм таких превращений включает замещение тиолят анионом галогена или фенольной группы субстрата. Транспорт образовавшихся конъюгатов в вакуоли (фаза 3) осуществляется так называемыми белками множественной лекарственной устойчивости (multidrug resistance-associated protein – MRP), к которым принадлежит субсемейство ABC-транспортеров, транспортная функция которых изучена в последнее время [17]. Трансформации конъюгатов включают такие реакции как частичная деградация, вторичная конъюгация, инкорпорация в клеточную стенку (фаза 4). Приведенная схема детоксикации ксенобиотиков в растениях описывает только основные, наиболее изученные процессы. Среди менее распространенных биотрансформаций гербицидов известно окисление атомов азота и серы, восстановление нитрогрупп, альдегидов, кетонов, восстановление непредельных карбонильных соединений, а также различные изомеризации [16, 18]. В настоящее время очевидно, что сейфнеры активируют ферментативные системы, ответственные за детоксикацию и защиту растения, такие как P450s, UGTs, GSTs, ABC-транспортеры, при этом сами они не обладают существенной токсичностью. Активация осуществляется через повышение экспрессии генов, включенных в метаболизм гербицидов. Пониманию происходящих при этом процессов способствуют интенсивные исследования по установлению геномов важнейших сельскохозяйственных растений, которые начались с полного секвинирования (установления всей линейной последовательности нуклеотидов генома) горчицы малой – арабидопсиса (Arabidopsis thaliana) [19]. Другим важнейшим направлением современных молекулярно-биологических исследований является изучение сигнальных механизмов, вызывающих повышение экспрессии этих генов. В последние годы собран достаточный экспериментальный материал для подтверждения гипотезы о том, что сейфнеры подключаются к существующему в растениях сигнальному пути, который служит адаптации к изменяющимся биотическим и абиотическим факторам внешней среды. Такая защитная система сформирована производными окисленных ненасыщенных жирных кислот, оксилипинами, которые вовлечены в процессы роста и развития всех аэробных организмов, а также в формирование ответных реакций организма на сигналы внешней среды. Оксилипины образуются ферментативно или спонтанно из ненасыщенных жирных кислот. В растениях субстратами для образования оксилипинов служат 16- и 18-углеродные ненасыщенные жирные кислоты. Пути биосинтеза оксилипинов достаточно просты, но обеспечивают образование разнообразных по структуре биологически активных соединений. Оксилипины участвуют в переносе стрессовых сигналов, регулируют экспрессию стресс-индуцируемых генов, а также взаимодействуют с многочисленными сигнальными путями в растительных клетках, включая сигнальные пути гормонов – ауксина, гиббереллина, этилена и абсцизовой кислоты [16, 19]. Среди всех оксилипинов в особую группу выделяют так называемые активные формы электрофилов (Reactive Electrophile Species – RES) к которым относятся α,β-ненасыщенные карбонильные соединения, такие, например, как 2(E)-алкенали, кетодиены и кетотриены жирных кислот. RES атакуют неклеофильные участки органических молекул, таких как глутатион, белки, нуклеиновые кислоты, изменяя свойства этих молекул, и зачастую приводя к поражению клеточных структур. Вместе с тем роль этих соединений в клетке не ограничивается деструктивными эффектами, RES индуцируют экспрессию генов, вовлеченных в регуляцию защитных реакций растений на избыточное освещение и присутствие ксенобиотиков, а также генов, контролирующих клеточный цикл [19, 20].
Переходя к вопросам практического применения антидотов, следует констатировать, что возможности использования пары гербицид–антидот очень широки. Такие сочетания можно использовать для следующих целей [11]:
– защита посевов от повреждающего уровня пестицидных остатков в почве, что позволяет проявлять большую гибкость при выборе культур в севообороте;
– использовать гербициды с предпочтительным токсикологическим профилем, но не обладающие высокой избирательностью;
– контроль над сорняками, ботанически родственными возделываемой культуре;
– защита минорных сельскохозяйственных культур, для которых разработка селективных гербицидов экономически не оправданна.
В настоящем обзоре обсуждается только первое применение из перечисленных. При этом в качестве фитотоксиканта имеет смысл рассматривать гербициды, обладающие высокой активностью и высокой персистентностью, т.е. способностью долго сохраняться в почве. Такое сочетание свойств определяет “отрицательное последействие”, т.е. угнетение остатками гербицида в почве культур севооборота, которые высевают через 1 год или позже после применения гербицида.
СУЛЬФОНИЛМОЧЕВИНЫ: СТРУКТУРА, СВОЙСТВА, ПРОБЛЕМА ОСТАТКОВ В ПОЧВЕ
Наиболее высокой биологической активностью обладают гербициды класса сульфонилмочевин. Структура соединений этого класса характеризуется наличием сульфонилмочевинного мостика между замещенным азином (симм-триазином, пиримидином) и орто-замещенным арильным или гетарильным остатком. Первым представителем этого класса соединений был хлорсульфурон (Chlorsulfuron) (1), коммерциализированной компанией DuPont в 1982 г. (рис. 2). В настоящее время зарегистрировано около 30 д.в. этого ряда, которые используют более чем в 80 странах мира для прополки основных агрономических культур [21]. В России зарегистрирована и широко используется бóльшая часть разработанных препаратов этого класса [22]. Сульфонилмочевины применяют в низких дозах (10–100 г/га), обеспечивая высокую избирательность действия и безопасность для человека и животных. Связано это с тем, что механизм фитотоксического действия сульфонилмочевин состоит в ингибировании ацетолактатсинтетазы АЛС (acetolactate synthase ALS, также называемой acetohydrohyacide synthase AHAS, EC 2.2.1.6) – первого фермента на пути биосинтеза аминокислот с разветвленной цепью (валин, лейцин, изолейцин). Ингибирование этого фермента останавливает синтез белка, что приводит к остановке деления клеток и последующей гибели организма. Такой метаболический путь существует только у грибов, бактерий, водорослей и высших растений, что обеспечивает низкую токсичность для других организмов, включая теплокровных [23].
Рис. 2.
Структурные формулы хлорсульфурона и метсульфуронметила, а также определяющий фрагмент молекулы сульфонилмочевин.

При крайне благоприятных токсикологических характеристиках сульфонилмочевин потенциальную опасность представляет их высочайшая фитотоксичность по отношению ко многим культурным растениям. Такие важнейшие сельскохозяйственные культуры как зерновые злаки (пшеница, рожь, ячмень, овес) относительно устойчивы к сульфонилмочевинам, но возникает проблема с выращиванием культур, следующих в севообороте за злаками. Особенно опасны в этом отношении широко использующиеся в сельскохозяйственном производстве хлорсульфурон 1 и метсульфурон-метил 2. Остаточные количества этих гербицидов могут повреждать ряд культур, следующих за зерновыми: сахарную свеклу, сою, рапс, кукурузу и т.п. [24, 25]. Существуют многочисленные примеры фитотоксического действия остатков сульфонилмочевин в почве. Например, урожай льна, сахарной свеклы, чечевицы, гороха и картофеля, полученный через 1 год после обработки участка хлорсульфуроном в дозе 10–40 г/га уменьшался в 2–9 раз. Остатки метсульфурон-метила в почве через год после применения в дозе 4.5 г/га снижали урожай люцерны на 38, картофеля – на 28% [25]. Подобных примеров можно найти большое количество, однако очевидно, что количественные показатели потерь урожая различных культур зависят от персистентности сульфонилмочевин в различных условиях.
Разложение сульфонилмочевин в почве происходит в результате химического гидролиза, фотолиза под действием света и микробиологической трансформации под действием микроорганизмов [26]. Существуют данные, полученные для метсульфурон-метила, что при pH < 6.0 основным путем разложения в почве является химический гидролиз, при более высоких величинах pH преобладает микробиологическое разложение. В слабокислых условиях (рН 4.0–6.0) с достаточно высокой скоростью реализуется гидролиз карбамидных связей сульфонилмочевин. При этом гербициды теряют свою фитотоксичность. Соответственно, остатки сульфонилмочевин представляют опасность для посевов в нейтральных и щелочных почвах [27]. На скорость разложения влияют также характеристики почвы, включая влажность, температуру, содержание органического вещества [28, 29]. В неблагоприятных для разложения сульфонилмочевин условиях (щелочная реакция почвы, низкие температуры и недостаточная влажность) последствия применения хлорсульфурона и метсульфурон-метила можно наблюдать через 2 и даже 3 года после их применения [25]. При этом показано, что остатки хлорсульфурона и метсульфурон-метила в почве даже в дозе, меньшей 0.2 г/га, могут оказать отрицательное влияние на рост и развитие таких культур как сахарная свекла, гречиха, горчица [22].
Широко используемой характеристикой персистентности гербицида является время его полужизни (полураспада) в почве [30]. В случае сульфонилмочевин этот параметр может дать искаженное представление о реальной угрозе отрицательного последействия гербицида, поскольку экспериментально показано, что достаточно быстро происходит потеря 50% активности гербицида, тогда как оставшиеся 50% сохраняются в 5–10 раз дольше [22].
УСПЕХИ СОЗДАНИЯ АНТИДОТНЫХ ПРЕПАРАТОВ ДЛЯ ЗАЩИТЫ ПОСЕВОВ ОТ ОСТАТКОВ СУЛЬФОНИЛМОЧЕВИН
Таким образом, защита посевов от остатков сульфонилмочевин в почве безусловно актуальна. Причем в нашей стране из-за относительно невысокой культуры земледелия эта проблема приобретает особое значение. В качестве подхода к ее решению хорошие результаты дает предпосевная обработка семян антидотами. Имеющаяся информация указывает на то, что наибольший эффект при таком применении дает NA. Инкрустация семян кукурузы, пшеницы, риса, или сорго нафталевым ангидридом в дозе 0.5 вес. % по отношению к семенам существенно повышала устойчивость всех культур к хлорсульфурону. Например, хлорсульфурон 1 в дозе 5 г/га снижал сухую массу проростков кукурузы до 15% по сравнению с не обработанным контролем. В том случае, когда семена были предварительно обработаны NA, масса проростков снижалась только до 80% [31]. Хлорсульфурон 1 в дозе 5 г/га снижал рост корней и стеблей кукурузы на 50–60%, но в том случае, если семена перед посевом были обработаны NA, для достижения такого же токсического эффекта была нужна доза хлорсульфурона 40 г/га, т.е. в 8 раз бóльшая. Эту величину называют “защитным фактором”. При обработке хлорсульфуроном 1 кукурузы, сорго и риса защитный фактор, который обепечивает NA, составляет от 4 до 8. В случае пшеницы и ячменя, которые значительно более устойчивы к действию хлорсульфурона, эта величина варьирует от 2 до 4, при этом токсическая доза хлорсульфурона 1 возрастает до 100–400 г/га [32]. Высокая эффективность NA для защиты посевов кукурузы от хлорсульфурона подтверждена в условиях Московской обл. и Приморского края; при этом показано, что норма расхода NA при обработке семян может быть существенно меньше той, которую применяли раньше [33]. Механизм защитного дейcтвия NA связан с индукцией специфических цитохром P450-монооксигеназ, которые катализируют гидроксилирование гербицидного субстрата, а также с повышением активности глутатион-S-трансфераз [25, 34–36].
В СССР группой ведущих разработчиков агрохимических препаратов была впервые разработана серия комбинированных, содержащих NA протравителей семян кукурузы, льна, сахарной свеклы, сои и рапса, получивших общее название “копранг” (комплексный протравитель и антидот гербицидов). Сочетание в одном препарате протравителя, инсектицида и антидота позволило обеспечивать интегрированную защиту растений от поражений грибными заболеваниями, почвообитающими вредителями и повреждений остатками хлорсульфурона 1 в почве. Оптимальный способ применения препарата – предпосевное инкрустирование семян сельскохозяйственных культур, что позволило включить антидот в единую схему протравливания семян [25, 33]. Серия этих препаратов была зарегистрирована Госкомиссией РФ, однако недостаточное финансирование не позволило внедрить их в производственную практику [33].
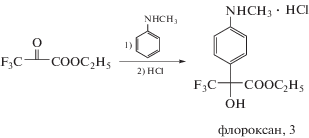
В своих исследованиях, направленных на создание композиций для предпосевной обработки семян, авторы в качестве эталона использовали NA, поскольку до сих пор отсутствует информация о промышленных препаратах, превосходящих NA в качестве антидотов к сульфонилмочевинам для предпосевной обработки семян. Наш подход к созданию таких препаратов основан на использовании синтезированного (в лаборатории физиологически активных фторорганических соединений ИНЭОС РАН) регулятора роста растений, получившего коммерческое название флороксан, который представляет собой растворимый в воде гидрохлорид 2-(4-метиламинофенил)-3,3,3-трифтор-2-гидроксипропионовой кислоты (рис. 3). Это соединение обладает свойствами стимулятора роста растений, которые обнаруживаются как при предпосевной обработке семян, так и опрыскивании вегетирующих растений. В дозе всего 100 мг/т семян соединение стимулировало развитие хлопчатника, приводя в конечном счете к увеличению урожая хлопка-сырца на 20% [37, 38].
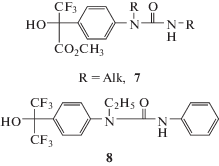
Попытки установления механизма действия этого соединения стандартными методами не дали ясных результатов. Вместе с тем анализ литературных данных позволяет сделать некоторые предположения. В 2009 г. появился патент Хоффманн ля Рош (Hoffmann-La Roche Inc.) в области контроля или предупреждения заболеваний центральной нервной системы, который защищает производные 2-фенил-3,3,3-трифтор-2-гидроксипропионовой кислоты в качестве соединений, взаимодействующих с рецепторами γ-аминомаслянной кислоты (ГАМК) – (GABAB receptor) [39]. Таким образом, флороксан 3, содержащий метиламиногруппу в фенильном ядре, является производным, подпадающим под действие патента, и, следовательно, с высокой степенью вероятности воздействующий на ГАМК-рецепторы. При этом гидрофильность флороксана, успешно прошедшего токсикологические испытания, должна препятствовать воздействию на ткани мозга человека и позвоночных животных, защищенные гематоэнцифалическим барьером. Вместе с тем недавно показано, что ГАМК находится в самом начале цепи, вызывающей реакцию растения на стресс [40]. Таким образом, есть основания полагать, что флороксан 3 воздействует на рост и развитие растений через сигнальную систему, воздействующую на метаболизм растительных гормонов, а возможно и участвует в переносе сигналов, регулирующих экспрессию стресс-индуцируемых генов. Подтверждение такого предположения требует серьезной экспериментальной проверки. Аргументом в пользу проведения такой работы является тот факт, что ряд мочевин, полученных из флороксана и родственных соединений, обладали высокой антидотной активностью по отношению к сульфонилмочевинам при применении в чрезвычайно низких дозах. Например, полученная из флороксана 3 хлорзамещенная диарилмочевина 4 (рис. 4) при обработке семян ярового рапса уже в дозе 1 г/т семян эффективно снижала токсическое действие содержащегося в почве промышленного гербицида метсульфурон-метила. Прирост зеленой массы растений при этом составлял 40% по сравнению с контролем. NA в такой дозе не оказывал заметного защитного действия [41, 42]. Полученный результат является первым примером эффективной защиты рапса от гербицидов класса сульфонилмочевин при предпосевной обработке семян в столь низкой дозе препарата. Показано также высокое защитное действие изомерной диарилмочевины 5 от хлорсульфурона на льне [43]. Антидотной активностью также обладают мочевины 6 и 7 (рис. 5) [44, 45].
Также продолжена разработка комплексных протравителей семян, обладающих антидотным действием (копранги) [25, 33]. В качестве исходного многокомпонентного состава использовали смесь, содержащую тебуконазол (ТБК) и тетраметилтиурамдисульфид (ТМТД) в качестве фунгицидов, NA как антидот, натриевую соль карбоксиметилцеллюлозы (Na-КМЦ) и другие формообразующие компоненты. Для получения однородных суспензий использовали технологию приготовления суспензионных препаратов в шаровой мельнице [46]. Полученные препараты стимулировали всхожесть семян различных сельскохозяйственных культур (яровой пшеницы, ярового рапса, кукурузы) и стимулировали их развитие. Предпосевная обработка семян рапса позволяла преодолевать 30%-ное подавление развития растений содержащимся в почве метсульфурон-метилом [47, 48]. Дальнейшие исследования были связаны с изучением возможности замены NA на другой эффективный антидот. Потребность в этом была вызвана отмеченной выше собственной фитотоксичностью NA, которая проявляется при хранении обработанных семян [12, 13]. Кроме того, современные агрохимические препараты используют в значительно более низких нормах, чем принято для NA, поскольку сокращение нормы расхода действующих химических веществ снижает экологическую нагрузку на агробиоценоз.
В качестве кандидата на место NA в составе комплексного протравителя с антидотным действием испытан представитель класса N-дихлорацетил-1,3-оксазолидинов – промышленный антидот фурилазол – (R,S-3-дихлорацетил-5-(2-фурил)-2,2-диметилоксазолидин 8 (рис. 6). Этот антидот разработан компанией Монсанто. Препарат используют в виде смесей с такими высокоактивными гербицидами как сульфонилмочевины и имидазолиноны при опрыскивании посевов кукурузы. Какие-либо данные по предпосевной обработке семян этим антидотом в печати отсутствуют. Предварительные испытания проводили in vitro в чашках Петри на проростках кукурузы. При проращивании семян, обработанных фурилазолом 8 в концентрациях 100 мг/т и 1 г/т семян, наблюдали значительное увеличение (до 45% длины корней и проросков). В дозе 25 г/т фурилазол проявлял ярко выраженную антидотную активность по отношению к хлорсульфурону 1. При подавлении гербицидом роста корней более, чем на 50%, препарат не только снимал эффект подавления роста, но и стимулировал рост корней приблизительно на такую же величину [50]. Дальнейшие испытания проводили в камерах искусственного климата (ЛИК). Для изучения влияния фурилазола на защиту всходов кукурузы от остатков в почве метсульфурон-метила 2 были приготовлены стандартные многокомпонентные композиции, содержащие в качестве антидота фурилазол в дозах из расчета 12.5, 25.0, 50.0 и 100 г/т семян. Для сравнения использовали стандартную композицию, содержащую 50.0 г NA/т семян. Показательным был эксперимент, в котором внесенный в почву гербицид снижал массу необработанных 3-недельных растений на 60%. Все варианты предпосевной обработки составами, содержащими фурилазол 8, демонстрировали частичную защиту от гербицида. Оптимальными являлись дозы 50–75 г/т семян, при которых снижение массы растений составляло только 20%. Дальнейшее увеличение содержания препарата не приводило к увеличению антидотного действия, но и не вызывало дальнейшее подавление растений. Cтандартная композиция, содержащая 50.0 г NA/т семян, не оказывала защитного действия [51]. Таким образом, фурилазол проявлял защитное действие в концентрациях, значительно более низких, чем NA, не обеспечивая полной защиты растений от токсичности сульфонилмочевины. Это, как нам кажется, означает, что фурилазол 8 может найти свое место в комплексных технологиях по защите растений от остатков фитотоксикантов в почве, разработку которых собираемся продолжить. Предпринята также попытка модифицировать структуру фурилазола 8 и изучить биологическую активность полученных новых соединений. Фурилазол 8 принадлежит к одному из основных классов антидотов, имеющих структуру амидов дихлоруксусной кислоты. Амиды моно- и трихлоруксусных кислот обладают меньшей активностью, чем дихлорацетильные производные [13]. Информацию о производных фурилазола, содержащих остатки фторуксусных кислот, обнаружить не удалось. Такие производные интересовали в первую очередь, поскольку введение атомов фтора часто позволяет выгодно модифицировать биологическую активность соединений [52]. При этом вероятность появления полезных свойств так велика, что в настоящее время ≈40% пестицидов содержат атомы фтора [53]. Синтез аналогов фурилазола 10–14 осуществили ацилированием 5-(2-фурил)-2,2-диметилоксазолидина 9 ангидридами или хлорангидридами дихлорфторуксусной (для соединения 10), хлорфторуксусной кислоты (для 11), хлордифторуксусной кислоты (для 12), дифторуксусной кислоты (для 13) и феноксидифторуксусной кислоты (для 14) в присутствии триэтиламина.
Испытания производных на антидотную и рострегулирующую активность проводили in vitro в чашках Петри на семенах кукурузы в концентрации 100 мг/т, 1 г/т и 10 г/т семян [50]. При выборе концентраций исходили из того, что использование относительно дорогих фторсодержащих аналогов фурилазола в сельскохозяйственной практике может быть экономически оправданным при применении этих препаратов в значительно более низких концентрациях по сравнению с фурилазолом. Испытания показали, что по крайней мере в низких концентрациях соединения 10–14 не обладали антидотной активностью по отношению к хлорсульфурону 1. Вместе с тем все фторсодержащие аналоги стимулировали как рост корней, так и проростков кукурузы при обработке семян этими соединениями. Наибольшей активностью обладало производное хлордифторуксусной кислоты 10, обработка которым в дозе 1 г/т семян приводила к двукратному увеличению корней и почти 50%-ному увеличению длины проростков, что значительно превосходило ростстимулирующую активность самого фурилазола 8. Столь ярко выраженная стимуляция роста и развития растений может найти практическое применение в составе многокомпонентных композиций для предпосевной обработки семян. Потребность в стимуляции развития растений вызвана в первую очередь тем, что фунгицидные композиции, как правило, приводят к некоторому, а зачастую и значительному подавлению развития растений. Для преодоления этого явления в составе фунгицидного протравителя зерновых культур успешно испытан флороксан 3 [54–56]. Вместе с тем в составе нашей базовой композиции для предпосевной обработки семян, содержащей ТБК и ТМТД в качестве фунгицидов, флороксан 3 не позволяет снять угнетающее растения действие фунгицидов на проростках кукурузы, рапса и сои. Его замена на фторсодержащее производное фурилазола 10 в концентрации 1 г/т семян позволяет не только снять подавление развития растений, но и стимулировать его в случае кукурузы и рапса, что выражается в увеличении биомассы по сравнению с необработанным контролем. Таким образом, 2‑хлор-2,2-дифтор-1-[(5-фуран-2-ил)-2,2-диметилоксазолидин-3-ил]этанон 10 представляет значительный интерес как потенциальный компонент фунгицидных композиций [57].
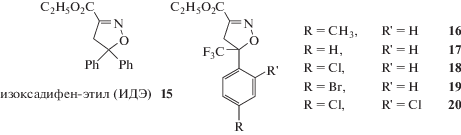
Еще одним объектом наших исследований был промышленный сейфнер – изоксадифен-этил (ИДЭ) – (Isoxadifen-ethyl) – этил-5,5-дифенил-4,5-дигидрооксазол-3-карбоксилат (ethyl 5,5-diphenyl-4,5-dihydroisoxazole-3-carboxylate) 15 (рис. 7). Этот современный сейфнер компании Байер (Bayer Crop Science) применяют в смеси с гербицидами семейства сульфонилмочевин для прополки посевов кукурузы и риса [35]. Использование ИДЭ 15 в составе стандартной для нас композиции, включавшей ТБК и ТМТД, продемонстрировало наличие умеренной антидотной активности по отношению к гербициду метсулфурон-метилу на проростках кукурузы и рапса. Например, на кукурузе удалось частично компенсировать снижение массы проростков, вызванное присутствием гербицида в почве – с 67 до 37%. При этом доза антидота составляла 100 г/т семян. Повышение дозы до 200 г/т не приводило к увеличению защитного эффекта [58]. Таким образом, по нашей оценке, изоксадифен-этил уступал по своей активности фурилазолу. В надежде повысить активность ИДЭ осуществили синтез его фторсодержащих производных 16–20 (рис. 7). При этом одна из фенильных групп была заменена на CF3-группу, а вторая модифицирована заместителями: СН3-, Cl, Br. Испытания, проведенные in vitro (в чашках Петри), на семенах кукурузы не обнаружили существенной антидотной активности [59]. Вместе с тем и сам ИДЭ в этих условиях не обладал такой активностью [58].
Значительные успехи достигнуты при внесении в почву сорбентов, связывающих остатки гербицидов [59–61]. В частности, с этой целью вполне успешно использован активированный уголь. Эффективность подхода снижается за счет обратимости адсорбции сульфонилмочевин, а значит следует искать сорбенты, которые были бы способны катализировать гидролиз сульфонилмочевин. Такую функцию предположительно могут играть цеолиты и родственные соединения, изучению которых будут посвящены дальнейшие работы.
ЗАКЛЮЧЕНИЕ
Использование антидотов в комплексных препаратах для предпосевной обработки семян позволяет в значительной степени преодолеть угнетающее действие на растения остатков сульфонилмочевинных гербицидов в почве. В качестве таких антидотов можно применять как новые оригинальные соединения, так и промышленные препараты, использующиеся в виде смеси с гербицидами для прополки посевов вегетирующих растений. Перспективным антидотом является промышленный препарат фурилазол. Разработки этого типа можно внедрять в практику сельского хозяйства уже сегодня. Применение таких технологий не требует дополнительных агрономических процедур и использует низкие дозы уже применяющихся антидотов. Для ряда сельскохозяйственных культур такие антидотные протравители можно применять профилактически.
Вместе с тем использование только антидотов, по-видимому, не позволит полностью решить проблему остатков гербицидов в почве. Разработка новых антидотов не только важна в практических целях, но и позволит использовать их как инструменты изучения защитных механизмов метаболизма растений.
Список литературы
Latifundist com – Химический анализ: аналитика мирового рынка СЗР. 4.12.2018. (http://latifundist/com/read/2291).
Жемчужин С.Г., Спиридонов Ю.Я., Босак Г.С. Нанотехнологии и пестициды // Агрохимия. 2019. № 11. С. 77–85.
Janaki P., Sharma N., Chinnusamy C., Sakhtivel N., Nitya C. Herbicide residues and their stratagies // Ind. J. Weed Sci. 2015. V. 47. № 3. P. 329–344.
Soundhia S. Herbicides residues in soil, water, plants, and non-targeted organisms and human health implications: an Indian perspective // Ind. J. Weed Sci. 2014. V. 46. № 1. P. 66–85.
Hoffman O.L. Inhibition of auxin effects by 2,4,6-trichlorophenoxyacetic acid // Plant Physiol. 1953. V. 28. P. 622–628.
Hoffman O.L., Gull P.W., Zeisig H.C., Epperley J.R.C. Factors influencing wild oat control with barban // Proc. North. Cen. Weed Cont. Conf. 1960. V. 17. P. 20.
Hoffman O.L. Chemical antidotes for EPTC on corn // Abstr. Weed Sci. Soc. Am. 1969. V. 9. P. 12.
Hoffman O.L. Herbicide antidotes: From concept to practice // Chemistry and action herbicide antidotes / Eds. Pallos F.M., Casida J.E. NY, USA: Academic Press, 1978. P. 35–61.
Hoffman O.L. Coated corn seed. US Patent 3,564,768 (1971).
Pallos F.M., Brokke M.E., Arnekley D.R. Belgian Patent 782120 (1972).
Davies J., Caseley J.S. Herbicide safeners: a review // Pestic. Sci. 1999. V. 55. P. 1043–1058.
Monako T.J., Weller C.C., Ashton F.M. Herbicides and the plants // Weed science: Principles and practices. NY, USA: Wiley, 2002. P. 98–126.
Jablonkai I. Herbicide safeners: Effective tools to improve herbicide selectivity // Herbicides – current research and case studies in use / Eds. Price A.J., Kelton J.A. Rijeka, Croatia: Intech Press, 2013. 652 p.
Davies J. Herbicide safeners – commercial products and tools for agrochemical research // Pest. Outlook. 2001. № 2. P. 10–15.
Спиридонов Ю.Я., Хохлов П.С., Шестаков В.Г. Антидоты гербицидов // Агрохимия. 2009. № 5. С. 81–91.
Riechers D.E., Kreuz K., Zhang Q. Detoxification without Intoxication: Herbicides safeners activate plant defence gene expression // Plant Phisiol. 2010. V. 153. P. 3–13.
Klein M., Burla B., Martinoia E. The multidrug resistance-associated protein (MRP/ABCC) subfamily of ATP-binding cassette transporters in plants // FEBS Lett. 2006. V. 580. P. 1112–1122.
Bounds S.V.J., Hutson D.H. The comparative metabolism of agrochemicals in plant and mammals // Metabolism of Agrochemicals in Plants / Ed. Roberts T. Chichester, UK: John Wiley&Sons, 2000. P. 179–209.
Савченко Т.В., Застрижная О.М., Климов В.В. Оксилипины и устойчивость растений к абиотическим стрессам // Биохимия. 2014. № 79. Вып. 4. С. 458–475.
Farmer E.E., Muller M.J. ROS-mediated lipid piroxidation and RES-activated signaling // Ann. Rev. Plant Biol. 2013. V. 64. P. 429–450.
Ort O. Newer sulfonylureas // Modern Crop Protection / Eds. Kramer W., Schirmer U. VILEY–VCH–Verlag GmbH & Co. KGaA, 2007. P. 45–87.
Спиридонов Ю.Я., Шестаков В.Г., Ларина Г.Е., Спиридонова Г.С. Как ослабить остаточное действие сульфонилмочевинных гербицидов? // Защита и карантин раст. 2006. № 2. С. 59–61.
Brown H.M., Cotterman J.C. Recent advances in sulfonylurea herbicides Herbicides inhibiting branched chain amino acid biosynthesis / Eds. Ebing W., J. Stetter W. Berlin–Heidelberg: Springer, 1994. V. 10. P. 47–81.
Макеева-Гурьянова Л.Т., Спиридонов Ю.Я., Шестаков В.Г. Сульфонилмочевины – новые перспективные гербициды. М.: ВНИИТЭИагропром, 1989. 56 с.
Питина М.П., Познанская Н.Л. Использование антидотов как путь экологически безопасного применения гербицидов на основе сульфонилмочевин // Агрохимия. 1994. № 4. С. 114–119.
Li Y., Zimmerman W.T., Gorman M.K., Reiser R.W., Fogel A.J., Haney P.E. Aerobic soil methabolism of metsulfuron-methyl // Pest. Sci. 1999. V. 55. P. 434–445.
Sarmah A.K., Sabadie J. Hydrolysis of sulfonylurea in soil and aquues solution: a Review // Agric. Food Chem. 2002. V. 50. P. 6253–6265.
Grey T.L., McCullough P.E. Sulfonylurea herbicides fate in soil: Dissipation, mobility, and other process // Weed Technol. 2012. V. 26. P. 579–581.
Леонтьев В.Н., Ахромович Т.И., Игнатовец О.С. Естественные пути деградации гербицидов ряда сульфонилмочевины // Тр. БГТУ. Химия, технол. орг. вещ-в и биотехнол. 2013. № 4. С. 197–204.
Sondhia S. Herbicides residues in soil, plants and non-targeted organisms and human health implication: an Indian perspective // Ind. J. Weed Sci. 2014. V. 46. № 1. P. 66–85.
Parker C., Richardson W.G., West T.M. Potential for extending the selectivity of DPX 4189 by use herbicide safeners // Proc. Br. Crop. Prot. Conf. Weeds. 1980. P. 15–22.
Barrett M. Protection of grass crops from sulfonylurea and imidazolinone toxicity // Crop safeners for herbicides. development, uses and mechanism of action / Eds. Hatzios K.K., Hoagland R.T. Academic Press, Inc. Ps, 1989. P. 195–219.
Спиридонов Ю.Я., Промоненков В.К., Швецов-Шиловский Н.И., Мочалкина К.И., Познанская Н.Л., Яковец В.П., Епишина Л.В., Макеев Ю.Н., Тарандина Т.Е. Об использовании 1,8-нафталевого ангидрида для защиты кукурузы от действия хлорсульфурона // Агрохимия. 1988. № 9. С. 106–110.
Persans M., Schuler M. Different induction of cytochrome P450 – mediated triasulfuron metabolism by naphtalic angidride and triasulfuron // Plant Physiol. 1995. V. 109. P. 1483–1490.
Rosinger C., Kecher H. Modern Crop Protection / Eds. Kramer W., Schirmer U. VILEY–VCH Verlag GmbH & Co. KGaA, 2007. P. 259–281.
Чкаников Д.И., Макеев А.М., Назарова Т.А., Устименко Н.В. Влияние антидота 1,8-нафталевого ангидрида на фитотоксичность и скорость метаболизма 2,4-дихлорфеноксиуксусной кислоты и хлорсульфурона в растениях // Физиология растений. 1991. Т. 38. Вып. 2. С. 290 –297.
Кадыров А.А., Свиридов В.Д., Спиридонов Ю.Я., Чкаников Н.Д. Композиция для обработки семян, обладающая рострегулирующим действием. Пат. РФ. № 2369094 (2009). Бюл. 2009. № 28.
Курбанова Э.Р., Закирова Р.П., Спиридонов Ю.Я., Халиков С.С., Чкаников Н.Д. Влияние регулятора роста флороксан на рост и урожайность хлопчатника // Агрохимия. 2019. № 6. С. 37–43.
Malherbe P., Masciadri R., Nercross R.D., Prinssen E. 2-Phenyl-3,3,3-trifluoro-2-hydrohypropipnic acid derivatives. US Pat. 7,504,428, March 17, 2009.
Ramesh S.A., Tyerman S.D., Bo X., Bose J., Kaur S., Conn V., Domingos P., Ullah S., Wege S., Shabala S., Feijo J.A., Ryan P.R., Gillham M. GABA signalling modulates plant growth by directly regulating the activity of plant-specific anions transporters // Nat. Commun. 2015. V. 6. № 1. P. 7879–1–7879–9.
Чкаников Н.Д., Спиридонов Ю.Я., Федоровский О.Ю., Халиков С.С., Музафаров А.М. Пат. РФ 2666732 (2018). Бюл. № 26.
Федоровский О.Ю., Халиков С.С., Спиридонов Ю.Я., Чкаников Н.Д. Антидотная активность нового производного стимулятора роста растений флороксан по отношению к гербициду ряда сульфонилмочевин – метсульфуронметилу // Агрохимия. 2019. № 5. С. 29–34.
Баскаков Ю.А., Константинова Н.В., Фридман Е.Э., Чкаников Н.Д., Свиридов В.Д., Спиридонов Ю.Я., Мочалкина К.И., Макеев Ю.Н. N-4-(1-Окси-1-этоксикарбонил-2,2,2-трифторэтил)-N'-м-хлорфенилмочевина, обладающая антидотной активностью к хлорсульфурону. Пат. РФ 1804056. Опубл. 20.11.1996.
Баскаков Ю.А., Константинова Н.В., Фридман Е.Э. Чкаников Н.Д., Свиридов В.Д., Спиридонов Ю.Я., Мочалкина К.И., Тарандина Т.Е., Шаповалов А.А. N-4-(1-оксикарбонил-2,2,2-трифторэтил)фенил-N-метил-N'-алкилмочевины, обладающие антидотной активностью по отношению к хлорсульфурону в посевах кукурузы и фасоли. Пат. РФ 1811162 А1. Опубл. 27.04.2000.
Баскаков Ю.А., Колобанова Л.П., Балеста П.С., Шаповалов А.А., Чепа Е.В., Чкаников Н.Д., Свиридов В.Д. N-[4-(2’-гидроксигексафторизопропил) фенил]-N-этил-N’-фенилмочевина, обладающая рострегулирующим действием. Пат. РФ 1743153С. Опубл. 27.02.1995.
Халиков С.С., Сапарбоева Н.К., Арипов Х.Н. Процессы измельчения в технологии приготовления суспензионных концентратов // Узбек. хим. журн. 1995. № 6. С. 50–54.
Халиков С.С., Чкаников Н.Д., Спиридонов Ю.Я., Глинушкин А.П. Новый препарат для предпосевной обработки семян с комплексной защитой от болезней и остатков гербицидов в почве // Агрохимия. 2016. № 6. С. 39–45.
Халиков С.С., Чкаников Н.Д., Спиридонов Ю.Я., Глинушкин А.П. Композиция для предпосевной обработки семян. Пат. РФ 2585858 (2015). Бюл. № 16 (2016).
Tomlin C.D.S. The pecticide manual. 12th ed. / Ed. Tomlin C.D.S. // The British Crop Protection Concil, 2000. 482 p.
Голубев А.С., Коротов Н.А., Федоровский О.Ю., Спиридонов Ю.Я., Чкаников Н.Д. Фторсодержащие аналоги промышленного антидота фурилазол // Агрохимия. 2017. № 6. С. 62–67.
Халиков С.С., Голубев А.С., Чкаников Н.Д., Коротов Н.А., Спиридонов Ю.Я. Инновационные протравители с антидотным действием // Агрохимия. 2017. № 4. С. 22–25.
Chkanikov N.D., Golubev A.S., Belyaeva E.V. New approaches to the synthesis of CF2-substituted heterocyclic antitumor cytostatic agents // INEOS OPEN. 2019. V. 2. № 2. P. 33–40.
Mantenau B., Pazenok S., Vors J.-P., Leroux F.R. New trends in the chemistry α-fluorinated ethers, thioethers, amines and phosphines // J. Fluorine Chem. 2010. V. 131. P. 140–158.
Власенко Н.Г., Бурлакова С.В., Халиков С.С., Федоровский О.Ю., Чкаников Н.Д. Флороксан – потенциальный компонент комплексных протравителей зерновых культур // Агрохимия. 2017. № 7. С. 49–54.
Власенко Н.Г., Бурлакова С.В., Федоровский О.Ю., Чкаников Н.Д., Халиков С.С. Комплексный фунгицид на основе фениламидов и азолов для защиты семенного материала яровой пшеницы // Агрохимия. 2018. № 10. С. 40–45.
Власенко Н.Г., Бурлакова С.В., Чкаников Н.Д., Халиков С.С. Фунгицидный протравитель на основе азолов для обработки семян зерновых культур // Агрохимия. 2019. № 6. С. 44–49.
Спиридонов Ю.Я., Чичварина О.А., Голубев А.С., Чкаников Н.Д., Халиков С.С. Инновационные протравители с антидотным действием. Изучение антистрессового действия фурилазола и его производного // Агрохимия. 2018. № 4. С. 45–49.
Спиридонов Ю.Я., Чичварина О.А., Голубев А.С., Чкаников Н.Д., Халиков С.С. Особенности антидотного действия изиксадифен-этила в составе протравителей семян сельскохозяйственных культур // Усп. совр. естествознания. 2018. № 10. С. 79–84.
Сиган А.Л., Голубев А.С., Беляева Е.В., Горфинкель С.М., Каграманов Н.Д., Спиридонов Ю.Я., Чкаников Н.Д. Синтез этил-5-арил-5-трифторметил-4,5-дигидроизоксазол-3-карбоксилатов, обладающих свойствами регуляторов роста растений // Изв. PАН. 2019. № 1. С. 99–103.
Chkanikov N.D., Spiridonov Yu.Ya., Khalikov S.S., Muzafarov A.M. Antidotes for reduction of phytotoxicity of the residues of sulfonylurea herbicides // INEOS OPEN. 2019. V.2. № 5. P.145–152.
Spiridonov Ju.Ja., Mukhin V.M., Karpachev V.V., Gorshkov V.I., Gorshkova E.K., Voropaeva N.L., Figovsky O.L. Soil detoxication by the means of activated carbon in breeding process // Inter. Lett. Natur. Sci. 2017. V. 62. P. 28–64.
Дополнительные материалы отсутствуют.