Агрохимия, 2020, № 6, стр. 78-96
ФУНКЦИИ УГЛЕРОДА В МИНЕРАЛИЗАЦИОННО-ИММОБИЛИЗАЦИОННОМ ОБОРОТЕ АЗОТА В ПОЧВЕ
1 Институт физико-химических и биологических проблем почвоведения РАН – обособленное подразделение ФИЦ “Пущинский научный центр биологических исследований РАН”
142290 Пущино, Московская обл., Институтская ул., 2, Россия
2 Всероссийский научно-исследовательский институт фитопатологии
143050 Московская обл., Одинцовский р-н, р.п. Большие Вяземы, ул. Институт, влад. 5, Россия
* E-mail: v.m.semenov@mail.ru
Поступила в редакцию 15.11.2019
После доработки 10.12.2019
Принята к публикации 10.03.2020
Аннотация
Рассмотрены механизмы процессов минерализации и иммобилизации азота в почве. Подчеркнута особая роль углерода в регулировании минерализационно-иммобилизационного оборота азота. Приведены примеры оценки гросс (общих) и нетто (чистых) размеров минерализации и иммобилизации азота в почве. Отмечено, что скорость выделения С-СО2 из почвы является объективным и достоверным индикатором азотминерализующего потенциала почвы.
ВВЕДЕНИЕ
Азот и углерод относятся к числу макробиогенных, жизненно важных первоэлементов-органогенов. Азот содержится в хлорофилле, нуклеиновых кислотах, аминокислотах и белках, играя важную роль в фотосинтезе, белковом обмене и продукционном процессе растений. Чем больше содержание азота в листьях растений, тем активнее происходит фотосинтез. Считается, что до 55% ассимилированного в растительных тканях углерода используется в метаболизме азота. Углерод в составе органических соединений и СО2 является одним из главных природных регуляторов жизнедеятельности почвенных микроорганизмов, осуществляющих процессы азотфиксации, аммонификации, нитрификации, анаммокса и денитрификации (рис. 1). На восстановление 1 М молекулярного азота азотфиксирующие микроорганизмы тратят 16 М АТФ, образующейся в результате окисления органических молекул. Свободноживущие микроорганизмы, не имеющие фотосинтетического аппарата, получают эти молекулы от других организмов, а фотосинтезирующие микроорганизмы, такие как цианобактерии, используют сахара, полученные в результате фотосинтеза. Источником энергии для ассоциативных и симбиотических азотфиксаторов являются органические соединения растений-хозяев.
Рис. 1.
Взаимодействие циклов углерода и азота в системе почва–растение–атмосфера: 1 – фотосинтез, 2 – опад, экссудаты, 3 – разложение, 4 – стабилизация, 5 – дыхание, 6 – минерализация, 7 – иммобилизация, 8 – нитрификация, 9 – поглощение растениями, 10 – биологическая фиксация, 11 – денитрификация, 12 – атмосферные выпадения, 13 – вымывание.
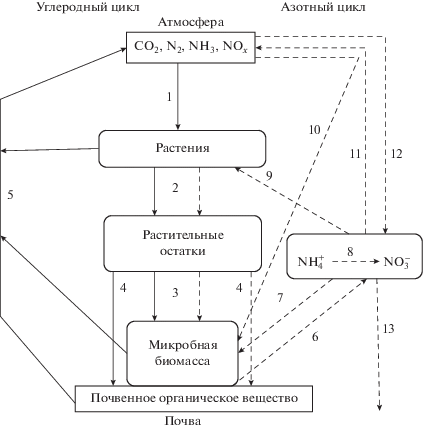
Круговороты азота и углерода тесно связаны между собой, оба цикла не могут осуществляться друг без друга [1]. Круговорот азота в экосистемах включает в себя процессы его поступления и удаления из почвы, преобразования из одной химической формы в другую и переноса между компартментами экосистемы [2–4]. Цикл углерода является одним из самых важных, комплексных и сложных, в котором ведущее положение занимают процессы фотосинтеза, разложения органических остатков, стабилизации в составе почвенного органического вещества и эмиссии диоксида углерода в атмосферу. Биогеохимический цикл углерода объединяет резервуары с длительным пребыванием углерода в них и динамические пулы, через которые осуществляется быстрый обмен элемента [5, 6].
Микробная биомасса является связующим звеном почвенных циклов углерода и азота, стоком и источником биофильных элементов, продуцентом физиологически активных соединений и “парниковых” газов [7]. В биомассе почвенных микроорганизмов происходит преобразование органических и минеральных соединений, синтезируются присущие только микроорганизмам соединения. Поступление углерода с корневыми выделениями, прижизненным опадом и растительными остатками детерминирует обилие, функциональную активность и разнообразие свободноживущих, симбиотических и ассоциативных групп азотфиксирующих микроорганизмов. По образному выражению Д. Дженкинсона, микробная биомасса является “игольным ушком, через которое должны пройти все органические вещества, поступающие в почву” [8].
Наличие строгих стехиометрических соотношений углерода с азотом в растениях, микробной биомассе, в почвенном органическом веществе и в других природных субстратах и объектах является условием и признаком устойчивого функционирования наземных экосистем [9]. Сдвиги природных соотношений C : N : P в биомассе растений и микроорганизмов могут происходить вследствие обогащения (эвтрофикация) или обеднения (олиготрофикация) наземных и водных экосистем элементами минерального питания [10, 11]. Нарушение соотношений C : N : P в организмах-продуцентах сопровождается изменением качества продукции, дезорганизацией круговорота питательных веществ и их передвижения по трофической сети в экосистеме, вызывая в конечном счете изменение таковых соотношений у организмов-потребителей. В итоге меняется состав и структура экосистемы, в которой виды с низким содержанием минеральных элементов вытесняются видами, богатыми питательными веществами, или наоборот. Изменения в соотношении N : P в организмах и экосистеме отражаются на скорости роста отдельных видов и их конкурентоспособности, приводя к перестройке видового разнообразия экосистемы с риском исчезновения некоторых видов. Соотношение в почве N : K в доступных растениям формах и степень подвижности почвенного азота являются ключевыми факторами, контролирующими накопление 137Cs растениями [12].
Массивное вовлечение в природный биогеохимический цикл технического азота во второй половине XX века привело к значимым изменениям в количестве и соотношении форм азота в почвах с самыми разнообразными негативными последствиями для окружающей среды [13, 14]. Одной из главных причин нитрогенизации окружающей среды стало нарушение природных углеродно-азотных равновесий и, как следствие, разбалансированность процессов минерализации и иммобилизации азота в почве [15, 16]. Была подчеркнута важность поддержания в почве экологически оптимальных соотношений органического углерода и минерального азота, в том числе путем внесения углерода растительных остатков для закрепления дополнительно минерализующегося азота [17].
Цели работы – рассмотрение механизмов процессов, слагающих минерализационно-иммобилизационный цикл азота в почве, сравнение общих и чистых размеров минерализации и иммобилизации азота, выявление роли органического углерода в минерализационно-иммобилизационных превращениях азота в почве.
МИНЕРАЛИЗАЦИОННО-ИММОБИЛИЗАЦИОННЫЙ ЦИКЛ АЗОТА В ПОЧВЕ
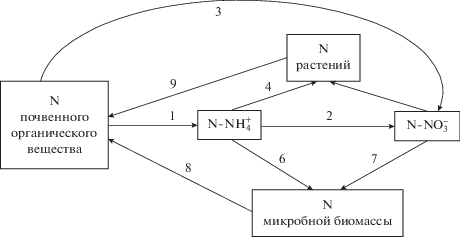
Непрерывное превращение минерализованного азота в органические продукты синтеза, а иммобилизованного азота – в минеральные продукты разложения, сопряженное с ростом и отмиранием микробной биомассы, определяется как минерализационно-иммобилизационная оборачиваемость (Mineralization–Immobilization Turnover) азота в почве (рис. 2). Процессы минерализациии и иммобилизации слагают гетеротрофный субцикл азота, связанный благодаря минерализации с автотрофным и элементным его подциклами: минерализованный N иммобилизуется в гетеротрофном субцикле, поглощается растениями в автотрофном субцикле и денитрифицируется в элементном субцикле [19]. Минерализация азота осуществляется на конечном этапе разложения органических веществ микроорганизмами, представляя собой превращение азота органических соединений в растворимые неорганические (минеральные) формы (N-NH4 и N‑NO3), которые могут быть доступны растениям. В действительности, минерализация азота – это не отдельный физиологический процесс, а совокупность множества физиологических процессов, осуществляемых микроорганизмами. Конечным процессом в минерализационных превращениях азота является аммонификация – превращение аминокислот до аммиака и аммония, катализируемое внутриклеточными и внеклеточными ферментами [20]. Образующийся в результате аммонификации аммоний подвергается нитрификации – последовательному окислению до нитрита и нитрата. Минерализации органического азота предшествует стадия деполимеризации. При деполимеризации происходит расщепление высокомолекулярных биополимеров, в которых содержится основная часть азота, до мономеров [4, 21].
Рис. 2.
Схема минерализационно-иммобилизационной оборачиваемости азота в почве [18]: 1 – гросс-минерализация, 2 – автотрофная нитрификация, 3 – гетеротрофная нитрификация, 4 – поглощение NH$_{4}^{ + }$ растениями, 5 – поглощение NO$_{3}^{ - }$ растениями, 6 – иммобилизация NH$_{4}^{ + }$, 7 – иммобилизация NO$_{3}^{ - }$, 8 – поступление с растительными остатками, 9 – поступление с микробной биомассой.
Агентами деполимеризации и аммонификации выступают гетеротрофные микроорганизмы, а нитрификации аммонийного азота – автотрофные и гетеротрофные микроорганизмы, включая грибы, бактерии и археи [22]. Деполимеризация осуществляется внеклеточными ферментами, включая протеиназы, хитиназы, амидазы и амидогидролазы. Субстратами для деполимеризации выступают белки, нуклеиновые кислоты, компоненты клеточных стенок микробной биомассы (аминосахара и их полимеры, хитин, пептидогликан). Источником азота могут быть также медленно разлагаемые гетероциклические и фенольные соединения, присутствующие в значительных количествах в почвенном органическом веществе. Экзоферменты уменьшают размер и сложность азотсодержащих органических молекул, облегчая их дальнейшее разложение или ассимиляцию. Белки расщепляются различными протеиназами и пептидазами (табл. 1). Протеиназы специфичны к крупным молекулам белков, а пептидазы могут расщеплять ди- или трипептиды или отдельные аминокислоты. Небольшие по размеру пептиды и аминокислоты, образующиеся в результате активности протеиназы, поглощаются микроорганизмами и затем метаболизируются внутриклеточными ферментами с образованием ${\text{NH}}_{{\text{4}}}^{{\text{ + }}}$ в качестве побочного продукта. Высвобождение N из непептидных C–N-связей в аминокислотах и мочевине катализируется амидогидролазами, дегидрогеназами и трансаминазами. Пептидогликангидролаза деполимеризует гликопептиды клеточных стенок, играя тем самым ключевую роль в разложении и обороте микробной биомассы. Полимеры аминосахаров, которые являются важными компонентами бактериальных и грибных клеточных стенок, гидролизуются гликозидазами. Хитиназа действует на хитин и хитодекстрины – основные соединения в грибах, а нуклеазы ответственны за разложение нуклеиновых кислот.
Таблица 1.
Типичные ферменты, участвующие в минерализации азота в почве [23]
| Фермент | Функция |
|---|---|
| Протеиназы/пептидазы | Гидролиз пептидных связей |
| Трипсин | Гидролиз до лизина и аргинина |
| Химотрипсин | Гидролиз до ароматических аминокислот |
| Субтилизин (микробная щелочная протеиназа) | Щелочная протеиназа из класса сериновых протеиназ |
| Карбоксильные протеиназы | Кислые протеиназы, похожие на пепсин или ренин |
| Микробные металлопротеиназы | Нейтральные протеиназы, содержащие Zn |
| Амидогидролазы | Гидролиз C–N связей линейных амидов |
| L-аспарагиназа | Гидролиз L-аспарагина |
| L-глутаминаза | Гидролиз L-глутамина |
| Амидаза | Гидролиз алифатических амидов |
| Уреаза | Гидролиз мочевины до CO2 и NH3 |
| Пептидогликан гидролаза | Гидролиз пептидогликановых связей |
| Амидиногидролазы | Гидролиз C–N-связей линейных амидинов (карбоксамидинов) |
| Аргиназа | Гидролиз аргинина до орнитина и мочевины |
| Трансаминазы (аминотрансферазы) | Перенос аминогрупп от аминокислот на кетокислоты без образования свободного аммиака |
| Дегидрогеназы дезаминирующие | Окислительное дезаминирование аминокислот |
| Глутаматдегидрогеназа | Дезаминирование L-глутаминовой кислоты в α-кетоглутаровую |
| Гликозидазы | Гидролиз аминосахаров и их полимеров |
| Хитиназа | Гидролиз хитиновых связей |
| Мурамидаза (лизоцим) | Гидролиз пептидогликанов (муреин, мукопептид) или мукополисахарида (гликозаминогликанов) |
| Нуклеазы | Гидролиз нуклеиновых кислот (ДНК и РНК) |
| ДНКаза (экзодезоксирибонуклеаза) | Катализирует разрушение ДНК |
| РНКаза (экзорибонуклеаза) | Катализирует разрушение РНК |
В большинстве случаев микробная деградация аминокислот, нуклеотидов и аминосахаров обусловлена потребностью гетеротрофных микробов в энергии и в углероде. В этом случае катаболический метаболизм перевешивает анаболические процессы, что приводит к экскреции ненужного ${\text{NH}}_{{\text{4}}}^{{\text{ + }}}$ [24]. Теоретически, аммиак в почве может образоваться путем прямого ферментативного расщепления аминов или амидов ферментами, которые попадают в почву после лизиса клеток. Однако деаминазы и деамидазы активны, как правило, в межклеточном пространстве внутри живых организмов, поэтому образование ${\text{NH}}_{{\text{4}}}^{{\text{ + }}}$ зависит от поступления в клетки небольших по размеру органических соединений – продуктов деполимеризации высокомолекулярных соединений внеклеточными ферментами.
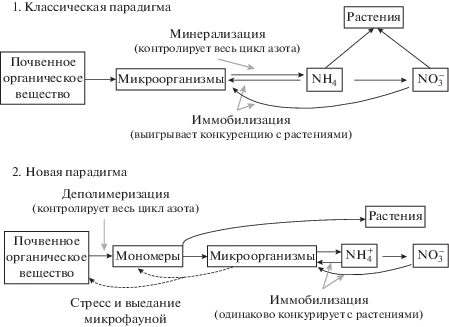
По новой парадигме главным процессом минерализации является не аммонификация органических соединений до ${\text{NH}}_{{\text{4}}}^{{\text{ + }}}$, а деполимеризация полимеров до мономеров (рис. 3). В одних случаях молекулы органических мономеров обогащенной азотом микрозоны ассимилируются микроорганизмами, поглощаются корнями растений, либо перемещаются с почвенным раствором в обедненные азотом микрозоны, где подвергаются ассимиляции гетеротрофами. В других случаях мономеры в местах их образования преимущественно минерализуются до аммония, который потребляется растениями, частично нитрифицируется или перемещается в обедненные азотом микрозоны. Третий и четвертый случаи, наиболее характерные для агроэкосистем – это преимущественная минерализация мономеров до аммония, частичная или значительная его нитрификация с преобладающим потреблением растениями аммония или нитратов соответственно, без выраженной миграции минеральных форм в обедненные азотом микрозоны почвы. В отличие от традиционного представления, по которому органический азот сначала минерализуется до ${\text{NH}}_{{\text{4}}}^{{\text{ + }}}$ и лишь потом поглощается микроорганизмами в почве [25], новая концепция допускает прямое поглощение микроорганизмами небольших органических молекул, например, аминокислот, без предварительной их минерализации [24]. Если в первом случае предполагается наличие строгой конкуренции микроорганизмов с растениями за минеральный азот, то во втором случае, когда микроорганизмы используют органический азот, а растения – минеральный, конкуренция менее выражена. Наличие прямого поглощения микроорганизмами органического азота объясняет трофическую сбалансированность микробно-растительных ассоциаций в естественных экосистемах.
Разложение органического вещества осуществляется по пути приоритетного использования гетеротрофными микроорганизмами углерода и зависит от биохимического качества субстрата, факторов окружающей среды (температуры, влажности, аэрации), физико-химических свойств почвы (pH, гранулометрического, агрегатного и минералогического состава) и разнообразия почвенного микробиома. Необходимое для синтетических процессов количество азота микроорганизмы получают непосредственно из разлагаемого материала, либо поглощая минеральные формы из почвы. Преимущественное использование микроорганизмами азота аммония или органических соединений зависит от доступности углерода и азота в почве, а также от концентрации ${\text{NH}}_{{\text{4}}}^{{\text{ + }}}$ в почвенном растворе. Если в разлагаемом материале содержится больше азота, чем необходимо для поддержания стандартного отношения C : N в биомассе микроорганизмов, которые разлагают органический субстрат, происходит экскреция аминокислот и аммония в почву (рис. 4). Максимальная эффективность ассимиляции углерода субстрата микроорганизмами оценивается в 0.60 [26]. Соотношение C : N в микробной биомассе варьирует от 3 до 24, а средняя арифметрическая величина соотношения равна 8.6 [27]. Поэтому субстрат с соотношением C : N ≈ 20 ± 4 считается идеальным для почвенных микроорганизмов. Однако в присутствующем в почве органическом веществе, как правило, содержится слишком мало азота, чтобы удовлетворить синтетические потребности микробного сообщества. При высокой обеспеченности доступным углеродом микроорганизмы будут вынуждены поглощать аммоний или нитраты из окружающей почвы. Этот минеральный азот становится иммобилизованным.
Рис. 4.
Влияние качества органического субстрата на минерализационно-иммобилизационные превращения азота в почве.

В широком смысле под иммобилизацией азота понимается его перевод в связанное состояние посредством включения в микробную биомассу и последующего закрепления в составе почвенного органического вещества. Ассимиляция микроорганизмами азота является биотическим этапом его иммобилизации. Микроорганизмы, демонстрируя фенотипическую пластичность (способность организма формировать разные фенотипы в ответ на различные условия среды), могут поглощать и ассимилировать как аммонийную и нитратную формы азота, так и небольшие органические молекулы, например, аминокислоты, сразу используя их для синтеза биомассы [24, 28]. Поступление NH3 в клетки может осуществляться путем диффузии через цитоплазматические мембраны, а аммония – с помощью транспортных белков. Внутриклеточное усвоение ${\text{NH}}_{4}^{ + }$ почвенными микроорганизмами осуществляется преимущественно путем синтеза глутамата и/или глютамина. При низких концентрациях ${\text{NH}}_{{\text{4}}}^{{\text{ + }}}$, типичных для большинства почв, функционирует ферментная система глутаминсинтетаза–глутаматсинтаза (GS–GOGAT), а при относительно высоких – глутаматдегидрогеназа (GDH). Нитраты могут быть иммобилизованы непосредственно бактериями и грибами, подвергаясь внутриклеточному восстановлению до ${\text{NH}}_{4}^{ + }$ в присутствии ассимиляторной нитратредуктазы и ассимиляторной нитритредуктазы. Синтез этих ферментов индуцируется нитратами и подавляется аммонием или глютамином.
В почве естественного сложения в действительности вероятно наличие микрозон как с высоким, так и с низким содержанием доступного углерода, как с преобладанием N-NH4, так и N-NO3. Поэтому в одних микрозонах почвы могут преобладать процессы минерализации (мобилизации), а в других – иммобилизации (стабилизации), нитрификации. Подобная разнонаправленность процессов была характерна при очаговом (локальном) размещении аммонийных форм азотных удобрений [29–31]. Поскольку ионы ${\text{NO}}_{3}^{ - }$ диффундируют в почве быстрее, чем ${\text{NH}}_{4}^{ + }$, образующиеся в микрозонах с высокой скоростью минерализации нитраты становятся главным источником азота для гетеротрофных микроорганизмов в микрозонах с преобладанием иммобилизации [32]. Высокая концентрация ${\text{NH}}_{4}^{ + }$ в очаге размещения удобрений, занимающим небольшой объем почвы, способствует мобилизации почвенного азота, но временно подавляет нитрификацию, тогда как в смежных с очагом зонах почвы сохраняются благоприятные для нитрификации и иммобилизации азота условия [29–31]. В итоге, в почве увеличивается продолжительность сбалансированного аммонийно-нитратного соотношения, а минеральный азот сохраняется к периоду наибольшей потребности растений в азоте [33].
Минеральные формы и органические соединения, образующиеся в результате минерализации и иммобилизации азота, подвергаются тем же превращениям, что и их предшественники, содержавшиеся в почве. Минерализация азота, ранее иммобилизованного микробной биомассой, называется реминерализацией, а иммобилизация ранее минерализованного азота – реиммобилизацией. Показано, что размеры микробной иммобилизации азота удобрений могут достигать 4/5 от внесенного количества в течение первых 4–7 сут, а основная часть азота удобрений поступает в растения, проходя через стадии иммобилизации и реминерализации [34]. Внесение растительных остатков с широким отношением углерода к азоту не снижает минерализацию азота, как принято считать, а наоборот усиливает, но в еще большей мере стимулирует иммобилизацию и реиммобилизацию азота, вследствие чего в почве обнаруживается низкое содержание минерального азота [35]. Как показано в этой работе, реминерализация иммобилизованного азота удобрений в серой лесной почве без растительных остатков и с пшеничной соломой составляла за 11–13 нед 61 и 27–46% или соответственно 0.26 и 0.20–0.25 мг/кг/сут. Подразделение процессов минерализации–реиммобилизации, иммобилизации–реминерализации, как и количественное измерение реминерализованного и реиммобилизованного азота, возможно только с помощью стабильного изотопа 15N. Наличие этапов реминерализации и реиммобилизации хорошо объясняет динамику минерального азота в почве, связывая ее с естественными циклами роста и отмирания микробной биомассы и со стрессовыми воздействиями факторов внешней среды на микробное сообщество и почвенное органическое вещество [28].
Циклы высушивания–увлажнения и замораживания–оттаивания вызывают частичное отмирание и лизис микробной биомассы, выброс цитоплазматических соединений выжившими клетками, и, как следствие, увеличение минерализации углерода и азота в почве [36, 37]. Реиммобилизации и реминерализации азота в почве способствует выедание простейшими, нематодами и другими микроскопическими животными биомассы бактерий и грибов с относительно низким отношением C : N. Со временем лизировавшиеся и переваренные в пищеварительном тракте клетки бактерий и грибов представляют собой источник минерализуемого азота, который в дальнейшем поступает в почву с экскрементами и отмершими телами [38]. Реминерализация и реиммобилизация обеспечивают рециркуляцию азота в экосистеме для повторного использования другими организмами.
ОБЩИЕ И ЧИСТЫЕ РАЗМЕРЫ МИНЕРАЛИЗАЦИИ, ИММОБИЛИЗАЦИИ И НИТРИФИКАЦИИ АЗОТА В ПОЧВЕ
Содержание минеральных форм азота в почве зависит одновременно от размеров их продукции и потребления. Поэтому следует определять размеры общей (гросс) и чистой (нетто) минерализации, нитрификации и иммобилизации [18, 39, 40]. Под гросс-минерализацией и гросс-нитрификацией азота понимается общая продукция в почве соответственно N-NH4 и N-NO3 до их потребления в других процессах. Гросс-минерализация эквивалентна аммонификации. “Потребление” включает в себя все процессы, которые ведут к расходу аммония и нитрата в почве. К потреблению ${\text{NH}}_{4}^{ + }$ относят его иммобилизацию микроорганизмами и нитрификацию, фиксацию минералами, а также улетучивание в виде аммиака. Допускается, что потребление ${\text{NH}}_{4}^{ + }$ в почве эквивалентно сумме гросс-иммобилизации N-NH4 и гросс-нитрификации. Потребление N-NO3 может включать иммобилизацию микроорганизмами, вымывание, денитрификацию и диссимиляторное восстановление нитратов.
Скорости гросс-минерализации и гросс-нитрификации азота почвенного органического вещества устанавливаются изотопным способом по изменению избытка 15N через 1–3 сут после добавления меченых соединений $^{{15}}{\text{NH}}_{4}^{ + }$ и $^{{15}}{\text{NO}}_{3}^{ - }$ соответственно [18, 39, 40]. Чем выше скорость минерализации почвенного азота микроорганизмами, тем существеннее снижение доли добавленного $^{{15}}{\text{NH}}_{4}^{ + }$ в составе N-NH4 почвы. Точно так же, чем интенсивнее окисление автотрофными нитрификаторами $^{{14}}{\text{NH}}_{4}^{ + }$ до $^{{14}}{\text{NO}}_{3}^{ - }$ или органического 14N до $^{{14}}{\text{NO}}_{3}^{ - }$ в случае гетеротрофной нитрификации, тем значительнее разбавление $^{{15}}{\text{NO}}_{3}^{ - }$ в почве. Парные комбинации солей, содержащих аммоний и нитрат, используют при одновременном расчете гросс-величин процессов минерализации, иммобилизации и нитрификации. Тот же результат достигается при парном применении 15NH4NO3 и NH415NO3. Размеры гросс-иммобилизации устанавливаются по разнице между гросс-потреблением ${\text{NH}}_{4}^{ + }$ и гросс-нитрификацией. Прямое определение гросс-иммобилизации аммонийного или нитратного азота производят по накоплению 15N в микробной биомассе. В почве без растений, где денитрификация считается незначительной, потребление нитрата часто эквивалентно его иммобилизации. Измерение гросс-потоков азота методом изотопного разбавления основано на ряде допущений: 1 – не происходит дискриминация изотопов (изотоп 15N в соединениях не ограничивает участие в процессах соединений, содержащих 14N и наоборот), 2 – 15N равномерно распределяется в почве, 3 – поддерживается естественное соотношение между пулами почвенного азота (добавленное соединение с 15N имеет то же химическое состояние и так же распределено в почве, что и природные соединения в почве, любые процессы трансформации N в почве, которые происходят в течение инкубационного периода, например, диффузия, фиксация, образование газов, иммобилизация, нитрификация в равной степени свойственны добавленному и содержащемуся в почве азоту) [41].
Оценка гросс-потоков азота из растительных остатков и других органических источников производится 3-мя способами. Разностный способ оценки гросс-минерализации азота растительных остатков основывается на добавлении раствора $^{{15}}{\text{NH}}_{4}^{ + }$ в почву с растительными остатками и без остатков. По разнице величин устанавливается гросс-минерализация азота собственно растительных остатков. Прямой метод предусматривает равномерное смешивание с почвой гомогенно измельченного органического материала, меченного по 15N и добавление в момент определения гросс-минерализации немеченого раствора N-NH4. Известен и такой способ определения гросс-потоков азота в почве, когда азотный пул почвенного органического вещества предварительно метится 15N. Для этого в почву заранее вносят меченный по 15N раствор соли и органический субстрат, инициирующий иммобилизацию, например, целлюлозу. Чем продолжительнее период прединкубации, тем больше вероятность того, что соотношение пулов минерального и минерализуемого азота в почве соответствует реальному состоянию и оба пула одинаково обогащены 15N. Более надежный способ получить равномерное распределение 15N по всем пулам почвенного азота – это использовать в исследованиях почву, на которой в предыдущий год выращивали растения с применением высокообогащенных по 15N азотных удобрений [2].
По обобщенным нами литературным данным, величины гросс-минерализации варьируют от 0.17 до 36.5 мг/кг/сут, гросс-нитрификации – от 0.17 до 3.89 мг/кг/сут, а гросс-иммобилизации – от 0.15 до 29 мг/кг/сут. Мета-анализ результатов многих исследований [42] показал, что чем больше содержится в почве общего азота, тем больше величины гросс-минерализации азота. Гросс-минерализация фактически может быть более чем на порядок больше, чем чистая минерализация [40]. Повышенное содержание аммония или нитратов в почве может быть результатом как высокой минерализации и нитрификации, так и незначительного их расходования. Поэтому гросс- и нетто-величины минерализации и нитрификации не всегда коррелируют между собой. Для нитрификации характерна логарифмическая зависимость от минерализации азота, когда при низких темпах минерализации скорость нитрификации высокая, а при высокой минерализации скорость нитрификации низкая [43]. В отличие от нитрификации, иммобилизация (ассимиляция) ${\text{NH}}_{4}^{ + }$ микробной биомассой возрастает почти линейно во всем диапазоне скоростей минерализации. Поэтому при низких размерах минерализации доминирующей статьей превращения аммонийного азота является нитрификация, а при высоких – иммобилизация. Содержание и качество почвенного органического вещества являются ключевыми факторами, определяющими как гросс-минерализацию азота, так и дальнейшую судьбу ${\text{NH}}_{4}^{ + }$: будет ли он нитрифицирован или ассимилирован почвенными микроорганизмами [43].
Нетто-минерализация азота – чистое накопление аммония (N-NH4) и нитрата (N-NO3) в почве за определенный промежуток времени. Допускается, что другие неорганические формы азота, образующиеся во время минерализации (например, ${\text{NO}}_{2}^{ - }$, N2O и NOx) либо незначительны по содержанию, либо нестабильны и быстро преобразуются в другую форму, поэтому их потоки не соизмеримы с увеличением пулов азота аммония и нитратов. Величина нетто-минерализации представляет собой баланс между общей минерализацией азота в почве (гросс-минерализация) и его расходом в результате микробной иммобилизации и потерь (табл. 2).
Таблица 2.
Способы оценки минерализации и нитрификации азота в почве
| Формула | Обозначение | |
|---|---|---|
| Нетто-минерализация (Nн-м, мг/кг) | ||
| Nн-м = Nг-м – (Nим + Nп) | Nг-м – гросс-минерализация, Nим – иммобилизация азота, Nп – потери азота (обычно пренебрегаются) | |
| Нетто-минерализация в лабораторных условиях (Nн-м, мг/кг) | ||
| Nн-м = [Nминt – Nминt0] | Nмин t – содержание N-NH4 + N-NO3 в конце инкубации, Nминt0 – то же в начале инкубации. | |
| Скорость нетто-минерализации в лабораторных условиях (Nн-м, мг/кг/сут или г/м2/сут) | ||
| Nн-м = [Nминt – Nминt0]/∆t | Nминt и Nминt0 – содержание N-NH4 + N-NO3 в конце и в начале инкубации, мг/кг; ∆t – время инкубации, сут | |
| Нетто-минерализация в полевых условиях (Nн-м, кг/га) | ||
| Nн-м = ∆Nмин + Np + Nв – Nуд | ∆Nмин – разница в запасах Nмин в почве (0–100 см) между осенним и весенним измерениями, кг/га; Np – вынос азота растениями, кг/га; Nв – инфильтрационные потери азота за пределы 0–100 см почвы, кг/га; Nуд – доза азота минеральных удобрений (N-NO3 + N-NH4 в органических удобрениях), кг/га | |
| Азотминерализующий потенциал почвы (N0) | ||
| Nt = N0(1 – exp (–kt)) | Nt – содержание Nмин в почве в течение инкубации, мг/кг; N0 – содержание потенциально-минерализуемого азота на начало инкубации, мг/кг; k – константа скорости минерализации, сут-1; t – время инкубации, сут | |
| Скорость нетто-нитрификации (Nн-н, мг/кг/сут или г N /м2/сут) | ||
| Nн-н = [(N-NO3)t – (N-NO3)0]/∆t | (N-NO3)t и (N-NO3)0 – содержание нитратного азота в конце и в начале инкубации, мг/кг; ∆t – время инкубации, сут | |
| Минерализация азота органических материалов | ||
| P = [1 – S(E/B)] | P – доля N минерализованного из субстрата, S – отношение C : N в субстрате, B – отношение C : N в микробной биомассе, E – доля углерода субстрата, усвоенного микроорганизмами | |
| Нетто-минерализация (нетто-иммобилизация) в почве с растительными остатками | ||
| Nн-м (Nим) = (С0 – Ct) + (At – A0) | Nн-м – нетто-минерализация, Nим – нетто-иммобилизация, A0 – Nмин в начале инкубирования (контроль), С0 – то же в вариантах с фитомассой, At – Nмин в срок отбора (контроль), Ct – то же в вариантах с фитомассой | |
В отсутствии растений и в условиях, исключающих вымывание и значимые газообразные потери азота, чистая минерализация азота определяется по изменению запасов минерального азота. Скорость нетто-минерализации почвенного азота характеризует количество накопленного в почве Nмин за время инкубации. Типичные величины скорости нетто-минерализации в необрабатываемых почвах в течение вегетационного периода с достаточной влажностью составляют 0.1–1.0 г N/м2/сут или 0.5–5.0 мг N/кг почвы/сут [44]. В полевых условиях с возделыванием сельскохозяйственных культур и внесением азота минеральных удобрений размеры нетто-минерализации устанавливают по изменению запасов Nмин в 1-метровой толще почвы и выносу азота урожаем культур.
Величины нетто-минерализации достаточно корректно отображают азотный режим почвы, доступность почвенного азота растениям, уровень азотных нагрузок в экосистеме и потенциальные величины потерь азота из почвы. Измерение нетто-минерализации осуществляют в полевых или в лабораторных условиях. Инкубация почвенных кернов в полевых условиях позволяет оценить чистую минерализацию азота при температурах, типичных для данного участка, без чрезмерного нарушения структуры почвы. Для сравнения азотминерализующего потенциала почв разных типов, местоположений и землепользований предпочтительнее инкубация в лабораторных условиях при постоянных режимах температуры и влажности [45]. При инкубации образцов в лабораторных условиях исключаются такие источники и процессы, влияющие на размеры пула Nмин в почве, как поглощение растениями, вымывание и атмосферные выпадения. Другие процессы, которые могут влиять на пул Nмин, в частности, денитрификация и улетучивание NH3, измеряются отдельно. Отрицательные величины в разнице запасов Nмин соответствуют чистой иммобилизации азота в почве.
Азотминерализующий потенциал почвы характеризует потенциальные размеры преобразования органического азота в неорганические формы при стандартных условиях температуры и влажности среды. Величина азотминерализующего потенциала почвы зависит от размера потенциально-минерализуемого пула почвенного органического вещества почвы и активности организмов, ответственных за его разложение и минерализацию. При инкубации в течение 2–6 нед основным источником минерализуемого азота выступают легко- и умеренно минерализуемые компоненты почвенного органического вещества с константами скорости минерализации соответственно k1 > 0.1 и 0.1 > k2 > 0.01/сут. Азотминерализующий потенциал всего почвенного органического вещества, включая и трудно минерализуемую его фракцию (k3 < 0.01/сут), устанавливается по результатам длительной инкубации на протяжении от полугода до года или более с измерением Nмин в почве с интервалами от 7-ми до 30-ти сут [46]. По количеству накопленного в почве Nмин устанавливают содержание потенциально-минерализуемого азота в почве на начало инкубации и константу скорости минерализации (табл. 2).
Показано, что в серой лесной почве под лесом и пашней содержалось потенциально-минерализуемого азота 74 и 37 мг/кг, в выщелоченном черноземе под залежью и разноудобренными посевами культур – 75 и 52 ± 1 мг/кг, в целинной и пахотной каштановой почве – 106 и 56 мг/кг [47, 48]. По другим данным, содержание N0 в разных почвах варьировало от 10–145 до 54–1610 мг/кг, а константы скорости минерализации – от 0.003–0.032 до 0.010–0.054 сут [49]. В работе этих авторов приведен обзор разных моделей, использованных для расчета азотминерализующего потенциала почвы, в том числе и многокомпонентных, допускающих подразделение органического пула азота на фракции, отличающиеся по константам скорости минерализации. Для точной оценки потенциально-минерализуемого азота инкубацию образца необходимо продолжать до тех пор, пока прирост содержания Nмин снизится до сравнительно небольших величин. При работе с воздушно-сухими образцами почвы необходима их прединкубация в течение 10–14 сут, потому что увлажнение сухих образцов сопровождается иммобилизацией содержащегося в почве минерального азота. В целом, чем продолжительнее инкубация, тем точнее параметры минерализации органического азота. Различия в азотминерализующем потенциале почвы одного и того же варианта могут быть связаны с сезонными изменениями неразложившихся растительных остатков в почве и микробной биомассы.
Определение азотминерализующей способности почвы позволяет оценивать и прогнозировать текущий ход минерализации почвенного азота и его возможные изменения под действием примененных азотных удобрений [50]. Главная особенность этого метода состоит в инкубации при стандартной температуре и влажности 5-ти субобразцов анализируемой почвы с возрастающими количествами азотного удобрения (от 0 до 2.5 или от 0 до 5 мг/мл) в течение 4-х нед. По истечению инкубации в субобразцах почвы определяют сумму минерального азота. Величину азотминерализующей способности почвы устанавливают нахождением первой производной уравнения регрессии, описывающего содержание доступного азота (N-NH4обм + N-NO3) в почве (Y) в зависимости от доз азотного удобрения (X). Сумма исходного Nмин и азотминерализующей способности почвы позволяет диагностировать потребность растений в течение всего вегетационного периода [13]. Показана зависимость азотминерализующей способности почвы от обеспеченности разлагаемым органическим веществом, подвижными формами фосфора и калия, вносимыми с органическими и минеральными удобрениями, способа обработки почвы, вида возделываемой культуры и других факторов. Азотминерализующая способность пахотной дерново-подзолистой почвы варьировала от 16 до 124 мг N/кг, серой лесной почвы – от 26 до 94 мг/кг, лугово-пойменной почвы – от 12 до 156 мг/кг. Отмечено, что под действием органических удобрений в дозах от 40 до 100 т/га азотминерализующая способность чернозема и дерново-подзолистой почвы на участках пашни была больше, чем на целине [13].
С целью более полного представления об азотном режиме почвы целесообразно оценивать нитрификационную способность почвы, под которой понимается накопление нитратов в почве при стандартной температуре и влажности за определенный промежуток времени. Величина нитрификационной способности почвы эквивалентна нетто-нитрификации. Нетто-нитрификация – чистая продукция в почве нитратного азота, исключающая то его количество, которое может быть иммобилизовано в микробной биомассе или денитрифицировано до газообразного азота в течение анализа (табл. 2). Так же, как и в случае минерализации, отрицательные величины нетто-нитрификации указывают на преобладание процессов потребления нитратов, которые могут расходоваться на иммобилизацию или теряться из почвы. Существует взаимосвязь между гросс-нитрификацией и потреблением ${\text{NO}}_{3}^{ - }$, при этом связь между общей нитрификацией и эмиссией закиси азота из почвы была недостоверной [42]. Следовательно, нитраты в почве больше иммобилизуются, чем используются в денитрификации.
МОБИЛИЗАЦИЯ И СТАБИЛИЗАЦИЯ АЗОТА В ПОЧВЕ
Наряду с биологически опосредованными процессами минерализации и иммобилизации, образование и расходование минерального азота в почве может осуществляться в результате химических реакций и физических явлений. Абиотическое высвобождение азота в почве из недоступного для микроорганизмов и растений состояния в доступное называется мобилизацией, а приобретение минеральными и органическими формами азота недоступного для биоты состояния обозначается стабилизацией [4].
Абиотическая мобилизация азота проявляется в виде растворения, десорбции обменно-поглощенного и дефиксации фиксированного N-NH4 при увеличении влажности почвы и концентрации одно- и двухвалентных катионов, при наличии условий, способствующих диспергированию глинистых частиц и органо-минеральных коллоидов. Примером физической и химической мобилизации азота является также вытеснение обогащенного нитратами почвенного раствора из микропор, хемодиссимиляция аминокислот, солюбилизация почвенных коллоидов и минералов. Почвенное органическое вещество, дестабилизированное абиотическими путями и утратившее химическую или физическую защищенность под действием природных и агрогенных нарушающих воздействий, становится биотически трансформируемым и источником потенциально-минерализуемого азота.
Процессы адсорбции N-NH4, аминокислот, амидов поверхностью органических и минеральных частиц, фиксации N-NH4 глинистыми минералами, “защемления” нитратов в микропорах, консервации простых N-органических соединений в микроагрегатах ведут к частичной или полной, краткосрочной или продолжительной абиотической стабилизации азота в почве [2, 51]. Известны и другие механизмы химической стабилизации азота, как, например, восстановление нитратов ионами Fe2+ и Mn2+, реакции нитритов с амидами и аминокислотами, образование гетероциклических соединений в результате взаимодействия аминокислот, N-NH4 и N-NO3 с полифенолами, образующимися при разложении растительных остатков [52, 53].
Мобилизационно-стабилизационные превращения в почве осуществляются независимо, так и во взаимосвязи с минерализационно-иммобилизационными. По обобщенным данным [42], гросс-минерализация азота в образцах почвы с нарушенным сложением в среднем в 1.6 раза больше, чем в образцах с естественным сложением (табл. 3). Размеры нетто-минерализации и нетто-нитрификации в перемешанных почвах, как правило, больше, чем в ненарушенных образцах. Скорость потребления ${\text{NH}}_{4}^{ + }$ (автотрофная нитрификация и гетеротрофная ассимиляция ${\text{NH}}_{4}^{ + }$ микроорганизмами) в нарушенных почвах в 1.7 раза больше, чем в неповрежденных почвах. Перемешивание почвы незначительно замедляет гросс-нитрификацию, но в значительной мере усиливает выделение закиси азота. Приведенные данные указывают, что различного рода воздействия на почву оказывают мобилизующее действие на минеральный пул азота, который вовлекается во внутрипочвенные превращения, и одновременно дестабилизируют почвенное органическое вещество. В результате утраты химической и/или физической защищенности почвенного органического вещества многие из его азотсодержащих компонентов становятся доступными для минерализации почвенными микроорганизмами. Абиотические процессы мобилизации-стабилизации характеризуются более высокой скоростью по сравнению с биотическими процессами минерализации и иммобилизации. Есть все основания считать, что роль процессов мобилизации-стабилизации во внутрипочвенном обороте азота значительно выше, чем считалось до сих пор, позволяя объяснить ряд непонятных моментов в поведении азота в почве.
Таблица 3.
Параметры внутрипочвенного цикла азота в почве с естественным и с нарушенным сложением, мг/кг/сут [42]
| Параметр | Сложение почвы | |
|---|---|---|
| Естественное | Нарушенное | |
| Выделение CO2 | 18.9 | 31.7 |
| Выделение N2O | 1.49 | 4.32 |
| Гросс-минерализация | 2.41 | 3.96 |
| Потребление ${\text{NH}}_{4}^{ + }$ | 2.59 | 4.29 |
| Нетто-минерализация | –0.52 | 0.25 |
| Гросс-нитрификация | 1.21 | 0.78 |
| Потребление ${\text{NO}}_{3}^{ - }$ | 1.55 | 0.88 |
| Нетто-нитрификация | –0.19 | 0.12 |
УГЛЕРОДНЫЙ КОНТРОЛЬ МИНЕРАЛИЗАЦИОННО-ИММОБИЛИЗАЦИОННОЙ ОБОРАЧИВАЕМОСТИ АЗОТА В ПОЧВЕ
Минерализационно-иммобилизационные превращения азота в почве сопряжены с жизненным циклом и метаболизмом почвенных микроорганизмов, представляя собой один из эффектов углеродно-азотных взаимодействий. Медиатором углеродно-азотных взаимодействий выступает микробная биомасса, драйверами – количество субстрата, доступность субстрата микроорганизмам, эффективность использования субстрата микроорганизмами и соотношение C : N в субстрате и в микробной биомассе, а результатом – количество и формы образующихся продуктов.
Микробная биомасса занимает центральное место во внутрипочвенном цикле азота, выступая источником минерализуемого азота, продуцентом азотсодержащих органических соединений, в том числе ферментов, участвующих в деполимеризации, аммонификации, нитрификации и ассимиляции и стоком азота при его иммобилизации. В микробной биомассе содержится от 2 до 5% от общего азота почвы, но благодаря непрерывному обороту ее истинный вклад в формирование и обновление почвенного пула азота гораздо существеннее. Непрерывный рост и отмирание микробной биомассы обеспечивает постоянный приток органического азота в почвенное органическое вещество в виде лабильных, быстро минерализуемых внутриклеточных компонентов и прочных, устойчивых к разложению клеточных стенок, которые стабилизируются в гумусе. По данным, полученным для почв разных экосистем, гросс-минерализация N положительно коррелирует с содержанием микробной биомассы, органического углерода и общего азота [43].
На единицу азота микробной биомассы (Nмб) приходилось 3 и более единиц потенциально-минерализуемого азота (N0), тогда как увеличение или снижение содержания в почве общего органического азота не вело к соответствующему изменению количества N0 [54]. Этими авторами установлено, что содержание углерода и азота микробной биомассы достоверно коррелировало с кумулятивным количеством минерализованного за 24 нед азота, позволяя хорошо диагностировать обеспеченность почвы доступным азотом. Активный пул почвенного азота на 28–36% представлен Nмин, на долю Nмб приходится 29–44%, необменного аммония – 0.3–5%, неидентифицируемых компонентов – ≈30% [55]. По нашим данным, в минеральной, микробной и неидентифицируемой (метаболической) фракциях активного пула содержится в среднем 12, 34 и 54% азота, а при добавлении растительных остатков – 3, 36 и 61% соответственно [56].
Доступность микроорганизмам субстрата является функцией его биохимического качества, которое характеризуют содержание растворимого углерода, общего азота, лигнина, полифенолов, отношения C : N, лигнин : N, полифенол : N, лигнин + полифенол : N [57]. Отношение C : N в органическом веществе не дает точного представления о биохимическом качестве разлагаемого материала, но достаточно релевантно отражает минерализационную способность органического вещества. Как правило, разложение субстратов с соотношением C : N < 20 или с содержанием общего азота >1.5% сопровождается нетто-минерализацией, а субстратов с C : N > 30 или с содержанием Nобщ < 1.5% – иммобилизацией минерального азота, содержащегося в почве. В случае сложных, исходно прочных материалов (например, лигнина) преобладание минерализации может происходить при соотношении C : N до 50 вследствие разной скорости разложения отдельных фракций сложного материала [58]. В уточненной модели минерализационно-иммобилизационной оборачиваемости азота [59] доля минерализованного из органического материала азота устанавливается, исходя из соотношений C : N в микробной биомассе и в разлагаемом субстрате (табл. 2).
Периодическое поступление свежего органического вещества в почву (прижизненный растительный опад, корневые выделения, растительные остатки, органические удобрения), образование твердых дискретных частиц (particulate organic matter) из разлагаемого органического материала и их высвобождение из разрушенных агрегатов создает избыток доступного микроорганизмам углерода, смещая углеродно-азотное равновесие, присущее почве, и инициируя иммобилизацию почвенного азота (рис. 5). Поскольку минерализованный углерод практически полностью улетучивается из почвы в виде С-СО2 в отличие от азота, потери которого составляют только часть от минерализованного количества, соотношение между углеродом разлагаемого субстрата и азотом, содержащимся в почве, сужается. Создаются предпосылки для замедления иммобилизации азота и преобладания минерализационных процессов с накоплением Nмин. Для сравнения, в почве чистого пара нет значимых источников свежего органического вещества, поступление которого могло бы инициировать иммобилизацию азота, поэтому даже при невысоких темпах минерализации гумифицированных компонентов почвенного органического вещества происходит накопление Nмин в почве.
В ранее выполненных нами исследованиях были определены удельные величины нетто-минерализации и иммобилизации азота при внесении в почву разных органических материалов [35]. Разложение в почве бактериальной массы Rhodobacter (C : N = 4.7) давало нетто-минерализацию азота в количестве 54–99 мг N/г внесенного углерода в начале разложения и 103–120 мг N/г внесенного углерода по истечению 8-ми нед. На получение 1 мг минерализованного азота расходовалось 10–18 и 8–10 мг углерода бактериальной биомассы. Следовательно, увеличение доли бактериальной массы в составе почвенного органического вещества будет способствовать преобладанию минерализации азота над его иммобилизацией. Разложение растительных остатков в почве давало как нетто-минерализацию азота, так и нетто-иммобилизацию в зависимости от соотношения C : N в их составе. При внесении зеленых листьев овса с C : N = 9 размеры нетто-минерализации азота увеличивались с 6–12.3 мг/г внесенного углерода в начале разложения до 15.5–16.1 мг/г углерода растительных остатков через 8 нед с начала наблюдений. На минерализацию 1 мг азота растительных остатков требовалось 81–167 и 62–64 мг углерода фитомассы, что во много раз превышало затраты бактериальной массы. В других исследованиях удельная нетто-минерализация азота при разложении в почве массы белого клевера с C : N = 9.8 составляла 51.3 мг/г внесенного углерода, а на 1 мг минерализованного азота требовалось 19.5 мг углерода [60]. Можно предположить, что количество азота, высвобождаемого при минерализации органического материала, зависит не столько от содержания азота в разлагаемом материале, сколько от эффективности использования микроорганизмами углерода из осваиваемого субстрата, которая уменьшалась в ряду: бактериальная биомасса > фитомасса клевера > зеленые листья овса.
Критическое соотношение C : N в растительных остатках, при котором начинается преобладание иммобилизации азота в почве, по-видимому, >18. Именно такое соотношение C : N имели зеленые листья кукурузы, добавление которых в почву вызывало краткосрочную нетто-иммобилизацию азота [35, 61]. Внесение других видов или более зрелых растительных остатков с C : N = = 26–34 сопровождалось умеренно продолжительной иммобилизацией, а с C : N = от 55 до 99 – долговременной. Судя по литературным данным, критическое соотношение C : N величина не постоянная и может меняться от 19 до 44 [57]. Поэтому применительно к минерализационно-иммобилизационной оборачиваемости азота в почве следует говорить не о точном критическом соотношении C : N в растительных остатках, а об интервале таковых. В отличие от строгой зависимости минерализации–иммобилизации азота от соотношения C : N в свежих органических материалах, добавленных в почву [58], соотношение валовых содержаний C : N в почве дает слабое представление о направленности и активности процессов превращения азота [43].
Определение удельной величины иммобилизации позволяет предсказывать вероятность временнóй недоступности растениям внесенного азота удобрений и эффективность предотвращения потерь азота из почвы, устанавливать размеры компенсации минерализованного азота почвы внесенным азотом удобрения, устанавливать дозу свежего органического вещества, необходимого для связывания минерального азота в почве, оставшегося неиспользованным после вегетации растений. Было рассчитано, что для связывания 1 кг остаточного нитратного азота в слое 0–20 см серой лесной почвы необходимо 39–100 кг углерода соломы, а в целом сбалансированное соотношение минерализационно-иммобилизационных процессов достигается при компенсации единицы минерального азота в почве 30–50 единицами доступного микроорганизмам органического углерода [15]. В нашем опыте на серой лесной почве удельная величина нетто-иммобилизации в начале разложения меченной по 15N фитомассы овса (С : N = 26) составляла 2.1–10.1 мг N/г углерода внесенного с фитомассой [35]. При таких величинах удельной иммобилизации для связывания одной единицы азота требовалось от 99 до 476 единиц углерода свежего органического вещества. В литературе на 1 г углерода, внесенного в почву с разными видами растительных остатков (соломы пшеницы, ячменя, гороха, стеблей кукурузы, рисовой шелухи, листьев рапса и др.) иммобилизовалось в среднем 27 мг N (от 10 до 53 мг N/г C), а на иммобилизацию единицы азота расходовалось 48 единиц углерода (от 19 до 100 мг C/мг N) [57]. При внесении в почву пшеничной соломы (C : N = 61) нетто-иммобилизация только азота аммиачной селитры составила в среднем за весь период наблюдений 23.8 мг N/г углерода соломы, а азота почвы и удобрений – 29.2 мг/г C соломы [35]. Было отмечено, что размеры иммобилизации азота могут лимитироваться не только наличием доступного углерода, но и обеспеченностью минеральным азотом, поэтому при низкой обеспеченности Nмин потенциальная азотиммобилизующая емкость почвы может быть больше актуальной. В других исследованиях при низком содержании Nмин в почве нетто-иммобилизация азота составляла 13 мг/г углерода пшеничной соломы, тогда как при высоком – 32 мг/г углерода [62].
Конечным продуктом минерализации органического вещества, наряду с N-NH4 и N-NO3, является диоксид углерода. Если минеральные формы в значительном количестве реутилизируются, а при определенных условиях накапливаются в почве, диоксид углерода, за исключением небольшого количества, потребляемого автотрофными микроорганизмами и поглощаемого почвенным раствором, преимущество выделяется из почвы. Современные способы газохроматографического измерения позволяют получить количественно точные величины количества С-СО2, на основании которых можно составить представления о размерах минерализации азота почвы. Однако на начальных этапах разложения свежего растительного опада растущие микроорганизмы больше иммобилизуют азот из разлагаемого материала и из окружающей массы почвы, чем минерализуют (рис. 5). Со временем, вследствие насыщения иммобилизованным азотом смеси опада и микробной биомассы устанавливается динамическое равновесие между наличием доступного углерода и потребностью в азоте, при котором количество высвобождаемого при минерализации азота будет равняться количеству углерода, окисленного до СО2. Микроорганизмы используют на ассимиляцию и дыхание разное количество углерода растительных остатков в зависимости от их качества и количества доступного углерода. Поэтому скорость эмиссии C-CO2 одновременно характеризует и минерализационную и иммобилизационную стадии оборачиваемости азота в почве, а удельную эффективность минерализации и иммобилизации азота следует соотносить не только к количеству субстрата, но и к количеству углерода, израсходованного на дыхание [63–66]. Если в начальные 17–20 сут с начала опыта выделение С-СО2 положительно коррелировало с иммобилизацией минерального азота (r = 0.643, n = 12), то начиная с 40–60-х сут, связь была отрицательной (r = –0.634, n = 12), свидетельствуя о преобладании в почве минерализации азота [66]. Величины гросс-минерализации и гросс-иммобилизации азота, как правило, строго коррелируют с выделением С-СО2 из почвы (соответственно R2 = 0.974, P < 0.001 и R2 = 0.980, P < 0.001), тогда как связь нетто-минерализации азота с выделением С-СО2 менее отчетливая или не проявляется вовсе [40]. В опыте с внесением в почву 8-ми видов растительных остатков скорость выделения С-СО2 теснее коррелировала с гросс-иммобилизацией азота (R2 = 0.74), чем с гросс-минерализацией (R2 = 0.41) [67]. Тесная связь иммобилизации азота с выделением С-СО2 (R2 = 0.984) обнаружена также в опытах с внесением в почву остатков древесного волокна [68].
Удельная эффективность минерализации азота бактериальной массы Rhodobacter (C : N = 4.7) на начальной стадии и в конце ее разложения в почве составляла 96–204 и 140–164 мг N/г С-СО2, соответствуя соотношению C : N, равному 5–10 и 6–7 [35]. Чтобы получить соотношение С-СО2 к азоту, минерализованному из растительных остатков, необходимо учитывать сопутствующую иммобилизацию азота, размеры которой будут превышать минерализацию. Разделить минерализационный и иммобилизационный вклад в эмиссию C-CO2 можно путем “перекрестной метки”, когда меченную по 15N фитомассу вносят в немеченую почву, а немеченную фитомассу – в меченную по 15N почву. Удельная величина нетто-иммобилизации в начале разложения фитомассы овса (С : N = 26) и через 8 нед составляла 10.4–37.8 мг и 5.4 мг N/г С-СО2, что соответствовало соотношениям C : N = 26–96 и 185 [35]. В других исследованиях с разными видами растительных остатков удельная иммобилизация азота составляла от 5.7 до 110 мг N/г С-СО2, показывая очень широкий диапазон соотношений минерализованного углерода к иммобилизованному азоту – от 9 до 176 [68–70].
К приведенному выше материалу необходимы следующие пояснения. Во-первых, в присутствии растений в полевых условиях дыхание корней может видоизменять динамику и размеры выделения С-СО2, продуцируемого микроорганизмами в течение минерализационно-иммобилизационных превращений азота. Во-вторых, скорость и кумулятивная величина эмиссии С-СО2 характеризует гросс- и нетто-потоки почвенного азота лишь в отсутствии свежих растительных остатков, видоизменяющих соотношение процессов минерализации и иммобилизации. В-третьих, свежий органический материал – предпочтительный источник углерода для микроорганизмов по сравнению с почвенным органическим веществом, большинство компонентов которого находится в стабилизированном состоянии и защищено от разложения. Поэтому количественные характеристики минерализации и иммобилизации азота, полученные для растительных остатков, могут отличаться от таковых для азота почвенного органического вещества. Соблюдение перечисленных условий позволяет оценивать азотминерализующий потенциал почвы по количеству потенциально-минерализуемого органического вещества, устанавливаемого по кумулятивному количеству С-СО2, выделившегося за время инкубации, соизмеримое вегетационному периоду [9]. Содержание углерода потенциально минерализуемого органического вещества (C0) [71] достоверно коррелировало с азотминерализующим потенциалом (N0) и нетто-минерализацией (Nн-м) азота [47] в серой лесной почве и в выщелоченном черноземе (r = 0.686, P = 0.007 и r = 0.822, P < 0.001 соответственно). Согласно полученным уравнениям регрессии, увеличение в этих почвах потенциально-минерализуемого углерода на 100 мг/кг позволит увеличить содержание потенциально-минерализуемого азота как минимум на 1.25 мг/кг, а нетто-минерализуемого азота – на 1.44 мг/кг. Соотношения C0 : N0 и C0 : Nн-м в необрабатываемых почвах составляли 31 ± 9 и 46 ± 9, а под пашней – 15 ± 5 и 28 ± 10 соответственно. В анализируемую выборку вошли варианты без удобрений и с внесением минеральных и органических удобрений, поэтому полученные соотношения C0 : N0 и C0 : Nн-м можно считать стандартными, отражающими текущее углеродно-азотное соотношение в серой лесной почве и выщелоченном черноземе. В необрабатываемых и пахотных почвах на чистую минерализацию азота приходилось в среднем 65 и 54% от потенциально-минерализуемого азота соответственно. Это могло быть обусловлено разным качеством минерализуемого пула органического вещества в целинных и пахотных почвах, так и дефицитом доступного углерода в пахотных почвах. Если азотминерализующий потенциал и размеры нетто-минерализации азота в пахотных почвах были соответственно в 1.5 и 1.8 раза меньше, чем в необрабатываемых участках, то обедненность углеродом потенциально-минерализуемого органического вещества достигала 3.1 раза. Убыль потенциально-минерализуемого органического вещества является характерным признаком агрогенной деградации пахотных почв. По сравнению с целинными и залежными угодьями пахотная дерново-подзолистая почва обеднена активным органическим веществом в среднем в 1.6 раза, серая лесная – в 1.9 раза, подтипы чернозема – в 2.4 раза, каштановые – в 1.2 раза, бурая лесная кислая – в 1.3 раза [72]. Недостаток доступного углерода – главная причина замедленного минерализационно-иммобилизационного оборота азота в почве и биологической инертности применяемых азотных удобрений.
ВЫВОДЫ
1. Количественная параметризация минерализационно-иммобилизационной оборачиваемости азота в почве и поддержание на этой основе природоподобного соотношения между потенциально-минерализуемыми пулами углерода и азота в почве является одним из приоритетных условий экологически сбалансированного круговорота азота в агроэкосистемах, сохранения и воспроизводства плодородия почвы, повышения эффективности удобрений и предотвращения нарушений в окружающей среде.
2. Использование высоких доз минеральных азотных удобрений в земледелии должно предусматривать комплекс мер по увеличению обеспеченности почвы потенциально-минерализуемым органическим веществом, которое является источником минерализуемого азота, обеспечивая одновременно пролонгированную иммобилизацию азота в почве. Чтобы синхронизировать этапы превращения азота в почве и его потребления растениями, важно не столько ограничить иммобилизацию, сколько обеспечить быструю и эффективную реминерализацию ранее иммобилизованного азота.
3. Меченные по 15N соединения остаются самым объективным и точным индикатором процессов превращения азота в почве и его потребления растениями. Программы исследований круговорота азота в агроэкосистемах должны включать определения азотминерализующего потенциала и нетто-минерализации азота, запасов углерода и азота микробной биомассы, скорости эмиссии С-СО2, а также потенциально-минерализуемого органического вещества.
Список литературы
Nieder R., Benbi D.K. Carbon and nitrogen in the terrestrial environment. Dordrecht: Springer, 2008. 430 p.
Кудеяров В.Н. Цикл азота в почве и эффективность удобрений. М.: Наука, 1989. 216 с.
Завалин А.А., Соколов О.А. Потоки азота в агроэкосистеме: от идей Д.Н. Прянишникова до наших дней. М.: ВНИИА, 2016. 591 с.
Семенов В.М. Современные проблемы и перспективы агрохимии азота // Пробл. агрохим. и экол. 2008. № 1. С. 55–63.
Кобак К.И. Биотические компоненты углеродного цикла. СПб.: Гидрометеоиздат, 1988. 248 с.
Кудеяров В.Н. Современное состояние углеродного баланса и предельная способность почв к поглощению углерода на территории России // Почвоведение. 2015. № 9. С. 1049–1060.
Horwath W.R. The Role of the soil microbial biomass in cycling nutrients // Microbial biomass: A Paradigm shift in terrestrial biogeochemistry / Ed. Tate K.R. London: World Scientific, 2017. P. 41–66.
Stockdale E.A., Murphy D.V. Managing soil microbial biomass for sustainable agroecosystems // Taм жe. P. 67–101.
Семенов В.М., Лебедева Т.Н. Проблема углерода в устойчивом земледелии: агрохимические аспекты // Агрохимия. 2015. № 11. С. 3–12.
Craine J., Elmore A.J., Wang L., Aranibar J., Bauters M., Boeckx P. Isotopic evidence for oligotrophication of terrestrial ecosystems // Nat. Ecol. Evolut. 2018. V. 2. P. 1735–1744.
Sardans J., Rivas-Ubach A., Peñuelas J. The C : N : P stoichiometry of organisms and ecosystems in a changing world: A review and perspectives // Perspect. .Plant Ecol. Evolut. Systemat. 2012. V. 14 (1). P. 33–47.
Тулина А.С., Ставрова Н.Г., Семенов В.М. Закономерности поступления 137Cs в растения из дерново-подзолистой песчаной почвы при внесении азотных удобрений // Агрохимия. 2007. № 11. С. 61–70.
Башкин В.Н. Агрогеохимия азота. Пущино: ОНТИ НЦБИ, 1987. 270 с.
Кудеяров В.Н., Биелек П., Соколов О.А., Кноп К., Пругар Я., Семенов В.М., Башкин В.Н., Моцик Ф., Скоржепова И., Шабаев В.П., Никитишен В.И. Баланс азота и трансформация азотных удобрений в почвах. Пущино: ОНТИ НЦБИ АН СССР, 1986. 160 с.
Кудеяров В.Н. Азотно-углеродный баланс в почве // Почвоведение. 1999. № 1. С. 73–82.
Кудеяров В.Н., Семенов В.М. Проблемы агрохимии и современное состояние химизации сельскохозяйственного производства в Российской Федерации // Агрохимия. 2014. № 10. С. 3–17.
Кудеяров В.Н., Благодатский С.А., Ларионова А.А. Изменение внутрипочвенных потоков азота при внесении азотных удобрений // Агрохимия. 1990. № 11. С. 47–53.
Hart S.C., Stark J.M., Davidson E.A., Firestone M.K. Nitrogen mineralization, immobilization, and nitrification // Methods of soil analysis. P. 2. Microbiological and biochemical properties / Eds. Bottomley P.S., Angle J.S., Weaver R.W. Madison: SSSA, 1994. P. 985–1018.
Jansson S.L., Persson J. Mineralization and immobilization of soil nitrogen // Nitrogen in agricultural soils / Ed. Stevenson F.J. Madison: SSSA, 1982. P. 229–252.
Semenov A.M., Khvatov I.L., Olenin A.V. Determination of the number of ammonification bacteria and activity of the ammonification process in soils and their relevance for the development of the of soil health parameter // Curr. Investigat. Agricult. Curr. Res. 2019. V. 6 (2). P. 715–722.
Schimel J.P., Bennett J. Nitrogen mineralization: Challenges of a changing paradigm // Ecology. 2004. V. 85 (3). P. 591–602.
Благодатская Е.В., Семенов М.В., Якушев А.В. Активность и биомасса почвенных микроорганизмов в изменяющихся условиях окружающей среды. М.: Тов-во научн. изд. КМК, 2016. 243 с.
Anand R., Germon J.C., Groffman P.M., Norton J.M., Philippot L., Prosser J.I., Schimel J.P. Nitrogen transformations // Handbook of soil sciences: Properties and processes. 2nd edit. / Eds. Huang P.M., Li Y., Sumner M.E. Boca Raton: CRC Press, 2012. P. 27.1–27.53.
Geisseler D., Horwath W.R., Joergensen R.G., Ludwig B. Pathways of nitrogen utilization by soil microorganisms – A review // Soil Biol. Biochem. 2010. V. 42. P. 2058–2067.
Jansson S.L. Tracer studies on nitrogen transformations in soil with special attention to mineralization-immobilization relationships // Annal. Royal Agricult. College (Sweden). 1958. V. 24. P. 101–362.
Sinsabaugh R.L., Manzoni S., Moorhead D.L., Richter A. Carbon use efficiency of microbial communities: stoichiometry, methodology and modeling // Ecol. Lett. 2013. V. 16. P. 930–939.
Cleveland C.C., Liptzin D. C : N : P stoichiometry in soil: is there a “Redfield ratio” for the microbial biomass? // Biogeochemistry. 2007. V. 85 (3). P. 235–252.
Bengtson P., Bengtsson G. Bacterial immobilization and remineralization of N at different growth rates and N concentrations // FEMS Microbiol. Ecol. 2005. V. 54. P. 13–19.
Семенов В.М., Мергель А.А. Мобилизующее действие очага азотных удобрений на азотсодержащие соединения почвы // Почвоведение. 1989. № 4. С. 46–54.
Семенов В.М., Соколов О.А. Превращение азотных удобрений в серой лесной почве при внесении их разными способами // Агрохимия. 1984. № 9. С. 3–10.
Соколов О.А., Семенов В.М., Силкина Н.П., Щербаков А.П. Поведение азота в очаге при локализации азотных удобрений // Почвоведение. 1983. № 12. С. 25–35.
Chen J., Stark J.M. Plant species effects and carbon and nitrogen cycling in a sagebrush-crested wheatgrass soil // Soil Biol. Biochem. 2000. V. 32 (1). P. 47–57.
Семенов В.М., Агаев В.А., Тимченко А.В., Соколов О.А. Методы регуляции аммонийно-нитратного питания растений при применении азотных удобрений // Агрохимия. 1987. № 4. С. 14–21.
Евдокимов И.В., Благодатский С.А., Кудеяров В.Н. Микробиологическая иммобилизация, реминерализация и поступление в растения азота удобрений // Почвоведение. 1993. № 4. С. 57–64.
Кузнецова Т.В., Ходжаева А.К., Семенова Н.А., Иванникова Л.А., Семенов В.М. Минерализационно-иммобилизационная оборачиваемость азота в почве при разной обеспеченности разлагаемым органическим веществом // Агрохимия. 2006. № 6. С. 5–12.
Bottner P. Response of microbial biomass to alternate moist and dry conditions in a soil incubated with 14C- and 15N-labelled plant material // Soil Biol. Biochem. 1985. V. 17. P. 329–337.
Семенов В.М., Когут Б.М., Лукин С.М. Влияние повторяющихся циклов высушивания–увлажнения–замораживания–оттаивания на активный пул органического вещества почвы // Почвоведение. 2014. № 4. С. 443–454.
Семенов В.М., Семенов А.М., Ван Бругген А.Х.К., Феррис Х., Кузнецова Т.В. Трансформация азота почвы и растительных остатков сообществом микроорганизмов и микроскопических животных // Агрохимия. 2002. № 1. С. 5–11.
Davidson E.A., Hart S.C., Shanks C.A., Firestone M.K. Measuring gross mineralization, immobilization, and nitrification by 15N isotopic pool dilution in intact cores // J. Soil Sci. 1991. V. 42. P. 335–349.
Hart S.C., Nason G.E., Myrold D.D., Perry D.A. Dynamics of gross nitrogen transformations in an old-growth forest: The Carbon connection // Ecology. 1994. V. 75. P. 880–891.
Murphy D.V., Recous S., Stockdale E.A., Fillery I.R.P., Jensen L.S., Hatch D.J., Goulding K.W.T. Gross nitrogen fluxes in soil: theory, measurement and application of 15N pool dilution techniques // Advan. Agron. 2003. V. 79. P. 69–118.
Booth M.S., Stark J.M., Hart S.C. Soil-mixing effects on inorganic nitrogen production and consumption in forest and shrubland soils // Plant and Soil. 2006. V. 289. P. 5–15.
Booth M.S., Stark J.M., Rastetter E. Controls on nitrogen cycling in terrestrial ecosystems: a synthetic analysis of literature data // Ecol. Monographs. 2005. V. 75(2). P. 139–157.
Robertson G.P., Wedin D., Groffman P.M., Blair J.M., Holland E.A., Nadelhoffer K.J., Harris D. Soil carbon and nitrogen availability. Nitrogen mineralization, nitrification, and soil respiration potentials // Standard soil methods for long-term ecological research / Ed. Robertson G.P.). N.Y., Oxford: University Press, 1999. P. 258–271.
Тулина А.С. Влияние температуры, влажности и внесения соломы на динамику минерализации органического вещества и почвенные пулы углерода и азота // Агрохимия. 2019. № 3. С. 3–18.
Stanford G., Smith S.J. Nitrogen mineralization potentials of soils // Soil Sci. Soc. Am. Proc. 1972. V. 36. P. 465–472.
Кузнецова Т.В., Кузнецов А.М., Тулина А.С., Семенова Н.А., Надежкина Е.В. Азотминерализующая способность серой лесной почвы и выщелоченного чернозема // Роль почв в сохранении устойчивости ландшафтов и ресурсосберегающее земледелие. Пенза: РИО ПГСХА, 2005. С. 333–335.
Кузнецова Т.В., Удальцов С.Н. Азотминерализующий потенциал чернозема выщелоченного и каштановой почвы // Черноземы Центральной России: генезис, эволюция и проблемы рационального использования. Воронеж: Изд.-полиграф. центр “Научная книга”, 2017. С. 285–289.
Benbi D.K., Richter J. A critical review of some approaches to modelling nitrogen mineralization // Biol. Fertil. Soils. 2002. V. 35. P. 168–183.
Башкин В.Н., Кудеяров В.Н. Определение азотминерализующей способности почв // Земледелие. 1986. № 11. С. 58–59.
Braun J., Mooshammer M., Wanek W., Prommer J., Walker T.W.N., Rütting T., Richter A. Full 15N tracer accounting to revisit major assumptions of 15N isotope pool dilution approaches for gross nitrogen mineralization // Soil Biol. Biochem. 2018. V. 117. P. 16–26.
Berntson G.M., Aber J.D. Fast nitrate immobilization in N saturated temperate forest soils // Soil Biol. Biochem. 2000. V. 32. P. 151–156.
Davidson E.A., Chorover J., Dailj D.B. A mechanism of abiotic immobilization of nitrate in forest ecosystems: the ferrous wheel hypothesis // Global Change Biol. 2003. V. 9. P. 228–236.
Deng S.P., Moore J.M., Tabatabai M.A. Characterization of active nitrogen pools in soils under different cropping systems // Biol. Fertil. Soils. 2000. V. 32. № 4. P. 302–309.
Liang B.C., Mackenzie A.F., Gregorich E.G. Changes in 15N abundance and amounts of biologically active soil nitrogen // Biol. Fertil. Soils. 1999. V. 30. P. 69–74.
Семенов В.М., Кузнецова Т.В., Иванникова Л.А., Семенова Н.А., Лисова Е.П. Участие растительной биомассы в формировании активной фазы почвенного азота // Агрохимия. 2001. № 7. С. 5–12.
Семенов В.М., Ходжаева А.К. Агроэкологические функции растительных остатков в почве // Агрохимия. 2006. № 7. С. 63–81.
Myrold D.D., Bottomley P.J. Nitrogen mineralization and immobilization // Nitrogen in agricultural soils / Eds. Raun W., Schepers J.S. Madison: WI., ASA, 2008. P. 157–172.
Barraclough D. The direct or MIT route for nitrogen immobilization: a 15N mirror image study with leucine and glycine // Soil Biol. Biochem. 1997. V. 29 (1). P. 101–108.
Henriksen T.M., Breland T.A. Evaluation of criteria for describing crop residue degradability in a model of carbon and nitrogen turnover in soil // Soil Biol. Biochem. 1999. V. 31. P. 1135–1149.
Кузнецова Т.В., Семенов А.В., Ходжаева А.К., Иванникова Л.А., Семенов В.М. Накопление азота в микробной биомассе серой лесной почвы при разложении растительных остатков // Агрохимия. 2003. № 10. С. 3–12.
Mary B., Recous S., Robin D. A model for calculating N fluxes in soil using 15N tracing // Soil Biol. Biochem. 1998. V. 30. P. 1963–1968.
Семенов В.М., Кузнецова Т.В., Розанова Л.Н., Кудеяpов В.Н. Продуцирование почвой СО2 и его эмиссия пpи минерализации азотсодержащих компонентов // Почвоведение. 1994. № 10. С. 79–85.
Семенов В.М., Кузнецова Т.В., Кудеяров В.Н. Иммобилизационно-мобилизационные превращения азота в серой лесной почве // Почвоведение. 1995. № 4. С. 472–479.
Семенов В.М., Кузнецова Т.В., Кудеяров В.Н. Высвобождение доступного для растений азота при минерализации активной фазы органического вещества почвы // Почвоведение. 1995. № 6. С. 732–739.
Кузнецова Т.В., Тулина А.С., Розанова Л.Н., Семенов В.М., Кудеяров В.Н. О сопряженности процессов метаболизма углерода и азота в почве // Почвоведение. 1998. № 7. С. 832–839.
Luxhøi J., Bruun S., Stenberg B., Breland T.A., Jensen L.S. Prediction of gross and net nitrogen mineralization-immobilization-turnover from respiration // Soil Sci. Soc. Am. J. 2006. V. 70. P. 1121–1128.
Hamnér K., Kirchmann H. Net nitrogen immobilization in soil induced by small additions of energy sources // Acta Agricult. Scand. 2005. V. 55. P. 177–185.
Hadas A., Kautsky L., Goek M., Kara E.E. Rates of decomposition of plant residues and available nitrogen in soil, related to residue composition through simulation of carbon and nitrogen turnover // Soil Biol. Biochem. 2004. V. 36. P. 255–266.
Recous S., Robin D., Darwis D., Mary B. Soil inorganic N availability: effect on maize residue decomposition // Soil Biol. Biochem. 1995. V. 27. № 12. P. 1529–1538.
Кузнецов А.М., Иванникова Л.А., Семин В.Ю., Надежкин С.М., Семенов В.М. Влияние длительного применения удобрений на биологическое качество органического вещества выщелоченного чернозема // Агрохимия. 2007. № 11. С. 21–31.
Семенов В.М., Когут Б.М., Зинякова Н.Б., Масютенко Н.П., Малюкова Л.С., Лебедева Т.Н., Тулина А.С. Биологически активное органическое вещество в почвах Европейской части России // Почвоведение. 2018. № 4. С. 457–472.
Дополнительные материалы отсутствуют.