Агрохимия, 2020, № 8, стр. 78-85
ВЛИЯНИЕ ВОДЫ, ОБРАБОТАННОЙ ПЛАЗМОЙ, НА РАЗВИТИЕ РАСТЕНИЙ
М. Ю. Андрианова 1, *, С. В. Коротков 2, Д. А. Коротков 2, Г. Л. Спичкин 3
1 Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, ул. Политехническая, 29, Россия
2 Физико-технический институт им. А.Ф. Иоффе РАН
194021 Санкт-Петербург, ул. Политехническая, 26, Россия
3 ООО НПО “Фитотехнология”
195220 Санкт-Петербург, ул. Гжатская, 27 лит. А, Россия
* E-mail: andrianova_myu@spbstu.ru
Поступила в редакцию 05.12.2019
После доработки 06.02.2020
Принята к публикации 11.05.2020
Аннотация
Приведены результаты исследования свойств воды, обработанной электроразрядной низкотемпературной плазмой. Описана экспериментальная установка, позволяющая на частоте до 500 Гц инициировать разряды в воде импульсами напряжения с амплитудой ~30 кВ и фронтом ~8 мкс и формировать микросекундные импульсы разрядного тока с амплитудой ~400 А и фронтом ~150 нс. Показано, что при сравнительно малом времени плазменной обработки (2–3 мин) в объеме воды ~0.7 л образуются азотная и азотистая кислоты с концентрацией до 7.5 мг N/л, обеспечивающие снижение рН до 3.5 ед., и короткоживущие окислители с концентрацией 2.5–3.0 мМ-экв/л, повышающие окислительно-восстановительный потенциал воды до +610 мВ. Установлено, что инкубация в плазменной воде стимулировала прорастание семян гороха по сравнению с водопроводной водой. Полив грунта плазменной водой увеличивал выход массы плодовых тел грибов-вешенок (Pleurotus ostreatus). Стимулирующего действия плазменной воды на рост корней лука-севка не обнаружено.
ВВЕДЕНИЕ
В настоящее время интенсивно исследуют влияние низкотемпературной плазмы, формируемой под действием электрических разрядов, что находит применение в разных областях, в том числе и в сельском хозяйстве. На различных культурах показано, что в результате обработки семян в газоразрядной плазме увеличивается их всхожесть, энергия прорастания, темпы роста, устойчивость к болезням, урожайность растений [1–5]. Эти эффекты объясняются действием на семена ультрафиолетового излучения, электрических и магнитных полей, а также атомов, ионов и радикалов с высокой реакционной способностью, образующихся в плазме.
Другое направление исследований состоит в изучении действия на растения воды, обработанной плазмой. Широкое распространение получили импульсные технологии плазменной обработки при создании высоковольтных разрядов в среде, содержащей компоненты воды и воздуха. При их использовании, помимо эффектов, вызванных короткоживущими веществами с высокой реакционной способностью (таких как ∙OH, HO2, H2O2, атомарные кислород и водород, и др.) [6], следует также учитывать действие образующихся биологически доступных соединений азота (${\text{NH}}_{4}^{ + }$ и ${\text{NO}}_{3}^{ - }$) [7–9].
Состав воды после плазменной обработки зависит от параметров электроразрядной плазменной установки и режима обработки. Плазменные установки отличаются по типу используемого разряда (барьерного, искрового, коронного, диафрагменного и др.), по длительности импульсов разрядного тока (микросекундного, наносекундного), по форме и расположению электродов (игл, цилиндров, колец, трубочек и др.), а также по величине и форме инициирующего разряд высокого напряжения и организации подачи воды и воздуха. Важной характеристикой является также длительность обработки воды, требующаяся для достижения желаемого эффекта. Она может составлять от единиц до десятков минут в зависимости от параметров установки [6, 8, 9].
Цель работы – изучение химического состава плазменной воды, полученной в опытной электроразрядной плазменной установке на основе генератора высоковольтных импульсов [10], и ее влияния на развитие растений и грибов.
МЕТОДИКА ИССЛЕДОВАНИЯ
Разработанная установка имела ряд характерных особенностей. Разряды создавались в заполненной водой многоэлектродной разрядной камере с объемом ~1 л. После пробоя межэлектродных промежутков в разряд вкладывалась сравнительно небольшая энергия ~1 Дж, исключающая возможность образования мощных ударных волн, способных разрушить стенки камеры, выполненные из оргстекла. Частота следования разрядов была высокой (до 500 Гц), при этом в процессе обработки воды достигалась достаточно большая скорость образования низкотемпературной плазмы.
Система электродов камеры состояла из верхнего потенциального дискового электрода с диаметром 24 мм, выполненного из молибдена, и 6-ти заземленных электродов в виде тонкостенных трубок из нержавеющей стали с наружным диаметром 3 мм, которые были равномерно распределены под краевой поверхностью дискового электрода. На электроды от генератора подавали импульсы высокого напряжения, нарастающие со скоростью ~4 кВ/мкс до максимальной величины 33 кВ.
Через трубчатые заземленные электроды в камеру подавали атмосферный воздух от компрессора. При этом в воде формировались потоки воздушных пузырьков. Расход воздуха выбирали так, чтобы пузырьки были отделены друг от друга прослойками воды. Образующиеся пузырьковые кластеры пробивались при приложении импульса высокого напряжения. В результате в межэлектродных промежутках развивались искровые разряды.
Суммарный ток разряда за время ~150 нс достигал амплитудного значения ~400 А. Малое сопротивление каналов разряда определяло сравнительно большое время рассеивания вводимой в разряд энергии (несколько мкс). Выходная цепь генератора обеспечивала униполярную форму тока разряда.
Наличие пузырьков обеспечило устойчивый пробой воды при межэлектродном расстоянии 1.2–1.5 см. При работе на частоте визуальное наблюдение через прозрачные стенки камеры свидетельствовало о том, что разряды имеют примерно одинаковую интенсивность и образуют плазменные конусы, расположенные по периметру дискового электрода. Достаточно большое межэлектродное расстояние и равномерное распределение плазмы по периметру дискового электрода позволяло обработать большой объем воды, находящийся в зоне разряда.
Воду для плазменной обработки отбирали в 5‑литровую емкость из водопроводного крана и выдерживали перед обработкой несколько часов для достижения комнатной температуры. Перед отбором воду из крана пропускали в течение 5 мин, чтобы предварительно вымыть продукты коррозии из труб. Длительность плазменной обработки воды составляла до 3 мин. Единовременно обрабатывали ~0.7 л воды, залитой в разрядную камеру.
Электропроводность воды измеряли портативным кондуктометром HANNA HI 8733 (HannaInstruments, Austria) (погрешность определения ±5%). Измерение рН воды проводили на рН-метре-иономере И-500 (Аквилон, Россия) (погрешность определения ±0.05 ед рН). Редокс-потенциал воды измеряли электродом DMI 140-SG (погрешность определения ±15%).
Йодометрию окислителей в воде проводили по методике, описанной в ГОСТ 1801-72 “Вода питьевая. Методы определения содержания остаточного озона”. Вытеснение йода из раствора йодида калия в условиях этой методики происходит не только под действием озона, но также нитритов, железа и других окислителей. На случай их мешающего влияния в методике предусмотрено предварительное вытеснение озона воздухом из исследуемой воды в другой сосуд с раствором для последующей йодометрии. В плазменной воде после вытеснения озон обнаружен не был. Следовательно, при йодометрии вытеснение йода происходило под действием иных окислителей.
Железо общее в воде измеряли по ГОСТ 4011-72 с сульфосалициловой кислотой. Фотометрирование окрашенных растворов проводили на спектрофотометре КФК-3-01 (ЗОМЗ, Москва), кювета 1 см, длина волны 425 нм. Погрешность определения ±14%. Нитраты и нитриты в воде определяли методом капиллярного электрофореза по методике М 01-30-2009 (ПНД Ф 14.1:2:4.157-99). Погрешность определения ±15%.
Содержание общего органического углерода и общего азота определяли на анализаторах TOC-Lcpn и TNM-L (Шимадзу, Япония). Погрешность определения ±15%.
Тестирование плазменной воды и других растворов на корнях лука (Allium-тест) проводили по методике [11]. Донца лука-севка сорта Штургартен инкубировали в исследованных растворах. Дважды в день подливали по 1–2 мл воды в пробирки для инкубации. Растворы полностью обновляли после 2-х и 3-х сут инкубации, измерение длины корней проводили через 4 сут после начала теста. Allium-тест проводили в трехкратной повторности, в каждой повторности брали по 10 луковиц.
Эксперименты с семенами проводили с использованием семян гороха сорта Никитка. Для проращивания семена раскладывали в открытых сосудах на ткань, пропитанную водой, и оставляли при комнатной температуре. Ежедневно в сосуды подливали одинаковое количество воды для пропитки ткани. Опыт проводили в четырехкратной повторности, в каждой повторности брали серию из 50 семян гороха. Для дальнейшего выращивания проросших семян гороха использовали почвогрунт “Цветочный” (ООО “Кушавераторф”, рН 5.5–6.5, содержание элементов питания не менее: N – 100, K2O – 250, P2O5 – 200 мг/л).
Также проверили действие водопроводной воды, обработанной плазмой, на рост плодовых тел грибов. Использовали покупные наборы, состоящие из спор вешенки и грунта для выращивания грибов производства фирмы “Золотой урожай” (www.eco-gribi.ru). Споры перемешивали с грунтом согласно рекомендациям изготовителя и поливали водопроводной водой (контроль) и плазменной водой в течение 3 мес. Для каждого варианта полива использовали по 5 грибных наборов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для оценки содержания биогенных элементов в воде был проведен ее химический анализ. Содержание общего органического углерода в воде до и после обработки не менялось и составило 4 мг/л. Таким образом, полного разрушения органических веществ в результате обработки воды не происходило.
Содержание железа общего в необработанной водопроводной воде составляло 0.2–0.5 мг Fe/л, а после обработки плазмой в течение 2–3 мин оно составило 3–5 мг Fe/л. Поступление железа в воду объясняется коррозией электродов при разряде. Значительная часть железа общего (>80%) была представлена взвесью, оседающей в течение нескольких часов.
По мере увеличения времени обработки воды ее электропроводность увеличивалась от 110 до 320 мк См/см, рН снижался от 7.2 до 3.4 (результаты частично представлены на рис. 1). В воде также росла концентрация общего азота (от 0.5 до 7.5 мг N/л), нитратов и нитритов (рис. 2). Это свидетельствовало об образовании азотной и азотистой кислот в результате взаимодействия азота воздуха с кислородом и водой под действием высоковольтных разрядов, что сходно с процессами абиотической фиксации азота в атмосфере [12]. Молярная концентрация ионов водорода в изученных в работе пробах была меньше суммы молярных концентраций нитратов и нитритов, что указывало на частичную нейтрализацию образовавшихся кислот примесями воды.
Рис. 1.
Изменение концентрации ионов водорода и электропроводности в зависимости от времени плазменной обработки воды.

Рис. 2.
Изменение концентраций общего азота, нитрат- и нитрит-ионов в зависимости от времени плазменной обработки воды.
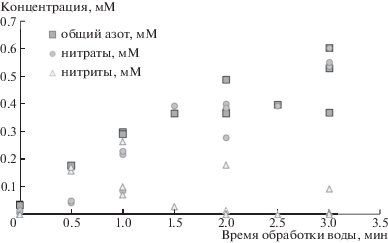
Образование азотной и азотистой кислот типично для плазменной обработки воды [9]. В некоторых установках после плазменной обработки в воде регистрируются также ионы аммония [8]. В нашем случае их обнаруживали только в воде до обработки в количестве 0.1 мг ${\text{NH}}_{4}^{ + }$/л, что объясняется применением сульфата аммония на водопроводных станциях Санкт-Петербурга при дезинфекции (хлорирование с аммонизацией [13]). Содержание общего азота (аммонийного и нитратного) в воде до обработки не превышало 0.6 мг N/л.
Результаты показали (рис. 1), что приблизительно отслеживать количество образующихся веществ (и устанавливать длительность обработки) можно по увеличению электропроводности воды. Однако рост концентраций общего азота замедлялся после обработки в течение 2–3 мин, поэтому более длительная обработка воды была нецелесообразной с точки зрения получения большего количества доступного для растений азота.
Некоторые пробы воды с одинаковым временем плазменной обработки сильно отличались по концентрации нитритов (рис. 2). Это объясняется тем, что химический анализ воды в разных повторностях опыта проводили спустя разное время. Если пробы анализировали методом капиллярного электрофореза в течение 1–2 ч после плазменной обработки, то в них регистрировали и нитриты, и нитраты. Если же химический анализ пробы выполняли спустя 1–2 сут, то в пробах обнаруживали только нитраты. Вероятно, происходило окисление нитритов до нитратов за счет кислорода воздуха или окислителей, образовавшихся в воде в результате плазменной обработки.
Для оценки содержания окислителей в воде, обработанной в течение 2.5 мин, определяли редокс-потенциал и проводили йодометрию спустя разное время после хранения воды при комнатной температуре. В тех же пробах определяли рН и электропроводность.
В первые 10–20 мин после плазменной обработки редокс-потенциал воды был положительным и составлял 590–610 мВ, в течение 1 сут он снижался до 440–510 мВ и спустя несколько сут доходил до 350–415 мВ (рис. 3). Электропроводность и рН воды за это время менялись в пределах погрешности измерения.
Известно, что на величину редокс-потенциала влияет содержание растворенного кислорода, а в хорошо аэрированной природной воде редокс-потенциал составляет от 300 до 500 мВ [14]. В настоящем исследовании были зарегистрированы показатели выше верхней границы этого диапазона. Для сравнения приготовили аэрированную водопроводную воду, через которую пропускали воздух как при плазменной обработке, но без подачи напряжения на электроды. В ней сразу после обработки редокс-потенциал составил 460–470 мВ, спустя час он уменьшился до 320 мВ и далее сохранялся примерно на том же уровне. Таким образом, полученные данные подтвердили образование при плазменной обработке быстроразлагающихся веществ, обеспечивших в начале повышение редокс-потенциала воды.
Результаты согласовались с литературными данными, например, в работе [15] обрабатывали дистиллированную воду диэлектрическим барьерным разрядом в потоке воздуха над поверхностью воды, при этом редокс-потенциал воды возрос с 300 до 600 мВ. В другой работе [16] был получен иной результат: в отсутствии аэрирования в установке редокс-потенциал воды снижался с 460 до 45 мВ, что объясняли образованием водорода под действием разрядов.
Йодометрия позволяет регистрировать окислители, способные вытеснять йод из йодида калия, т.е. окислители с потенциалом >536 мВ. По данным проведенной в работе йодометрии, в воде, обработанной плазмой, сразу после обработки регистрировали содержание окислителей 2.5–3.0 мМ-экв/л. Их количество уменьшалось в 2 раза в течение первого часа после обработки (рис. 4) и сходило на нет в течение 1 сут. В аэрированной водопроводной воде вытеснение йода не регистрировали. Судя по величинам стандартных окислительно-восстановительных потенциалов [17], к числу возможных окислителей относятся HO2· , Н2О2, OH, атомарный О, а также HNO2 и, возможно, другие азотсодержащие соединения. Проведенные опыты на модельных растворах показали, что в условиях использованной методики нитраты натрия (11 мг N/л) не вытесняют йод, а нитриты натрия (0.7–13 мг N/л) – вытесняют, причем у последних количество вытесненного йода спустя несколько часов такое же, как и сразу после приготовления раствора. Таким образом, быстрое разрушение нитритов в обработанной воде (зарегистрированное по данным капиллярного электрофореза и описанное выше) происходит не за счет их взаимодействия с кислородом воздуха, а благодаря образовавшимся другим окислителям.
Рис. 4.
Изменение количества йода, вытесненного окислителями после плазменной обработки воды. Количество титранта (тиосульфата натрия) равно количеству йода, мМ-экв/л.

Для выяснения действия воды, обработанной плазмой, на сельскохозяйственные культуры, были проведены опыты на растениях и грибах. Для изучения влияния на корни растений был поставлен Allium-тест. Поскольку известно ингибирующее влияние низкого рН на рост корней лука [11], были сделаны соответствующие контроли и растворы нейтрализованной плазменной воды. Все растворы были приготовлены за 1 сут до начала теста. Тестировали следующие растворы: T1 – водопроводная вода, рН 6.80, T2 – водопроводная вода с добавлением HNO3 до рН 3.55, T3 – водопроводная вода с добавлением ~20 мг Са(ОН)2/л и HNO3 до рН 6.80, P1 – плазменная вода, рН 3.50, P2 – плазменная вода, нейтрализованная Са(ОН)2 до рН 6.80, P3 – плазменная вода, нейтрализованная Nа2CO3 до рН = 6.74 (табл. 1). Показано, что основным фактором, повлиявшим на рост корней лука, была величина рН воды. В растворах с низким рН рост корней был замедлен. Явного стимулирования роста корней нейтрализованной плазменной водой обнаружено не было (хотя и ингибирующего ее действия тоже не выявлено).
Таблица 1.
Результаты Allium-теста
| Параметр | Варианты | |||||
|---|---|---|---|---|---|---|
| Т1 | Т2 | Т3 | Р1 | Р2 | Р3 | |
| Число корней (среднее на луковицу), шт | 30 | 12 | 33 | 14 | 32 | 29 |
| Средняя длина корня, мм | 22 | 4 | 20 | 4 | 19 | 16 |
| Стандартное отклонение длины корней, мм | 14 | 2 | 12 | 2 | 10 | 9 |
| Суммарная длина корней (средняя для луковицы), мм | 699 | 51 | 665 | 56 | 628 | 451 |
Примечание. T1– водопроводная вода, рН 6.80, T2 – водопроводная вода с добавлением HNO3 до рН 3.55, T3 – водопроводная вода с добавлением ~20 мг Са(ОН)2/л и HNO3 до рН 6.80, P1 – плазменная вода, рН 3.50, P2 – плазменная вода, нейтрализованная Са(ОН)2 до рН 6.80, P3 – плазменная вода, нейтрализованная Nа2CO3 до рН = 6.74.
Влияние обработки плазмой на прорастание семян изучали на горохе. Семена проращивали в воде в течение 5 сут в 4-х вариантах: 1 – семена инкубировали в водопроводной воде (контроль), 2 – семена инкубировали в свежей плазменной воде, обработанной 3 мин, 3 – семена инкубировали в растворе 5 мг HNO3/л, приготовленном на водопроводной воде, 4 – семена предварительно обрабатывали в разрядной камере (3 мин) и затем инкубировали в свежей плазменной воде, обработанной 3 мин.
Для семян гороха начало прорастания было отмечено на 3-и сут после начала опыта (табл. 2). Сравнение вариантов 1–3 показало, что плазменная вода наиболее эффективно действовала на горох, что выражалось в более раннем начале прорастания семян, большей длине корней (как средней, так и суммарной). Это можно объяснить действием содержащихся в плазменной воде питательных веществ, главным образом нитратов. Стимулирующий эффект от инкубации в растворе азотной кислоты был больше, чем в водопроводной воде, но меньше, чем в плазменной воде. Вероятно, это различие связано с действием других веществ, содержащихся в плазменной воде. Отсутствие ингибирующего эффекта при низком рН воды, возможно, связано с тем, что при инкубировании семян полной замены воды не проводили, так что некоторому увеличению рН могли способствовать вещества, выделяемые корнями, и также углекислый газ из воздуха.
Таблица 2.
Результаты проращивания семян гороха
| Продолжительность проращивания, сут | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Вариант | 3-и | 4-е | 5-е | ||||||
| n | l | Sl | n | l | Sl | n | l | Sl | |
| 1 | 0 | 0 | 0 | 4 | 7 | 27 | 42 | 10 | 396 |
| 2 | 0 | 0 | 0 | 38 | 9 | 352 | 50 | 19 | 933 |
| 3 | 0 | 0 | 0 | 23 | 7 | 169 | 44 | 15 | 673 |
| 4 | 8 | 7 | 60 | 40 | 14 | 550 | 50 | 32 | 1598 |
Примечания. 1. Варианты: 1 – семена инкубировали в водопроводной воде (контроль), 2 – семена инкубировали в свежей плазменной воде, обработанной 3 мин, 3 – семена инкубировали в растворе 5 мг HNO3/л, приготовленном на водопроводной воде, 4 – семена предварительно обрабатывали в разрядной камере (3 мин) и затем инкубировали в свежей плазменной воде, обработанной 3 мин. То же в табл. 3. 2. n – количество проросших семян гороха (среднее для 50-ти семян), l – средняя длина корня, мм, Sl – суммарная длина корней в варианте, мм.
Наиболее эффективное действие на семена оказал вариант обработки 4: на 1 сут ускорялось прорастание семян гороха, на 4-е и 5-е сут средняя длина корней была в 2–3 раза больше, чем в контроле. Вероятно, это было связано с повышением проницаемости покровов семян в результате их предварительной обработки в разрядной камере, благодаря чему облегчалось поглощение воды и ускорялся рост проростков [3]. По данным 4-суточной инкубации рассчитали энергию прорастания семян гороха. Она составила 8% для варианта 1, 75 – для варианта 2, 46 – для варианта 3 и 79% – для варианта 4. Этот показатель в контроле (вариант 1) был гораздо меньше, чем для разных сортов гороха (22–100%) [18]. Вероятно, это было вызвано допущенными отступлениями от процедуры проращивания, описанной в ГОСТ 12038-84 (недостаточное увлажнение, изменения температуры, отсутствие предварительного охлаждения семян), что замедлило их развитие в целом. На 5-е сут доля проросших семян гороха была больше и составила в варианте 1 – 84, в варианте 2 – 100, в варианте 3 – 88 и в варианте 4 – 100%.
Семена гороха после проращивания в вариантах 1 и 2 высадили в грунт и продолжали поливать соответствующей водой в течение 11 сут. Результаты измерения длины стебля приведены в табл. 3. Показано небольшое стимулирующее действие плазменной воды на рост стебля гороха.
Таблица 3.
Средняя длина стебля при выращивании гороха в грунте, см
| Продолжительность проращивания, сут | |||
|---|---|---|---|
| Вариант | 4-е | 7-е | 11-е |
| 1 | 2.5 | 4.3 | 5.9 |
| 2 | 3.1 | 6.1 | 7.7 |
Действие плазменной воды также проверили на грибах. Споры вешенки перемешали с грунтом. Одну серию поливали водопроводной, другую – плазменной водой. После 3 мес. выращивания плодовые тела были срезаны и взвешены. Средняя масса плодовых тел из набора, который поливали водопроводной водой, составила 87 г, плазменной водой – 201 г, т.е. примерно в 2 раза больше.
Поскольку использование для полива воды, обогащенной нитратами, может привести к их накоплению в продуктах питания, определили содержание нитратов в водном экстракте грибов. Содержание нитратов составило (в мг/кг сырого веса): в грибах, с поливом водопроводной водой – 21, в грибах с поливом плазменной водой – 12 мг/кг. Согласно санитарным нормам для продуктов питания [19], в грибах содержание нитратов не нормируется, в овощах норматив составляет от 60 до 500 мг/кг (в зависимости от вида овощей). Таким образом, норматив содержания нитратов в продуктах питания в опытных грибах не был превышен.
ЗАКЛЮЧЕНИЕ
Исследованы химические и биологические свойства водопроводной воды, обработанной плазмой в опытной установке, созданной в ФТИ им А.Ф. Иоффе РАН. Плазма формируется в воде, насыщенной пузырьками воздуха, под действием высоковольтного импульса от генератора. Напряжение между электродами в разрядной камере составило до 33 кВ, частота импульсов – 500 Гц, время нарастания напряжения на разрядном промежутке – до 8 мкс, амплитуда тока после пробоя разрядного промежутка – до 400 А, фронт импульса тока после пробоя – около 150 нс. После пробоя через разрядный промежуток протекает униполярный пульсирующий ток, который полностью затухает через ~10 мкс. Длительность плазменной обработки воды составила 2.5–3 мин.
Под действием плазмы в воде происходило увеличение содержания нитратов и нитритов (от 0.5 до 7.5 мг N/л), электропроводности (от 110 до 320 мкСм/см), снижение рН (с 6.8 до 3.5). Окислительно-восстановительный потенциал плазменной воды достигал 610–590 мВ сразу после обработки, в течение 1 ч он снижался до 400 мВ. Йодометрический анализ показал наличие в воде окислителей с потенциалом >536 мВ сразу после обработки в концентрации 2.5–3.0 мМ-экв/л. Количество этих окислителей уменьшалось до нуля в течение 4 ч.
В опытах на растениях было показано отсутствие ингибирующего влияния нейтрализованной плазменной воды на корни лука-севка в Allium-тесте.
Плазменная вода оказывала стимулирующее действие на развитие семян гороха: семена прорастали на более раннем сроке, проростки имели большую длину корней (в 2 раза по сравнению с водопроводной водой на 5-е сут проращивания семян). После высаживания проросших семян в грунт в течение 11 сут длина стебля была на 20–40% больше у растений, которые поливали плазменной водой по сравнению с поливом водопроводной водой. Обработка семян в разрядной камере перед проращиванием стимулировала прорастание семян гороха.
Полив плазменной водой также стимулировал развитие грибов вешенок. При выращивании вешенок в грунте с поливом плазменной водой масса плодовых тел была в 2 раза больше, чем при поливе водопроводной водой, при этом концентрация нитратов в грибах не превышала норматив для продуктов питания.
Список литературы
Гордеев Ю.А. Методологические и агробиологические основы предпосевной биоактивации семян сельскохозяйственных культур потоком низкотемпературной плазмы: Автореф. дис. … д-ра биол. наук. Смоленск, 2012. 46 с.
Selcuk M., Oksuz L., Basaran P. Decontamination of grains and legumes infected with Aspergillus spp. and Penicillum spp. by cold plasma treatment // Bioresource Technol. 2008. V. 99. P. 5104–5109.
Bormashenko E., Grynyov R., Bormashenko Y., Drori E. Cold radiofrequency plasma treatment modifies wettability and germination speed of plant seeds // Sci. Rep. 2012. V. 2. P. 741.
Галиуллин Р.Р., Шарифуллин Ф.С., Нагмутдино-ва А.И., Вознесенский Э.Ф. Исследование влияния ВЧЕ-плазменной обработки на посевные свойства семян сельскохозяйственных культур // Вестн. технол. ун-та. 2016. Т. 19. № 22. С. 154–156.
Zhou Z., Huang Y., Yang S., Chen W. Introduction of a new atmospheric pressure plasma device and application on tomato seeds // Sci. Res. 2011. V. 2. № 1. P. 23–27.
Бобкова Е.С., Гриневич В.И., Исакина А.А., Рыбкин В.В. Разложение органических соединений в водных растворах под действием электрических разрядов атмосферного давления // Изв. высш. учеб. завед. Сер. химия и хим. технол. 2011. Т. 54. № 6. С. 3–17.
Иванова И.П., Трофимова С.В., Карпел Вел Лейтнер Н., Аристова Н.А., Архипова Е.В., Буркина О.Е., Сысоева В.А., Пискаров И.М. Анализ активных продуктов излучения плазмы искрового разряда, определяющих биологические процессы в клетках // Совр. технол. в медицине. 2012. № 2. С. 20–60.
Judée, F., Simon S., Bailly C., Dufour T. Plasma-activation of tap water using DBD for agronomy applications: Identification and quantification of long lifetime chemical species and production/consumption mechanisms // Water Res. 2018. V. 133. P. 47–59.
Thagard S.M., Locke B.R. Electrical discharge plasma for water treatment // Advanced oxidation processes for water treatment. fundamentals and applications / Ed. Stefan M. IWA Publishing, 2018. P. 493–534.
Коротков С.В., Аристов Ю.В., Козлов А.К., Коротков Д.А., Рольник И.А. Генератор электрических разрядов в воде // Приборы и техника эксперимента. 2011. № 2. С. 47–50.
Fiskesjö G. The Allium test in wastewater monitoring // Environ. Toxicol. Water Qual. 1993. V. 8. № 3. P. 291–298.
Исидоров В.А. Экологическая химия. СПб.: Химиздат, 2001. 304 с.
ГУП “Водоканал Санкт-Петербурга”. Технологии очистки. URL: http://www.vodokanal.spb.ru/vodosnabzhenie/tehnologii_ochistki (по состоянию сайта на ноябрь 2019 г.).
Søndergaard M. Redox potential // Encyclopedia of Inland Waters / Ed. Gene E. Likens, 2009. P. 852–859.
Sua X., Tian Y., Zhou H., Li Y., Zhang Z., Jiang B., Yang B., Zhang J., Fang J. Inactivation efficacy of non-thermal plasma activated solutions against Newcastle disease virus // Appl. Environ. Microbiol. 2018. V. 84(9). P. e02836-17.
Miyahara T., Oizumi M., Nakatani T., Sato T. Effect of voltage polarity on oxidation-reduction potential by plasma in water // AIP Advan. 2014. V. 4. P. 047115.
Барон Н.М., Пономарева А.М., Равдель А.А., Тимофеева З.Н. Краткий справочник физико-химических величин. СПб.: Иван Федоров, 2002. 240 с.
Каменев В.А., Казакова О.А., Торопова Е.Ю. Повышение качества семян гороха на основании фитоэкспертизы в лесостепи Западной Сибири // Актуальные проблемы агропромышленного комплекса. Новосибирск, 2016. С. 31–36.
СанПиН 2.3.2.1078-01 Гигиенические требования безопасности пищевой ценности пищевых продуктов (с изменениями и дополнениями).
Дополнительные материалы отсутствуют.



