Агрохимия, 2021, № 1, стр. 70-78
Фитотоксичность нанокомпозитов селена в природных матрицах на развитие растений картофеля in vitro
А. И. Перфильева 1, *, О. А. Ножкина 1, И. А. Граскова 1, Н. С. Забанова 1, 2, Б. Г. Сухов 3
1 Сибирский институт физиологии и биохимии растений Сибирского отделения РАН
664033 Иркутск, ул. Лермонтова, 132, Россия
2 Иркутский государственный университет
664003 Иркутск, ул. Карла Маркса, 1, Россия
3 Иркутский институт химии им. А.Е. Фаворского Сибирского отделения РАН
664033 Иркутск, ул. Фаворского, 1, Россия
* E-mail: alla.light@mail.ru
Поступила в редакцию 04.04.2020
После доработки 08.06.2020
Принята к публикации 13.10.2020
Аннотация
В качестве потенциальных агентов, используемых для оздоровления культурных растений, исследовали нанокомпозиты (НК) селена, инкапсулированные в природные матричные оболочки арабиногалактана, крахмала и каррагинана. Представлены данные по фитотоксичности НК на рост и развитие in vitro растений картофеля различных сортов по устойчивости к кольцевой гнили и данные по содержанию селена в растительных тканях при обработке НК. Показано отсутствие негативного воздействия НК селена и арабиногалактана (НК Se/Аг) и НК селена и каррагинана (НК Se/Кар) на растения в концентрации 0.000625% селена. НК селена и крахмала (НК Se/Кр) угнетал растения. Наличие стресса у растений подтверждено увеличенным содержанием диеновых конъюгатов в их тканях и повышенной активностью пероксидазы. Содержание селена в тканях картофеля, культивируемого с НК Se, было минимальным. НК Se/Аг и НК Se/Кр в концентрации, увеличенной в 10 раз, оказывали губительное воздействие на картофель, наблюдаемое через 4–8 ч после обработки. При этом содержание селена в тканях растений было в 2 раза больше по сравнению с вариантом обработки картофеля селеном в концентрации 0.000625%. НК Se/Кар оказывал слабо выраженное негативное воздействие на растения картофеля, однако содержание селена в таких пробах было максимальным и составляло 0.15%.
ВВЕДЕНИЕ
Мировое сельское хозяйство при производстве продукции активно использует пестициды. Эти вещества являются незаменимыми в целях защиты сельскохозяйственных культур как на этапе до, так и после сбора урожая. Пестициды применяют в качестве регуляторов роста микроорганизмов, насекомых или растений, дефолиантов, осушителей, агентов для предотвращения преждевременного опадения плодов. Кроме того, пестициды используют в качестве веществ, наносимых на плоды для их защиты от порчи во время хранения и транспортировки [1–3]. Действующие вещества большей части пестицидов относятся к хлорорганическим соединениям, органофосфатам, карбонатам и пиретроидам [4]. Хотя пестициды распыляются непосредственно на растения и почву, только ≈1% распыленного агента доставляется к цели [5]. Некоторые из них, например, хлорорганические пестициды остаются в окружающей среде более 30 лет [6]. Пестициды накапливаются в семенах и плодах культурных растений [7, 8], загрязняют водоемы [9, 10] и почву [11, 12], оказывая негативное влияние на почвенные организмы [13, 14]. Пестициды даже приводят к гибели людей, работающих с ними и потребляющих продукцию, содержащую пестициды в большом количестве [15–18]. Таким образом, накопление и аккумуляция действующих веществ пестицидов в тканях культурных растений является серьезной проблемой используемых препаратов [19].
В настоящее время является актуальным поиск экологически безопасных агентов, способных ограничить распространение заболеваний картофеля, в том числе, бактериозов [20]. Важно разработать химические агенты, обладающие высоким бактерицидным эффектом, при этом не оказывающие негативного воздействия на окружающую среду. Для решения этой задачи рассматривается возможность применения нановеществ [21]. Для применения в агрохимии особенный интерес вызывает селен. Селен (Se) – ультрамикроэлемент, участвующий в важных биохимических реакциях клетки, процессах повышения стрессоустойчивости растений [22–24], при этом он токсичен при высоких концентрациях [25, 26]. Кроме того, селен принимает участие в синтезе токоферолов, токотриенолов, убихинонов, хлорофилла и трикарбоновых кислот, в метаболизме длинноцепочечных жирных кислот [27]. В последнее время во многих регионах мира отмечен дефицит Se в почве и его нехватка для растений [28–30]. Кроме того, удобрения, включающие в свой состав Se, часто не оказывают должного эффекта, поскольку Se переходит в нерастворимые соединения [31, 32].
При избытке селена отмечают аналогичную закономерность, как и при его недостатке – рост и цветение растения задерживаются, отмечается хлороз листьев, потеря тургора тканей стеблей и, как следствие, вилт, растения теряют устойчивость к изменяющимся факторам среды. На биохимическом уровне в различных ферментах происходит замена серы на селен благодаря сходству строений их атомов – подобному строению внешних электронных оболочек. В результате этого отмечается накопление свободных растворимых аминокислот и торможение синтеза белка, возникающего вследствие замещения цистеина и метионина их аналогами, содержащими селен, селеноцистеином и селенометионином [24–27].
Большинство имеющихся работ, посвященных действию наноселена на растения, свидетельствуют о его положительном влиянии на растения. Например, показано, что экзогенное опрыскивание наноселеном базилика Ocimum basilicum L. повышает его антиоксидантный потенциал [28], усиливает рост растений табака Nicotiana tabacum L. [29], и арахиса Arachis hypogaea L. [30]. Предполагают, что увеличение роста высших растений после воздействия на них наночастиц (НЧ) селена происходит благодаря повышению продуктивности фотосинтеза [31]. Показано также изменение жирнокислотного профиля в клетках растений под влиянием НЧ селена [30].
В качестве потенциальных соединений для оздоровления картофеля от бактериальных заболеваний могут быть перспективными нанокомпозиты (НК) селена в полимерных матрицах природного происхождения. Благодаря своему строению такие НК обеспечивают адресную доставку токсичных агентов в бактериальную клетку, не вредя растениям. Обработка НК бактериального патогена, вызывающего кольцевую гниль, а также зараженных растений картофеля показала положительный эффект, при котором отмечали массовую гибель патогена и отсутствие негативного эффекта на растения [37–41]. При этом влияние НК в повышенной концентрации, которое можно наблюдать при накоплении НК в окружающей среде после обработки ими растений, на рост и развитие здоровых растений картофеля не изучали.
Цель работы – исследование влияния повышенной концентрации НК селена в природных матрицах на развитие картофеля in vitro и накопление селена в его тканях.
МЕТОДИКА ИССЛЕДОВАНИЯ
В работе использовали НК трех видов, различающиеся по типу полимера матрицы, в которую были упакованы НЧ селена:
1 – НК селена и арабиногалактана (НК Se/Аг), содержание селена составило 6.4%;
2 – НК селена и крахмала (НК Se/Кр), содержание селена – 12%;
3 – НК селена и каррагинана (НК Se/Кар), содержание селена – 2%.
Синтез нанокомпозита селена с арабиногалактаном (НК Se/Аг) проводили окислением бис(2-фенилэтил)фосфинодиселенофосфината натрия пероксидом водорода в водном растворе арабиногалактана. Подробно процесс синтеза описан ранее [38]. Синтез нанокомпозита селена с крахмалом (НК Se/Кр) осуществляли на основе готового препарата крахмала (Sigma-Aldrich, США). Подробно процесс синтеза описан ранее [42]. Для создания нанокомпозита селена и каррагинана (НК Se/Кар) использовали каррагинан марки WR (1800 кДа) (CP Celko, Дания). К раствору 1 г каррагинана в 30 мл воды при перемешивании добавляли 6 мл водного раствора 0.025 г SeO2 и затем 0.01 г NaBH4 в 1 мл воды. Продолжительность реакции 10 мин. Нанокомпозит осаждали этанолом. Осадок отфильтровывали и высушивали при комнатной температуре и атмосферном давлении. Выход составлял 94% [43].
Для экспериментов использовали растворы НК, в которых содержание селена нормировали до 0.000625% (концентрация подобранная ранее, при которой отмечен антибактериальный эффект на фитопатогенные бактерии и отсутствие негативного эффекта на растения) и в увеличенной концентрации в 10 раз (0.00625%).
Эксперименты проводили на растениях картофеля in vitro двух сортов, контрастных по устойчивости к патогенам: Луговской – устойчивый и Лукьяновский – восприимчивый [44]. Растения размножали с помощью черенкования и выращивали на готовой питательной среде Мурасиге–Скуга (Sigma-Aldrich, США). Картофель культивировали в агаризованной среде в течение 20 сут при 26°С и освещенности 5–6 кЛк. Далее переносили в жидкую среду культивирования и вносили водные растворы НК.
Для изучения фитотоксичности нанокомпозитов растения картофеля сорта Лукьяновский и сорта Луговской in vitro помещали в емкости со средой культивирования (жидкой питательной средой Мурасиге–Скуга). В эксперименте использовали следующие варианты для каждого сорта картофеля: 1 – контроль, 2 – растения, обработанные НК Se/Аг (инкубировали в среде с добавлением НК Se/Аг (0.000625% селена) – вариант НК Se/Аг, 3 – растения, обработанные НК Se/Кр (инкубировали в среде с добавлением НК Se/Кр (0.000625% селена) – вариант НК Se/Кр, 4 – растения, обработанные НК Se/Кар (инкубировали в среде с добавлением НК Se/Кар (0.000625% селена) – вариант НК Se/Кар, 5 – растения, обработанные НК Se/Аг повышенной концентрации (инкубировали в среде с добавлением НК Se/Аг (0.00625% селена) – вариант НК Se/Аг*10, 6 – растения, обработанные НК Se/Кр (инкубировали в среде с добавлением НК Se/Кр (0.00625% селена) – вариант НК Se/Кр*10, 7 – растения, обработанные НК Se/Кар (инкубировались в среде с добавлением НК Se/Кар (0.00625% селена) – вариант НК Se/Кар*10. В течение первых суток через каждые 2 ч фиксировали число завядших листьев (0, 2, 4, 6 и 8 ч). Опыт продолжали 4 сут. В конце эксперимента определяли накопление селена в изученных растениях картофеля.
Определение содержания первичных продуктов перекисного окисления липидов (ПОЛ) – диеновых конъюгатов в тканях картофеля проводили по методике [45] с использованием гексана и изопропанола спустя 60 мин после внесения раствора НК в среду роста картофеля in vitro. Активность гвояколзависимой пероксидазы определяли по методу Бояркина [46] спустя 3 ч коинкубации растений с НК.
Накопление селена изучали на 4-е сут в тканях растений после обработки картофеля НК при помощи стандартной методики рентгеновского спектрального энергодисперсионного микроанализа (РСЭДМА). Пробы, полученные из растертой и слегка подсушенной растительной ткани, наклеивали на электропроводный клей и помещали в камеру для съемки при помощи электронного сканирующего микроскопа “Hitachi ТМ 3000” с X-детектором SDD Xflash 4304, где они подвергались электронному удару. С помощью пучка электронов атомы исследуемого образца возбуждались, испуская характерное для каждого химического элемента рентгеновское излучение. Исследуя энергетический спектр такого излучения, делали выводы о качественном и количественном составе образца.
Полученные данные обработали с помощью методов математической статистики с использованием программы MS Excel.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В литературе встречаются исследования фитотоксичности НЧ и их комплексов, но при этом стандартизированной методики для подобных исследований нет. Имеются результаты как о положительном влиянии НЧ на рост и развитие растений, так и о негативном эффекте НЧ на жизнеспособность растительного организма [47, 48]. Была проверена токсичность НК на рост и развитие картофеля in vitro 2-х сортов как в концентрации селена 0.000625%, которая токсична для возбудителя кольцевой гнили, и в концентрации в 10 раз выше (0.00625% селена).
На начальном этапе для выявления наличия состояния стресса у растения под воздействием НК было исследовано изменение активности пероксидазы и содержание продуктов перекисного окисления липидов (ПОЛ) в тканях картофеля, подвергнутого обработке НК.
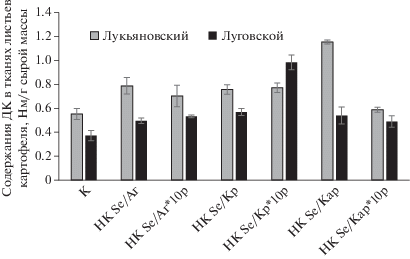
При стрессе в клетках растений высвобождается большое количество активных форм кислорода (АФК), которое способно спровоцировать биохимическое повреждение клеток продуктами ПОЛ [49]. Содержание продуктов ПОЛ является одним из показателей оценки степени повреждения клеток растений при стрессе [50]. Было исследовано влияние НК на содержание диеновых конъюгатов (ДК) в тканях корня и листьев картофеля (рис. 1). Обнаружено, что все обработки НК, кроме НК Se/Кар*10, вызывали повышение содержания ДК в тканях картофеля восприимчивого сорта Лукьяновский. Количество ДК в тканях растений сорта Луговской увеличивалось при внесении в среду культивирования НК Se/Аг, НК Se/Аг*10, НК Se/Кр и НК Se/Кр*10. Обработка картофеля сорта Луговской НК Se/Кар и НК Se/Кар*10 не оказывала влияния на содержание продуктов ПОЛ в тканях листьев. Изменение содержания ДК в тканях листьев картофеля восприимчивого сорта проявлялось в большей степени по сравнению с изменениями содержания ДК в тканях устойчивого сорта. Наблюдаемые сортовые различия являются логичными, т.к. растения восприимчивого сорта более ярко реагировали на любые стрессовые воздействия в отличие от растений устойчивого сорта.
Рис. 1.
Влияние НК на содержание диеновых конъюгатов (ДК) в тканях листьев картофеля сортов Луговской и Лукьяновский in vitro.
Представлены результаты воздействия НК на активность пероксидазы в тканях листьев картофеля (рис. 2). Пероксидаза является очень чувствительным ферментом к различным стрессовым факторам, поэтому часто изменение активности этого фермента можно применять для оценки устойчивости организма к стрессу [51–53].
Рис. 2.
Влияние НК на активность пероксидазы в тканях листьев картофеля сортов Луговской и Лукьяновский in vitro.
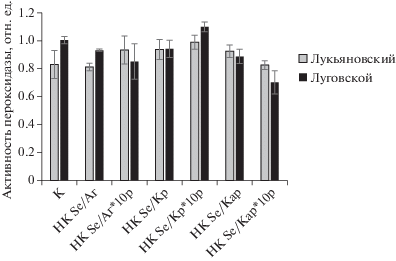
Обнаружено, что в контрольных растениях активность фермента была выше в тканях картофеля устойчивого сорта Луговской по сравнению с активностью фермента в тканях растений восприимчивого сорта Лукьяновский. Обработка растений НК Se/Аг, НК Se/Аг*10, НК Se/Кр и НК Se/Кар не оказывала влияния на активность пероксидазы обоих сортов. Воздействие НК Se/Кр*10 вызывало достоверное повышение активности фермента в тканях картофеля обоих сортов, что свидетельствовало о стрессовом состоянии растений. Обработка растений НК Se/Кар*10 приводила к снижению активности пероксидазы в тканях картофеля устойчивого сорта Луговской.
Таким образом, проведенные исследования биохимических показателей растений картофеля свидетельствовали о наличие стрессового состояния растений картофеля обоих сортов при их обработке НК Se/Кр*10. В этом варианте наблюдали повышение содержания ДК и активности пероксидазы в тканях листьев картофеля. Обработка растений НК Se/Кар*10 не свидетельствовала о наличие стресса у растений.
Также визуально отслеживали состояние растений в течение 4 сут инкубации, производили подсчет завядших листьев. Обнаружено, что у растений картофеля сорта Лукьяновский, восприимчивого к патогенам, первые признаки увядания листьев отмечались уже через 2–6 ч в первые сутки наблюдений во всех вариантах с 10-кратным превышением концентрации селена (рис. 3а). Растения картофеля, обработанные НК с концентрацией селена 0.000625%, сохраняли жизнеспособность на этом этапе наблюдения.
Рис. 3.
Влияние НК на количество завядших листьев картофеля сортов Лукьяновский (а) и Луговской (б) in vitro.

В опытах с растениями сорта Луговской, устойчивого к фитопатогенам, только спустя 6 ч появлялись первые увядающие растения в вариантах с 10-кратным превышением концентрации селена (рис. 3б). При этом все контрольные растения и растения, подвергнутые обработке НК в концентрации 0.000625% селена, сохраняли жизнеспособность, их листья не увядали.
На 2-е сут было отмечено, что растения, подвергнутые обработкам НК Se/Аг*10, НК Se/Кр, НК Se/Кр*10 и НК Se/Кар*10 имели множество завядших листьев, стебли таких растений теряли тургор. Контрольные растения также имели завядшие листья, но их количество было значительно меньше, чем во всех опытных вариантах, кроме обработок НК Se/Аг и НК Se/Кар.
На 4-е сут наблюдений контрольные растения сорта Лукьяновский сохраняли жизнеспособность. Отсутствие вилта стеблей и пожелтения листьев отмечали в вариантах НК Se/Аг и НК Se/Кар, при этом завядшие листья наблюдали. На этом этапе картофель, подвергнутый воздействию НК Se/Кр, практически полностью погиб, был отмечен вилт, скручивание, пожелтение листьев. В вариантах с увеличенной концентрацией селена наблюдали иную закономерность: растения в вариантах НК Se/Аг*10 и НК Se/Кр*10 погибали, их стебли истончались, теряли тургор, листья желтели и отпадали.
В следующие сутки наблюдений отмечено, что наибольшую жизнеспособность сохраняли растения, обработанные НК в концентрации селена 0.000625% (рис. 3а). Картофель, подвергнутый обработке НК Se/Аг, НК Se/Аг*10 и НК Se/Кар, на этом этапе культивирования начал погибать, отмечали активное завядание листьев, потерю тургора тканей стеблей.
Картофель сорта Луговской, обработанный НК в концентрации селена 0.000625%, сохранял жизнеспособность как на 2-е, так и на 4-е сут наблюдений. На 2-е сут наблюдений растения в вариантах НК Se/Аг*10 и НК Se/Кр*10 начали погибать, на 4-е сут отмечено усиление этого процесса. При этом сохранялась жизнеспособность растений в варианте НК Se/Кар*10 (рис. 3б). В конце периода наблюдения, на 4-е сут, отмечено повышенное завядание и скручивание листьев растений, подвергнутых обработке НК в повышенной концентрации. Максимальное количество погибших листьев отмечено в варианте НК Se/Аг*10 у обоих сортов картофеля.
Таким образом, диагностика жизнеспособности в динамике показала отсутствие токсичного эффекта НК Se/Аг и НК Se/Кар с концентрацией селена 0.000625% на растения картофеля обоих сортов в течение всего периода наблюдения. НК Se/Кр оказывал негативное влияние на жизнеспособность картофеля сорта Лукьяновский на 2‑е сут эксперимента. Увеличенная в 10 раз концентрация НК Se/Аг и НК Se/Кр проявила губительное воздействие на картофель сорта Лукьяновский уже через 2–6 ч и через 6 ч – картофеля сорта Луговской, что приводило к завяданию большей части листьев и потери тургора стеблей в конце периода наблюдения. В варианте НК Se/Кар*10 растения выглядели значительно лучше, чем в других вариантах с увеличенным внесением НК.
Исследованные растения картофеля также были проанализированы на содержание селена с помощью метода рентгеновского спектрального энергодисперсионного микроанализа по окончанию опыта. Не было выявлено наличие селена как в тканях растений картофеля обработанного и не обработанного НК Se/Аг (0.000625% селена). Обработка картофеля НК Se/Кр и НК Se/Кар концентрации селена 0.000625% приводила к накоплению селена в незначительных количествах (0.03 и 0.07% соответственно). 10-кратное увеличение концентрации всех 3-х НК повышало содержание селена в 2 раза по сравнению с этим показателем в тканях растений картофеля по сравнению с концентрацией 0.000625% селена. Следует отметить, что обработка 10-кратно увеличенной концентрацией НК не приводила к значительному накоплению селена в тканях картофеля. Наибольшее содержание селена было выявлено в варианте НК Se/Кар*10 и составило всего 0.15% от общего количества исследованных химических элементов в пробе.
ЗАКЛЮЧЕНИЕ
Показано отсутствие выраженного негативного воздействия НК Se/Кар и НК Se/Аг в концентрации 0.000625% селена на рост и развитие растения картофеля обоих сортов in vitro. Выявлено отсутствие накопления селена в тканях таких растений картофеля. Обработка НК Se/Кр угнетала растения, при этом накопление селена в тканях составляло 0.03% от всех химических элементов. Увеличенная в 10 раз концентрация НК Se/Аг и НК Se/Кр оказывала губительное воздействие на картофель, регистрируемое в первые часы после обработки, что подтверждено высокой активностью стрессового фермента пероксидазы и повышенным содержанием ДК. Содержание селена в тканях растений в этих случаях удваивалось по сравнению с вариантами обработки растений НК с концентрацией селена 0.000625%. Повышенная концентрация НК Se/Аг вызывала максимальное пожелтение и отмирание листьев растений сорта Лукьяновский. НК Se/Кар в увеличенной дозе не вызывал стрессового состояния растений, что также подтверждено низким содержанием ДК и пониженной активностью пероксидазы в тканях листьев таких растений. Тем не менее, содержание селена в таких пробах было максимальным и составляло 0.15%. Полученные результаты свидетельствовали о том, что повышенная концентрация НК приводит к избытку селена в тканях растения картофеля, что вызывает гибель растения.
Список литературы
Storck V., Karpouzas D.G., Martin-Laurent F. Towards a better pesticide policy for the European Union // Sci. Total. Environ. 2017. V. 575. P. 1027–1033.
Захаренко В.А. Мониторинг фитосанитарного состояния агроэкосистем в связи с прогнозированием площадей обработок пестицидами в Российской Федерации // Агрохимия. 2018. № 12. С. 3–26.
Захаренко В.А. Использование пестицидов в аграрном секторе России в контексте развития глобальных рынков средств зашиты растений // Агрохимия. 2020. № 3. С. 43–48.
Kumar J., Melo J.S. Overview on biosensors for detection of organophosphate pesticides // Curr. Trends Biomed. Eng. Biosci. 2017. V. 5. P. 555–663.
Kumar P., Kim K.-H., Deep A. Recent advancements in sensing techniques based on functional materials for organophosphate pesticides // Biosens. Bioelectron. 2015. V. 70. P. 469–481.
Liu S., Zheng Z., Li X. Advances in pesticide biosensors: current status, challenges, and future perspectives // Anal. Bioanal. Chem. 2013. V. 405. P. 63–90.
El-Mehdawi A.F., Pilon-Smits E.A.H. Ecological aspects of plant selenium hyperaccumulation // Plant Biol. 2012. V. 14. P. 1–10.
Bempah C.K., Donkor A., Yeboah P.O., Dubey B., Oseifosu P. A preliminary assessment of consumer’s exposure to organochlorine pesticides in fruits and vegetables and the potential health risk in Accra Metropolis, Ghana // Food Chem. 2011. V. 128. P. 1058–1065.
Hijosa-Valsero M., Bécares E., Fernández-Aláez C., Fernández-Aláez M., Mayo R., Jiménez J.J. Chemical pollution in inland shallow lakes in the Mediterranean region (NW Spain): PAHs, insecticides and herbicides in water and sediments // Sci. Total. Environ. 2016. V. 544. P. 797–810.
Горбатов В.С., Астайкина А.А., Аптикаев Р.С., Тихонов В.В. Сравнительная оценка опасности и риска пестицидов для водных организмов // Агрохимия. 2019. № 11. С. 17–26.
Ukalska-Jaruga A., Smreczak B., Siebielec G. Assessment of pesticide residue content in polish agricultural soils // Molecules. 2020. V. 25. № 3. P. 587.
Zhang F., He J., Yao Y., Hou D., Jiang C., Zhang X., Di C., Otgonbayar K. Spatial and seasonal variations of pesticide contamination in agricultural soils and crops sample from an intensive horticulture area of Hohhot, North-West China // Environ. Monit. Assess. 2013 V. 185(8). P. 6893–6908.
Baćmaga M., Wyszkowska J., Kucharski J. The influence of chlorothalonil on the activity of soil microorganisms and enzymes // Ecotoxicology. 2018. V. 27(9). P. 1188–1202.
Иванцова Е.А. Влияние пестицидов на микрофлору почвы и полезную биоту // Вестн. Волгоград. гос. ун-та. Сер. 11. Естеств. науки. 2013. № 1(5). С. 35–40.
Курдиль Н.В., Иващенко О.В., Струк В.Ф., Богомол А.В. Особенности острых отравлений пестицидами в условиях города: карбаматы, пиретроиды, неоникотиноиды // Медицина неотложных состояний. 2015. № 4(67). С. 51–57.
Mew E.J., Padmanathan P., Konradsen F., Eddleston M., Chang S.S., Phillips M., Gunnel D. The global burden of fatal self-poisoning with pesticides 2006–15: systematic review // Affect. Disord. 2017. V. 219. P. 93–104.
Chowdhury F.R., Dewan G., Verma V.R., Knipe D.W., Isha I.T., Faiz M.A., Gunnell D.J., Eddleston M. Bans of who class I pesticides in Bangladesh-suicide prevention without hampering agricultural output // Inter. J. Epidemiol. 2018. V. 47(1). P. 175–184.
Bonvoisin T., Utyasheva L., Knipe D., Gunnell D., Eddleston M. Suicide by pesticide poisoning in India: a review of pesticide regulations and their impact on suicide trends // BMC Public. Health. 2020. V. 20(251). P. 389–394.
Schiavon M., Pilon-Smits E.A.H. The fascinating facets of plant selenium accumulation – biochemistry, physiology, evolution and ecology // New Phytol. 2017. V. 213. P. 1582–1596.
Анисимов Б.В., Белов Г.Л., Варицев Ю.А., Еланский С.Н., Журомский Г.К., Завриев С.К., Зейрук В.Н., Иванюк В.Г., Кузнецова М.А., Пляхневич М.П., Пшеченков К.А., Симаков Е.А., Склярова Н.П., Сташевски З., Усков А.И., Яшина И.М. Защита картофеля от болезней, вредителей и сорняков. М.: Картофелевод, 2009. 272 с.
Жемчужин С.Г., Спиридонов Ю.Я., Клейменова И.Ю., Босак Г.С. Нанотехнологии и пестициды (дайджест публикаций за 2011–2017 гг.) // Агрохимия. 2019. № 5. С. 89–96.
Барабой В.А., Шестакова Е.Н. Селен: биологическая роль и антиоксидантная активность // Укр. биохим. журн. 2004. Т. 76. № 1. С. 23–32.
Вихрева В.А., Блинохватов А.А., Клейменова Т.В. Селен в жизни растений: монография. Пенза: РИО ПГСХА, 2012. 222 с.
White P.J. Selenium metabolism in plants // Biochim. Biophys. Acta Gen. Subj. 2018. pii: S0. V. 4165(18). P. 30138–7. https://doi.org/10.1016/j.bbagen.2018.05.006
Kolbert Z., Molnár Á., Feigl G., Van Hoewyk D. Plant selenium toxicity: Proteome in the crosshairs // J. Plant Physiol. 2019. V. 232. P. 291–300. https://doi.org/10.1016/j.jplph.2018.11.003
Pilon-Smits E.A.H. On the ecology of selenium accumulation in plants // Plants (Basel). 2019. V. 8(7). pii: E197. https://doi.org/10.3390/plants8070197
Gupta M., Gupta S. An Overview of selenium uptake, metabolism, and toxicity in plants // Front Plant Sci. 2017. V. 7. P. 1–14.
Вихрева В.А., Лебедева Т.Б. Содержание селена в почвах и растения лесостепи среднего Поволжья // Молодой ученый. 2010. № 11(22). Т. 2. С. 195–198.
Шеуджен А.Х., Лебедовский И.А., Бондарева Т.Н. Биогеохимия и агрохимия селена // Научн. журн. КубГАУ. 2013. № 92(08).
Голубкина Н.А., Кекина Е.Г., Надежкин С.М. Перспективы обогащения сельскохозяйственных растений йодом и селеном (обзор) // Микроэлементы в медицине. 2015. Вып. 16(3). С. 12–19.
Mechora Š. Selenium as a protective agent against pests: A Review // Plants (Basel). 2019. V. 8(8). pii: E262. https://doi.org/10.3390/plants8080262
Кирюшина А.П. Актуальность и экологические риски использования селеновых удобрений // Использование и охрана природных ресурсов в России. 2018. № 2(154). С. 33–35.
Ardebili Z.O., Ardebili N.O., Jalili S., Safiallah S. The modified qualities of basil plants by selenium and/or ascorbic acid // Turk. J. Bot. 2015. V. 39. P. 401–407.
Jiang C., Zu C., Shen J., Shao F., Li T. Effects of selenium on the growth and photosynthetic characteristics of flue-cured tobacco (Nicotiana tabacum L.) // Acta Soc. Bot. Pol. 2015. V. 84. P. 71–77.
Hussein H.A., Darwesh O.M., Mekki B.B., El-Hallouty S.M. Evaluation of cytotoxicity, biochemical profile and yield components of groundnut plants treated with nano-selenium // Biotechnol. Rep. (Amst). 2019. V. 12(24). P. 1–7.
Feng T., Chen S., Gao D., Liu G., Bai H., Li A., Peng L., Ren Z. Selenium improves photosynthesis and protects photosystem II in pear (Pyrus bretschneideri), grape (Vitis vinifera), and peach (Prunus persica) // Photosynthetica. 2015. V. 53. P. 609–612.
Perfileva A.I., Moty’leva S.M., Klimenkov I.V., Graskova I.A., Skhov B.G., Trofimov B.A. Development of antimicrobial nano-selenium biocomposite for protecting potatoes from bacterial phytopathogens // Nanotechnol. Russia. 2017. V. 12. № 9/10. P. 553–558.
Перфильева А.И., Ножкина О.А., Граскова И.А., Сидоров А.В., Лесничая М.В., Александрова Г.П., Долмаа Г., Клименков И.В., Сухов Б.Г. Синтез нанобиокомпозитов селена и серебра и их влияние на фитопатогенную бактерию Clavibacter michiganensis subsp. sepedonicus // Изв. РАН. Сер. хим. 2018. № 1. С. 157–163.
Перфильева А.И., Ножкина О.А., Граскова И.А., Дьякова А.В., Павлова А.Г., Александрова Г.П., Клименков И.В., Сухов Б.Г., Трофимов Б.А. Нанокомпозиты селена с полисахаридными матрицами стимулируют рост картофеля in vitro, инфицированного возбудителем кольцевой гнили // Докл. АН. 2019. Т. 489. № 3. С. 325–330.
Граскова И.А., Перфильева А.И., Ножкина О.А., Дьякова А.В., Нурминский В.Н., Клименков И.В., Судаков Н.П., Бородина Т.Н., Александрова Г.П., Лесничая М.В., Сухов Б.Г., Трофимов Б.А. Воздействие наноразмерного селена на возбудитель кольцевой гнили и картофель in vitro // Химия раст. сырья. 2019. № 3. С. 345–354.
Ножкина О.А., Перфильева А.И., Граскова И.А., Дьякова А.В., Нурминский В.Н., Клименков И.В., Бородина Т.Н., Александрова Г.П., Сухов Б.Г., Трофимов Б.А. Биологическая активность нанокомпозита селена, инкапсулированного в макромолекулы каррагинана, по отношению к возбудителю кольцевой гнили и растениям картофеля in vitro // Рос. нанотехнол. 2019. Т. 14. № 3. С. 79–86.
Карпова Е.А., Сухов Б.Г., Колесникова Л.И., Власов Б.Я., Ильина О.П., Артемьев А.В., Лесничая М.В., Погодаева Н.Н., Сайванова С.А., Кузнецов С.В., Трофимов Б.А. Антиоксидантное средство с гепатопротекторным эффектом на основе наноструктурированного селена и способы его получения и применения: Пат. 2557992, РФ // Б.И. 2015. № 21. С. 14.
Lesnichaya M.V., Shendrik R., Sukhov B.G. Relation between excitation dependent luminescence and particle size distributions for the selenium nanoparticles in κ-carrageenan shell // J. Lumin. 2019. V. 211. P. 305–313.
Romanenko A.S., Riffel A.A., Graskova I.A., Rachenko M.A. The role of extracellular pH-homeostasis in potato resistance to ringrot pathogen // J. Phytopathol. 1999. V. 147(11–12). P. 679–688.
Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. М.: Наука, 1972. 252 с.
Бояркин А.Н. Быстрый метод определения активности пероксидазы // Биохимия. 1951. Т. 16. С. 352.
Ruttkay-Nedecky B., Krystofova O., Nejdl L., Adam V. Nanoparticles based on essential metals and their phytotoxicity // J. Nanobiotechnol. 2017. V. 15. № 33.
Siddiqi K.S., Husen A. Plant response to engineered metal oxide nanoparticles // Res. Lett. 2017. V. 12. № 92. P. 1–18.
Курганова Л.Н. Перекисное окисление липидов – одна из возможных компонент быстрой реакции на стресс // СОЖ. 2001. № 6. С. 76–78.
Петухов А.С., Хритохин Н.А., Петухова Г.А. Перекисное окисление липидов в клетках растений в условиях городской среды // Вестн. РУДН. Сер. Экология и безопасность жизнедеятельности. 2018. Т. 26. № 1. С. 82–90. https://doi.org/10.22363/2313-2310-2018-26-1-82-90
Huang Y., Bie Z., Liu Z., Zhen A., Wang W. Protective role of proline against salt stress is partially related to the improvement of water status and peroxidase enzyme activity in cucumber // Soil Sci. Plant Nutr. 2009. V. 55. P. 698–704.
Baysal Furtana G., Tipirdamaz R. Physiological and antioxidant response of three cultivars of cucumber (Cucumis sativus L.) to salinity // Turk. J. Biol. 2010. V. 34. P. 287–296.
Олешук Е.Н., Гриц А.Н., Попов Е.Г., Янчевская Т.Г. Экспресс-оценка стрессоустойчивости интродуцируемых сортов винограда (Vitis) по активности окислительно-восстановительных ферментов // Proceed. Nation. Acad. Sci. Belarus. Biol. Ser. 2016. № 4. Р. 33–41.
Дополнительные материалы отсутствуют.


