Агрохимия, 2021, № 10, стр. 89-96
Обработка растений пшеницы бактериями Pseudomonas Protegens ДА1.2 нивелировала негативное действие гербицида чисталан в условиях дефицита воды
А. В. Феоктистова 1, *, М. Д. Тимергалин 1, Т. В. Рамеев 1, С. П. Четвериков 1
1 Уфимский институт биологии – обособленное структурное подразделение
Уфимского федерального исследовательского центра РАН
450054 Уфа, Просп. Октября, 69, Россия
* E-mail: feoktistova.arisha@yandex.ru
Поступила в редакцию 11.03.2021
После доработки 06.04.2021
Принята к публикации 12.07.2021
Аннотация
Показано влияние ауксинпродуцирующего толерантного штамма бактерий Pseudomonas protegens ДА1.2 на растения пшеницы в условиях комбинированного стресса, вызванного засухой и гербицидом. Установлено положительное действие исследованных бактерий на состояние растений пшеницы, обработанных гербицидом чисталан в условиях дефицита почвенной влаги: снижение содержания маркеров стресса МДА и пролина, предотвращение ингибирования роста растений, нормализация содержания хлорофиллов. При комбинированном стрессе наблюдали изменение концентраций и перераспределение фитогормонов, а дисбаланс в распределении ауксинов между побегом и корнем в растениях мог быть причиной уменьшения их устойчивости к засухе в сочетании с гербицидом. Обработка растений ауксинпродуцирующей бактерией Pseudomonas protegens ДА1.2 восстанавливала нормальное соотношение ауксинов между побегом и корнем в растениях.
ВВЕДЕНИЕ
Засуха (дефицит почвенной влаги) – серьезный стресс, ограничивающий урожайность культурных растений, в частности, пшеницы относительно имеющегося у них генетического потенциала [1]. Сорняки – еще одна из самых серьезных проблем современного сельского хозяйства, вызывающая в среднем снижение урожайности на 35% [2]. Эффективность гербицидов в борьбе с сорными растениями увеличила их применение для защиты от потери урожайности сельскохозяйственных культур [3]. Тем не менее, применение препаратов для химической прополки растений негативно сказывается и на культурных растениях, вызывая, так называемый “гербицидный стресс”, который становится наиболее ощутимым в условиях засухи [4].
Известно, что при абиотических стрессах (таких как гербициды и/или засуха) фотосинтез является наиболее уязвимым в процессе формирования биомассы растений [5–7]. Также есть данные о негативном влиянии гербицидов на антиоксидантную систему растений [8].
Роль регуляторов роста растений, в качестве которых давно известны гормоны растений, в стрессоустойчивости позволяет растениям выбрать необходимую стратегию для противодействия неблагоприятным последствиям абиотического стресса и индукции резистентности растений [9]. Они являются одной из ключевых систем, интегрирующих метаболические и эволюционные процессы во всем растении, и необходимы для нормального функционирования многих процессов роста на протяжении всей жизни растений, а также влияют на урожайность и качество сельскохозяйственных культур.
В последнее время все больший интерес в нивелировании абиотических стрессов отводится бактериальным препаратам. В научной литературе прослежены 2 направления исследований по уменьшению ущерба, наносимого применяемыми в настоящее время гербицидами: ускорение процесса их естественного разрушения и снижение негативного воздействия на культурные растения. Микробиологическая трансформация и детоксикация пестицидов представлена в литературе достаточно полно [10–12]. Однако потенциал бактерий в нивелировании пестицидного стресса растений изучен недостаточно. Посвященные этому публикации единичны [13–15]. Работ, посвященных использованию ростстимулирующих бактерий в условиях комбинированного стресса, обусловленного засухой и гербицидной обработкой, нами не обнаружено.
Выделенный ранее штамм Pseudomonas protegens ДА1.2 обладал наличием ряда полезных признаков: устойчивостью к гербицидам, способностью к синтезу ауксинов и мобилизации неорганических фосфатов, антагонизмом к фитопатогенным грибам, ростом в отсутствии источника азота в среде, ростстимулирующим и антистрессовым влиянием на растения пшеницы [16]. Цель работы – показ перспективности использования штамма бактерий Pseudomonas protegens ДА1.2 в качестве антистрессанта растений пшеницы на фоне комбинированного стресса гербицид + засуха.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследование проводили в лабораторных условиях на растениях мягкой яровой пшеницы (Triticum aestivum L.) засухоустойчивого сорта Экада 109. В работе использовали штамм бактерий P. protegens ДА1.2 из коллекции микроорганизмов УИБ УФИЦ РАН и гербицид (против двудольных) на основе ауксинподобных действующих веществ 2,4-Д (2-этилгексиловый эфир) и дикамбы (натриевая соль) – препарат Чисталан экстра (производитель ООО “АХК-АГРО”, Уфа).
Условия засухи достигали путем сокращения полива до 30% от полной влагоемкости почвы (ПВП) и поддержания ее на протяжении всего эксперимента (контроль на уровне 60%).
Семена пшеницы стерилизовали и проращивали в течение 3-х сут. Затем высаживали в сосуды объемом 0.5 л с почво-песочной смесью в соотношении 10 : 1. Растения выращивали на светоплощадке (14-часовой фотопериод, 190 мкмоль м–2 с–1 ФАР, температура 22–26°С). Через 7 сут растения обрабатывали гербицидом и бактериями как описано ранее [17]. Пробы на гормоны (ИУК, АБК и цитокинины), пролин, малоновый диальдегид (МДА) и хлорофилл отбирали через 3 сут после обработки, а ростовые показатели оценивали через 2 нед. Фитогормоны определяли методом иммуноферментного анализа [18], пролин – методом Bates [19] с модификациями, МДА – методом Costa [20], хлорофилл – спектрофотометрическим методом [21].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
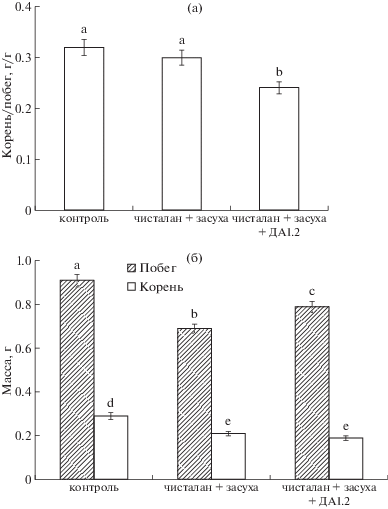
Одновременное воздействие засухи и гербицида чисталан приводило к снижению сырой массы как корня, так и побега растений пшеницы (на 24 и 32% соответственно), однако внесение бактерий P. protegens ДА1.2 в этих условиях способствовало увеличению массы побега (на 13% по сравнению с растениями при воздействии стресса), не вызывая при этом увеличения массы корня.
Известно, что при дефиците воды и/или элементов минерального питания типичной реакцией растений является относительная активация роста корня [22, 23]. В наших же экспериментах у растений, выращиваемых в условиях гербицидной обработки при недостатке воды, соотношение масс корень : побег не менялось по сравнению с контролем (рис. 1а), т.к. достоверно снижалась сырая масса и корня, и побега (рис. 1б), в то время как добавление ростстимулирующих бактерий в раствор гербицида приводило к снижению этого соотношения (т.е. наблюдали относительную активацию роста побега).
Рис. 1.
Соотношение масс корень : побег (а), масса побега и корня (б) растений пшеницы сорта Экада 109 через 14 сут после обработки. Статистически отличающиеся величины обозначены разными буквами, t-тест, р ≤ 0.05. То же на рис. 2–4; n = 20.
Накопление низкомолекулярных соединений является одной из ранних адаптивных реакций растений на действие стрессоров различной природы, одним из таких стрессовых метаболитов является аминокислота пролин. Повышение концентрации пролина в листьях пшеницы наблюдали в ответ на загрязнение ионами металлов, осмотический и температурный стрессы [24–26].
Действительно, в нашей работе при дефиците увлажнения почвы и опрыскивании гербицидом концентрация пролина в побегах растений резко возрастала (более чем на 100%), тогда как внесение изученных бактерий приводило к снижению этого показателя до уровня контроля (рис. 2а).
Рис. 2.
Содержание пролина (а) и МДА (б) в побегах растений пшеницы сорта Экада 109 через 3 сут после обработки, n = 9.

МДА – один из метаболитов при перекисном окислении липидов и его накопление в растениях показывает, что они находятся в стадии сильного окислительного стресса [7]. Обработка растений гербицидом при засухе приводила к накоплению МДА (на 15% относительно контроля), тогда как внесение бактерий штамма P. protegens ДА1.2 нивелировало стресс снижением роста его концентрации (рис. 2б). Таким образом, снижение уровня содержания МДА свидетельствовало об уменьшении повреждающего действия активных форм кислорода в листьях пшеницы при инокуляции растений бактериями P. protegens ДА1.2 в условиях комбинированного стресса, что способствовало поддержанию их роста и указывало на благоприятный антистрессовый эффект бактерий штамма ДА1.2.
Другим важным показателем состояния растений в условиях стресса является уровень содержания хлорофиллов а, б [27]. Показано, при что комбинированном стрессе гербицид + засуха содержание хлорофиллов в листьях пшеницы снижалось на 8% (рис. 3). Положительное влияние бактерий выражалось в нивелировании негативного влияния гербицида на фотосинтетический аппарат. Это отражалось на количественном содержании пигментов в растениях, инокуляция бактериями приводила к повышению суммарного содержания хлорофиллов на фоне комбинированного стресса на 17%. Высокая концентрация хлорофиллов характерна для здоровых растений, поскольку связана с большей эффективностью фотосинтеза. Таким образом, взаимодействие пшеницы с ростстимулирующими бактериями штамма ДА1.2 улучшало состояние растений по сравнению с необработанными бактериями аналогами.
Рис. 3.
Содержание хлорофиллов a и б в побегах растений пшеницы сорта Экада 109 через 3 сут после обработки, n = 9.

Далее, учитывая, что масса корней растений обоих вариантов по сравнению с контролем оставалась одинаково низкой, провели оценку осуществления гормональной регуляции полученных ростовых ответов.
Внесение гербицида чисталан (гербицид из класса синтетических ауксинов) приводило к накоплению ИУК более чем в 2.5 раза (рис. 4а). Этот эффект был обнаружен и в предыдущих работах при действии только гербицидного стресса [17, 28]. Предположили, что это могло быть связано со способностью растений к поглощению экзогенных ауксинов [17, 28], или же сам гербицид действовал на содержание эндогенной ИУК [29]. Данное предположение не противоречит уже имеющимся работам [30]. Наблюдаемый дисбаланс в распределении ауксинов между побегом и корнем в растении, вызываемый гербицидом, мог быть причиной уменьшения устойчивости растения к засухе. Накопление ауксинов под влиянием бактерий в корнях служит одним из механизмов, ответственных за улучшение состояния растений при обработке гербицидом в условиях засухи.
Рис. 4.
Содержание ИУК (а), АБК (б) и цитокининов (в) в побегах и корнях (на г сырой массы) растений пшеницы сорта Экада 109 через 3 сут после обработки, n = 9.

Накопление АБК вызывает закрытие устьиц в условиях дефицита воды [31]. Снижение тургорного давления в клетках при обезвоживании резко активирует синтез АБК, которая накапливается главным образом в хлоропластах клеток листа [32]. Было выявлено накопление АБК в растениях при воздействии стресса (рис. 4б). Наиболее сильно оно проявлялось в корнях, что могло быть следствием торможения их роста. Что касается цитокининов, то стресс приводил к повышению их содержания (рис. 4в), однако при внесении бактерий наблюдали наибольшее накопление цитокининов в побеге. Известно, что цитокинины необходимы для роста побега [33], подавляют рост корней [34] и являются антагонистами АБК [35]. Накопление цитокининов под влиянием изученного стрессового воздействия могло компенсировать рост-ингибирующее действие повышенного уровня АБК, что в наибольшей степени проявлялось в растениях, обработанных бактериями.
ЗАКЛЮЧЕНИЕ
Таким образом, впервые получены данные о влиянии ростстимулирующих бактерий на растения пшеницы в условиях комбинированного стресса, вызванного засухой и применением гербицида. Бактериальный штамм Pseudomonas protegens ДА1.2 оказывал положительное влияние на состояние растений пшеницы, обработанных гербицидом чисталан, в условиях дефицита почвенной влаги, вызывая снижение содержания биохимических маркеров стресса МДА и пролина, предотвращение ингибирования роста растений, нормализацию содержания хлорофиллов. Показано, что вызванный гербицидом чисталан дисбаланс в распределении ауксинов между побегом и корнем в растениях мог быть причиной уменьшения устойчивости растения к засухе. На этом фоне накопление ауксинов при обработке бактериальным штаммом ДА1.2 не стимулировало роста корня, что было связано с ингибирующим действием АБК и цитокининов в корнях растений пшеницы. Таким образом, применение бактерий P. protegens ДА1.2 повысило устойчивость растений пшеницы к воздействию гербицида и засухи и он может быть рекомендован как основа препарата для повышения толерантности растений.
Список литературы
Asseng S., Guarin J.R., Raman M. Wheat yield potential in controlled-environment vertical farms // Proc. Natl. Acad. Sci. 2020. https://doi.org/10.1073/pnas.2002655117
Oerke E.C. Crop losses to pests // J. Agricult. Sci. 2006. V. 144. P. 31–43.
Varhney S., Khan M.I.R., Masood A., Per T.S., Rasheed F., Khan N.A. Contribution of plant growth regulators in mitigation of herbicidal stress // J. Plant Biochem. Physiol. 2015. V. 3. Doi:https://doi.org/10.4172/2329-9029.1000160
Мокроносов А.Т. Фотосинтетическая функция и целостность растительного организма. М.: Наука, 1983. 64 с.
Никитин Н.В. Научно-практические аспекты технологии применения современных гербицидов в растениеводстве. М.: Печатный город, 2010. 200 с.
Kutilkin V.G. Weediness and yield of spring barley depending on the farming system elements // Res. J. Pharmaceut. Biol. Chem. Sci. 2018. V. 9. № 5. P. 911–918.
Загоскина Н.В., Назаренко Л.В. Активные формы кислорода и антиоксидантная система растений // Вестн. МГПУ. Сер. Естественные науки. 2016. № 2. С. 9–23.
Ahemad M., Khan M.S. Ameliorative effects of Mesorhizobium sp. MRC4 on chickpea yield and yield components under different doses of herbicide stress // Pest. Biochem. Physiol. 2010. V. 98. P. 183–190.
Han L., Zhao D., Li C. Isolation and 2,4-D-degrading characteristics of Cupriavidus campinensis BJ71 // Brazil. J. Microbiol. 2015. V. 46. № 2. P. 433–441.
Silva T.M., Stets M.I., Mazzetto A.M., Andrade F.D., Pileggi S.A.V. Degradation of 2,4-D herbicide by microorganisms isolated from Brazilian contaminated soil // Brazil. J. Microbiol. 2007. V. 38. P. 522–525.
Martins P.F., Carvalho G., Gratão P.L., Dourado M.N., Pileggi M. Effects of the herbicides acetochlor and metolachlor on antioxidant enzymes in soil bacteria // Proc. Biochem. 2011. V. 46. P. 1186–1195.
Kanissery R.G., Sims G.K. Biostimulation for the enhanced degradation of herbicides in soil // Appl. Environ. Soil Sci. 2011. V. 2011. Art. ID 843450.
Ahemad M., Khan M.S. Ameliorative effects of Mesorhizobium sp. MRC4 on chickpea yield and yield components under different doses of herbicide stress // Pest. Biochem. Physiol. 2010. V. 98. P. 183–190.
Bourahla M., Djebbar R., Kaci Y., Abrous-Belbachir O. Alleviation of bleaching herbicide toxicity by PGPR strain isolated from wheat rhizosphere // Analele Universităţii din Oradea, Fascicula Biologie. 2018. V. XXV. P. 74–83.
Chennappa G., Sreenivasa M.Y., Nagaraja H. Azotobacter salinestris: a novel pesticide-degrading and prominent biocontrol PGPR bacteria // Microorganisms for Green Revolution. Microorganisms for Sustainability. 2018. V. 7. P. 23–43.
Четвериков С.П., Четверикова Д.В., Бакаева М.Д., Кенджиева А.А., Стариков С.Н., Султангазин З.Р. Перспективный штамм бактерий Pseudomonas рrotegens для стимуляции роста сельскохозяйственных злаков, устойчивый к гербицидам // Прикл. биохим. и микробиол. 2021. Т. 57. № 1. С. 87–94.
Тимергалин М.Д., Феоктистова А.В., Рамеев Т.В., Кудоярова Г.Р., Четвериков С.П. Роль ауксинпродуцирующих бактерий в преодолении стресса растениями пшеницы в условиях обработки гербицидом чисталан // Агрохимия. 2020. № 11. С. 35–40.
Veselov S.U., Kudoyarova G.R., Egutkin N.L., Guili-Zade V.Z., Mustafina A.R., Kof E.M. Modified solvent partitioning scheme providing increased specificity and rapidity of immunoassay for indole 3-acetic acid // Physiologia Plantarum. 1992. V. 86. P. 93–96.
Bates L.S., Waldren R.P., Teare I.D. Rapid determination of free proline for water-stress studies // Plant and Soil. 1973. V. 39. P. 205–207.
Costa H., Gallego S.M., Tomaro M.L. Effect of UV-B radiation on antioxidant defense system in sunflower cotyledons // Plant Sci. 2002. V. 162. P. 939–945.
Кудряшов А.П., Дитченко Т.И., Молчан О.В., Смолич И.И., Яковец О.Г. Физиология растений: лабораторный практикум для студентов биологического факультета. Минск: БГУ, 2011. 70 с.
Vysotskaya L.B., Korobova A.V., Veselov S.Y., Dodd I.C., Kudoyarova G.R. ABA mediation of shoot cytokinin oxidase activity: assessing its impacts on cytokinin status and biomass allocation of nutrient deprived durum wheat // Func. Plant Biol. 2009. V. 36. P. 66–72.
Davies W.J., Kudoyarova G., Hartung W. Long-distance ABA signaling and its relation to other signaling pathways in the detection of soil drying and the mediation of the plant’s response to drought // J. Plant Growth Regul. 2005. V. 24. P. 285–295.
Yang Y., Zhang Y., Wei X., You J., Wang W., Lu J., Shi R. Comparative antioxidative responses and proline metabolism in two wheat cultivars under short term lead stress // Ecotoxicol. Environ. Saf. 2011. V. 74. P. 733–740.
Mwadzingeni L., Shimelis H., Tesfay S., Tsilo T.J. Screening of bread wheat genotypes for drought tolerance using phenotypic and proline analyses // Front. Plant Sci. 2016. V. 7. Art. 1276.
Полетаев И.С., Денисов Е.П., Солодовников А.П., Шагиев Б.З., Степанов Д.С. Изменение стрессовой ситуации растений яровой пшеницы при внекорневой подкормке удобрениями и биопрепаратами // Аграр. научн. журн . 2018. № 4. С. 9–12.
Николаева М.К., Маевская С.Н., Шугаев А.Г., Бухов Н.Г. Влияние засухи на содержание хлорофилла и активность ферментов антиоксидантной системы в листьях трех сортов пшеницы, различающихся по продуктивности // Физиология растений. 2010. Т. 57. № 1. С. 94–102.
Феоктистова А.В., Тимергалин М.Д., Рамеев Т.В., Четвериков С.П. Влияние совместного применения бактерий, продуцирующих фитогормоны, и гербицида Чисталан на физиолого-морфологические параметры растений пшеницы // Аграр. научн. журн. 2020. № 11. С. 67–70.
Kudoyarova G.R., Vysotskaya L.B., Arkhipova T.N., Kuzmina L.Yu., Galimsyanova N.F., Sidorova L.V., Gabbasova I.M., Melentiev A.I., Veselov S.Yu. Effect of auxin producing and phosphate solubilizing bacteria on mobility of soil phosphorus, growth rate, and P acquisition by wheat plants // Acta Physiol. Plantarum. 2017. V. 39. P. 253.
Шарипова Г.В., Веселов Д.С., Кудоярова Г.Р., Тимергалин М.Д., Wilkinson S. Влияние ингибитора рецепции этилена на рост, водный обмен и содержание абсцизовой кислоты у растений пшеницы при дефиците воды // Физиология растений. 2012. Т. 59. № 4. С. 619–626.
Sung Z.R. Relationship of indole-3-acetic acid and tryptophan concentrations in normal and 5-methyltryptophan-resistant cell lines of wild carrots // Planta. 1979. V. 145. № 4. P. 339–345.
Уоринг Ф., Филлипс И. Рост растений и дифференцировка: Пер. с англ. М.: Мир, 1984. 512 с.
Martin A.C., del Pozo J.C., Iglesias J., Rubio V., Solano R., de la Pena A., Leyva A., Paz-Ares J. Influence of cytokinins on the expression of phosphate starvation responsive genes in Arabidopsis // Plant J. 2000. V. 24. P. 559–568.
Werner T., Nehnevajova E., Kollmer I., Novak O., Strnad M., Kramer U., Schmulling T. Root-specific reduction of cytokinin causes enhanced rootgrowth, drought tolerance, and leaf mineral enrichment in Arabidopsis and tobacco // Plant Cell. 2010. V. 22. P. 3905–3920.
Dodd I. C. Root-to-shoot signalling: assessing the roles of ‘up’ in the up and down world of long-distance signalling in planta // Plant Soil. 2005. V. 274. P. 251–270.
Дополнительные материалы отсутствуют.


