Агрохимия, 2021, № 2, стр. 65-70
Имидаклоприд и технологии его применения для защиты семенных посадок картофеля от тлей
О. В. Долженко 1, Т. В. Долженко 2, *
1 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург–Пушкин, ш. Подбельского, 3, Россия
2 Санкт-Петербургский государственный аграрный университет
196601 Санкт-Петербург–Пушкин, Петербургское ш., 2, Россия
* E-mail: dolzhenkotv@mail.ru
Поступила в редакцию 15.04.2020
После доработки 17.05.2020
Принята к публикации 10.08.2020
Аннотация
Приведены результаты исследований биологической эффективности инсектицида из химического класса неоникотиноидов – имидаклоприда в виде концентрата суспензии (КС), содержащей 200 и 600 г д.в./л; водорастворимого концентрата (ВРК), содержащего 200 г д.в./л; водно-диспергируемых гранул (ВДГ), содержащих 700 г д.в./кг действующего вещества и водного раствора (ВР) – 0.1 г.д.в./л для защиты семенного картофеля от тлей – переносчиков вирусов. Использованы следующие технологии применения инсектицида: предпосадочная обработка клубней, обработка дна борозды одновременно с посадкой клубней, опрыскивание растений. Сделан вывод о высокой биологической эффективности (до 100%) имидаклоприда и возможности эффективного применения различных технологий внесения инсектицида против тлей на семенном картофеле как в открытом, так и в защищенном грунте.
ВВЕДЕНИЕ
Вирусные и вироидные болезни сильно снижают эффективность картофелеводства. По мнению Д. Шпаара [1], вирусные эпифитотии возникают в годы появления большого числа тлей-переносчиков, когда вирусы особенно сильно распространяются, что отрицательно сказывается на экономике семеноводства картофеля. Большинство афидофильных вирусов картофеля составляют неперсистентные вирусы, передающиеся на сравнительно недалекое расстояние при очень непродолжительном питании переносчиков на больных и здоровых растениях. Поскольку преобладающее число этих вирусов широко распространено в основных зонах картофелеводства, разработка мер защиты семенных посадок от их переносчиков является настоятельной необходимостью, и в этом случае основная роль принадлежит химическому методу [1, 2].
Наибольшее хозяйственное значение в качестве переносчиков вирусов в посадках картофеля имеют следующие виды тлей: Myzodes persicae Sulz., Aphis nasturtii Kalt., Aphis frangulae Kalt., Macrosiphum euphorbiae Thom., Aulacorthum solani Kalt [3–8]. Число видов тлей, регистрируемых в мире в качестве переносчиков вирусов, ежегодно возрастает, а некоторые исследователи [1, 9] считают, что любой вид тли можно рассматривать в качестве переносчика вирусной инфекции. Установлено, что период возможного заселения полей картофеля как разными видами тлей, так и их комплексом, может длиться до 9-ти и более недель. Оптимально в течение всего этого времени требуется обеспечить гибель тлей-мигрантов в семенных посадках при их первых попытках питаться на защищаемом растении, поскольку период от всходов картофеля до цветения характеризуется высокой чувствительностью к вирусам. Очень часто вредители питаются внутри свернутых листьев и в нижней части картофельного куста, что затрудняет активную работу препаратов контактного действия. Поэтому основными требованиями, предъявляемыми в данном случае к препаратам, являются высокая эффективность и продолжительность их афицидного действия, чтобы максимально сократить кратность обработок. По этой же причине наиболее рациональным для защиты семенных посадок картофеля является использование инсектицидов системного действия [9–14].
В системе сертификации семян картофеля в Российской Федерации с 1 января 2018 г. введен новый межгосударственный стандарт ГОСТ 33996–2016 “Картофель семенной. Технические условия и методы определения качества” [15–17]. В соответствии с ГОСТом, в семенном картофеле не допускается наличие возбудителей инфекционных болезней и вредителей, имеющих карантинное значение (рак картофеля, бурая бактериальная гниль, золотистая цистообразующая картофельная нематода, картофельная моль и др.); установлены дифференцированные нормы для контроля фитопатогенных вирусов на основе лабораторного тестирования листовых и клубневых проб в зависимости от ступени размножения оригинального семенного материала, включая исходный in vitro материал, миниклубни, первое полевое поколение из миниклубней и супер-суперэлиту. Для всех классов (поколений), относящихся к категории оригинального семенного материала, введены достаточно жесткие нормативные допуски по вирусам, вызывающим тяжелые формы морщинистой и полосчатой мозаики (YBK), скручивания листьев картофеля (ВСЛК) и вироида веретеновидности клубней (ВВКК). Наличие YBK и ВСЛК в исходном in vitro материале и миниклубнях не допускается. В первом полевом поколении из миниклубней предельно допустимая норма не должна превышать 0.5%, в супер–суперэлите – 1%. В отношении ВВКК для всех поколений установлен нулевой допуск.
Борьбу с вирусными болезнями картофеля необходимо проводить при семеноводстве картофеля на всех этапах: в лабораторных условиях, в защищенном грунте и в полевых условиях.
В течение длительного времени выращивание миниклубней было ориентировано на использование обогреваемых зимних грунтовых теплиц. Сегодня производители используют менее затратные технологии выращивания миниклубней в весенне-летнем обороте в условиях необогреваемых каркасных укрытий тоннельного типа с применением легких синтетических укрывных материалов.
Комплекс агроприемов, ограничивающих распространение вирусной и другой инфекции в полевых условиях [18], должен включать: обеспечение необходимой изоляции от других посадок картофеля более низких классов или посадок товарного картофеля, предпосадочную обработку клубней препаратами инсектицидно-фунгицидного действия, создание условий, наиболее благоприятных для быстрого роста и развития растений в первоначальный период вегетации, мониторинг активности популяций тлей, мигрирующих на посадках картофеля, регулярное проведение фитосортопрочисток, применение эффективных и экологически безопасных средств защиты растений в период вегетации, предуборочное удаление ботвы химическим или механическим способом при достижении оптимальной семенной товарности клубней с учетом динамики мигрирующих переносчиков вирусов (летающей генерации тлей). Система борьбы с вирусными болезнями картофеля должна быть основана на точных данных о переносчиках в каждых конкретных условиях выращивания семенного картофеля.
Так как с вирусными болезнями картофеля нельзя бороться прямым способом, их развитие надо предотвращать нарушением инфекционного цикла, элементами которого являются источник вируса, переносчик и растение-хозяин [1].
На основании вышесказанного, цель работы – оценка биологической эффективности и технологий применения имидаклоприда для защиты картофеля от тлей в условиях открытого и защищенного грунта.
МЕТОДИКА ИССЛЕДОВАНИЯ
Полевые опыты проводили в Ленинградской обл. в 2012–2019 гг. (ООО “Славянка-М”, Ленинградская плодоовощная опытная станция, опытное поле Санкт-Петербургского государственного аграрного университета) на семенных участках картофеля Solanum tuberosum L. сортов Невский, Удача, Ред Скарлет, Чароит. Тест-объект – имаго и личинки тлей (сем. Aphididae).
Варианты опыта: 1 – имидаклоприд в виде концентрата суспензии (КС), содержащей 200 и 600 г/л действующего вещества, 2 – водорастворимого концентрата (ВРК), содержащего 200 г/л действующего вещества, 3 – водно-диспергируемых гранул (ВДГ), содержащих 700 г/кг действующего вещества, 4 – готовый к применению препарат в виде водного раствора (ВР), содержащего 0.1 г/л действующего вещества, 5 – эталон (зарегистрированный, применяемый в практике препарат с высоким защитным эффектом), 6 – необработанный контроль. Размещение делянок рендомизированное, размер делянок 50 м2, повторность четырехкратная. Способ применения инсектицида в зависимости от препаративной формы: предпосадочная обработка клубней, обработка дна борозды одновременно с посадкой клубней, опрыскивание растений.
Показателем биологической эффективности препарата являлась величина снижения численности тлей относительно контроля при внесении обработанных клубней или обработке дна борозды в процессе посадки клубней и относительно исходной с поправкой на контроль при опрыскивании растений [19].
Проведение учетов в поле: подсчет имаго и личинок на 100 листьях, сорванных произвольно с разных ярусов растений в каждой повторности мелкоделяночного опыта. Сроки учетов зависели от способа применения инсектицида. При посадке обработанных клубней или обработке дна борозды в процессе посадки клубней: предварительный учет (определение срока появления тлей в контроле), 1-й учет – 3-и сут после появления тлей в контроле, 2-й учет – 7-е сут после появления тлей в контроле, последующие учеты с интервалом в 7 сут до десикации (скашивания) ботвы. При опрыскивании растений: предварительный учет (непосредственно перед обработкой), 1-й учет – на 3‑и сут после обработки, 2-й учет – на 7-е сут после обработки, 3-й учет – на 14-е сут после обработки, последующие учеты – по необходимости.
Для наблюдений за появлением, динамикой численности и видовым составом тлей при выращивании миниклубней в теплицах учебно-опытного сада СПбГАУ применяли метод желтых чашек (сосудов Мерике) [5, 12, 13]. Данный метод дает возможность определить активность лета тлей и их видовой состав. Принцип метода заключается в установленной Мерике способности некоторых видов тлей лететь на желтый цвет. Сосуды, заполненные водой, размещали между опытными теплицами, между теплицами и лесополосой и внутри теплиц, где выращивали миниклубни картофеля.
Непосредственно в теплицах размещали по 2 ловушки – в начале и конце теплицы. Сбор насекомых проводили еженедельно утром, в одно и то же время. Насекомых из каждой ловушки помещали во флаконы с 70%-ным спиртом. Отловленный в ловушки энтомологический материал идентифицировали в лабораторных условиях (ВИЗР, старший научный сотрудник, канд. биол. наук М.Н. Берим).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
К перспективным инсектицидам против вредителей картофеля относят современные препараты на основе действующих веществ из класса неоникотиноидов. Представителям данного химического класса свойственны высокая биологическая активность против широкого спектра вредителей сельскохозяйственных культур (в том числе и картофеля), достаточно низкие нормы применения, высокое системное и трансламинарное действие в растениях, умеренная стойкость в объектах окружающей среды. Одним из них является имидаклоприд, который обладает контактно-кишечным и системным действием. Имидаклоприд блокирует постсинаптические никотинэнергические рецепторы нервной системы вредных насекомых. В результате подавляется передача сигналов через центральную нервную систему вредителей, отчего они сначала теряют двигательную активность, затем прекращают питаться и погибают. Необходимо отметить, что имидаклоприд слабо проникает через гематоэнцефалический барьер млекопитающих. Вследствие этого неоникотиноиды очень токсичны для вредителей и умеренно или малотоксичны для млекопитающих. Коэффициент избирательности составляет >2000 [20–23].
Установлено, что на эффективность и уровень экологической безопасности средств защиты растений может существенно влиять технология их применения [10]. Применение имидаклоприда способом обработки дна борозды при посадке клубней картофеля и способом обработки клубней перед посадкой позволило минимизировать контакт препарата с воздухом, а затем и с нецелевыми организмами.
Оценка биологической эффективности имидаклоприда, КС (200 г/л) в регуляции численности тлей при обработке дна борозды при посадке клубней картофеля проведена по схеме: имидаклоприд, КС (200 г/л) – в нормах применения 0.5, 0.75 и 1.0 л/га, эталон – препарат актара, ВДГ (250 г/кг) – 0.6 кг/га, контроль без обработки. Инсектицид показал высокую биологическую эффективность (100%) в варианте с максимальной нормой применения 1.0 л/га в течение практически всего периода учетов. Лишь на 35-е сут после появления всходов показатель биологической эффективности находился на уровне 89.1% (рис. 1).
Рис. 1.
Биологическая эффективность инсектицидов для защиты картофеля от тлей-переносчиков вирусов (максимальные нормы применения) (Ленинградская обл.)
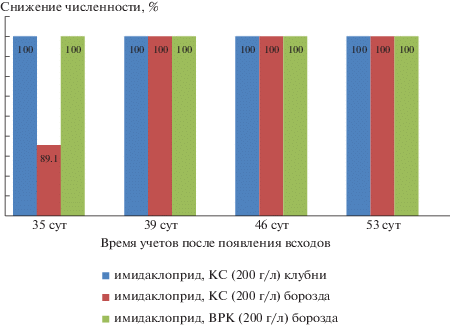
Оценка биологической эффективности имидаклоприда, КС (200 г/л) при его использовании для обработки клубней перед посадкой, проведена по схеме: имидаклоприд, КС (200 г/л) – в нормах применения 0.15, 0.2 и 0.25 л/т, эталон – препарат табу, ВСК (500 г/л) – 0.1 л/т и контроль без обработки. Инсектицид при этой технологии применения показал высокую биологическую эффективность (100%) в борьбе с тлями-переносчиками вирусов на картофеле в течение практически всего периода учетов (рис. 1). Лишь на 39-е сут после появления всходов в вариантах с нормами применения 0.15 и 0.2 л/т показатель биологической эффективности находился на уровне 86.1%, на 46-е сут учетов в варианте с нормой применения 0.2 л/т этот показатель составил 70.0%.
Использование имидаклоприда в форме водорастворимого концентрата (ВРК), содержащего также 200 г/л инсектицида, при применении обработки дна борозды при посадке клубней проводили по схеме: имидаклоприд, ВРК (200 г/л) в нормах применения 0.5 и 1.0 л/га, эталон – препарат Актара, ВДГ (250 г/кг) – 0.6 кг/га и контроль без обработки. Биологическая эффективность, которую определяли по снижению численности тлей в зависимости от времени после появления всходов, в варианте с нормой применения 0.5 л/га в течение учетного периода менялась от 67.4 до 100%, при норме применения 1.0 л/га была равна 100% в течение всего периода учетов (рис. 1), не уступая эффективности эталонного препарата.
Предпосадочную обработку клубней проводили также концентратом суспензии (КС), но содержащей уже не 200, а 600 г имидаклоприда/л. Наблюдения за тлями в опытных вариантах начали с момента появления их на растениях картофеля. Первые особи тлей зафиксированы в контроле на 36‑е сут после появления всходов. На 39-е сут после появления всходов тли были отмечены во всех вариантах. Высокая биологическая эффективность инсектицида была отмечена при всех нормах применения (табл. 1). Визуально отмечено, что в вариантах с применением инсектицидов тли, попадая на обработанные растения и начав питаться, через некоторое время погибали.
Таблица 1.
Биологическая эффективность имидаклоприда, КС (600 г/л) в борьбе с тлями (сем. Aphididae) на картофеле (предпосадочная обработка клубней, Ленинградская обл.)
| Вариант | Норма применения препарата, л/т | Снижение численности тлей относительно контроля по суткам учетов после появления всходов, % | |||
|---|---|---|---|---|---|
| 39 | 43 | 50 | 57 | ||
| Имидаклоприд, КС (600 г/л) | 0.15 | 96.4 | 95.5 | 100 | 100 |
| Имидаклоприд, КС (600 г/л) | 0.25 | 100 | 95.5 | 100 | 100 |
| Имидаклоприд, КС (600 г/л) | 0.3 | 100 | 95.5 | 100 | 100 |
| Эталон круйзер, СК (350 г/л) | 0.2 | 100 | 90.9 | 86.9 | 100 |
| НСР01 | – | 7.7 | 2.1 | 1.6 | 0 |
В период вегетации растений картофеля была проведена обработка растений инсектицидом с высоким содержанием имидаклоприда (водно-диспергируемые гранулы – ВДГ, 700 г/кг) в норме применения 0.125 кг/га. Учеты биологической эффективности проводили в течение 3-х нед после обработки: на 3-и, 7-е, 14-е и 21-е сут после обработки она составила 95.4, 79.4, 75.0 и 63.0% соответственно. Стоит отметить, что, несмотря на самое высокое содержание имидаклоприда, эффективность приема обработки растений в период вегетации уступала эффективности применения инсектицида двумя описанными выше способами.
Таким образом, представленные результаты позволили сделать вывод об универсальности препаратов на основе имидаклоприда и возможности эффективного применения различных технологий их внесения (с учетом экологичности) против тлей на картофеле.
Сложность применения инсектицидов при выращивании миниклубней картофеля в защищенном грунте заключается в том, что обработки против тлей-переносчиков вирусов необходимо проводить еженедельно, а препаратов в Государственном каталоге пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации [24], на данной культуре в теплице не существует. В статьях, опубликованных в различных журналах, можно найти не только химические, а даже и биологические препараты, рекомендованные авторами, но они никогда не были зарегистрированы не только на картофеле в защищенном грунте, но и на других культурах (картофин, вертициллин и т.п.) [6].
В настоящей работе изучили действие имидаклоприда, водный раствор (ВР) (0.1 г/л), разрешенного, с одной стороны, в борьбе с тлями на овощных и цветочных культурах защищенного грунта, а с другой стороны, – на картофеле открытого грунта для борьбы с колорадским жуком. Обработки в теплице проводили еженедельно, независимо от количества и вида выявленных особей тлей. Это было необходимо, поскольку опасность представляет не повреждение, которое наносят тли, а передаваемая ими вирусная инфекция. Даже пробные уколы единичных особей неспециализированных видов тлей могут привести к инфицированию растений картофеля вирусами. При выращивании миниклубней заражение растений вирусами недопустимо [1, 18, 25, 26]. Показателем эффективности действия изученного водного раствора имидаклоприда явился проведенный лабораторией Россельхозцентра по Ленинградской обл. иммуноферментный анализ на наличие скрытой вирусной инфекции как в фазе цветения (листья), так и в миниклубнях после уборки. В опытных растениях и полученных клубнях не было обнаружено латентной вирусной инфекции.
Список литературы
Шпаар Д., Быкин А., Дрегер Д., Захаренко А., Иванюк В., Каленская С., Кюрцингер В. Картофель. Выращивание, уборка и хранение. Научн.-практ. рук-во. М.: Агродело, 2007. 457 с.
Toor R., Teulon D. Potato aphid virus project – Final report 2002–2005 – Towards an insecticide resistance management strategy to control aphid virus vectors in potatoes // New Zealand Institute for Crop and Food Research, October, 2005.
Амелюшкина Т.А., Семешкина П.С. Комплекс агроприемов при выращивании семенного картофеля (метод. рекоменд.). Калуга, 2010. С. 25–31.
Анисимов Б.В., Белов Г.Л., Варицев Ю.А., Еланский С.Н., Журомский Г.К., Завриев С.К., Зейрук В.Н. Защита картофеля от болезней, вредителей и сорняков. М.: Картофелевод, 2009. 272 с.
Берим М.Н. Тли – вредители картофеля // Защита картофеля. 2017. № 1. С. 30–34.
Зейрук В.Н., Белякова Н.А., Белов Г.Л., Васильева С.В., Деревягина М.К. Биологический метод защиты меристемного картофеля в закрытом грунте // Защита картофеля. 2018. № 2. С. 3–8.
Попова Л.А., Шаманин А.А., Корелина В.А., Берим М.Н. Динамика численности тлей-переносчиков вирусов на семенных посадках картофеля в Архангельской области // Вестн. Курск. ГСХА. 2018. № 9. С. 69–76.
Шелабина Т.А., Берим М.Н. Мониторинг динамики численности тлей – потенциальных переносчиков вирусов на посадках картофеля на Северо-Западе России // Изв. Оренбург. ГАУ. 2018. № 5 (73). С. 111–114.
Pelletier Y., Nie X., Giguere M.-F. A New approach for the identification of Aphid Vectors (Hemiptera, Aphididae) of potato Virus Y // J. Econ. Entomol. 2012. V. 105. Iss. 6. P. 1909–1914.
Долженко В.И., Голубев А.С., Долженко О.В., Герасимова А.В. Ассортимент пестицидов для защиты картофеля // Картофель и овощи. 2014. № 2. С. 22–24.
Сухорученко Г.И., Иванова Г.П., Волгарев С.А., Вилкова Н.А., Фасулати С.Р., Верещагина А.Б., Берим М.Н. Система интегрированной защиты репродукционного семенного картофеля от комплекса вредных организмов в Северо-Западном регионе Российской Федерации. СПб., 2016. 137 с.
Волгарев С.А., Иванова Г.П., Сухорученко Г.И., Берим М.Н. Проблемы мониторинга тлей – переносчиков вирусной инфекции при выращивании меристемного картофеля на примере Ленинградской области // Вестн. защиты раст. 2018. № 4 (98). С. 34–40.
Фоминых Т.С., Медведева К.Д. Вирусные болезни картофеля на Северо-Западе России // Вестн. защиты раст. 2018. № 4 (98). С. 40–44.
Mowry T., Ophus J. Effects of sub-lethal imidacloprid levels on potato leafroll virus transmission by Myzus persicae // Entomol. Exp. Applicata. 2002. V. 103. P. 249–255.
Анисимов Б.В., Зебрин С.Н., Логинов С.И. На мировом уровне // Картофель и овощи. 2016. № 7. С. 20–21.
Pest free potato (Solanum spp.) micropropagative material and minitubers for international trade (2010) // International Standards for Phitosanitary Measures. ISPM, FAO, 2011. 20 p.
Межгосударственный стандарт ГОСТ 33996-2016 Картофель семенной. Технические условия и методы определения качества. М.: Стандартинформ, 2016. 41 с.
Анисимов Б.В., Симаков Е.А., Жевора С.В., Овэс Е.В., Зебрин С.Н., Митюшкин А.В., Журавлев А.А., Блинков Е.Г., Юрлова С.М., Усков А.И., Зейрук В.Н., Федотова Л.С. Современные технологии производства семенного картофеля. Практ. рук-во. Чебоксары, 2018. 48 с.
Методические указания по регистрационным испытаниям инсектицидов, акарицидов, моллюскоцидов и родентицидов в сельском хозяйстве. СПб., 2009. 280 с.
The Pesticide Manual. BCPC, 2012. 561 p.
Илларионов А.И. Экотоксикология пестицидов. Воронеж: ВГАУ, 2016. 262 с.
Zang Y., Zhong Y., Luo Y. Genotoxicity of two novel pesticides for the earthworm // Environ. Pollut. 2000, V. 6. P. 271–278.
Cox L. Imidacloprid // J. Pest. Reform. 2001. V. 21. № 1. P. 15–21.
Государственный каталог пестицидов и агрохимикатов, разрешенных для применения на территории Российской Федерации. М., 2019. 848 с.
Сухорученко Г.И., Долженко В.И., Новожилов К.В. Методы оценки действия инсектицидов на членистоногих // Вестн. защиты раст. 2006. № 3. С. 3–12.
Технологический процесс производства оригинального, элитного и репродукционного семенного картофеля. Практ. рук-во / Под ред. Малько А.М., Анисимова Б.В. М.: Россельхозцентр, ВНИИКХ, 2017. 64 с.
Дополнительные материалы отсутствуют.


