Акустический журнал, 2020, T. 66, № 5, стр. 563-574
Особенности звукопроведения в легких человека в диапазонах частот 80–1000 Гц и 10–19 кГц
В. И. Коренбаум a, *, А. Д. Ширяев a
a Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН
690041 Владивосток, ул. Балтийская 43, Россия
* E-mail: v-kor@poi.dvo.ru
Поступила в редакцию 26.03.2018
После доработки 06.02.2020
Принята к публикации 25.02.2020
Аннотация
При зондировании легких человека с использованием техники сжатия импульса в низкочастотном диапазоне 80–1000 Гц установлено преимущественное звукопроведение к поверхности грудной клетки через паренхиму легких продольных, а не сдвиговых волн со скоростями распространения от 100 до 15 м/с. При зондировании через рот для первых 2–3 приходов выявлена значимая разница эффективных углов падения фронта волны зондирующего сигнала на поверхность грудной клетки, подтверждающая ранее сформулированные представления о воздушно-структурном и структурном механизмах проведения звука из просвета бронхиального дерева на стенку грудной клетки. При зондировании с поверхности тела из надключичной области наблюдаются 2 низкоскоростных прихода (15–50 м/с), эффективные углы падения которых по вертикали свидетельствует о структурном звукопроведении от точечного источника, образованного штампом виброизлучателя. При зондировании виброизлучателем с поверхности грудной клетки в высокочастотном диапазоне 10–19 кГц установлено существование низкоскоростных приходов со скоростями распространения 50–150 м/с, трактуемых как результат распространения продольной звуковой волны по паренхиме легких, и наличие высокоскоростных приходов со скоростями 150–1000 м/с, связываемых с распространением продольной волны по плотным тканям грудной клетки. Выявлена зависимость соотношения амплитуд пиков низкоскоростных и высокоскоростных приходов от воздухонаполнения паренхимы легких. Низкоскоростное распространение продольных звуковых волн в обоих диапазонах частот гипотетически объяснено с позиций модели “эффективной” водоподобной среды с микропузырьками воздуха.
ВВЕДЕНИЕ
В 1816 году Р. Лаэннек изобрел метод аускультации легких с помощью стетоскопа, устанавливаемого на поверхности грудной клетки. Эта неинвазивная методика широко применяется во врачебной практике уже в течение почти двух столетий. Однако она носит субъективный характер и не соответствует требованиям современной доказательной медицины.
Интенсивные исследования по объективизации акустических феноменов дыхания ведутся с 70-х годов прошлого века [1]. Тем не менее надежные диагностические методики все еще не созданы. В частности, до сих пор не достигнуты успехи в создании низкочастотной акустической визуализации или томографии легких [2]. Одна из основных проблем – слабая изученность распространения звуков в дыхательной системе человека [3, 4].
Прежние исследования звукопроведения в легких человека касались преимущественно давно используемого на практике низкочастотного диапазона до 1000 Гц, характеризуемого скоростями распространения звуковых волн в пределах 15–200 м/с [5]. На более высоких частотах звукопроведение считалось невозможным из-за повышенного затухания в тканях паренхимы легких. Однако недавно был экспериментально выявлен неожиданный феномен дополнительного “акустического окна прозрачности” легких человека в высокочастотном диапазоне 10–40 кГц, характеризуемого скоростью звука около 1000 м/с [6]. Таким образом, исследуемая акустическая картина еще более усложнилась.
Авторами предложен оригинальный метод зондирования легких человека [7] путем подачи сложных сигналов в рот и с поверхности грудной клетки и вычисления взаимно-корреляционной функции излученного и принятого на поверхности грудной клетки сигналов. Этот метод известен в радио- и гидролокации как метод сжатия импульса. Исследования, выполненные с его помощью для низкочастотного диапазона 80–1000 Гц [7, 8, 5 ], и пилотная апробация в высокочастотном диапазоне 10–19 кГц, произведенная с использованием акустических датчиков для низкочастотного диапазона [9], позволили экспериментально выявить наличие нескольких путей проведения звуковых волн к поверхности грудной клетки, отличающихся скоростью распространения. Обнаружено, в частности, наличие низкоскоростных приходов звуковой волны, результирующая скорость звука которых близка в обоих частотных диапазонах.
Целью данной работы является дальнейшее изучение характеристик распространения звука через легкие человека in vivo в диапазонах частот 80–1000 Гц и 10–19 кГц при трансмиссионном зондировании с помощью метода сжатия импульса.
ОБЗОР МОДЕЛЬНЫХ ПРЕДСТАВЛЕНИЙ О РАСПРОСТРАНЕНИИ ЗВУКОВЫХ ВОЛН В ЛЕГКИХ ЧЕЛОВЕКА
В связи с отсутствием строгой теории, рассмотрим имеющиеся к настоящему времени эмпирические представления, неизбежно, по своему характеру, весьма приближенные. Исследуемый акустический тракт ограничен поверхностью грудной клетки (порядка 30 см в диаметре для взрослого человека). Внутренняя часть грудной клетки заполнена легочной паренхимой, представляющей собой смесь микропузырьков воздуха и водоподобной ткани.
Скорость звука для продольной волны частотой ниже 1 кГц в такой среде согласно модели “эффективной среды” определяется сжимаемостью воздуха в пузырьках и плотностью тканей (близкой к воде) [10]. В результате, расчетная скорость звука в паренхиме легких имеет низкое значение около 20–30 м/с. Последнее значение на частотах 100–300 Гц (диапазон наиболее интенсивного звукопроведения) дает длину продольной звуковой волны λ = 30…10 см, при этом волновой размер исследуемой области составляет (1…3)λ.
Существует возможность и иного представления рассматриваемой среды – в виде поро-вязко-эластичной модели Био [11]. В последнем случае согласно численным оценкам [11] существует быстрая продольная волна со скоростями распространения в пределах 25–50 м/с и медленная продольная волна – со скоростями распространения около 5 м/с. Кроме того, имеет место и сдвиговая волна со скоростью распространения 2–3 м/с.
Основными особенностями паренхимы легких как акустической среды в диапазоне частот ниже 1 кГц являются высокое затухание (от 3 до 20 дБ/см [11]), которое в сочетании с расхождением волнового фронта от источника позволяет пренебречь отраженными и переотраженными звуковыми волнами [12], а также очень малое значение модуля сдвига, которое, в сочетании с высоким затуханием, не должно допускать распространения сдвиговых волн на существенные дистанции (из глубины грудной клетки на ее поверхность). Однако последнее утверждение ранее экспериментально не проверялось.
Таким образом, исходя из модельных соображений, для диапазона частот ниже 1 кГц мы пришли к приближенной акустической модели, представляющей источник (чаще точечный), который излучает в неограниченную среду [3]. Допустимость подхода, связанного с распространением звуковых волн внутри грудной клетки человека в этом частотном диапазоне, вытекает из полученных в работе [5] результатов экспериментальной оценки близости скоростей распространения зондирующего сигнала при измерении в нескольких точках поверхности грудной клетки. Однако измерения акустических характеристик источника излучения обычно приходится выполнять в его ближней волновой зоне. При этом акустические датчики при диаметре контактирующей с поверхностью тела области 25 мм имеют в низкочастотном диапазоне небольшие волновые размеры, что позволяет предположить, что падающая на них звуковая волна может считаться локально плоской (кривизной фронта волны можно пренебречь).
Паренхима легких отделена от внешней среды стенкой грудной клетки, образованной мягкими тканями. Скорость продольных звуковых волн в стенке грудной клетки близка к скорости звука в воде. Так как толщина стенки грудной клетки составляет 2–3 см (волновой размер λ/1000), в волновом смысле она может быть представлена тонким слоем, лежащим на акустически мягкой границе, на которой размещены акустические датчики. Однако сдвиговой жесткостью этих тканей пренебречь уже не представляется возможным. Дело в том, что именно сдвиговая жесткость этого тонкого слоя в проекции установочной поверхности датчика [3] в сочетании с массой самого акустического датчика определяет частоту резонанса его подвеса (установки), которая влияет на амплитудно-частотную характеристику (АЧХ) акустических датчиков [13].
Поскольку далее будут рассматриваться результаты, полученные с использованием датчиков акселерометрического типа, проанализируем более подробно особенности их функционирования на поверхности грудной клетки. Как было показано ранее [13], при характерных массо-габаритах однокомпонентных датчиков этого типа (акселерометр массой 7.5 г, установленный на эбонитовом основании диаметром 25 мм) частота резонанса подвеса для них лежит в районе f0 = = 90–150 Гц. Причем резонанс, вследствие существенного затухания сдвиговых колебаний, отличается низкой добротностью. В результате, на частотах, начиная примерно с 120–225 Гц (1.5 f0), акселерометрический датчик, ориентированный осью чувствительности нормально к поверхности тела, для продольной звуковой волны, бегущей изнутри грудной клетки, представляет собой приемник колебательной скорости. Тогда как на частотах ниже 60–100 Гц (f0/1.5) он будет вести себя как приемник колебательного ускорения – акселерометр [13].
При установке на том же основании втрое более массивного трехкомпонентного акселерометра, согласно известной формуле для частоты резонанса подвеса [13] произойдет ее снижение в (3)0.5 = 1.73 раза, т.е. примерно до 52–87 Гц.
При работе датчика существенно выше частоты резонанса подвеса его колебания отстают от колебаний среды, что порождает сдвиговые “обтекающие препятствие” смещения тканей поверхностного слоя среды примерно в области проекции его установки на поверхность тела при падении продольной волны в нормальном направлении. Наблюдаемая картина схожа с виброизолирующим эффектом армированного резинового виброизолятора [14] и описана нами ранее в [3]. Именно сдвиговая жесткость тонкого поверхностного слоя биологических тканей (меньшая, чем продольная) определяет в этом случае упругость подвеса и частоту резонанса подвеса датчика. Аналогично влияние сдвиговой жесткости тонкого слоя будет сказываться при возбуждении сдвиговых осцилляций датчика на поверхности тонкого слоя продольной волной (или ее проекцией), падающей на него с тангенциальных направлений. Следовательно, при малых в волновом смысле размерах датчика можно с некоторой осторожностью (экспериментальных данных нет) предположить, что относительные чувствительности продольной и тангенциальных компонент трехкомпонентного акселерометра будут близки, по крайней мере, на частотах выше 1.5f0, т.е. примерно с 80–130 Гц, а, значит, и в основной части исследуемого низкочастотного диапазона.
Что касается диапазона частот 10–20 кГц, то на средней частоте 15 кГц при скорости звука 1000 м/с длина продольной звуковой волны составит 6.7 см, а при скорости звука 100 м/с–6.7 мм соответственно. Особенности затухания звука в паренхиме легких в этом диапазоне частот совершенно неизвестны. Кроме того, здесь уже нельзя пренебрегать направленностью акустического датчика (диаметр воспринимающей поверхности 25 мм при скорости звука 100 м/с составляет 3.7λ) и, хотя и в меньшей степени, источника излучения (диаметр штампа 10 мм составляет 1.5λ). Именно поэтому исследование звукопроведения в данном диапазоне частот будет выполнено при насколько возможно противолежащих (оппозитных) по отношению к торсу добровольцев положениях вибростенда и акустических датчиков, лежащих на противоположных половинах грудной клетки, с целью сближения ориентации акустических осей их излучения/приема.
Можно было бы ожидать, что используемые для регистрации проведенного зондирующего сигнала однокомпонентные акселерометрические датчики в высокочастотном диапазоне 10–20 кГц за счет эффекта виброизоляции подвеса в рамках рассмотренной выше модели [13] должны быть полностью развязаны от колебаний поверхности тела и потому совершенно нечувствительны к колебательной скорости продольной волны, бегущей изнутри грудной клетки. Однако на практике в этом диапазоне, напротив, наблюдаются достаточно мощные отклики датчиков на зондирующий сигнал [9]. Объяснение, видимо, заключается в том, что в столь высокочастотном диапазоне (10–19 кГц) датчики акселерометрического типа воспринимают колебательное ускорение присоединенной (соколеблющейся) массы среды [16], т.е. вновь начинают вести себя как акселерометры.
МЕТОД
Установка для трансмиссионного зондирования легких человека, описанная ранее [5, 17 ], дополнительно оснащена комплектом устанавливаемых на поверхности грудной клетки однокомпонентных датчиков акселерометрического типа, способных работать сразу в обоих исследуемых частотных диапазонах (выполнены на основе акселерометров 333B52 (PCB Piezotronics), имеющих частоту собственного резонанса около 35 кГц), и 3-х компонентным акселерометрическим датчиком для диапазона частот 80–1000 Гц (выполненным на акселерометре 317A41 (PCB Piezotronics)).
При этом нужно заметить, что однокомпонентные акселерометрические датчики преимущественно реагируют на продольную волну, тогда как тангенциально ориентированные компоненты 3-х компонентного акселерометрического датчика могут регистрировать как сдвиговые волны, так и составляющие продольной волны, приходящей под значительным углом падения (углом к нормали к поверхности установки датчика). Разделить продольные и сдвиговые волны можно будет, только если они имеют различные скорости распространения. Тем не менее, если предположение о близости чувствительностей каналов акселерометра выполняется, то для составляющих продольных волн можно определить отношение амплитуд сигнала в тангенциальных и продольном направлениях, и через функции arctg(Uvt/Ul), arctg(Uht/Ul), где vt – вертикальная тангенциальная, ht – горизонтальная тангенциальная, l – продольная компоненты, попытаться оценить углы падения фронта звуковой волны на датчик в вертикальном и горизонтальном направлениях соответственно, по аналогии с тем, как это сделано ранее для подводных векторных приемников (например, [15]).
Регистрация сигналов от указанных датчиков через соответствующие цепи питания предварительных усилителей осуществлялась на 16-канальном электронном самописце Powerlab (ADInstruments), обеспечивающем запись и отображение временных реализаций величин электрического напряжения (в вольтах), подаваемых на вход каждого из каналов.
Для низкочастотного диапазона 80–1000 Гц в качестве зондирующего сигнала был использован фазоманипулированный (ФМ) сигнал, представляющий собой совокупность разнесенных по времени М-кодированных (основание – 511 отсчетов) последовательностей с тремя различными несущими частотами 200, 300, 750 Гц [7], частота дискретизации 10 кГц. Для высокочастотного диапазона в качестве зондирующих сигналов использован линейно частотно-модулированный (ЛЧМ) сигнал с полосой частот 10–19 кГц и продолжительностью перестройки 6 секунд. Верхний предел частоты сигналов этого диапазона ограничен 19 кГц, чтобы обеспечить выполнение правила Найквиста при частоте дискретизации 40 кГц.
Описанные сигналы излучались в дыхательную систему человека через рот электродинамическим громкоговорителем [17], оснащенным трубкой со сменным одноразовым фильтром, в низкочастотном диапазоне, а с поверхности грудной клетки – компактным вибростендом 4810 Brüel&Kjær в обоих частотных диапазонах. Излучатели управлялись аналоговым сигналом с ЦАП профессиональной выносной звуковой карты Transit, M-Audio персонального компьютера, генерируемым с частотой дискретизации 96 кГц. Сигнал на излучатели подавался через усилитель мощности 860 PHONIC MAX.
Используемые точки установки акустических датчиков и проекции штампа виброболта вибростенда на поверхности грудной клетки показаны на рис. 1. Акустические датчики приклеивались на медицинскую двустороннюю клеящую ленту, а вибростенд удерживался рукой оператора с обеспечением ориентации оси виброболта примерно по нормали к поверхности грудной клетки. В эксперименте было задействовано 4 добровольца, давших информированное согласие на участие в эксперименте.
Рис. 1.
Схема точек установки акселерометрических датчиков (№ 2–14) и проекции штампа виброболта вибростенда (Б1–Б4) на торсе обследуемого.

При обработке сигналов вычислялся коэффициент взаимной корреляции $Rxy$(1), показывающий степень корреляции между излученной репликой сигнала x (на выходе звуковой карты) и принятым сигналом y в каналах 16-канального самописца
где Fxy – взаимно-корреляционная функция реплики излученного сигнала х и принятого сигнала у; Fxx(0) – максимум автокорреляционной функции сигнала x, а Fyy(0) – сигнала y. При этом информация об относительных амплитудах принятых сигналов теряется. Для того чтобы выделить и эту информацию, по аналогии с передаточной функцией введена нормировка взаимно-корреляционной функции на максимум автокорреляционной функции реплики излучаемого сигнала xПолученный корреляционный коэффициент $Txy$(2) линейно зависит от амплитуды принятого сигнала, тогда как амплитуда реплики излученного (записываемой на канал 1 самописца) остается постоянной. Величина $Txy$ может быть представлена и в логарифмическом масштабе, что оказалось удобным для анализа звукопроведения в высокочастотном диапазоне.
Для функций $Rxy$, $Txy$ рассчитывались огибающие Гильберта, в результате чего получались графики, обычно называемые свертками зондирующего и принятого сигналов. На рис. 2 в качестве примера показаны отклики излученного ЛЧМ сигнала высокочастотного диапазона (канал самописца № 1) и датчика № 7 (канал самописца № 7), а также амплитуда функции $Rxy$ и ее огибающая.
Рис. 2.
Характерный вид сигналов при зондировании высокочастотным сигналом 10–19 кГц (трасса Б1 – т. 7, доброволец Ш.) при спокойном дыхании (HF1): Канал 1 – реплика излученного виброизлучателем ЛЧМ сигнала (канал 1 самописца), Канал 7 – отклик датчика № 7 (Канал 7 самописца), Rxy – коэффициент взаимной корреляции откликов, его огибающая – свертка, точки – выделенные пики огибающей, цифры– результирующая скорость звука, м/с.
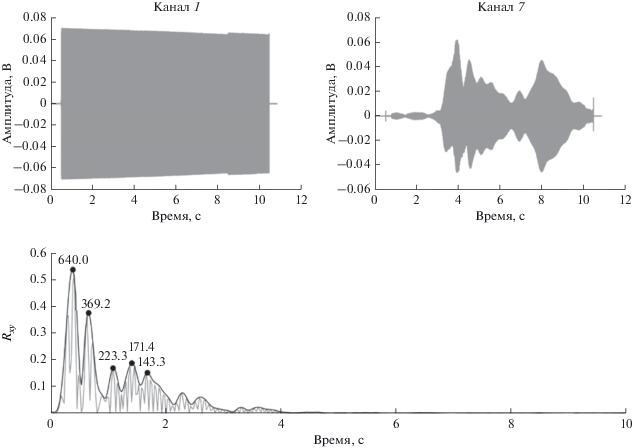
Каждый пик свертки в соответствии с общеизвестными радио- и гидролокационными соображениями, а также нашим опытом [5, 7–9], трактуется как отдельный приход зондирующего сигнала (звуковой волны), имеющий свою определенную временную задержку. Каждый такой приход сигнала распознавался автоматическии (рис. 2). При этом максимумы огибающей Rxy находились путем численного дифференцирования, выделялись максимумы, превышающие пороговое значение. Пороговое значение устанавливалось равным максимальному уровню боковых лепестков относительно основного лепестка автокорреляционной функции – для сигнала ФМ 15%, для сигнала ЛЧМ 18%. Кроме того, использовалось дополнительное требование – абсолютный уровень Rxy обнаруженного пика должен быть выше 0.1. Соответствующие указанным условиям пики отмечались метками и далее переносились на графики функции Txy.
Результирующая скорость распространения звуковой волны для каждого прихода сигнала рассчитана по прямо измеренному пелвиметром расстоянию между центром следа проекции штампа виброболта вибростенда на поверхности тела (или 2-го трахеального акселерометрического датчика при зондировании через рот, с учетом поправки на время распространения зондирующего сигнала от контрольного датчика у рта до датчика № 2 [5]) и центром позиции конкретного приемного акустического датчика, отнесенному к временной задержке, определяемой по свертке. Рассчитанные значения скорости звука обозначены цифрами над пиками свертки (рис. 2 и далее).
ИССЛЕДОВАНИЕ ПРОВЕДЕНИЯ ЗВУКА В ДИАПАЗОНЕ ЧАСТОТ 80–1000 ГЦ 3-Х КОМПОНЕНТНЫМ АКСЕЛЕРОМЕТРИЧЕСКИМ ДАТЧИКОМ
Зондирование легких осуществлялось при излучении ФМ сигнала через рот на спокойном выдохе [7], тогда как зондирование легких с поверхности грудной клетки виброизлучателем выполнялось при спокойном дыхании.
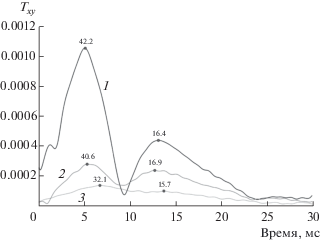
Характерные свертки для откликов трех компонент трехкомпонентного акселерометрического датчика, установленного в т. 7 на одном и том же добровольце, на излучение низкочастотного зондирующего сигнала в рот представлены на рис. 3, а на излучение вибростендом из точки Б1 – на рис. 4. Положение и ориентация трехкомпонентного датчика одни и те же: кривая 1 – продольная компонента с нормальной ориентацией к поверхности грудной клетки, кривая 2 – вертикальная тангенциальная компонента, кривая 3 – горизонтальная тангенциальная компонента.
Рис. 3.
Огибающие Гильберта функции Txy для трехкомпонентного акселерометрического датчика в точке 7 при зондировании через рот (доброволец С): кривая 1 – продольная компонента с нормальной ориентацией к поверхности грудной клетки, кривая 2 – вертикальная тангенциальная компонента, кривая 3 – горизонтальная тангенциальная компонента.
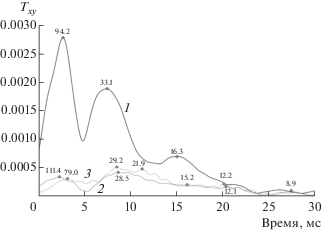
Рис. 4.
Огибающие Гильберта функции Txy для трехкомпонентного акселерометрическогодатчика в точке 7 при зондировании вибростендом из точки Б1 (доброволец С): кривая 1 – продольная компонента с нормальной ориентацией к поверхности грудной клетки, кривая 2 – вертикальная тангенциальная компонента, кривая 3 – горизонтальная тангенциальная компонента.
Первое, на что следует обратить внимание на рис. 3, – это хорошо выраженные пики свертки по продольной компоненте акселерометрического датчика. Обычно в нижних отделах легких при зондировании через рот наблюдается 3 таких пика, характеризующих приходы зондирующего сигнала. Амплитуды этих пиков (приходов) существенно превышают (в 2–10 раз) пики, наблюдаемые при сходных задержках времени на свертках тангенциальных компонент акселерометрического датчика.
Скорости значимых по амплитуде приходов, определяемых по пикам сверток каналов акселерометра, лежат в пределах 15–111 м/с. Этот диапазон скоростей распространения хорошо согласуется с данными, полученными для той же полосы частот 80–1000 Гц на обширной выборке обследуемых ранее [5], и характерен для распространения продольной звуковой волны. Действительно, если бы было существенным распространение через паренхиму легких сдвиговых волн, соотношение амплитуд пиков сверток каналов акселерометра (рис. 3) изменилось бы в пользу тангенциальных каналов. Что касается возможности распространения сдвиговых волн по поверхности грудной стенки, то выявленные ранее при этом скорости распространения 2–3 м/с [18, 11 ] для наблюдаемых в случае зондирования через рот приходов не обнаруживаются вовсе.
Итак, если вкладом сдвиговых и поверхностных волн при зондировании через рот можно пренебречь, то через отношения амплитуд пиков в каналах акселерометрического датчика появляется возможность оценить углы падения фронта продольной волны (волн) на участок поверхности тела, где размещен акселерометрический датчик. Для случая, показанного на рис. 3, эти оценки приведены в табл. 1.
Таблица 1.
Оценки углов прихода фронта волны при зондировании через рот (рис. 3).
| Область излучения | Точка установки датчика | № прихода на свертке (рис. 3) | Отношения пиковых амплитуд компонент акселерометра | Uvt/Ul, Uht/Ul | Угол падения, градусы |
|---|---|---|---|---|---|
| Рот | 7 | 1 | Горизонтальная тангенциальная/продольная, Uht/Ul | 0.11 | 12.4 |
| Рот | 7 | 1 | Вертикальная тангенциальная/продольная, Uvt/Ul | 0.12 | 13.5 |
| Рот | 7 | 2 | Горизонтальная тангенциальная/продольная, Uht/Ul | 0.27 | 28.4 |
| Рот | 7 | 2 | Вертикальная тангенциальная/продольная, Uvt/Ul | 0.22 | 23.8 |
| Рот | 7 | 3 | Горизонтальная тангенциальная/продольная, Uht/Ul | 0.63 | 32.2 |
| Рот | 7 | 3 | Вертикальная тангенциальная/продольная, Uvt/Ul | 0.30 | 31.0 |
Как следует из табл. 1, первый приход зондирующего сигнала имеет очень малые углы падения и по вертикали, и по горизонтали, и, следовательно, характеризует продольную звуковую волну, распространяющуюся почти по нормали к оси чувствительности этой компоненты акселерометра. Такое распространение характерно для так называемого “воздушно-структурного” механизма звукопроведения [3], когда звуковая волна, излучаемая в полость рта, большую часть пути до датчика пробегает по просвету дыхательных путей и переизлучается в паренхиму легких только на уровне достаточно удаленных (дистальных) мелких бронхов [5]. Кстати, и наблюдаемые скорости распространения для первого прихода согласуются с ранее выполненными оценками для этого механизма [5].
Второй и третий приходы (рис. 3) характеризуют фронты волн, хотя и распространяющихся с разными скоростями, но падающими на акустический датчик в направлении горизонтали практически под одним углом. В направлении вертикали эти углы различаются немного больше. Однако интересно, что величины этих углов намного (в 2–2.5 раза) превышают вертикальный угол, наблюдаемый для 1-го прихода. Сами значения углов падения для каждого из приходов могут определяться не слишком точно, поскольку их оценка требует выполнения ранее высказанного дискуссионного предположения об идентичности влияния системы подвеса на чувствительности продольного и тангенциальных каналов трехкомпонентного акселерометрического датчика. Но значимое изменение углов падения в одних и тех же условиях излучения и приема означает распространение сигнала по другому пути или от другого источника. Судя по результирующим скоростям 2-го и 3-го приходов, здесь имеет место гораздо более длинный ход звуковой волны по паренхиме легких, чем по просвету дыхательных путей, как для 1-го прихода. Эти соотношения длин хода звуковых волн, да и скорости распространения, более характерны для так называемого “структурного” механизма звукопроведения [3], когда звуковая волна, излучаемая в полость рта, переизлучается в паренхиму легких из просвета дыхательных путей на уровне трахеи или крупных бронхов [5]. Интересно, что первый из этих “структурных” приходов по скорости распространения 33 м/с близок к предсказаниям скорости быстрой продольной волны по модели Био (25–45 м/с), тогда как второй, имеющий скорость 16 м/с – к предсказаниям модели “эффективной среды” (22 м/с), а вовсе не медленной продольной волны по модели Био (5 м/с) [11].
Перейдем теперь к оценке результатов зондирования с поверхности грудной клетки (рис. 4, табл. 2) на том же обследуемом. Обычно в нижних отделах легких при зондировании с поверхности грудной клетки наблюдается 2 пика свертки, характеризующих приходы зондирующего сигнала. Интересно, что скорости распространения этих приходов близки к скоростям 2-го и 3-го приходов при зондировании через рот. Практически полная идентичность по скоростям распространения наблюдается для 2-го прихода при зондировании с поверхности грудной клетки из позиции Б1 и 3-го прихода при зондировании через рот. Поскольку при зондировании с поверхности грудной клетки из точки Б1 штамп виброболта вибростенда размещен примерно на уровне середины длины трахеи, отсюда следует, что переизлучение в паренхиму легких звуковой волны, описываемой 3-м приходом, при зондировании через рот должно происходить преимущественно из внутригрудного участка трахеи. Это наблюдение идеально укладывается в модель “структурного” звукопроведения по паренхиме легких [5]. Первый приход сигнала при зондировании с поверхности грудной клетки из позиции Б1, будучи более высокоскоростным, скорее всего, должен быть связан с звукопроведением по более плотным тканям легких, например, средостению. Передача сигнала по плотным тканям грудной клетки в просвет трахеи с частичным задействованием “структурного” механизма звукопроведения по просвету дыхательных путей также не исключена. Вероятным объяснением первого прихода сигнала при зондировании с поверхности грудной клетки может быть и вышеописанная быстрая продольная волна по модели Био [11].
Таблица 2.
Оценки углов прихода фронта волны при зондировании с поверхности грудной клетки (рис. 4)
| Область излучения | Точка установки датчика | № прихода на сверткe (рис. 4) | Отношения пиковых амплитуд компонент акселерометра | Uvt/Ul, Uht/Ul | Угол падения, градусы |
|---|---|---|---|---|---|
| Б1 | 7 | 1 | Горизонтальная тангенциальная/продольная, Uht/Ul | 0.13 | 14.6 |
| Б1 | 7 | 1 | Вертикальная тангенциальная/продольная, Uvt/Ul | 0.26 | 27.5 |
| Б1 | 7 | 2 | Горизонтальная тангенциальная/продольная, Uht/Ul | 0.23 | 24.7 |
| Б1 | 7 | 2 | Вертикальная тангенциальная/продольная, Uvt/Ul | 0.54 | 47.2 |
Что касается соотношения амплитуд пиков наблюдаемых приходов на свертках (рис. 4), то здесь разница между продольным и вертикальным тангенциальным каналами заметно меньше, чем при зондировании через рот. Поскольку все условия зондирования идентичны (один и тот же обследуемый, датчик в одном и том же расположении, меняется только позиция излучателя), можно, также как и прежде, исключить влияние сдвиговых волн. Следовательно, можно оценить и углы падения фронтов волн на акустический датчик (табл. 2). Как и ранее, сами значения углов падения для каждого из приходов не слишком точны, поскольку их оценка требует выполнения ранее высказанного дискуссионного предположения об идентичности влияния системы подвеса на чувствительности продольного и тангенциальных каналов трехкомпонентного акселерометрического датчика, однако значимое изменение углов падения в тех же условиях приема означает распространение сигнала по другому пути или от другого источника.
Согласно табл. 2, при зондировании из точки Б1 фронт волны зондирующего сигнала, характеризуемого 1-м приходом, падает под существенным вертикальным углом, близким к углу падения 2-го прихода при зондировании через рот.
Угол падения для фронта волны зондирующего сигнала, характеризуемого 2-м приходом, несколько больше, однако и позиция штампа вибростенда Б1 смещена по направлению к этому датчику ближе, чем нижняя часть трахеи, предполагаемая в качестве основного источника “структурного” звукопроведения при зондировании через рот. В целом, эффективные углы падения фронта (фронтов) звуковой волны по вертикали намного больше, чем для первого прихода при зондировании через рот. Это наблюдение может быть интерпретировано как результат звукопроведения от точечного источника, образованного штампом виброизлучателя, непосредственно или опосредовано через средостение или трахею по паренхиме легких, по контрасту со случаем “воздушно-структурного” звукопроведения при зондировании через рот.
Следует заметить, что при зондировании с поверхности грудной клетки на свертках продольной компоненты трехкомпонентного акселерометра иногда наблюдаются более слабые по амплитуде, чем вышеописанные, пики особо низкоскоростных приходов (менее 5 м/с), которые можно трактовать как вызванные колебательными смещениями штампа виброизлучателя сдвиговые волны, распространяющиеся по поверхности грудной клетки [16, 11 ]. Вследствие высокого затухания таких колебаний и большого расстояния между излучателем и акустическим датчиком (в данном случае не менее 20 см) эти сигналы, вероятно, претерпевают очень существенное ослабление по сравнению с прошедшими через паренхиму легких продольными волнами.
ИССЛЕДОВАНИЕ ПРОВЕДЕНИЯ ЗВУКА В ДИАПАЗОНЕ ЧАСТОТ 10–19 КГЦ
В высокочастотном диапазоне зондирование легких осуществлялось только виброизлучателем с поверхности грудной клетки по схеме, показанной на рис. 1. Зондирование через рот в этом диапазоне частот оказалось невозможным вследствие недостаточного уровня излучаемых динамиком сигналов. При выполнении зондирования обследуемые последовательно выполняли следующие дыхательные маневры: спокойное дыхание (HF1), задержку дыхания при максимально глубоком вдохе (HF2), задержку дыхания при максимально полном выдохе (HF3). Поскольку при маневре спокойного дыхания (HF1) была выявлена высокая вариабельность времен и амплитуд приходов сигнала, далее анализировались только маневры с задержками дыхания HF2, HF3, вариабельность при которых оказалась существенно ниже.
При частоте дискретизации 40 кГц 16-канальный самописец PowerLab (ADInstruments) обеспечивал возможность синхронной регистрации сигналов только для 7 каналов. По этой причине, а также для снижения влияния направленности акустических датчиков и виброизлучателя запись сигналов производилась от датчиков, расположенных на противоположных штампу виброизлучателя половинах грудной клетки (оппозитно) (рис. 1).
Согласно рис. 2 при зондировании в высокочастотном диапазоне, так же как и в низкочастотном, по функции Rxy удается разделять низкоскоростные и высокоскоростные приходы звуковых волн. Таким образом, возможность разложения полученных сигналов на высокоскоростные и низкоскоростные приходы, впервые выявленная ранее [9], подтверждена и на этой, независимой, выборке обследуемых при использовании специальных высокочастотных акустических датчиков. Однако приходов в высокочастотном диапазоне наблюдается гораздо больше, чем в низкочастотном. Это свидетельствует о более сложных закономерностях звукопроведения, зависящих от ориентации акустических осей направленных (в этом диапазоне частот) датчиков и излучателей и, вероятно, включающих переотражение от более плотных легочных структур, рефракцию и дисперсию. На настоящем этапе исследования разделить эти эффекты не представляется возможным. Тем не менее, чтобы минимизировать, по крайней мере, влияние переотражений и направленности датчиков/излучателя, рассмотрим далее звукопроведение на оппозитных трассах (излучатель и датчик расположены на противолежащих половинах грудной клетки). Углы расположения источника излучения к акустической оси приема датчика и расположения датчика к акустической оси излучения источника приближенно оценивались с помощью транспортира.
Закономерен вопрос, не являются ли некоторые из фиксируемых приходов результатом распространения сдвиговых волн. Исчерпывающе ответить на этот вопрос пока невозможно, т.к. трехкомпонентный акселерометрический датчик не пригоден для высокочастотного диапазона из-за недостаточно высокой частоты собственного резонанса чувствительного элемента. Однако при используемых оппозитных положениях виброизлучателя и датчика, вследствие близкой к оси приема ориентации акустического датчика на источник и близкой к оси излучения ориентации источника на датчик, доминирующим по величине Txy, очевидно, должен считаться вклад распространяющихся прямо вдоль трассы между датчиком и излучателем продольных звуковых волн (сдвиговые волны в биотканях на тех же дистанциях должны затухать в большей степени).
При исследованиях на оппозитных трассах излучатель–датчик установлено существование низкоскоростных приходов со скоростями распространения в среднем 50–150 м/с. Их амплитуда и/или скорость обратно зависят от степени воздухонаполнения легких при задержке дыхания на вдохе и выдохе, что позволяет трактовать эти приходы как результат распространения продольной звуковой волны преимущественно по паренхиме легких.
Амплитуды высокоскоростных приходов имеют скорости 150–1000 м/с и чаще усиливаются при уменьшении воздухонаполнения легких при задержках дыхания на выдохе. Поэтому они могут быть связаны с распространением продольной волны по плотным тканям грудной клетки (стенки бронхов, стенки сосудов и наполняющая их кровь [6]).
Обнаруженные низкоскоростные приходы имеют скорость звука в пределах 50–150 м/с, что для средней частоты исследуемого диапазона 15 кГц дает длины волн от 0.33 до 1 см. Столь небольшие длины волн могут обеспечить пространственное разрешение в паренхиме легких патологических участков, отличающихся по акустическим свойствам, размерами порядка первых единиц сантиметров! Таким образом, выявленный феномен низкоскоростного распространения звука в легких человека в диапазоне 10–19 кГц представляется перспективным для обеспечения акустической визуализации с высоким разрешением или даже томографии легочной паренхимы.
Кроме того, выявлено 4 варианта соотношения амплитуд высокоскоростных и низкоскоростных приходов и их изменения в зависимости от степени воздухонаполнения легких при задержках дыхания на вдохе и выдохе. Огибающие Гильберта функции Txy (свертки зондирующего и принятого сигналов) для этих типов показаны на диаграммах рис. 5–8. Они представлены в логарифмическом масштабе (10 lg), чтобы в одном графике вместить результаты, полученные и для задержки на вдохе (HF2), и для задержки на выдохе (HF3).
Рис. 5.
Огибающие Гильберта функции Txy (тип 1) при зондировании с поверхности грудной клетки на трассе Б1 – т. 11 (угол расположения источника излучения к акустической оси приема датчика до 30°, угол расположения датчика к акустической оси излучения источника до 45°), доброволец К1: для глубокого вдоха (HF2) и глубокого выдоха (HF3).

Рис. 6.
Огибающие Гильберта функции Txy (тип 2) при зондировании с поверхности грудной клетки на трассе Б3 – т. 11 (угол расположения источника излучения к акустической оси приема датчика 15°–20°, угол расположения датчика к акустической оси излучения источника до 30°), доброволец С: для глубокого вдоха (HF2) и глубокого выдоха (HF3).

Рис. 7.
Огибающие Гильберта функции Txy (тип 3) при зондировании с поверхности грудной клетки на трассе Б4 – т. 10 (угол расположения источника излучения к акустической оси приема датчика 15°–20°, угол расположения датчика к акустической оси излучения источника до 30°), доброволец С: для глубокого вдоха (HF2) и глубокого выдоха (HF3).
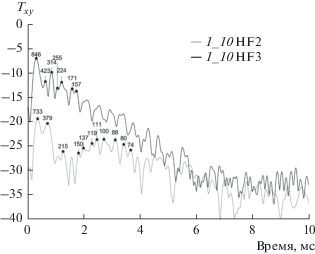
Рис. 8.
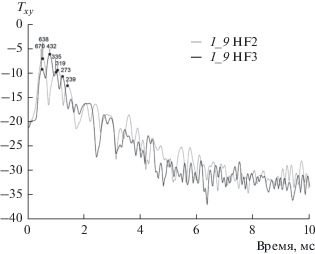
Огибающие Гильберта функции Txy (тип 4) при зондировании с поверхности грудной клетки на трассе Б2 – т. 9 (угол расположения источника излучения к акустической оси приема датчика до 30°, угол расположения датчика к акустической оси излучения источника до 45°), доброволец К2: для глубокого вдоха (HF2) и глубокого выдоха (HF3).
Тип 1 (рис. 5) – появление высокоскоростных приходов при выдохе (HF3) по сравнению с вдохом (HF2) без существенных изменений основных низкоскоростных приходов.
Тип 2 (рис. 6) – существенное увеличение амплитуд высокоскоростных приходов при выдохе (HF3) по сравнению с вдохом (HF2).
Тип 3 (рис. 7) – резкое увеличение амплитуд высокоскоростных и низкоскоростных приходов при выдохе (HF3) по сравнению с вдохом (HF2).
Тип 4 (рис. 8) – отсутствие какой-либо динамики амплитуды или скорости высокоскоростных и низкоскоростных приходов между выдохом (HF3) и вдохом (HF2).
Один из этих вариантов – тип 4 (рис. 8), характеризующийся преобладанием амплитуд высокоскоростных приходов и на вдохе, и на выдохе, может быть акустически интерпретирован как снижение воздухонаполнения легочной ткани на вдохе, и встречается только у одного немолодого добровольца К2 с длительным течением гормонозависимой бронхиальной астмы, а не у 3-х других, которые являются молодыми здоровыми лицами. Следовательно, предложенный подход может быть перспективен для оценки локальной вентиляции участков легочной паренхимы.
Заметим, что наблюдаемая разница звукопроведения между вдохом и выдохом не может быть объяснена смещением положений излучателя и датчика, т.к. основное изменение объема легких достигается за счет движений диафрагмы, а не поверхности грудной клетки. Поэтому реально измеренные пелвиметром прямые расстояния между положениями излучателя и датчика при маневрах задержки дыхания на вдохе (HF2) и выдохе (HF3) различались не более чем на 0.5–1 см, что менее 5% от минимальной исследуемой дистанции и потому не может приводить к столь драматическим изменениям огибающей функции Txy, которые наблюдаются на рис. 5–7!
Поскольку скорость распространения поверхностных волн по стенке грудной клетки для высокочастотного диапазона неизвестна, возникает вопрос, не связаны ли наблюдаемые приходы с этим механизмом звукопроведения. Однако в этом случае также не должно быть таких значимых изменений между вдохом и выдохом, которые наблюдаются на большинстве оппозитных трасс, например, рис. 5–7.
МОДЕЛЬНЫЕ ОБОБЩЕНИЯ
Итак, нами экспериментально установлено низкоскоростное звукопроведение в обоих диапазонах частот, наиболее вероятно, осуществляемое посредством продольных звуковых волн. Возникает вопрос, какой механизм может объяснить распространение продольных звуковых волн в обоих диапазонах частот 80–1000 Гц и 10–19 кГц с близкими скоростями?
Что касается модели Био [11], то оценок для высокочастотного диапазона 10–19 кГц не имеется. Если, используя модель “эффективной среды”, применить известную формулу Миннаерта [19] для водоподобной среды с пузырьками, то резонансная частота пузырьков воздуха в воде определяется как f = 3.26/r, где r – радиус пузырька. При радиусе легочных альвеол r = 0.1–0.15 мм, получаем резонансную частоту f = 22–33 кГц. Таким образом, и низкочастотный 80–1000 Гц, и высокочастотный 10–19 кГц диапазоны проведения звука в легких лежат заметно ниже фундаментального резонанса альвеол. Следовательно, в обоих частотных диапазонах скорость звука должна определяться податливостью воздуха в альвеолах и плотностью тканей стенки альвеол. Таким образом, в обоих частотных диапазонах скорости звука через нормально заполненную воздухом паренхиму легких должны быть достаточно близки. Это действительно и наблюдается по результатам приведенных измерений при зондировании с поверхности грудной клетки, где для низкоскоростных приходов получены скорости 50–150 м/с в высокочастотном диапазоне 10–19 кГц, а в низкочастотном диапазоне 80–1000 Гц – скорости 15–50 м/с. Последние значения, кстати, хорошо согласуются с независимыми результатами [5].
Однако в этом случае закономерен вопрос, почему продольные звуковые волны не распространяются в паренхиме легких в полосе частот 1–10 кГц [6], находящейся между диапазонами 80–1000 Гц и 10–19 кГц, где звукопроведение можно полагать доказанным?
ЗАКЛЮЧЕНИЕ
В низкочастотном диапазоне 80–1000 Гц установлено преимущественное проведение к поверхности грудной клетки через паренхиму легких продольных, а не сдвиговых волн со скоростями распространения от 100 (через рот) до 15 м/с. При зондировании через рот для первых 2–3 приходов зондирующего сигнала выявлена значимая разница эффективных углов падения фронта продольной волны зондирующего сигнала на поверхность грудной клетки, подтверждающая ранее сформулированные представления о воздушно-структурном и структурном механизмах проведения звука из просвета бронхиального дерева на стенку грудной клетки [7, 8, 5 ]. При зондировании с поверхности грудной клетки виброизлучателем из надключичной области наблюдаются 2 более низкоскоростных прихода (от 50 до 15 м/с), эффективные углы падения которых по вертикали намного больше, чем для первого прихода при зондировании через рот, что свидетельствует о структурном звукопроведении от точечного источника, образованного штампом виброизлучателя.
При зондировании виброизлучателем с поверхности грудной клетки в высокочастотном диапазоне 10–19 кГц установлено существование низкоскоростных приходов со скоростями распространения 50–150 м/с, трактуемых как результат распространения продольной звуковой волны преимущественно по паренхиме легких, и наличие высокоскоростных приходов со скоростями 150–1000 м/с, связываемых с распространением продольной волны по плотным тканям грудной клетки. Вывлена зависимость соотношения амплитуд пиков низкоскоростных и высокоскоростных приходов от воздухонаполнения паренхимы легких. Выполнены оценки, показывающие, что низкоскоростные приходы звуковой волны могут обеспечить пространственное разрешение порядка первых единиц сантиметров при выявлении отличающихся по акустическим свойствам участков в паренхиме легких.
Возможность существования низкоскоростного распространения продольных звуковых волн в обоих исследованных диапазонах частот укладывается в модель “эффективной” водоподобной среды с микропузырьками воздуха, частота фундаментального резонанса легочных альвеол в которой, оцененная по формуле Миннаерта [17], составляет 23–33 кГц.
Полученные результаты существенно расширяют феноменологию распространения звуковых волн в легких человека и кажутся многообещающими в плане перспектив создания альтернативной акустической визуализации паренхимы легких в медицинских целях.
Исследование низкочастотного звукопроведения в легких человека выполнено при поддержке НИР № 0271-2019-0010 по Программе фундаментальных научных исследований государственных академий наук на 2019-2021 гг. (регистрационный номер: АААА-А20-120031890011-8). Исследование высокочастотного звукопроведения и акустическое моделирование для обоих диапазонов частот выполнены при поддержке гранта РФФИ 16-08-00075-а.
Список литературы
Дьяченко А.И., Михайловская А.Н. Респираторная акустика (обзор) // Труды ИОФАН. 2012. Т. 68. С. 136–181.
Peng Y., Dai Z., Mansy H., Sandler R., Balk A., Royston T. Sound transmission in the chest under surface excitation: an experimental and computational study with diagnostic applications // Med. Biol. Eng. Comp. 2014. V. 52. № 8. P. 695–706.
Коренбаум В.И., Тагильцев А.А., Кулаков Ю.В. Особенности передачи звука голоса человека на стенку грудной клетки // Акуст. журн. 1998. Т. 44. № 3. С. 380–390.
Henry B., Royston T.J. A multiscale analytical model of bronchial airway acoustics // J. Acoust. Soc. Am. 2017. V. 142. № 4. P. 1774–1783.
Korenbaum V., Shiriaev A. Sound propagation through human lungs, under transmission sounding with acoustic signal of 80–1000 Hz frequency band // Proc. of Meetings on Acoustics (POMA). 2015. V. 23. № 1. P. 020002.
Rueter D., Hauber H., Droeman D., Zabel P., Uhlig S. Low-frequency ultrasound permeates the human thorax and lung: a novel approach to non-invasive monitoring // Ultraschall in der Medizin-European J. of Ultrasound. 2010. V. 31. № 1. P. 53–62.
Коренбаум В.И., Нужденко А.В., Тагильцев А.А., Костив А.Е. Исследование прохождения сложных звуковых сигналов в дыхательной системе человека // Акуст. журн. 2010. Т. 56. № 4. С. 537–544.
Коренбаум В.И., Дьяченко А.И., Нужденко А.В., Лопаткин Н.С., Тагильцев А.А., Костив А.Е. Прохождение сложных звуковых сигналов в дыхательной системе человека в зависимости от скорости звука в используемой газовой смеси // Акуст. журн. 2011. Т. 57. № 6. С. 854–861.
Korenbaum V., Shiryaev A., Tagiltsev A., Kamenev S. Features of 10–19 kHz sound propagation through human lungs // 26-th Congress of the European Federation of Societies for Ultrasound in Medicine and Biology. 2014. P. 66.
Paciej R., Vyshedskiy A., Shane J., Murphy R. Transpulmonary speed of sound input into the supraclavicular space // J. Appl. Physiol. 2003. V. 94. P. 604–611.
Dai Z., Peng Y., Mansy H., Sandler R., Royston T. Poro-visco-elastic modeling of mechanical wave motion in the lungs // J. Vib. Acoust. 2014. V. 136. № 051012–1.
Коренбаум В.И., Тагильцев А.А., Горовой С.В., Ширяев А.Д., Костив А.Е. О дальнометрии источников свистящих дыхательных звуков в легких человека при интенсиметрической обработке сигналов, зарегистрированных на поверхности грудной клетки // Акуст. журн. 2016. Т. 62. № 5. С. 600–608.
Коренбаум В.И., Тагильцев А.А., Дьяченко А.И., Костив А.Е. Сравнение характеристик акустических датчиков различных типов при регистрации дыхательных звуков на поверхности грудной клетки человека // Акуст. журн. 2013. Т. 59. №. 4. С. 530–538.
Ляпунов В.Т., Лавендел Э.Э., Шляпочников С.А. Резиновые виброизоляторы. Л.: Судостроение, 1988. 216 с. С. 10–33.
Гордиенко В.А. Векторно-фазовые методы в акустике. М.: ФИЗМАТЛИТ, 2007. 480 с.
Антонец В.А., Аксенова Р.Х., Казаков В.В. Измерение колебаний на поверхности мягких тканей. Методы вибрационной диагностики реологических характеристик мягких биологических тканей. Горький: ИПФ АН СССР, 1990. С. 7–17.
Коренбаум В.И., Тагильцев А.А., Костив А.Е., Ширяев А.Д. Аппаратно-программный комплекс для многоканального исследования распространения звуковых колебаний в дыхательной системе человека // Приборы и техника эксперимента. 2013. № 6. С. 82–87.
Dyachenko A., Mikhailovskaya A., Semenov Yu., Timanin E., Vasiliev V. Elastic waves propagation on the surface of the human chest wall // IFMBE Proceedings. 2013. V. 39. P. 238–241.
Minnaert M. On musical air-bubbles and the sound of running water // Philosophical Magazine. 1933. № 16 (104). P. 235–248.
Дополнительные материалы отсутствуют.
Инструменты
Акустический журнал


