Акустический журнал, 2020, T. 66, № 5, стр. 556-562
Частотно-временной анализ звуков второго тона сердца для оценки давления в легочной артерии
В. Г. Андреев a, *, В. В. Грамович c, М. В. Красикова a, b, А. И. Корольков a, О. Н. Выборов c, Н. М. Данилов c, Т. В. Мартынюк c, О. В. Родненков c, О. В. Руденко a
a Московский государственный университет имени М.В. Ломоносова, физический факультет, кафедра акустики
119991 Москва, Россия
b Университет ИТМО, физико-технический факультет
197101 Санкт-Петербург, Россия
c ФГБУ “НМИЦ кардиологии” Минздрава РФ
121552 Москва, Россия
* E-mail: andreev@acs366.phys.msu.ru
Поступила в редакцию 21.04.2020
После доработки 21.04.2020
Принята к публикации 28.04.2020
Аннотация
Предложен способ неинвазивной оценки давления в легочной артерии, основанный на выделении аортальной и легочной компонент звука второго тона сердца S2 и определении времени задержки между ними. Алгоритм выделения аортальной и легочной компонент основан на преобразовании Вигнера–Вилла. Проведен анализ фонокардиограмм 96 пациентов с легочной гипертензией (ЛГ), записанных врачами ФГБУ “НМИЦ кардиологии” с помощью оригинального комплекта аппаратуры. Сигналы S2 удалось разделить на компоненты и определить задержки между ними у 53 пациентов с ЛГ. Построена зависимость задержек между компонентами от величины давления в легочной артерии (ДЛА), измеренной методом катетеризации правых отделов сердца (КПОС). Для семи пациентов с легочной гипертензией полученные зависимости были использованы для предсказания величины ДЛА по измеренной временной задержке. Для пяти пациентов коэффициент детерминации предсказанных значений ДЛА составил 0.83, что свидетельствует о достаточно хорошей корреляции с измерениями методом КПОС.
ВВЕДЕНИЕ
Разработка методов неинвазивной диагностики легочной гипертензии (ЛГ) – заболевания, сопровождающегося стойким повышением среднего давления (более 25 мм рт. ст.) в легочной артерии (ЛА), является актуальной проблемой современной кардиологии. В настоящее время измерение давления в легочной артерии (ДЛА) проводится только в условиях стационара обученным персоналом с применением современного оборудования. Основным методом прямого измерения давления в правых отделах сердца и легочной артерии является введение катетера через подключичную или внутреннюю яремную вену [1]. Использование данного метода в клинике сопровождается рядом ограничений и рисками возникновения осложнений. Эхокардиография (ЭхоКГ) – единственный неинвазивный метод количественной оценки ДЛА в клинике. Для его правильного применения требуется подготовленный персонал, способный корректно измерить и интерпретировать полученные данные [2]. Метод имеет ряд серьезных ограничений, связанных с особенностями его аппаратной реализации.
При аускультации сердца хорошо выслушиваются первый и второй тоны. Первый (систолический) тон возникает во время систолы при захлопывании митрального и трикуспидального клапанов и при сокращении желудочков. Он синхронизован с зубцом R на электрокардиограмме (ЭКГ). Второй (диастолический) образуется в начале диастолы (периода расслабления сердца) при захлопывании аортального и легочного клапанов; он синхронизован с зубцом T на ЭКГ (рис. 1а). При патологических состояниях можно прослушать также дополнительные (третий и четвертый) тоны сердца.
Рис. 1.
(а) – Фонокардиограмма (ФКГ) (сплошная линия) и ЭКГ (пунктирная), записанные у пациента. Импульсы S1 и S2 соответствуют первому и второму тонам сердца. Они синхронизированы соответственно с зубцами R и T на ЭКГ. (б) – Аортальная А2 и легочная P2 компоненты модельного сигнала второго тона S2 (на вставке). Компонента P2 (пунктирная линия) задержана на Δt = 30 мс относительно А2.

В норме сигнал второго тона S2 содержит несколько колебаний и имеет длительность порядка 60 мс (вставка на рис. 1б). Легочная гипертензия в ряде случаев приводит к некоторой задержке времени закрытия легочного клапана Δt и расщеплению импульса на две компоненты – аортальную (A2) и легочную (P2) (рис. 1б). У таких пациентов наблюдается корреляция между длительностью задержки между компонентами S2 и величиной ДЛА [3]. Величина времени задержки Δt может варьироваться в пределах 10–70 мс. При Δt < 30 мс компоненты визуально не разделяются, и сигнал S2 выглядит как один импульс (вставка на рис. 1б). Кроме того, повышение давления в ЛА приводит к дополнительному растяжению упругих стенок сосудов и створок легочного клапана, в результате чего спектр сигнала легочной компоненты может смещаться в сторону более высоких частот [4–6]. Систематические измерения сигнала второго тона сердца свиней в зависимости от уровня ДЛА, контролируемого медикаментозно, показали, что сигналы обеих компонент имеют вид чирпированных импульсов (рис. 1б) [7, 8]. Мгновенная частота на фронте импульсов достигает значений 150–200 Гц, затем в течение первых 15–20 мс частота быстро уменьшается до значений 70–80 Гц, после чего медленно спадает до уровня 35–40 Гц. Такое поведение частоты соответствует теоретической модели, где легочный клапан, моделируемый упругой натянутой мембраной в жидкости, возбуждался коротким импульсом, возникающим при резком закрытии клапана [5, 6].
Целью настоящей работы являлось изучение возможности оценки величины ДЛА путем регистрации сигнала второго сердечного тона S2, выделения аортальной и легочной компонент и построения корреляционной зависимости времени задержки между компонентами от ДЛА, измеренного на ограниченной выборке пациентов с легочной гипертензией. Полученная таким образом корреляционная зависимость использовалась для предсказания величины ДЛА у пациентов, не входящих в указанную выборку и сравнения предсказанных значений с измеренными методом катетеризации правых отделов сердца (КПОС).
МЕТОДИКА ИЗМЕРЕНИЯ ФКГ И ЭКГ В КЛИНИКЕ
Регистрация сигналов ФКГ и ЭКГ проводилась врачами ФГБУ “НМИЦ кардиологии” у пациентов с ЛГ различной степени тяжести. Для записи сигналов был разработан и создан комплекс аппаратуры, на использование которого в условиях клиники было получено разрешение Этического комитета кардиоцентра. В соответствии с общепринятыми правилами проведения биомедицинских исследований, у всех пациентов было получено письменное информированное согласие на участие в настоящем исследовании. Сигналы тонов сердца записывались у пациентов в день проведения КПОС, а в ряде случаев непосредственно в рентгеноперационной при проведении КПОС.
В качестве приемника акустических сигналов использовался медицинский стетоскоп с мембраной, которая соединялась штатным звукопроводом с микрофоном. Сигнал микрофона усиливался и поступал на один из входов USB осциллографа (Picoscope). На второй вход осциллографа подавался сигнал ЭКГ, модуль которого находился в одном корпусе с микрофоном. Оцифрованные сигналы ФКГ и ЭКГ с выхода осциллографа поступали на персональный компьютер для записи и последующей обработки. Сигналы ФКГ регистрировались в четырех положениях на грудине на выдохе при задержке дыхания. Длительность записи ФКГ составляла 12–15 с и содержала около 10 полных сердечных циклов, которые в дальнейшем обрабатывались. Точка выслушивания легочного клапана (ЛК) [3], расположенная во втором межреберье слева от грудины, оказалась оптимальной для регистрации сигналов второго тона сердца.
Полоса частот сигналов второго тона лежит в пределах 20–250 Гц. Поэтому амплитудно-частотная характеристика (АЧХ) приемного тракта должна быть максимально равномерной в указанном частотном диапазоне. Измерения АЧХ мембраны стетоскопа, соединенной с микрофоном и усилителем, проводились в безэховой камере кафедры акустики физического факультета МГУ. Было показано, что чувствительность микрофона незначительно растет с увеличением частоты от 20 до 500 Гц. Наличие мембраны стетоскопа приводит к уменьшению чувствительности в области частот 20–80 Гц и повышению чувствительности в диапазоне 180–300 Гц. Такая частотная зависимость изменяет форму и спектр регистрируемых сигналов, однако в данном случае использование мембраны создает дополнительное преимущество, поскольку амплитуда сигнала на высоких частотах усиливается, а на низких частотах, где амплитуда и так достаточно велика, ослабляется.
Обработка записанных ФКГ проводилась как вручную, так и в автоматическом режиме. По записанной ЭКГ определялась длительность сердечного цикла Tс как интервал между соседними R-зубцами (рис. 1а). Считалось, что сигнал S2 начинается в момент времени, равный 0.3Tс, и соответствует T-зубцу на ЭКГ. Длительность выделяемого сигнала выбиралась равной 300 мс, что существенно превышает типичную длительность S2, однако такой интервал позволял учесть физиологические особенности пациентов. Отметим, что профили сигналов S2 от цикла к циклу заметно менялись, поэтому каждый из выделенных сигналов обрабатывался отдельно, а полученные в результате временные задержки усреднялись. Для снижения уровня высокочастотного шума применялся фильтр низких частот, пропускающий частоты ниже 500 Гц.
Сигнал второго тона S2(t) является нестационарным, поэтому для его анализа используются различные частотно-временные преобразования. Таковыми, например, являются оконное преобразование Фурье [9], вейвлет-анализ [10]. Разделение компонент сигнала второго тона целесообразно проводить с помощью преобразования Вигнера–Вилла (В–В), поскольку оно обеспечивает наилучшее разрешение в частотно-временной области для чирпированных импульсов [11, 12]:
(1)
$P(\tau ,f) = \int\limits_{ - \infty }^\infty y (\tau + {t \mathord{\left/ {\vphantom {t 2}} \right. \kern-0em} 2})y*(\tau - {t \mathord{\left/ {\vphantom {t 2}} \right. \kern-0em} 2}){{e}^{{ - j2\pi ft}}}dt,$(2)
$H(t) = \frac{1}{\pi }{\text{v}}{\text{.p}}{\text{.}}\int\limits_{ - \infty }^{ + \infty } {\frac{{{{S}_{2}}(t{\kern 1pt} ')}}{{t - t{\kern 1pt} '}}dt{\kern 1pt} '} .$Величина P(τ, f) может рассматриваться в качестве оценки плотности энергии сигнала на данной частоте в фиксированный момент времени. В спектре сигнала S2(t) высокие частоты существуют ограниченное время, не превышающее 20 мс, остальное время преобладают относительно низкие частоты 35–40 Гц. Если задержка между компонентами превышает 40 мс, то функция P(τ, f) имеет в частотно-временной области два выраженных максимума, соответствующих энергетическим центрам аортальной и легочной компонент. Длительность интервала между этими максимумами соответствует времени Δt. Для нахождения компонент при меньших задержках проводилось пропускание сигнала S2(t) через фильтры, срезающие низкие частоты. Частота среза увеличивалась последовательно с 30 до 100 Гц с шагом 5 Гц [13]. На каждом шаге фильтрации строилось преобразование В–В отфильтрованного сигнала и определялись локальные максимумы, соответствующие энергетическим центрам компонент. В ряде случаев положение одной из компонент определялось по виду преобразования В–В сигнала S2(t), построенного без фильтрации, а положение второй компоненты определялось и уточнялось по отфильтрованным сигналам. При Δt < 10 мс разделить компоненты описанным методом практически невозможно, что накладывает определенные ограничения на его использование.
На рис. 2 изображены сигналы второго тона S2, измеренные у пациента с ЛГ (рис. 2а) и у пациента с нормальным значением ДЛА (рис. 2б). У пациента с ЛГ сигнал явно разделяется на два импульса. На преобразовании В–В, построенном для этого сигнала, различимы две отдельные области, соответствующие аортальной А2 и легочной Р2 компонентам (рис. 2в). Временная задержка Δt определяется как интервал между их энергетическими центрами. Появление легочной компоненты в момент времени 70 мс хорошо видно на рис. 2в. В момент появления легочной компоненты в ее спектре присутствуют составляющие с частотами 100–120 Гц. Наличие в спектре высоких частот может являться дополнительным признаком ЛГ. Отметим, что на рис. 2в в интервале 40–70 мс видны интерференционные полосы – артефакты, связанные с нелинейностью преобразования В–В [13]. При малых задержках влияние этих артефактов становится значительным, поэтому планируется использовать сглаженное преобразование В–В [12, 14]. Однако вид временного окна и его длительность пока не оптимизированы. У пациента с нормальным значением ДЛА сигнал S2 не разделяется на компоненты независимо от фильтрации, и на преобразовании В–В присутствует только одна область (рис. 2г).
РЕЗУЛЬТАТЫ
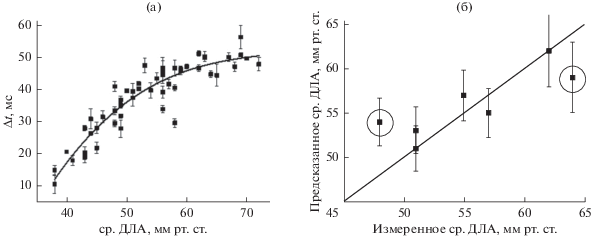
В работе была проанализирована выборка из 113 пациентов, 96 из которых с диагнозом ЛГ (85%), и у 17 (15%) ДЛА было в норме. У пациентов без ЛГ величина ДЛА, по этическим соображениям, определялась методом ЭхоКГ, а пациентам с ЛГ проводилась КПОС. Для большинства пациентов с ЛГ имеются записи временных профилей давления в различных отделах сердца, измеренные во время катетеризации. Из общего числа обследованных пациентов с диагнозом ЛГ разделить сигнал второго тона на компоненты и измерить задержку между ними удалось только у 53. Результаты измерений задержки для первых 46 пациентов были использованы для построения зависимости Δt от величины ср. ДЛА, полученной при катетеризации (символы на рис. 3а). Экспериментальная зависимость была аппроксимирована кубическим полиномом:
(3)
$\Delta t{\kern 1pt} [{\text{ms}}] = - 218 + 10.23x - 0.132{{x}^{2}} + 5.8 \times {{10}^{{ - 4}}}{{x}^{3}},$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В ряде работ [7, 8] предлагается использовать задержку, нормированную на период сердечного цикла Tc: NSI = Δt/Tc. Частота сердечных сокращений варьируется в достаточно широких пределах у различных пациентов. Даже в процессе проведения измерений ФКГ частота сердечного ритма у одного и того же пациента может изменяться в зависимости от нагрузки и эмоционального состояния. Зависимость Δt/Tc от ср. ДЛА может быть универсальной для пациентов с различной частотой сердечного цикла. В наших измерениях величина Δt/Tc варьировалась от 1 до 7% в зависимости от пациента. Такой большой диапазон (в 7 раз) приводит к растягиванию масштаба по вертикали на графике зависимости Δt/Tc от ср. ДЛА, увеличению разброса данных и уменьшению коэффициента детерминации при аппроксимации данных полиномиальной зависимостью (R2 ≈ 0.7). Поэтому было решено в качестве основного параметра оставить Δt. Возможно, что нормированная задержка Δt/Tc может быть полезна для оценки ср. ДЛА у одного и того же пациента при условии значительной вариабельности частоты его сердечного ритма.
Наряду с зависимостью Δt(ср. ДЛА) была построена и проанализирована зависимость Δt от величины систолического ДЛА (СДЛА). Вариабельность СДЛА оказалась выше, чем ср. ДЛА, что привело к дополнительному разбросу данных на графике зависимости Δt(СДЛА) и снижению коэффициента детерминации при аппроксимации данных полиномиальной зависимостью (R2 ≈ 0.65).
Зависимость Δt(ср. ДЛА) у пациентов с разделяющимися аортальной и легочной компонентами оказалась наиболее подходящей для оценки величины ср. ДЛА. Этот экспериментально установленный факт не является очевидным, поскольку основным параметром, управляющим процессом звукообразования при схлопывании створок легочного клапана, является перепад давления в правом желудочке (ПЖ) и ЛА [4–6]. Для объяснения роли именно величины ср. ДЛА можно предложить несколько механизмов. В основе формирования времени задержки лежит несинхронное сокращение и расслабление желудочков сердца вследствие повышенной нагрузки на ПЖ и вызванных ею изменений правого желудочка. Повышенная нагрузка на ПЖ определяется именно ср. ДЛА, так как этот показатель менее зависит от других параметров гемодинамики, и в большей степени определяется легочным сосудистым сопротивлением, которое, в свою очередь, отражает степень поражения (стенозирования) легочных артерий. Систолическое же давление является производной величиной не только от легочного сосудистого сопротивления, но и параметров гемодинамики (например, наполнения ПЖ, которое в свою очередь, зависит от венозного возврата, объема циркулирующей крови, податливости миокарда ПЖ, сердечного ритма и его частоты), а также сократительной функции ПЖ и податливости стенок магистральных легочных артерий. СДЛА обуславливается главным образом ударным объемом крови ПЖ, максимальной скоростью ее изгнания и растяжимостью стенок ЛА. Чем выше будут вышеуказанные параметры, тем выше будет, соответственно, величина СДЛА. Поэтому при одних и тех же значениях ср. ДЛА систолическое давление варьируется в достаточно широких пределах. Возможно, что были погрешности в определении СДЛА при катетеризации из-за дыхательной вариабельности измерений. Необходимо также учесть, что измерения ФКГ и проведение КПОС были разнесены по времени (от нескольких часов до суток), и только у нескольких пациентов они проводились одномоментно в рентгеноперационной.
Еще раз следует отметить, что предложенный метод оценки давления в ЛА может быть использован только в случае разделения сигнала второго тона сердца S2 на аортальную и легочную компоненты. Это условие является серьезным ограничением метода, поскольку только примерно у 50% обследованных пациентов эти компоненты в нашем исследовании разделились в частотно-временной области. Требуется также уточнить корреляционную зависимость Δt(ср. ДЛА) для пациентов с начальной и умеренной ЛГ, у которых ср. ДЛА лежит в диапазоне 25–45 мм рт. ст. В настоящее время ведется работа в данном направлении.
Теоретический анализ генерации колебаний, возникающих при захлопывании легочного клапана, показал, что спектр колебаний упругих стенок ЛА при их дополнительном растяжении смещается в высокочастотную область. Такое растяжение стенок может вызываться повышенным давлением крови в ЛА. Поэтому анализ спектрального состава сигнала второго тона сердца S2 и присутствие в нем высокочастотных компонент может обеспечить дополнительную информацию о величине давления в ЛА.
ЗАКЛЮЧЕНИЕ
Показано, что при условии разделения сигнала второго тона на компоненты существует достаточно хорошая корреляция между временем задержки Δt и величиной ср. ДЛА. Если время задержки изменяется в диапазоне 10–50 мс, то величину ср. ДЛА можно оценить, и она с достоверностью порядка 80% будет находиться в пределах 35–65 мм рт. ст. При времени задержки, превышающем 55 мс, значение ср. ДЛА не предсказывается; можно только предполагать, что ср. ДЛА высокое и превышает 70 мм рт. ст. Задержка Δt менее 10 мс не измеряется описанным выше методом. Следует отметить, что даже при разделении сигнала второго тона на компоненты, предсказание ср. ДЛА по измеренной задержке у ряда пациентов оказалось довольно неточным. Поэтому продолжается поиск дополнительных признаков в сигналах ФКГ, которые позволили бы повысить точность и надежность предсказания ДЛА.
Работа выполнена при финансовой поддержке РФФИ, грант № 18-02-00736.
Список литературы
Zamanian R., Waxman A.B., Maron B.A. Pulmonary Hypertension: Basic Science to Clinical Medicine // Springer. 2015. P. 371.
Шиллер Н.Б., Осипов М.А. Клиническая эхокардиография // Практика. 2005. 344 с.
Алмазов В.А., Салимьянова А.Г., Шляхто Е.В. Аускультация сердца. СПб: Издательство СПбГМУ, 1996. 458 с.
Sikarskie D.L., Stein P.D., Vable M. Mathematical model of aortic valve vibration // Mathematical Modelling in Science and Technology. Pergamon, 1984. C. 709–714.
Андреев В.Г., Грамович В.В., Выборов О.Н., Мартынюк Т.В., Родненков О.В., Руденко О.В. Ударное возбуждение звука при схлопывании створок полулунных клапанов сердца // Акуст. журн. 2019. Т. 65. № 2. С. 232–240.
Андреев В.Г., Грамович В.В., Выборов О.Н., Мартынюк Т.В., Родненков О.В., Руденко О.В. Колебания полулунного клапана, моделируемого упругой натянутой мембраной в жидкости // Акуст. журн. 2019. Т. 65. № 6. С. 647–652.
Xu J., Durand L.-G., Pibarot P. Nonlinear transient chirp signal modeling of the aortic and pulmonary components of the second heart sound // IEEE Transactions on Biomedical Engineering. 2000. V. 47. № 10. P. 1328–1335.
Xu J., Durand L.-G., Pibarot P. Extraction of the aortic and pulmonary components of the second heart sound using a nonlinear transient chirp signal model // IEEE Transactions on Biomedical Engineering. 2001. V. 48. № 3. P. 277–283.
Allen J.B., Rabiner L.R. A unified approach to short-time Fourier analysis and synthesis // Proc. IEEE. 1977. V. 65. № 11. P. 1558–1564.
Debbal S.M., Bereksi-Reguig F. Automatic measure of the split in the second cardiac sound by using the wavelet transform technique // Computers in Biology and Medicine. 2007. V. 37. P. 269–276.
Mecklenbräuker W., Hlawatsch F. The Wigner distribution: theory and applications in signal processing // Elsevier Science, 1997. P. 480.
Djebbari A., Bereksi-Reguig F. Detection of the valvular split within the second heart sound using the reassigned smoothed pseudo Wigner–Ville distribution // BioMedical Engineering OnLine. 2013. V. 12: 37. https://doi.org/10.1186/1475-925X-12-37
Лесик М.В., Корольков А.И., Андреев В.Г. Методы анализа пульмональной компоненты второго сердечного тона // Учен. зап. физ. фак-та Моск. ун-та. 2018. № 4. С. 1840703–1–1840703–8.
Barma S., Chen B., Man K.L., Wang J. Quantitative measurement of split of the second heart sound (S2) // IEEE/ACM Transactions on Computational Biology and Bioinformatics. 2015. V. 12. № 4. P. 851–860.
Дополнительные материалы отсутствуют.
Инструменты
Акустический журнал