Акустический журнал, 2021, T. 67, № 3, стр. 345-348
Исследование оптоакустических сигналов на моделях эритроцитов в жидкости с контрастными наноагентами
Д. А. Кравчук a, *, И. Б. Старченко b, Д. В. Орда-Жигулина c, К. А. Воронина a
a Федеральное государственное автономное образовательное учреждение Южный федеральный университет Институт нанотехнологий, электроники и приборостроения
347922 Таганрог, ул. Шевченко 2, Россия
b ООО Параметрика
347922 Таганрог, ул. Свободы 19/1, Россия
c Федеральное государственное бюджетное учреждение науки “Федеральный исследовательский центр
Южный научный центр Российской академии наук”
344006 Ростов-на-Дону, пр. Чехова 41, Россия
* E-mail: Kravchukda@sfedu.ru
Поступила в редакцию 26.01.2021
После доработки 28.01.2021
Принята к публикации 08.02.2021
Аннотация
Выполнено математическое моделирование эритроцитов с учетом их насыщения кислородом. Приводятся результаты экспериментального исследования формирования оптоакустического сигнала в жидкости, содержащей модели эритроцитов в виде полистирольных сфер с наночастицами. В качестве контрастных агентов использованы углеродные нанотрубки, иммобилизированные к моделям эритроцитов. Полученные профили акустических сигналов для серии лазерных импульсов позволяют сделать вывод о возможности оценок качественного и количественного состава эритроцитов в облучаемой лазером жидкости. Статья подготовлена по материалам доклада на 3-й Всероссийской акустической конференции (21–25 сентября 2020 г., г. Санкт-Петербург).
ВВЕДЕНИЕ
Важнейшей задачей исследований в области медицинской диагностики является создание и применение новых диагностических средств и методов, необходимых для своевременного диагностирования физиологических процессов. Для решения поставленной задачи можно использовать оптоакустический (ОА) эффект – термооптическое возбуждение акустических волн в жидкой среде при поглощении в ней лазерного излучения, Известно, что углеродные нанотрубки сильно поглощают лазерное излучение и при этом занимают незначительный объем. С помощью оптоакустического преобразования рассеянные сигналы можно зарегистрировать ультразвуковым преобразователем. Для проведения измерения уровня агрегации эритроцитов и их насыщения кислородом в крови удобно применять неинвазивные методики исследования, которые можно получить при использовании оптоакустического эффекта.
Существуют многочисленные возможности исследования гематологического состава in vitro, однако больший интерес представляет неинвазивный анализ как удобный метод, не меняющий морфологический состав крови. Для усиления сигнала эффективно использование наноразмерных агентов. Углеродные нанотрубки, размером до 100 нм, сильно поглощают лазерное излучение. Это позволяет применять лазеры малой мощности для исключения нанесения вреда кожному покрову [1].
Оптоакустическая проточная цитометрия in vivo имеет большой клинический потенциал для ранней неинвазивной диагностики рака, инфекций (малярии и бактериемии), серповидной анемии и сердечно-сосудистых заболеваний [2–5]. Для клинического применения эта диагностическая платформа все еще требует проведения ряда исследований.
В работе [6], целью которой было математическое моделирование, описывающее формирование ОА сигнала от модели эритроцита как сферического источника поглощения, авторы пришли к выводу, что амплитуда ОА сигнала монотонно возрастает с увеличением концентрации эритроцитов, что делает возможным определение уровня гемоглобина. Предлагается использовать оптоакустический эффект для установления степени агрегации эритроцитов.
Для обнаружения внутриэритроцитарных вирусов (малярии) предлагается использование углеродных нанотрубок в качестве контрастных агентов. Их размеры (до 0.1 мкм) сопоставимы с размерами вирусов (0.02–0.3 мкм). К тому же углеродные нанотрубки биодеградируемы и обладают качественной адгезией к поверхности вирусов [6–8]. Однако, встречается мнение, что углеродные нанотрубки токсичны [9, 10], но возможно использование преимуществ других контрастных наноагентов в анализах in vitro, поскольку они являются основой терапии при лечении раковых заболеваний.
Модели оксигенированных эритроцитов и их распределение в крови построены с помощью метода Монте‑Карло. Целью работы является моделирование эритроцитов и формирование ими акустических сигналов в результате оптоакустического эффекта. В этом случае биологическая ткань облучается короткими лазерными импульсами (с длительностью несколько наносекунд). Оптические и термоупругие свойства ткани, в которой поглощается лазерное излучение, исследуются путем регистрации акустического сигнала с использованием ультразвуковых преобразователей.
МОДЕЛИРОВАНИЕ
Для решения поставленных задач предлагается использование методов обработки сигналов, системного анализа, математической статистики. При математическом моделировании в качестве инструментария используется среда Matlab R2014b.
Аналитическое выражение акустического поля, формируемого жидкой сферой, можно записать в следующем виде [11]:
(1)
$\begin{gathered} p_{f}^{1}\left( q \right) = \frac{{i\mu \beta {{I}_{0}}{{\nu }}_{{\text{s}}}^{{}}{{\alpha }^{2}}}}{{{{C}_{p}}r}} \times \\ \times \,\,\frac{{\left[ {\sin q - q\cos q} \right]{{e}^{{i{{k}_{f}}\left( {r - \alpha } \right)}}}}}{{{{q}^{2}}\left[ {\left( {1 - q} \right)\left( {\frac{{\sin q}}{q}} \right) - \cos q + i\rho \nu \sin q} \right]}}~, \\ \end{gathered} $Рис. 1.
(а) – Два вида источников акустического сигнала (красные (темные) ‑ оксигенированные эритроциты, а голубые (серые) круги – дезоксигенированные эритроциты); (б) – агрегированные эритроциты (2 агрегата).
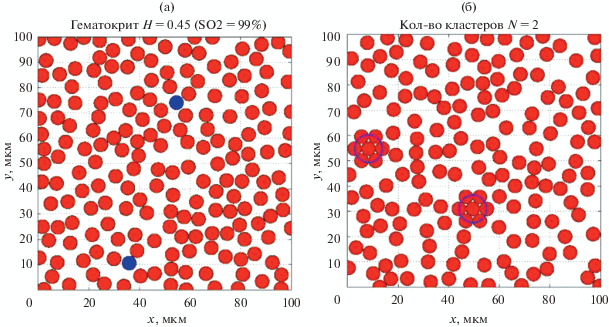
Математическое моделирование оксигенированных и дезоксигенированных эритроцитов заключается в нескольких этапах: формирование трехмерной реализации тканей с условием неперекрытия сфер, представляющих собой моделируемые эритроциты. Моделирование проводится с помощью программной среды Matlab и метода Монте‑Карло. Размер объема моделирования был взят 100 × 100 × 100 мкм. Этот объем заполняется эритроцитами, аппроксимированными в виде жидкостных сфер с уровнем гематокрита 40% [7]. Аналогичным образом формируем ткани с агрегированными эритроцитами. Модель позволяет формировать эритроциты в агрегаты с различной степенью заполнения.
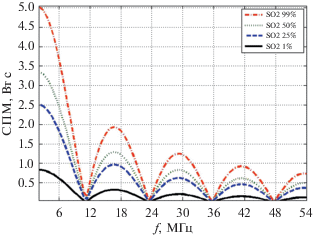
На рис. 2 показаны спектральные плотности мощности акустического сигнала при 1, 25, 50 и 99% кислородонасыщения крови для лазерного излучения с длиной волны 1064 нм. По мере увеличения насыщения кислородом (SO2) спектральная мощность сигнала также увеличивалась.
РЕЗУЛЬТАТЫ
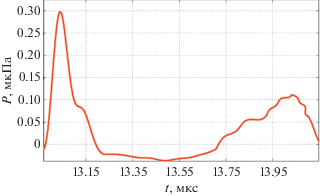
Разработанные теоретические модели были проверены экспериментально с помощью лазерной установки LIMO 100-532/1064-U [12–14] с длительной импульса 84 нс. Моделируемые эритроциты выполнены из полистирольных микросфер с соответствующими формами и размерами эритроцитов. На рис. 3 показаны модельные эритроциты из полистирольных микросфер. Как правило, свойства тканевого поглотителя являются важными при моделировании. Кроме того, для оптоакустической системы поглотители должны иметь хорошо известные, универсальные и стабильные тепловые и акустические параметры, аналогичные параметрам биоткани при оптоакустической томографии [15–19]. Изображения получены с помощью растрового микроскопа Nova Nanolab 600.
В результате эксперимента зарегистрирован акустический сигнал (рис. 4), сформированный в натрий-фосфатном растворе с наночастицами углерода, заполненном полистирольными сферами на 45%. Регистрация сигнала проводилась с помощью пьезоэлектрического преобразователя, запись производилась с помощью модульного измерительного комплекса NI PXI 1042Q на базе LabVIEW.
ЗАКЛЮЧЕНИЕ
Разработан алгоритм моделирования реализаций тканей, состоящих из оксигенированных и дезоксигенированных эритроцитов в среде Matlab на основе алгоритма Монте‑Карло. Рассчитаны спектральные плотности мощности акустического сигнала, возбужденного лазерным излучением с длиной волны 1064 нм при 1, 25, 50 и 99% насыщения эритроцитов кислородом. Установлено, что при увеличении насыщения кислородом моделируемых эритроцитов с 1 до 99%, спектральная плотность мощности акустического сигнала увеличивается в 6 раз. Это позволяет сделать вывод о возможности регистрации уровня насыщения кислородом эритроцитов в крови оптоакустическим методом.
Список литературы
Джуплина Г.Ю., Старченко И.Б. Система и методика исследования наноразмерных артефактов в кровотоке // Известия ЮФУ. Технические науки. 2010. № 8(10). С. 61–64.
Tuchin V.V., Tárnok A., Zharov V.P. In vivo flow cytometry: a horizon of opportunities // Cytometry. 2011. V. A79(10). P. 737–745.
Galanzha E.I., Zharov V.P. Photoacoustic flow cytometry // Methods. 2012. V. 57(3). P. 280–296.
Galanzha E.I., Zharov V.P. Circulating tumor cell detection and capture by photoacoustic flow cytometry in vivo and ex vivo // Cancers (Basel). 2013. V. 5(4). P. 1691–1738.
Cai C., Carey K.A., Nedosekin D.A., Menyaev Y.A., Sarimollaoglu M., Proskurnin M.A., Zharov V.P. In vivo photoacoustic flow cytometry for early malaria diagnosis // Cytometry. 2016. V. A89(6). P. 531–542.
Кравчук Д.А., Старченко И.Б. Исследование генерации оптоакустического сигнала на рассеивателях различной формы для диагностики клеток методом проточнoй цитометрии in vivo // Прикаспийский журнал: управление и высокие технологии. 2017. № 4(40). С. 174–183.
Kravchuk D.A. Mathematical model of detection of intra-erythrocyte pathologies using optoacoustic method // Biomedical Photonics. 2018. T. 7. № 3. P. 36–42.
Кравчук Д.А., Старченко И.Б. Теоретическая модель для диагностики эффекта кислородонасыщения эритроцитов с помощью оптоакустических сигналов // Прикладная физика. 2018. № 4. С. 89–94.
Митрофанова И.В., Мильто И.В., Суходоло И.В. Возможности биомедицинского применения углеродных нанотрубок // Бюллетень сибирской медицины. 2014. Т. 13. № 1. С. 135–144.
Саяпина Н.В., Сергиевич А.А., Баталова Т.А., Новиков М.А., Асадчева А.Н., Чайка В.В., Голохваст К.С. Экологическая и токсикологическая опасность углеродных нанотрубок: обзор российских публикаций // Известия Самарского научного центра Российской академии наук. 2014. Т. 16. № 5(2). С. 949–953.
Diebold G.J. // Photoacoustic imaging and spectroscopy. Ed. Wang L.V. Taylor and Francis Group. LLC. 2009. Ch. 1. P. 3–17.
Kravchuk D.A. Simulation of acoustic signals with an optoacoustic effect for the detection of red blood cells of various shapes by a laser cytometer // Applied Physics. 2019. № 5. P. 93–99.
Kravchuk D.A. Experimental studies on the excitation and registration of an optoacoustic signal in a liquid // IEEE Int. Siberian Conf. on Control and Communications (SIBCON-2019). 2019. Art. № 8729639.
Starchenko I.B., Kravchuk D.A., Kirichenko I.A. An optoacoustic laser cytometer prototype // Biomedical Engineering. 2018. V. 51. №. 5. P. 308–312.
Nedosekin D.A., Fahmi T., Nima Z.A. Photoacoustic in vitro flow cytometry for nanomaterial research // Photoacoustics. 2017. № 6. P. 16–25.
Fonseca M., Zeqiri B., Beard P.C. Characterisation of a phantom for multiwavelength quantitative photoacoustic imaging // Phys. Med. Biol. 2016. V. 61(13). P. 4950–4973.
Fonseca M., Zeqiri B., Beard P. Characterisation of a PVCP based tissue-mimicking phantom for Quantitative Photoacoustic Imaging // Proc. SPIE. Int. Soc. Opt. Eng. 2015. Art. № 9539, 953911.
Егерев С.В., Овчинников О.Б., Фокин А.В. Оптоакустическое преобразование в суспензиях: конкуренция механизмов и статистические характеристики // Акуст. журн. 2005. Т. 57. № 2. С. 204–277.
Бычков А.С., Черепецкая Е.Б., Карабутов А.А., Макаров В.А. Улучшение пространственного разрешения изображения в оптоакустической томографии с помощью конфокальной антенны // Акуст. журн. 2018. Т. 64. № 1. С. 71–77.
Дополнительные материалы отсутствуют.
Инструменты
Акустический журнал