Журнал аналитической химии, 2019, T. 74, № 1, стр. 67-80
Новые подходы к определению и групповой идентификации физиологически активных соединений в растительных материалах и коммерческой продукции методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированиемА. Н. Ставрианиди, Т. М. Байгильдиев, Е. А. Стекольщикова, О. А. Шпигун, И. А. Родин
А. Н. Ставрианиди 1, *, Т. М. Байгильдиев 1, Е. А. Стекольщикова 1, О. А. Шпигун 1, И. А. Родин 1
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: stavrianidi.andrey@analyt.chem.msu.ru
Поступила в редакцию 26.02.2018
После доработки 20.07.2018
Принята к публикации 20.07.2018
Аннотация
Обзор разработанных авторами способов целевого определения физиологически активных компонентов различных растений – розавина, розарина, салидрозида из растения Rhodiola rosea, гинсенозидов Rb1, Rg1, Rf и Re из азиатского женьшения Panax ginseng, псевдогинсенозидов F11 и RT5 из американского женьшеня P. quinquefolius, салидрозида А и салидрозида В из семян Schisandra chinensis, байкалина, байкалеина, вогонина и скутелларина из корня шлемника байкальского Scutellariae baicalensis, глицирризина из корня солодки Glycyrrhiza glabra. Рассматриваются также способы индивидуальной и групповой идентификации широкого круга сапонинов, содержащихся в растениях рода Panax, листьях четочника молитвенного Abrus precatorius L. и корне солодки Glycyrrhiza glabra; способы оценки количества протодиосцина, диосцина и диосгенина в надземных частях растения T. terrestris, а также широкого круга гинсенозидов в различной продукции на основе женьшеня с применением метода количественного анализа многокомпонентной системы. Разработанные способы отличаются простотой, достоверностью, оригинальностью и могут быть использованы для контроля качества широкого круга растительной продукции.
Обнаружение и определение физиологически активных компонентов в различных лекарственных средствах и пищевых добавках – сложная и чрезвычайно актуальная задача, требующая использования современных высокоинформативных методов исследования. В мире ежегодно увеличивается число новых лекарственных препаратов, пищевых добавок, различных средств традиционной медицины (ТМ), которые не всегда проходят тщательную проверку на предмет фальсификации и часто могут не только не оказывать положительного или лечебного воздействия на потребителя, но и приносить значительный вред его здоровью. Различают подходы, направленные на обнаружение и определение нескольких выбранных заранее целевых аналитов, и более сложные способы обнаружения и идентификации групп неизвестных веществ, близких по структуре. Одним из наиболее мощных и универсальных способов определения целевых соединений и исследования структуры неизвестных веществ является метод жидкостной хромато-масс-спектрометрии (ЖХ–МС), сочетающий возможности высокочувствительного определения в режиме тандемной масс-спектрометрии, высокоселективного разделения исследуемых смесей, а также идентификации неизвестных веществ.
Для целевого определения небольшого круга маркерных соединений растений на следовом уровне применяют жидкостную тандемную хромато-масс-спектрометрию и режим мониторинга выбранных реакций. Для достижения высокой чувствительности детектирования в режиме мониторинга выбранных реакций необходимо применение “мягких” методов ионизации, а также получение масс-спектров стандартных образцов для выбора характеристичных ионов для каждого определяемого соединения. В растениях, содержащих большое количество маркерных соединений, целевой подход уступает место способу групповой идентификации соединений, который позволяет не только более полно охарактеризовать исследуемые объекты, но и провести групповой количественный анализ без привлечения большого количества стандартных образцов. Для этого получают масс-спектры группы соединений, имеющие характерную совокупность ионов и близкие пути фрагментации, что позволяет собрать информацию о структуре компонентов и относить хроматографические пики к этой группе соединений. Такие гибридные методы анализа предполагают обработку большого массива масс-спектральной информации, которую не всегда удается автоматизировать. В жидкостной хромато-масс-спектрометрии для целей идентификации не хватает качественных электронных библиотек и баз данных, содержащих информацию о масс-спектрометрическом поведении физиологически активных компонентов растительного сырья. В отсутствие таких универсальных библиотек детальные исследования путей фрагментации и разработка подходов для групповой ВЭЖХ–МС/МС-идентификации этих веществ позволят расширить круг определяемых компонентов пищевых продуктов и лекарственных средств на основе растений. Важной стадией как целевого, так и группового анализа также является изучение этапов экстрагирования и выделения определяемых соединений, не разрушающих их структуру и обеспечивающих достижение высоких степеней извлечения из анализируемых объектов.
В данной работе описаны способы целевого определения широкого круга физиологически активных компонентов в растительных материалах, оригинальные способы групповой идентификации нескольких классов физиологически активных компонентов, способы определения физиологически активных компонентов методом количественного анализа многокомпонентной системы (КАМС), а также другие способы анализа состава растительной продукции.
ЦЕЛЕВОЕ ОПРЕДЕЛЕНИЕ ФИЗИОЛОГИЧЕСКИ АКТИВНЫХ КОМПОНЕНТОВ РАСТЕНИЙ
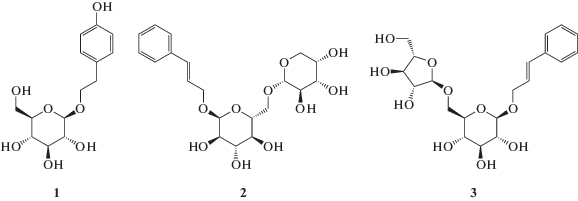
Развитие современной медицинской науки неразрывно связано с созданием новых лекарственных средств. Одним из путей создания новых эффективных препаратов является тщательное исследование химического состава лекарственных растений, находящих широкое применение в лечебной практике. Так, например, в состав Rhodiola rosea входят такие физиологически активные вещества, как салидрозид, розавин и розарин [1]. Первоначально качество препаратов с экстрактами из Rhodiola rosea определяли по количеству содержащегося в них салидрозида. Однако позже выяснили, что салидрозид является общим соединением для целого семейства растений [2], поэтому стали определять качество данных препаратов по концентрации в них розавина и розарина, близких по свойствам салидрозиду. Салидрозид, розавин и розарин – природные анксиолитики (антидепрессанты), их суммарное содержание в корневище родиолы розовой может достигать нескольких процентов. Структурные формулы салидрозида, розавина и розарина представлены на схеме 1 .
Схема 1 . Структурные формулы салидрозида (1), розавина (2) и розарина (3) [3].
С использованием метода жидкостной хромато-масс-спектрометрии нами разработан способ одновременного определение салидрозида, розавина и розарина в экстрактах из корневища Rhodiola rosea [3]. Пределы обнаружения (нг/мл) составили 2 для салидрозида, 4 для розавина и 6 для розарина. Предложенный подход апробировали при анализе экстрактов из корневища Rhodiola rosea. Для анализа растительных экстрактов использовали обращенно-фазовый вариант хроматографии на сорбенте с привитыми группами SB-С18. Детектирование осуществляли методом тандемной масс-спектрометрии с ионизацией электрораспылением в режиме мониторинга выбранных реакций для отрицательных ионов. Для определения использовали следующие выбранные реакции: m/z 427 → m/z 293 (определение), m/z 427 → m/z 249 (качественное подтверждение) для розарина; m/z 427 → m/z 294 (определение), m/z 427 → m/z 149 (качественное подтверждение) для розавина; m/z 299 → m/z 119 (определение), m/z 299 → m/z 89 (качественное подтверждение) для салидрозида. Преимуществами разработанного способа анализа являются его высокие достоверность и правильность, что позволяет использовать его в качестве референтного.
Женьшеневые сапонины (гинсенозиды) являются основными действующими веществами растений рода Panax. Эти растения активно используют в производстве средств ТМ в Китае, Корее, Японии, США и на Дальнем Востоке. В настоящее время женьшень применяют как биологически активную добавку, общеукрепляющее средство, повышающее сопротивляемость организма к физическому, химическому и биологическому стрессу [4, 5]. Кроме того, показано, что препараты, содержащие женьшень, эффективны в качестве лекарственных средств, в частности, они обладают противораковой активностью [6, 7]. На данный момент более 620 гинсенозидов выделено из растения рода Panax [8]. Молекула любого гинсенозида состоит из основания (сапогенина) и углеводных боковых цепей, которые в свою очередь также могут иметь заместители более простой структуры. Наиболее распространены гинсенозиды с протопанаксатриольными (ППТ), протопанаксадиольными (ППД), окотиллольными (ОТ) и олеаноловым кислотным (ОАК) сапогенинами. На протяжении последних 50 лет многие исследователи разрабатывали методы идентификации и определения гинсенозидов в растительных материалах, экстрактах и коммерческих продуктах. Гинсенозиды разделяли с помощью газовой хроматографии, тонкослойной хроматографии и ВЭЖХ. Для ВЭЖХ-определения гинсенозидов применяли спектрофотометрическое и флуоресцентное детектирование, а позднее детектирование по светорассеянию и масс-спектрометрию. Наиболее поздние варианты экстрагирования и способы определения гинсенозидов рассмотрены нами в обзоре [9] c критической оценкой результатов.
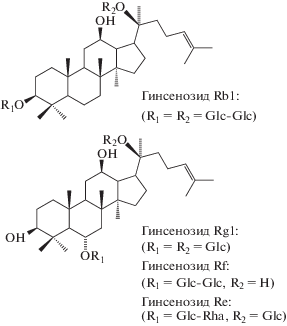
Нами разработан способ одновременного определения гинсенозидов в экстрактах из растительного сырья и продуктах на их основе [10]. Применимость данного способа подтверждена при определении четырех основных гинсенозидов Rg1, Rb1, Rf и Re (схема 2 ) в образцах корней азиатского женьшеня (Panax ginseng), фитопродукте и чае на его основе.
Схема 2 . Структурные формулы гинсенозидов Rb1, Rg1, Rf и Re [10].
Для оценки содержания в смеси или образце гинсенозидов с ППТ-сапогенинoм, например Rg1, Rf и Re, использовали ионы с m/z 459.4, 441.4, 423.4 и 405.5, а для гинсенозидов с ППД-сапогенинoм, например Rb1, использовали ионы с m/z 443.4, 425.4 и 407.5. Эти наборы ионов, паттерны фрагментации, являются не только характеристичными для наиболее распространенных [8] указанных гинсенозидов, но и самыми интенсивными (рис. 1).
Рис. 1.
Масс-спектр гинсенозида Rg1, полученный в режиме сканирования на гибридной линейной ионной ловушке [10].
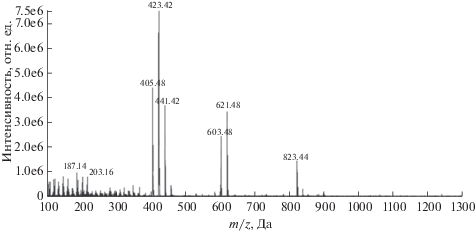
Интенсивности выбранных ионов близки, и все они соответствуют сапогенину с потерей некоторого числа молекул воды, поэтому суммирование интенсивностей данных сигналов гарантирует получение лучших пределов обнаружения, независимо от изменений условий выполнения анализа. Количественный анализ проводили в двух режимах. Для Rb1, Rg1, Rf и Re в режиме сканирования по сумме интенсивностей выбранных сигналов достигнуты пределы обнаружения 10, 6, 3 и 9 нг/мл, в режиме мониторинга выбранных ионов – 6, 6, 1 и 3 нг/мл соответственно. Сравнивать чувствительность определения данных соединений по сумме интенсивностей выбранных сигналов в водных растворах в упомянутом выше режиме сканирования и в режиме мониторинга тех же выбранных сигналов по значению коэффициента чувствительности некорректно из-за разных условий получения аналитического сигнала в данных режимах, однако из полученных пределов обнаружения можно заключить, что разница между этими способами определения незначительна, а использование режима сканирования, при котором третий квадруполь работает в качестве линейной ионной ловушки (ЛИЛ), позволяет не только определять гинсенозиды с достаточной чувствительностью, но и одновременно идентифицировать их. Попытки повысить чувствительность определения данных веществ, используя режим мониторинга выбранных реакций, не привели к успеху, так как не удалось получить достаточно интенсивные сигналы, соответствующие протонированным или депротонированным молекулам гинсенозидов, из-за легкости протекания их фрагментации в источнике ионов масс-спектрометра. Для апробации разработанного способа определения гинсенозидов проанализировали образцы экстрактов из свежего и высушенного корней растения Panax ginseng, корейского чая на основе женьшеня и очищенного фитопродукта неизвестного состава, в которых успешно обнаружили и определили гинсенозиды Rb1, Rg1, Rf и Re.
Связь положительного влияния на организм человека и животных некоторых продуктов растительного происхождения напрямую связана с содержанием в них индивидуальных физиологически активных компонентов. Положительное влияние может оказывать как группа соединений, так и отдельные вещества. Задача идентификации отдельных компонентов растительной продукции является очень важной и актуальной, так как в дальнейшем могут быть созданы препараты и лекарства на основе только действующих компонентов растительной продукции.
Нами разработан способ быстрой идентификации гинсенозидов, содержащихся в корейском женьшеневом чае методом ВЭЖХ–МС с использованием ЛИЛ [11]. Гинсенозиды экстрагировали из корейского женьшеневого чая в ультразвуковой ванне 40%-ным (по объему) раствором этанола в воде в течение 30 мин. Разделение смеси стандартов гинсенозидов и экстракта проходит за 30 мин на обращенно-фазовой колонке в режиме градиентного элюирования. В качестве подвижной фазы использовали 0.1%-ную муравьиную кислоту в воде и ацетонитрил. При анализе 8 стандартных растворов гинсенозидов (Rb1, Re, Rg1, Rf, Rd, Rb2, Rb3 и Rc) обнаружено, что в условиях электрораспылительной ионизации гинсенозиды образуют катионированные молекулы [M + Na]+ в режиме регистрации положительно заряженных ионов и депротонированные молекулы [M–H]– в режиме регистрации отрицательно заряженных ионов. Фрагментация данных ионов происходит только с разрывом гликозидных связей, что позволило провести их однозначную идентификацию. Все фрагментные ионы выбранных гинсенозидов интерпретированы и охарактеризованы. Показано, что масс-спектры фрагментных ионов в режиме регистрации положительных ионов дают больше информации о структуре сапогенина и боковых сахаридных последовательностей по сравнению с аналогичными спектрами для депротонированных молекул гинсенозидов [M–H]–. Достоинством разработанного способа идентификации гинсенозидов с использованием ЛИЛ, во-первых, является уникальная возможность одновременного получения информации о структуре каждого найденного гинсенозида и детектирования катионированных молекул [M + Na]+ и тем самым выделения группы изомерных гинсенозидов. Во-вторых, появляется возможность сравнения путей фрагментации изомерных и изобарных соединений в одинаковых условиях, что позволяет их различать. В экстракте из корейского женьшеневого чая идентифицировано более 22 гинсенозидов, масс-спектры которых полностью интерпретированы и охарактеризованы. Разработанный способ позволяет быстро идентифицировать неизомерные сапонины, изомерные сапонины с различными сапогенинами и изомерные сапонины со значительными различиями в структуре даже без использования стандартных образцов.
Наша работа [12] посвящена разработке удобного, быстрого и неразрушающего метода извлечения гинсенозидов из объектов со сложной матрицей, совместимого с чувствительным ВЭЖХ–МС-детектированием этих соединений. Для извлечения гинсенозидов использовали ультразвуковую экстракцию при 30°С. В качестве экстрагента применяли смеси воды с метанолом либо этанолом. Изучали влияние состава экстрагирующей смеси, объема смеси и числа последовательных актов экстрагирования на эффективность экстрагирования. Для масс-спектрометрического детектирования использовали третий квадруполь, работающий в режиме ЛИЛ. Способом введено–найдено подтвердили применимость разработанного способа экстрагирования гинсенозидов Rb1, Rg1 и Rc из корня женьшеня; степени извлечения выбранных гинсенозидов составляли от 80 до 110%. При ультразвуковом экстрагировании в выбранных условиях не происходит превращения Rb1 и Rc в гинсенозиды Rg3 и Rh2 соответственно. Показано, что применение смесей вода–метанол и вода–этанол с концентрацией органического растворителя 40–80% в качестве экстрагента обеспечивает наилучшие значения степеней извлечения широкого круга гинсенозидов. Также показано, что для экспрессного анализа коммерческих продуктов достаточно одного акта экстрагирования 10 мл смеси, так как потери аналитов не превышают 10–15% в сравнении с многократным экстрагированием той же смесью.
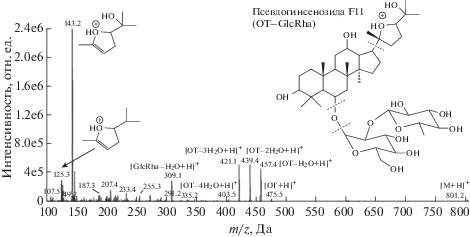
Для определения псевдогинсенозидов F11 и RT5 – биомаркеров американского женьшеня (P. quinquefolius) – применяли метод ВЭЖХ–МС/МС [13]. Обнаружено, что, в отличие от гинсенозидов, псевдогинсенозиды могут образовывать протонированные молекулы за счет протонирования атома кислорода, входящего в состав пятичленного цикла (рис. 2), который разомкнут в молекулах гинсенозидов (схема 2 ). Таким образом, псевдогинсенозиды могут быть обнаружены и определены с высокой чувствительностью в режиме мониторинга выбранных реакций в присутствии изомерных и близких по свойствам гинсенозидов. Для масс-спектрометрического детектирования выбрали следующие реакции: m/z 801 → → m/z 143 (определение), m/z 801 → 439 m/z (качественное подтверждение) для F11; m/z 655 → m/z 143 (определение), m/z 655 → m/z 439 (качественное подтверждение) для RT5. Для близких по свойствам псевдогинсенозидов F11 и RT5, в отличие от предыдущей работы [10], в режиме изократического элюирования удалось добиться приемлемого хроматографического разделения. Для F11 и RT5 достигнуты пределы обнаружения 10 и 20 нг/мл соответственно.
Разработанный способ апробировали при анализе высушенных корневищ P. ginseng, выращенных в Брянской области и Сибири, а также сушеных долек корня P. quinquefolius. Псевдогинсенозид F11 обнаружен и определен в образцах азиатского женьшеня, выращенных в Сибири, и в образцах сушеных долек корня P. quinquefolius. Псевдогинсенозид RT5 обнаружен только в образцах сибирских высушенных корневищ P. ginseng. Присутствие псевдогинсенозидов в образцах сибирских высушенных корневищ P. Ginseng свидетельствует о присутствии в данном образце примесей американского женьшеня.
Лимонник китайский (Schisandra chinensis (Turcz.) Baill) – вид цветковых растений рода Лимонник (Schisandra) семейства Лимонниковые (Schisandraceae). В состав семян S. chinensis входит большое число активных компонентов – лигнанов, являющихся компонентами современных лекарственных средств и пищевых добавок [14]. Препараты на основе S. chinensis применяют в ТМ в качестве антиспазматического тоника для легких и почек [15], они также способствуют выработке жидкости в организме, тонизируют почки и вызывают седативный эффект [14]. Кроме того, на протяжении нескольких сотен лет препараты на основе этого растения используют для лечения бессонницы [16]. Основными биоактивными компонентами S. chinensis являются схизандрол А и схизандрол В (схема 3 ), наряду с схизандринами А, В, С, содержащимися примерно на том же уровне концентраций в спиртовых экстрактах [17].
Схема 3 . Структурные формулы схизандролов А и В [18].
Нами разработан способ совместного определения схизандролов А и В в экстрактах из семян Schisandra chinensis методом ВЭЖХ–МС/МС [18]. Для выбора наиболее подходящего способа экстрагирования схизандролов А и В сравнили экстрагирование водно-ацетонитрильной вытяжкой в ультразвуковой ванне при 30°C и водной вытяжкой с кипячением. Установлено, что при приготовлении водной вытяжки определяемые соединения извлекаются в 9 раз хуже по сравнению с экстрагированием водно-ацетонитрильной смесью. Масс-спектрометрическое детектирование проводили в режиме мониторинга выбранных реакций, так как в масс-спектре определяемых соединений наблюдались интенсивные сигналы, соответствующие протонированным молекулам схизандролов А и В (m/z 433 для схизандрола А и m/z 417 для схизандрола В), а также их характерным фрагментным ионам, образующимся в ячейке соударений (m/z 415 и 384 для схизандрола А, m/z 399 и 368 для схизандрола В). Хроматографическое разделение экстрактов осуществляли в режиме градиентного элюирования. Для схизандролов А и В достигнуты пределы обнаружения 8 и 4 нг/мл соответственно.
Основным компонентом корня солодки является глицирризин (глицирризиновая кислота; 20β-карбокси-11-оксо-30-норолеан-12-ен-3β-ил-2-О-β-D-глюкопирануронозил-α-D-глюкопиранозидуроновая кислота). Глицирризин обладает противовоспалительным, противовирусным, антиаллергенным эффектом, а также проявляет хемопрофилактическую активность против рака и СПИДа [19–21]. Наряду с глицирризином, более 400 других тритерпеновых сапонинов и флавоноидов, отвечающих за терапевтический эффект, обнаружено в G. glabra и родственных видах [22]. Так, помимо глицирризина в корнях солодки находится большое число других важных сапонинов близкой структуры, например ликорица-сапонин G2; в состав растения входят также их сапогенины (агликоны) – глицирретовая кислота, глабролид и др. [22]. Таким образом, для оценки состава препарата или исходного растительного материала необходимо идентифицировать пики сапонинов на хроматограмме, а затем рассчитать содержания хотя бы основных компонентов, стандартные образцы которых доступны. Поскольку глицирризин содержится в корнях солодки в значительно бóльших количествах по сравнению с другими сапонинами, нами предложен способ его ВЭЖХ–МС/МС-определения в растительных материалах [23]. Разделение проводили в обращенно-фазовом режиме на колонке С18 с применением градиентного элюирования. В качестве подвижной фазы использовали 0.1%-ную муравьиную кислоту (подвижная фаза А) и ацетонитрил (подвижная фаза Б). Количественный анализ проводили в режиме мониторинга выбранных реакций в варианте регистрации отрицательно заряженных ионов. Для определения и качественного подтверждения использовали переходы m/z 821 → m/z 471 и m/z 821 → m/z 193 соответственно. Предел обнаружения глицирризина составил 2 нг/мл, градуировочный график линеен в диапазоне от 6 до 1000 нг/мл. Глицирризин извлекали из образцов корня солодки и женьшеневого улуна в ультразвуковой ванне смесью изопропанола с водой (7 : 3, по объему). Экстракты фильтровали и разбавляли в 10 и 100 раз подвижной фазой А. Из чайных гранул женьшеня и корня солодки извлекалось около 80 и 90% глицирризина соответственно.
Шлемник байкальский (Scutellariae baicalensis) – одно из наиболее популярных растений ТМ, которое используют при лечении воспалительных процессов, гипертонии, сердечно-сосудистых заболеваний, а также при бактериальных и вирусных инфекциях, благодаря входящим в его состав активным компонентам, таким как байкалин, байкалеин, вогонин и скутелларин. Нами разработан высокочувствительный способ совместного определения байкалина, байкалеина, вогонина и скутелларина в экстрактах из растительных материалов [24]. Хроматографическое разделение проводили на обращенно-фазовой колонке в режиме градиентного элюирования за 20 мин. В качестве подвижной фазы использовали смесь 0.5%-ной муравьиной кислоты в воде и ацетонитрил. Масс-спектрометрическое детектирование проводили в варианте регистрации отрицательно заряженных ионов в режиме мониторинга выбранных реакций: m/z 283 → m/z 268, m/z 283 → m/z 163 для вогонина (первый переход для определения, второй для качественного подтверждения), m/z 461 → m/z 285, m/z 461 → m/z 175 для скутелларина, m/z 445 → m/z 269, m/z 445 → m/z 175 для байкалина и m/z 269 → m/z 195, m/z 269 → m/z 139 для байкалеина. Достигнутые пределы обнаружения определяемых соединений лежат в диапазоне от 1 до 4 нг/мл. Показана возможность применения разработанного способа в анализе двух коммерчески доступных образцов корня Scutellariae baicalensis.
Данные по пределам обнаружения, а также условиям хромато-масс-спектрометрического определения выбранных физиологически активных компонентов растений представлены в табл. 1.
Таблица 1.
Разработанные подходы для целевого определения физиологически активных компонентов растительного сырья
| Метод анализа | Физиологически активное вещество | Предел обнаружения, нг/мл | Объект | Режим масс-спектрометрического детектирования | Хроматографические условия разделения | Литература |
|---|---|---|---|---|---|---|
| ВЭЖХ–МС/МС | Салидрозид Розавин Розарин |
2 4 6 |
Корневища Rhodiola rosea | Режим мониторинга выбранных реакций: m/z 299 → m/z 119, m/z 299 → → m/z 89 для салидрозида m/z 427 → m/z 294, m/z 427 → →m/z 149 для розавина m/z 427 → m/z 293, m/z 427 → → m/z 249 для розарина |
Zorbax SB – C18 150 мм × × 2.1 мм, 5 мкм. Подвижная фаза A – 0.5% HCOOH в воде, подвижная фаза Б – ацетонитрил, изократический режим (A : B = 85 : 15, по объему), 0.35 мл/мин |
[3] |
| ВЭЖХ–МС | Гинсенозиды: Rb1 Rg1 Rf Re |
10 6 3 9 |
Женьшень свежий, женьшень измельченный, женьшень сухой, корейский женьшеневый чай, женьшень “Фитопродукт” | Режим сканирования по сумме интенсивностей выбранных сигналов с использованием линейной
ионной ловушки: m/z 459.4, 441.4, 423.4 и 405.5 для Rg1, Rf и Re m/z 443.4, 425.4 и 407.5 для Rb1 |
Acclaim C18 150 × 2.1 мм, 2.2 мкм. Подвижная фаза A – 0.5% HCOOH в воде, подвижная фаза Б – ацетонитрил, градиентное элюирование, 0.4 мл/мин |
[10] |
| ВЭЖХ–МС | Гинсенозиды: Rb1 Rg1 Rf Re |
6 6 1 3 |
Женьшень свежий, женьшень измельченный, женьшень сухой, корейский женьшеневый чай, женьшень “Фитопродукт” | Режим мониторинга выбранных сигналов: m/z 459.4, 441.4, 423.4 и 405.5 для Rg1, Rf и Re m/z 443.4, 425.4 и 407.5 для Rb1 |
Acclaim C18 150 × 2.1 мм, 2.2 мкм. Подвижная фаза A – 0.5% HCOOH в воде, подвижная фаза Б – ацетонитрил, градиентное элюирование, 0.4 мл/мин |
[10] |
| ВЭЖХ–МС/МС | Псевдогинсенозиды: F11 RT5 |
10 20 |
Высушенные корневищ P. Ginseng (Брянская область, Сибирь), | сушеные дольки корня P. Quinquefolius | Режим мониторинга выбранных реакций: m/z 801→ m/z 143, m/z 801 → → m/z 439 для F11 m/z 655→ m/z 143, m/z 655 → → m/z 439 для RT5 |
Acclaim 120 C18 column 150 × 2.1 мм, 3 мкм. Подвижная фаза A – 0.5% HCOOH в воде, подвижная фаза Б – ацетонитрил, изократический режим (A : B = 65 : 35, по объему), 0.4 мл/мин |
[13] |
| ВЭЖХ–МС/МС | Схизандрол А Схизандрол В |
4 8 |
Семяна Schisandra chinensis | Режим мониторинга выбранных реакций: m/z 433→ m/z 415, m/z 433→ → m/z 384 для схизандрола А m/z 417→ m/z 399, m/z 417→ → m/z 368 для схизандрола В |
Acclaim C18 150 × 2.1 мм, 2.2 мкм. Подвижная фаза A – 0.5% HCOOH в воде, подвижная фаза Б – ацетонитрил, градиентное элюирование, 0.4 мл/мин |
[18] |
| ВЭЖХ–МС/МС | Глицирризин | 2 | Женьшеневый улун, корень солодки | Режим мониторинга выбранных реакций m/z 821→ m/z 351, m/z 821→ m/z 193 |
Acclaim C18 150 × 2.1 мм, 2.2 мкм. Подвижная фаза A – 0.1% HCOOH в воде, подвижная фаза Б – ацетонитрил, градиентное элюирование, 0.4 мл/мин |
[23] |
| ВЭЖХ–МС/МС | Вогонин Скутелларин Байкалин Байкалеин |
1 3 1 4 |
Образцы корня Scutellaria baicalensis | Режим мониторинга выбранных реакций m/z 283 → m/z 268, m/z 283 → → m/z 163 для вогонина m/z 461 → m/z 285, m/z 461 → → m/z 175 для скутелларина m/z 445 → m/z 269, m/z 445 → → m/z 175 для байкалина m/z 269 → m/z 195, m/z 269 → → m/z 139 для байкалеина |
Acclaim C18 150 × 2.1 мм, 3 мкм. Подвижная фаза A – 0.5% HCOOH в воде, подвижная фаза Б – ацетонитрил, градиентное элюирование, 0.4 мл/мин |
[24] |
ГРУППОВАЯ ИДЕНТИФИКАЦИЯ ФИЗИОЛОГИЧЕСКИ АКТИВНЫХ КОМПОНЕНТОВ РАСТЕНИЙ
Для того, чтобы охарактеризовать образец препарата ТМ, чаще всего применяют прием получения “отпечатков пальцев”, т.е. устанавливают присутствие, соотношение и состав нескольких характеристичных компонентов – биомаркеров растений. Существующие способы основаны на определении нескольких биомаркеров, стандартные образцы которых чаще всего коммерчески доступны, а условия детектирования индивидуальны (мониторинг выбранных реакций или псевдомолекулярных ионов по точному значению m/z). Для повышения достоверности результатов при таком способе идентификации компонентов в пищевых добавках и лекарственных средствах возможно использование более информативных способов анализа, таких как ВЭЖХ–МС в режиме сканирования, например, с использованием ЛИЛ, и в режиме регистрации диагностических ионов, которые встречаются в масс-спектрах целой группы близких по структуре компонентов того или иного растения. Недостатком первого способа является необходимость трудоемкой ручной обработки данных, поскольку объединение таких масс-спектров в единую базу или библиотеку невозможно из-за индивидуальных особенностей источников ионов разных производителей, их состояния, состава применяемых подвижных фаз и т.д. Кроме того, полное хроматографическое разделение недостижимо даже при анализе экстракта из одного растения, а тем более при анализе экстракта из смешанного препарата, когда происходит наложение масс-спектров компонентов с близкими временами удерживания, что сильно осложняет интерпретацию. Второй способ, хотя и проигрывает в информативности, поскольку все сигналы в масс-спектрах фрагментных ионов не регистрируют, обладает рядом преимуществ. Во-первых, в некоторых случаях, например для группы родственных сапонинов, можно выделить целый набор диагностических ионов из паттерна фрагментации сапогенина [25]. Это позволяет отличить эту группу от других гликозидов даже при совпадении их брутто-формул, что повышает информативность и достоверность такого подхода. Во-вторых, на хроматограммах, полученных по сигналам диагностических ионов, можно выделить все пики исследуемой группы соединений, что также повышает информативность и возможность автоматизации данного подхода.
Для групповой идентификации широкого круга гинсенозидов в растениях рода Panax и продуктах на основе женьшеня мы применили ВЭЖХ–МС с ЛИЛ [25]. Ультразвуковое экстрагирование гинсенозидов из растительных материалов проводили двумя порциями по 10 мл смеси вода–метанол (4 : 1, по объему). Показано, что в выбранных условиях экстрагирования не происходит разрушения определяемых гинсенозидов и степени извлечения высоки (>80%). Хроматографическое разделение проводили в режиме градиентного элюирования, продолжительность анализа составила 45 мин. Для каждого пика гинсенозида на масс-хроматограмме по значению m/z сигнала, соответствующего катионированной молекуле [M + Na]+, определен состав его углеводной цепочки, присутствие ацетильных или малоновых заместителей, а также его молекулярная масса. Для определения типа сапогенина получали масс-хроматограммы смеси 17 стандартных образцов коммерчески доступных гинсенозидов и суммировали относительные интенсивности характеристичных ионов, принадлежащих паттернам фрагментации ППТ, ППД и ОТ сапогенинов (m/z 459, 441, 423, 405, 367, 349, 281, 229 для ППТ; 443, 425, 407, 369, 351, 283, 231 для ППД; и 475, 457, 439, 421, 403, 143, 125, 107 для ОТ). Таким образом, получены три характерные переменные и построена тестовая выборка масс-спектров гинсенозидов в трехмерном пространстве (рис. 3). Применение разработанного способа позволило провести групповую идентификацию гинсенозидов в экстрактах из 8 растительных материалов.
Рис. 3.
Тестовая выборка в трехмерном пространстве. Облака соответствуют гинсенозидам с ППД-, ППТ-, ОТ- и ОАК-сапогенинами [25].
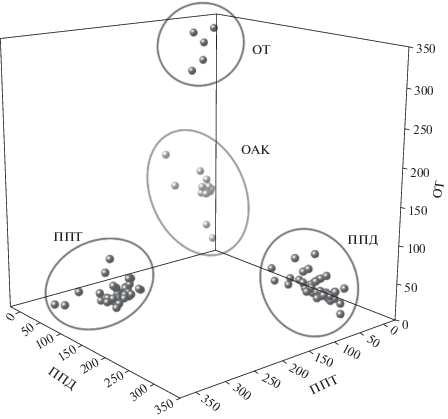
Для количественной оценки 17 стандартных гинсенозидов использовали наиболее интенсивные фрагментные ионы с m/z 423, 425 и 439, принадлежащие соответственно паттернам фрагментации ППТ, ППД и ОТ сапогенинов. Пределы обнаружения составили от 3 до 10 нг/мл, а градуировочные зависимости линейны в диапазоне от 10 до 5000 нг/мл. Прецизионность и внутрилабораторная прецизионность определения концентрации гинсенозидов (значения sr) не превышала 2%.
Разработанный способ групповой идентификации расширен и использован для определения сапонинов, содержащихся в разных видах растений, обладающих сладким привкусом и ароматом – женьшене, абрусе и солодке [23]. Корень солодки голой (Glycyrrhiza glabra) семейства бобовые (Fabaceae) используют во всем мире в качестве естественного подсластителя и в некоторых случаях в качестве ароматизатора для приготовления конфет и различных продуктов. Кроме того, порошкообразный корень солодки обычно применяют в качестве лекарственного средства, он входит в состав примерно 60% предписаний и рецептов в ТМ [26]. Экстракт корня солодки обладает противоспазматическими, антидиабетическими, антидепрессивными, гепато-протекторными свойствами, отхаркивающим эффектом и улучшает память [27–30]. Глицирризин, а также абрусозиды из листьев четочника молитвенного (Abrus precatorius L.) [31] отвечают за сладкий вкус и аромат, интенсивность которого в 170 раз выше по сравнению с сахарозой [32].
Для извлечения сапонинов из женьшеневого улуна, корней солодки и листьев четочника молитвенного использовали смесь изопропанол–вода (7 : 3, по объему), экстрагировали в ультразвуковой ванне в течение 40 мин при 25–30°С. Полученные экстракты разбавляли в 10 и 100 раз 0.1%-ной муравьиной кислотой в воде. Хроматографическое разделение экстрактов проводили в режиме градиентного элюирования. В качестве подвижной фазы использовали 0.1%-ную муравьиную кислоту в воде и ацетонитрил. Для сопоставления сапониновых профилей исследуемых экстрактов получали хроматограммы при одновременной регистрации сигналов из паттернов фрагментации нескольких сапогенинов (табл. 2).
Таблица 2.
Диагностические ионы паттернов фрагментации сапогенинов исследуемых групп сапонинов растительного происхождения [23]
| Тип сапогенина | Растение | Диагностические ионы, m/z |
|---|---|---|
| Протопанаксатриол | Женьшень | 441, 423, 405 |
| Протопанаксадиол | Женьшень | 443, 425, 407 |
| Олеаноловая кислота | Женьшень | 439, 393 |
| Абрусогенин | Абрус молитвенный* | 485, 467, 449, 431, 439, 421, 403 |
| Глицирретовая кислота | Солодка | 471, 453, 435, |
| 24-Гидроксиглицирретовая кислота | Солодка | 487, 469, 451 |
| 24-Гидрокси-11-дезоксо-глицирретовая кислота | Солодка | 473, 455, 437 |
| 24-Гидроксиглабролид | Солодка | 503, 485, 467 |
Использование длительных программ градиентного элюирования позволяет для идентификации компонентов применять как времена удерживания основных пиков, так и присутствие всех характеристичных сигналов для каждой группы сапонинов. Графической иллюстрацией данного похода являются хроматограммы, построенные по сумме сигналов каждого паттерна фрагментации. Так, продемонстрировано присутствие абрусозидов из листьев A. precatorius, а также компонентов экстракта корня солодки в составе женьшеневого улуна, что обусловливает сладкий привкус этого вида чая. Однако оригинальные гинсенозиды женьшеня в этом продукте не обнаружены, что свидетельствует о его возможной фальсификации. Таким образом, предложенный способ позволяет на основании сопоставления профилей тритерпеновых сапонинов идентифицировать присутствие в составе растительных продуктов и пищевых добавок экстрактов из корней солодки, женьшеня или листьев четочника молитвенного, которые могут отвечать за наличие сладкого вкуса или аромата.
Для более достоверной идентификации структуры соединений необходимо дополнительное применение метода ЯМР, который мы использовали в исследовании состава женьшеневого улуна [33]. В метанольном экстракте идентифицирован новый компонент, относящийся к циклоартановому типу сапонинов, а также пять новых соединений. Структуры идентифицировали при помощи одномерного и двумерного ЯМР, масс-спектрометрии высокого разрешения, а также ВЭЖХ с масс-спектрометрическим детектированием в ЛИЛ. Показано, что эти соединения имеют различные углеводные цепочки, прикрепленные к молекуле абрусогенина. Сравнили сапониновые профили четырех коммерчески доступных образцов женьшеневых улунов и листьев четочника молитвенного. В результате идентифицировали три известных абрусозида и шесть новых ацетиловых и малониловых производных абрусогенина. Оригинальные гинсенозиды в экстракте не обнаружили. Таким образом, можно сделать вывод, что абрусозиды могли быть использованы в качестве заменителей сладковатого вкуса чая.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ МНОГОКОМПОНЕНТНОЙ СИСТЕМЫ
В последние годы в области анализа и контроля качества средств ТМ широкое применение находит способ количественного анализа многокомпонентной системы (КАМС), который позволяет определять содержания аналитов без применения их стандартных образцов, используя лишь факторы пересчета и устанавливая концентрацию одного референтного компонента в пробе [34]. Это – относительно новый метод количественного анализа, поэтому важно показать и доказать возможность его применения на практике, сравнивая значения концентраций определяемых соединений, полученные разными способами. Наиболее часто для такой оценки применяют относительную ошибку метода (ООМ, %) [35]:
Метод КАМС также применен нами для определения гинсенозидов в продуктах на основе женьшеня [40]. Сравнивали способы определения гинсенозидов с ППТ- и ППД-сапогенинами в различных продуктах на основе женьшеня с применением методов ВЭЖХ с УФ- и МС-детектированием, а также метода КАМС. Шестнадцать гинсенозидов различной полярности разделяли на обращенно-фазовой колонке в режиме градиентного элюирования за 40 мин. В качестве подвижной фазы использовали 0.1%-ную муравьиную кислоту в воде и ацетонитрил. Ультрафиолетовое детектирование проводили при длине волны 230 нм. Масс-спектрометрическое детектирование осуществляли в режиме мониторинга выбранных ионов, характерных для ППТ (m/z 405, 423) и ППД (407, 425) сапогенинов. Гинсенозиды определяли в различных продуктах на основе женьшеня при помощи градуировочного графика и методом КАМС. Для определяемых гинсенозидов рассчитали значения факторов пересчета в условиях ВЭЖХ-УФ и ВЭЖХ–МС. Относительная ошибка метода не превышала 7 и 11% в случае применения методов ВЭЖХ-УФ и ВЭЖХ–МС для определения гинсенозидов соответственно в большом количестве анализируемых объектов. Полученные результаты показывают, что метод КАМС может быть успешно применен для определения гинсенозидов вместо метода внешнего стандарта в случае отсутствия стандартных образцов определяемых гинсенозидов. Показано также, что согласно американской и европейской Фармокопеи метод КАМС в сочетании с ВЭЖХ-УФ дает завышенные значения параметров, используемых для контроля качества продуктов на основе женьшеня, по сравнению с методом КАМС в сочетании с ВЭЖХ–МС. Это можно объяснить боле низкой селективностью метода ВЭЖХ-УФ. Таким образом, метод КАМС в сочетании с ВЭЖХ–МС можно успешно применять для оценки содержания гинсенозидов в продуктах на основе женьшеня.
* * *
Для целевого определения физиологически активных компонентов растений выбраны условия экстрагирования, не разрушающие целевые соединения и обеспечивающие высокие степени извлечения, а также подобраны условия хромато-масс-спектрометрического детектирования, позволяющие достичь низких пределов обнаружения. Для определения салидрoзида, розавина, розарина, псевдогинсенозидов F11 и RT5, схизандролов А и В, байкалина, байкалеина, вогонина, скутелларина, а также глицирризина использовали режим мониторинга выбранных реакций, обеспечивающий достижение низких пределов обнаружения соединений в диапазоне от 1 до 20 нг/мл. Гинсенозиды Rb1, Rg1, Rf и Re не способны образовывать протонированные молекулы в режиме регистрации положительных ионов, а интенсивность сигналов, соответствующих депротонированным молекулам в режиме регистрации отрицательных ионов низка, однако в масс-спектре данных соединений при использовании линейной ионной ловушки наблюдается характерные паттерны фрагментации, содержащие группу интенсивных сигналов. Таким образом, для определения данных гинсенозидов применен режим сканирования по сумме интенсивностей выбранных сигналов с использованием линейной ионной ловушки, который обеспечил возможность одновременной идентификации и высокочувствительного определения данных соединений с пределами обнаружения в диапазоне от 3 до 10 нг/мл. С использованием метода ВЭЖХ с масс-спектрометрическим детектированием в линейной ионной ловушке получены характерные паттерны фрагментации женьшеневых сапонинов и сапонинов, содержащихся в растениях рода Panax, листьях четочника молитвенного Abrus precatorius L. и корне солодки Glycyrrhiza glabra. Паттерны фрагментации, а также характерные времена удерживания сапонинов позволили провести групповую идентификацию гинсенозидов с ППТ-, ППД-, ОТ- и ОАК-сапогенинами, а также обнаружить присутствие группы абрусозидов из листьев A. precatorius и компонентов экстракта корня солодки в составе женьшеневого улуна, что обусловливает сладкий привкус этого вида чая. Также с помощью препаративной хроматографии и применения методов ЯМР, масс-спектрометрии высокого разрешения и ВЭЖХ–МС/МС подтверждена структура нескольких новых соединений в экстракте из женьшеневого улуна. Для количественной оценки содержания гинсенозидов, а также компонентов надземных частей растения T. terrestris, успешно применен метод КАМС, позволяющий по найденным факторам пересчета относительно референтного соединения с известной концентрацией проводить количественный анализ без применения стандартных образцов. Полученные результаты могут быть использованы для контроля качества широкого круга растительной продукции, изучения состава полезных растительных материалов, а также для создания лекарственных препаратов на основе идентифицированных физиологически активных компонентов.
Работа поддержана Российским научным фондом (РНФ) (№ гранта: 17-13-01146).
Список литературы
Panossian A., Wikmana G., Sarris J. Rosenroot (Rhodiola rosea): Traditional use, chemical composition, pharmacology and clinical efficacy // Phytomedicine. 2010. V. 17. № 7. P. 481.
Drasar P., Moravcova J. Recent advances in analysis of Chinese medical plants and traditional medicines // J. Chromatogr. B. 2004. V. 812. № 1–2. P. 3.
Родин И.А., Ставрианиди А.Н., Браун А.В., Шпигун О.А., Попик М.В. Одновременное определение салидрозида, розарина и розавина в экстрактах из Rhodiola rosea методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием // Масс-спектрометрия. 2012. Т. 9. № 1. С. 61. (Rodin I.A., Stavrianidi A.N., Braun A.V., Shpigun O.A., Popik M.V. Simultaneous determination of salidroside, rosavin and rosarin in extracts from Rhodiola rosea be high performance liquid chromatography with tandem mass spectrometry detection // J. Analyt. Chem. 2012. V. 67. № 13. P. 1026.)
European Scientific Cooperative on Phytotherapy Monographs. The Scientific Foundation for Herbal Medicinal Products. Germany: Thieme, 2003. P. 211.
Kiefer D., Pantuso T. Panax ginseng // Am. Family Phys. 2003. V. 68. № 8. P. 1539.
Kang J.H., Song K.H., Woo J.K., Park M.H., Rhee M.H., Choi C., Oh S.H. Ginsenoside Rp1 from Panax ginseng exhibits anti-cancer activity by down-regulation of the IGF-1R/Akt pathway in breast cancer cells // Plant Foods Hum Nutr. 2011. V. 66. № 3. P. 298.
Nag S.A., Qin J.J., Wang W., Wang M.H., Wang H., Zhang R. Ginsenosides as anticancer agents: In vitro and in vivo activities, structure-activity relationships, and molecular mechanisms of action // Front Pharmacol. 2012. V. 3. P. 25.
Yang W.-Z., Ye M., Qiao X., Liu C.-F., Miao W.-J., Bo T., Tao H.-Y., Guo D.-A. A strategy for efficient discovery of new natural compounds by integrating orthogonal column chromatography and liquid chromatography/mass spectrometry analysis: Its application in Panax ginseng, Panax quinquefolium and Panax notoginseng to characterize 437 potential new ginsenosides // Anal. Chim. Acta. 2012. V. 739. P. 56.
Родин И.А., Ставрианиди А.Н., Браун А.В., Шпигун О.А. Современные способы идентификации и определение гинсенозидов // Вестн. Моск. ун-та. Сер. 2. Химия. 2013. Т. 54. № 3. С. 135. (Rodin I.A., Stavrianidi A.N., Braun A.V., Shpigun O.A. Modern methods of identifying and determining ginsenosides // Mosc. Univ. Chem. Bull. 2013. V. 68. № 3. P. 127.)
Родин И.А., Ставрианиди А.Н., Браун А.В., Шпигун О.А., Беризовская Е.И. Одновременное определение гинсенозидов методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием // Масс-спектрометрия. 2013. Т. 10. № 2. С. 129. (Stavrianidi A.N., Rodin I.A., Braun A.V., Shpigun O.A., Berizovskaya E.I. Simultaneous determination of ginsenosides be high-performance liquid chromatography with tandem mass spectrometry detection // J. Analyt. Chem. 2014. V. 69. № 13. Р. 1252.)
Stavrianidi A., Rodin I., Braun A., Shpigun O. The use of linear ion trap for qualitative analysis of phytochemicals in Korean ginseng tea // Biomed. Chromatogr. 2013. V. 27. № 6. P. 765.
Ставрианиди А.Н., Родин И.А., Браун А.В., Шпигун О.А. Быстрый способ ультразвуковой экстракции гинсенозидов из растительного сырья и продуктов на основе женьшеня для ВЭЖХ-МС/МС анализа // Аналитика и контроль. 2013. Т. 17. № 4. С. 1.
Ставрианиди А.Н., Родин И.А., Браун А.В., Стекольщикова Е.А., Шпигун О.А. Определение биомаркеров P. quinquefolius в растительных материалах и коммерческих продуктах комбинированным методом высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии // Масс-спектрометрия. 2014. Т. 11. № 1. С. 45. (Stavrianidi A.N., Rodin I.A., Braun A.V., Stekolshchikova E.A., Shpigun O.A. Determination of biomarkers of P. quinquefolius in plant materials and commercial products // J. Analyt. Chem. 2014. V. 69. № 14. P. 1323.)
Liu H., Lai H., Liu J., Zhang Z., Qi Y., Zhang J., Song J., Wu C., Zhang B., Xiao P. Comprehensive chemical analysis of Schisandra chinensis by HPLC–DAD–MScombined with chemometrics // Phytomedicine. 2013. V. 20. № 12. P. 1135.
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China 2010. Beijing: Chin. Med. Sci. Press, 2011.
Song Yu C., Fei L. Clinical Guide to Chinese Herbs and Formulae. London: Churchill Livingstone, 1993. 304 p.
Zhang W.D., Wang Q., Wang Y., Wang X.J., Pu J.X., Gu Y., Wang R. Application of ultrahigh-performance liquid chromatography coupled with mass spectrometry for analysis of lignans and quality control of Fructus Schisandrae chinensis // J. Sep. Sci. 2012. V. 35. № 17. P. 2203.
Ставрианиди А.Н., Родин И.А., Браун А.В., Стекольщикова Е.А., Ананьева И.А., Шпигун О.А. Разработка способа определения схизандролов А и В в экстрактах из семян Schisandra chinensis методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием // Химия растительного сырья. 2015. № 3. С. 97.
Finney R.S.H., Somer G.F. The antiinflammatory activity of glycyrrhetinic acid and derivatives // J. Pharm. Pharmacol. 1958. V. 10. № 1. P. 613.
Pompei R., Flore O., Marcialis M.A., Pani A., Loddo B. Glycyrrhizic acid inhibits virus growth and inactivates virus particles // Nature. 1979. V. 281. № 5733. 689.
Jo E.H., Kim S.H., Ra J.C., Kim S.R., Cho S.D., Jung J.W., Yang S.R., Park J.S., Hwang J.W., Aruoma O.I., Kim T.Y., Lee Y.S., Kang K.S. Chemopreventive properties of the ethanol extract of chinese licorice (Glycyrrhiza uralensis) root: induction of apoptosis and G1 cell cycle arrest in MCF-7 human breast cancer cells // Cancer Lett. 2005. V. 230. № 2. P. 239.
Zhang Q., Ye M. Chemical analysis of the Chinese herbal medicine Gan-Cao (licorice) // J. Chromatogr. A. 2009. V. 1216. № 11. P. 1954.
Ставрианиди А.Н., Стекольщикова Е.А., Родин И.А., Шпигун О.А. Хроматомасс-спектрометрическая идентификация и определение глицирризина в экстрактах из корня солодки и пищевых продуктах // Аналитика и контроль. 2017. Т. 21. № 3. С. 230.
Байгильдиева Д.И., Байгильдиев Т.М., Ставриани-ди А.Н., Шпигун О.А., Родин И.А. Одновременное определение вогонина, скутелларина, байкалина и байкалеина в экстрактах из Scutellariae baicalensis методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием // Масс-спектрометрия. 2018. Т. 15. № 1. С. 5.
Stavrianidi A., Rodin I., Braun A., Stekolshchikova E., Shpigun O. Single-run HPLC/ESI-LITMS profiling of ginsenosides in plant extracts and ginseng based products // Biomed. Chromatogr. 2015. V. 29. № 6. P. 853.
Wang Y.C., Yang Y.S. Simultaneous quantification of flavonoids and triterpenoids in licorice using HPLC // J. Chromatogr. B. 2007. V. 850. № 1–2. P. 392.
Kao T.-C., Wu C.-H., Yen G.-C. A review of the bioactivity and potential health benefits of licorice // J. Agric. Food Chem. 2014. V. 62. № 3. P. 542.
Dhingra D., Parle M., Kulkarni S.K. Memory enhancing activity of Glycyrrhiza glabra in mice // J. Ethnopharmacol. 2004. V. 91. № 2–3. P. 361.
Ko B.S., Jang J.S., Hong S.M., Sung S.R., Lee J.E., Lee M.Y., Jeon W.K., Park S. Changes in components, glycyrrhizin and glycyrrhetinic acid, in raw Glycyrrhiza uralensis fisch, modify insulin sensitizing and insulinotropic actions // Biosci. Biotechnol. Biochem. 2007. V. 71. № 6. P. 1452.
Ma J., Peng W.L., Liang D., Fu N.Y., Pang D.B., Xu A.L. The Extract of Glycyrrhiza uralensis fisch induces apoptosis in MGC-803 cells and its molecular mechanisms // Biomed. Res. 2000. V. 21. № 3. P. 129.
Kinghorn A.D., Soejarto D.D. Discovery of terpenoid and phenolic sweeteners from plants // Pure Appl. Chem. 2002. V. 74. № 7. P. 1169.
Tanaka O. Improvement of taste of natural sweeteners // Pure Appl. Chem. 1997. V. 69. № 4. P. 675.
Stavrianidi A., Stekolshchikova E., Rodin I., Godovikov I., Shpigun O. Structure elucidation of sweet-tasting cycloartane-type saponins from ginseng oolong tea and Abrus precatorius L. leaves // Nat. Prod. Res. doi 10.1080/14786419.2017.1416383
Wang Z.M., Gao H.M., Fu X.T., Wang W.H. Multi-components quantitation by one marker new method for quality evaluation of Chinese herbal medicine // Zhongguo Zhong Yao Za Zhi. 2006. V. 31. № 23. P. 1925.
Wang C.Q., Jia X.H., Zhu S., Komatsu K., Wang X., Cai S.Q. A systematic study on the influencing parameters and improvement of quantitative analysis of multi-component with single marker method using notoginseng as research subject // Talanta. 2015. V. 134. P. 587.
Ставрианиди А.Н., Стекольщикова Е.А., Турова П.Н., Родин И.А., Шпигун О.А. Применение метода количественного анализа многокомпонентной системы для хроматомасс-спектрометрического определения диосгенина, диосцина и протодиосцина в экстрактах из травы Tribulus terrestris // Вестн. Моск. ун-та. Сер. 2. Химия. 2017. Т. 58. № 3. С. 144. (Stavrianidi A.N., Stekolshchikova E.A., Turova P.N., Rodin I.A., Shpigun O.A. Quantitative analysis of a multicomponent system for liquid chromatography-mass spectrometry determination of diosgenin, dioscin and photodioscin in plant extracts of Tribulus terrestris // Mosc. Univ. Chem. Bull. 2017. V. 72. № 3. P. 135.)
Gauthaman K., Adaikan P.G., Prasad R.N.V. Aphrodisiac properties of Tribulus Terrestris extract (protodioscin) in normal castrated rats // Life Sci. 2002. V. 71. № 12. P. 1385.
Блинова К.Ф., Борисова Н.А., Гортинский Г.Б., Грушвицкий И.В., Забинкова Н.Н., Комарова М.Н., Мусаева Л.Д., Николаева Л.А., Регир В.Г., Селенина Л.В., Сыровежко Н.В., Теслов Л.С., Харитонова Н.П., Шатохина Р.К., Яковлев Г.П. Ботанико-фармакогностический словарь. Справ. пособие. М.: Высшая школа, 1990. С. 272.
Sarvin B., Stekolshchikova E., Rodin I., Stavrianidi A., Shpigun O. Optimization and comparison of different techniques for complete extraction of saponins from T. terrestris // J. Appl. Res. Med. Aromat. Plants. 2018. V. 8. P. 75.
Stavrianidi A., Stekolshchikova E., Porotova A., Rodin I., Shpigun O. Combination of HPLC-MS and QAMS as a new analytical approach for determination of saponins in ginseng containing products // J. Pharm. Biomed. Anal. 2017. V. 132. P. 87.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии