Журнал аналитической химии, 2019, T. 74, № 11, стр. 846-855
Автоматизация микроэкстракционного концентрирования на принципах циклического инжекционного анализа
К. С. Вах a, *, **, И. И. Тимофеева a, А. В. Булатов a
a Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Университетский просп., 26, Россия
* E-mail: k.vakh@spbu.ru
** E-mail: krisitna-fulmes@mail.ru
Поступила в редакцию 18.10.2018
После доработки 10.12.2018
Принята к публикации 19.04.2019
Аннотация
Обзор микроэкстракционных методов разделения и концентрирования, автоматизированных на принципах равновесных проточных методов анализа. Обсуждаются принципы и возможности автоматизированных методов капельной, дисперсионной микроэкстракции и экстракции из гомогенного раствора. Аналитические возможности рассматриваемых методов подтверждаются примерами анализа проб пищевых продуктов и биологических жидкостей.
Важным направлением современной аналитической химии является разработка новых методов разделения и концентрирования, обеспечивающих высокую чувствительность анализа в сочетании с его миниатюризацией и автоматизацией. Для автоматизации и миниатюризации методов разделения и концентрирования широкое применение находят проточные методы [1]. Они позволяют существенно увеличить производительность анализа, сократить расход реагентов и образующихся отходов и улучшить воспроизводимость. В аналитической практике к концентрированию микрокомпонентов при их проточном определении прибегают, прежде всего в тех случаях, когда чувствительность методов прямого определения этих компонентов недостаточна [2].
Одним из широко используемых методов концентрирования является жидкостно–жидкостная экстракция (ЖЖЭ), позволяющая проводить концентрирование аналитов самой различной природы из проб сложного состава. Тем не менее ЖЖЭ при традиционной схеме экстракционного процесса имеет существенные недостатки: использование относительно больших объемов дорогостоящих и зачастую токсичных и пожароопасных растворителей. Кроме того, эффективность концентрирования с точки зрения достигаемых коэффициентов концентрирования по традиционной схеме осуществления ЖЖЭ часто недостаточна [3].
В последнее время интенсивно развивались микроэкстракционные методы, которые преимущественно разрабатывались с ориентацией на современные инструментальные методы анализа, в том числе и на проточные. Возможности и ограничения микроэкстракционных методов описаны в многочисленных обзорах [4–6]. Обычно при сочетании проточных методов анализа и методов микроэкстракционного концентрирования в гидравлические схемы включают специальные устройства: экстракционные колонки [7], экстракционные камеры [8], мембранные [9] и хроматомембранные [10] ячейки, трубки с полыми волокнами [11]. В таких устройствах процесс микроэкстракции или разделения фаз осуществляется в режиме реального времени. Часто для увеличения экспрессности и воспроизводимости анализа сочетают стадии дериватизации и микроэкстракции и детектирования in situ [12]. Для подачи экстрагентов в гидравлические схемы обычно используют шприцевые насосы, которые позволяют точно дозировать небольшие объемы органических растворителей. Подходы к автоматизации микроэкстракционных методов на принципах неравновесных проточных методов представлены в ряде обзоров [13–15].
В настоящем обзоре рассматривается автоматизация пробоподготовки на принципах микроэкстракции в циклическом инжекционном анализе (ЦИА) [16, 17], который развивается на кафедре аналитической химии Института химии СПбГУ.
Капельная микроэкстракция. Первым из описанных методов жидкостной микроэкстракции является капельная микроэкстракция (КМЭ) [18]. В КМЭ экстрагент в виде отдельной капли (объем экстрагента составляет 1–30 мкл) погружают в раствор пробы на конце иглы микрошприца (рис. 1a), при этом аналиты распределятся между микрокаплей экстрагента и фазой пробы. После установления межфазного равновесия капля экстракта извлекается обратно в микрошприц и передается на анализ. Капельная микроэкстракция в ряде случаев обеспечивает рекордно высокие коэффициенты концентрирования (для аналитов с высокими значениями коэффициентов распределения). К недостаткам метода относится длительность массопереноса целевых аналитов из раствора в каплю экстрагента и низкая воспроизводимость, связанная с неустойчивостью капли.
Рис. 1.
Схемы капельной микроэкстракции в стационарном режиме (а) и в условиях циклического инжекционного анализа (б).
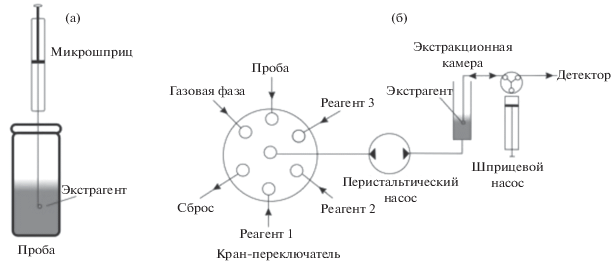
Существенно повысить воспроизводимость КМЭ удалось путем ее автоматизации. Реализация КМЭ в условиях ЦИА потребовала применения шприцевых насосов, которые позволяют дозировать каплю экстрагента в экстракционную камеру с раствором пробы (рис. 1б). Процесс выделения аналита в каплю экстрагента интенсифицируется, благодаря реверсивному движению шприцевого насоса, в результате чего капля многократно вводится и отбирается обратно в проточную систему.
По предложенной схеме реализована задача циклического инжекционного потенциометрического определения кофеина в пробах слюны с предварительным выделением аналита методом КМЭ [19]. В качестве экстрагентов изучены легколетучие хлорорганические растворители с высокой плотностью для обеспечения устойчивости капли в процессе КМЭ и их последующего испарения из экстракционной камеры с целью реэкстракции в растворитель для потенциометрического детектирования аналитов. Согласно разработанной схеме (рис. 1б) последовательно осуществляются процедуры микроэкстракции, замены растворителя и детектирования. Для этого в экстракционную камеру с помощью шприцевого насоса через кран-переключатель подают порцию пробы, в которую с помощью шприцевого насоса выдавливают каплю экстрагента. После завершения массопереноса и удаления пробы из смесительной камеры каплю экстрагента, содержащую кофеин, выдавливают в экстракционную камеру и испаряют экстрагент потоком воздуха, затем растворяют аналит в растворе необходимого состава и направляют в детектор. Так, для автоматизированного потенциометрического определения кофеина в слюне использовали чувствительный к катиону сенсор с жидким внутренним контактом. Сенсор изготовлен на основе мембраны из пластифицированного поливинилхлорида, содержащей тетракис[3,5-бис(трифторметил)фенил]борат калия в качестве электроактивного компонента. Следует отметить, что потенциометрическое определение кофеина в слюне неселективно. Этот недостаток эффективно преодолен использованием метода КМЭ и заменой растворителя. Аналитические характеристики разработанной методики определения кофеина представлены в табл. 1.
Таблица 1.
Аналитические характеристики автоматизированных методик, включающих микроэкстракционное выделение/концентрирование
| Объект анализа | Аналит | Метод детектирования/ определения |
Метод ЖЖЭ | Предел обнаружения, М (г/л) |
Произво-дительность (анализов в час) |
sr | Степень извлечения, % | Коэффициент концентрирования (объем пробы/ объем экстрагента, мкл) |
Литература |
|---|---|---|---|---|---|---|---|---|---|
| Слюна | Кофеин | Потенциометрия | КМЭ | 6 × 10−6 | 6 | 0.020–0.026 | 70 | 210 (300/1) |
[19] |
| Слюна | Антипирин | Спектрофотометрия | ДЖМЭ | 1 × 10−3 | 6 | 0.045 | – | – (1000/300) |
[22] |
| Слюна | Антипирин | Спектрофотометрия | ДЖМЭ | 0.5 × 10−3 | 6 | 0.02–0.025 | – | – (1000/300) |
[24] |
| Куриное мясо | Офлоксацин | ВЭЖХ–УФ | ДЖМЭ | 2 × 10−9 | 3 | 0.021–0.067 | – | – | [25] |
| Моча | Прокаинамид | ВЭЖХ–УФ | ЖЭГР | 2 × 10−7 | 10 | 0.012–0.020 | – | – (100/200) |
[31] |
| Соки | Карбафос, | ВЭЖХ–МС/МС | ЖЭГР | (3 × 10−6) | 5 | 0.03–0.05 | 90–95 | – | [32] |
| диазинон, | (3 × 10−7) | ||||||||
| имидоклоприд, | (3 × 10−5) | ||||||||
| байлетон | (3 × 10−6) | ||||||||
| Лекарственные препараты | Диклофенак | Спектрофотометрия | ЖЭГР | 0.8 × 10−3 | 7 | 0.01–0.08 | – | – (500/600) |
[33] |
| Моча | Тетрациклин | ВЭЖХ–Ф | ЖЭГР | (0.17 × 10−3) | 7 | 0.04–0.08 | 90 | 18 (1000/50) |
[36] |
| Моча | Офлоксацин | ВЭЖХ–ФЛ | ЖЭГР | 1 × 10−8 | 5 | 0.02–0.04 | – | – (1000/50) |
[37] |
Дисперсионная жидкостная микроэкстракция (ДЖМЭ) относится к следующему поколению микроэкстракционных методов [20]. Для реализации ДЖМЭ в экстракционную систему вводят дополнительное диспергирующее вещество (рис. 2а). В качестве таких веществ предложено использовать полярные органические растворители или газ, образующийся в результате химической реакции. Для традиционного варианта ДЖМЭ применяют органический диспергирующий растворитель, который неограниченно смешивается как с водной фазой, так и с фазой экстрагента. В результате быстрого ввода смеси, содержащей диспергирующий растворитель и экстрагент, в фазу анализируемого раствора происходит образование эмульсии – диспергирование экстрагента на микрочастицы с размером десятые–сотые доли микрометра. Это приводит к резкому увеличению поверхности массообмена и скорости установления межфазного равновесия (менее 1 мин) [21].
Рис. 2.
Схемы дисперсионной жидкостной микроэкстракции в стационарном режиме (а), в условия циклического инжекционного анализа с диспергированием экстрагента полярным растворителем (б) и газовой фазой (в).
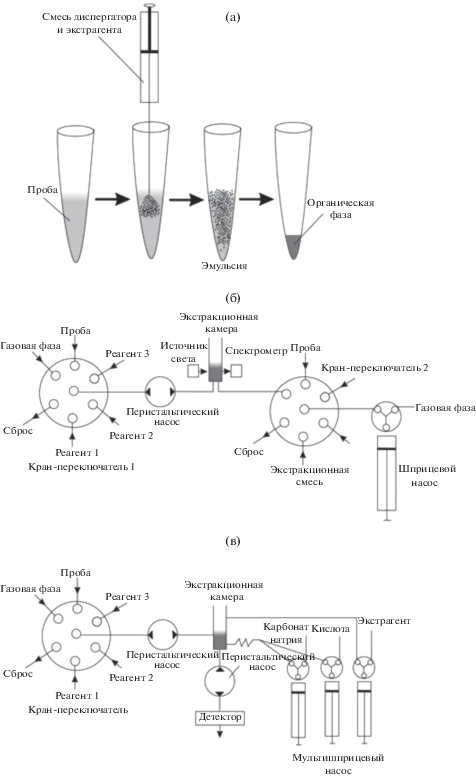
Для автоматизации дериватизации с последующей ДЖМЭ при диспергировании экстрагента полярным растворителем разработана схема пробоподготовки на принципах ЦИА (рис. 2б). В соответствии с этой схемой последовательно осуществляют процедуры дериватизации и ДЖМЭ с помощью двух однотипных кранов-переключателей и перистальтического (для подачи водных сред) и шприцевого (для подачи органических жидкостей) насосов. Для выполнения дериватизации и ДЖМЭ изготовлена специальная экстракционная камера, совмещенная с системой спектрофотометрического детектирования через оптоволоконный кабель. В камеру с помощью перистальтического и шприцевого насосов через однотипные краны-переключатели подаются порции пробы, реагентов и смеси экстрагента с диспергирующим растворителем. Во всех случаях перемешивание водных растворов осуществляется при подаче газовой фазы в экстракционную камеру с помощью перистальтического насоса.
Метод ДЖМЭ реализован в автоматизированной методике спектрофотометрического определения антипирина в слюне [22]. Использовали реакцию образования окрашенного производного 4-нитрозоантипирина в кислой среде в присутствии нитрит-ионов. Растворы пробы и нитрит-ионов подавали в экстракционную камеру и перемешивали потоком газовой фазы. Затем в камеру с помощью шприцевого насоса вводили смесь, содержащую диспергирующий растворитель (ацетонитрил) и экстрагент (хлористый метилен) в объемном соотношении 1 : 1.5. При этом происходило образование эмульсии, которая для быстрого разделения фаз перемешивалась потоком азота. После разделения фаз в экстракционной камере измеряли значение оптической плотности нижней органической фазы. Аналитические характеристики разработанной методики определения антипирина в слюне представлены в табл. 1.
К основным преимуществам классической ДЖМЭ можно отнести низкий расход органических растворителей, высокие коэффициенты концентрирования, простоту исполнения и экспрессность. Однако наряду с достоинствами, ДЖМЭ имеет серьезный недостаток – полярный диспергирующий растворитель снижает эффективность выделения аналитов в фазу экстрагента за счeт увеличения их растворимости в водной фазе [20]. Для решения этой проблемы предложено использовать в качестве диспергирующего вещества газ, образующуюся в результате химической реакции [23]. Такой способ диспергирования экстрагента реализован в ЦИА [24].
Для проточного анализа биологических жидкостей с микроэкстракционным выделением при диспергировании экстрагента газовой фазой разработана и включена в схему анализа многоканальная экстракционная камера (рис. 2в). В качестве дисперигирующего газа для ДЖМЭ 4-нитрозоантипирина использовали диоксид углерода, образующийся из карбонат-ионов при подкислении. Следует отметить, что при диспергировании экстрагента газовой фазой наблюдается более высокая скорость разделения фаз, что позволило сократить продолжительность анализа.
Для устранения основного недостатка ДЖМЭ реализован подход, основанный на диспергировании экстрагента в водной фазе диспергирующим органическим растворителем, способным к ионизации при изменении кислотности раствора [25]. В качестве диспергирующего растворителя изучены различные карбоновые кислоты. Показано, что при введении смеси различных органических экстрагентов и карбоновых кислот в водную щелочную среду происходит нейтрализация карбоновых кислот и быстрое и эффективное диспергирование органической фазы с последующим разделением фаз без центрифугирования. На примере микроэкстракционного выделения офлоксацина в дихлорметан подтверждено, что диспергирующий растворитель (акриловая кислота) при ионизации оказывает высаливающий эффект и обеспечивает более высокий коэффициент распределения аналита по сравнению с классическими диспергирующими растворителями, такими как метанол и ацетонитрил.
Жидкостная экстракция из гомогенного раствора (ЖЭГР) основана на фазовом разделении гомогенного раствора пробы с одновременным массопереносом целевых аналитов в образующуюся органическую фазу. Фазовое разделение при этом может быть инициировано за счет эффектов высаливания [26], высахаривания [27], добавления воды [28], изменения температуры [29] или рН раствора [30]. Метод ЖЭГР – простой и универсальный. Он позволяет снизить расход реагентов и дорогостоящих растворителей, продолжительность экстракции и стоимость анализа. Кроме того, образование органической фазы из гомогенного раствора может быть относительно просто реализовано в экстракционной камере (рис. 3а), коммутированной в гидравлическую схему равновесного проточного анализа.
Рис. 3.
Схемы жидкостной экстракции из гомогенного раствора, в экстракционной камере (а) и в шприцевом насосе (б).
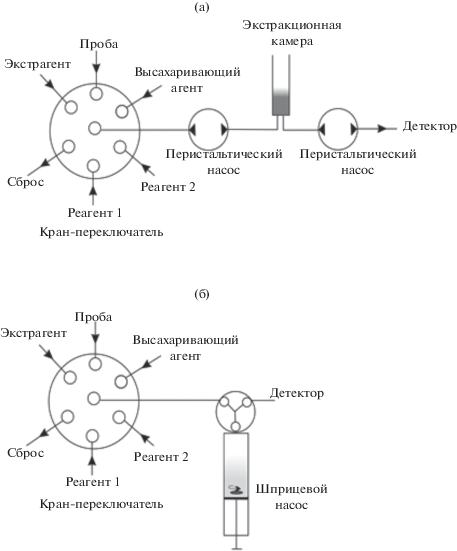
В качестве экстрагентов в ЖЭГР обычно используют полярные растворители (метанол, ацетонитрил, ацетон), которые смешиваются с водой, образуя гомогенную систему. Растворимость полярных растворителей в воде можно понизить, добавляя вещества, которые сольватируются преимущественно водой, – органические и неорганические соли (высаливающие агенты), а также моно- и дисахариды (высахаривающие агенты), что приводит к разделению фаз. Эта возможность реализована в автоматизированных схемах ЖЭГР для определения прокаинамида в пробах мочи [31] и пестицидов (карбафоса, диазинона, имидоклоприда и байлетона) в соках [32].
Схема определения прокаинамида в моче предполагает последовательное введение порций пробы мочи, ацетонитрила (экстрагент) и раствора глюкозы (высахаривающий агент) в экстракционную камеру (рис. 3а). Поток воздуха использовали для перемешивания фаз, ускорения экстракционного процесса и последующего разделения фаз. После быстрого фазового разделения в экстракционной камере выделившуюся фазу ацетонитрила, содержащую прокаинамид, инжектировали в ВЭЖХ−УФ-систему. Достоинствами данного метода является простота реализации и экспрессность выполнения стадии пробоподготовки. Кроме того, ацетонитрил входит в состав подвижной фазы, что исключает необходимость стадии замены растворителя перед вводом экстракта в систему ВЭЖХ–УФ.
На эффекте высахаривания, применяемом для разделения фаз в системе проба−ацетонитрил, основана также методика определения пестицидов в соках. Принципиальное отличие этой схемы – использование в качестве экстракционной камеры шприцевого насоса, в который последовательно отбирают порции пробы, ацетонитрила и раствора высахаривающего агента (рис. 3б). Для перемешивания применяли вкладыш магнитной мешалки, помещенный в шприцевой насос. После разделения фаз, верхняя органическая фаза (экстракт) подавалась в систему ВЭЖХ–тандемный масс-спектрометр (ВЭЖХ–МС/МС). Разработанный автоматизированный вариант ЖЭГР, реализуемый в шприцевом насосе, является простым, удобным, экспрессным и надежным методом пробоподготовки, а сочетание с ВЭЖХ–МС/МС позволило достичь требуемых низких пределов обнаружения пестицидов (табл. 1).
Показано, что высаливающее действие могут оказывать и растворы щелочей. Эта возможность использована для одновременной дериватизации и микроэкстракции диклофенака [33]. Так, предложена полностью автоматизированная процедура встроенного в линию спектрофотометрического определения диклофенака в лекарственных препаратах. Метод основан на окислении диклофенака гексацианоферратом натрия в щелочной среде с последующей стадией выделения фазы ацетонитрила из гомогенного раствора и одновременной экстракцией аналита. Аналитический сигнал измеряли непосредственно в фазе ацетонитрила, используя оптический зонд, что позволило осуществить детектирование кинетически нестабильной окисленной формы диклофенака, сохраняя при этом высокую воспроизводимость анализа (табл. 1).
Новым направлением в ЖЭГР стало применение экстрагентов с “переключаемой гидрофильностью” (ЭПГ). В качестве таких экстрагентов предложено использовать третичные амины [34] и высшие карбоновые кислоты [35], которые позволили реализовать ЖЭГР в микроэкстракционном варианте. Для перевода гетерогенной системы водная фаза–третичный амин в гомогенную систему последний переводят в гидрокарбонат по реакции с диоксидом углерода. Кроме того, обнаружено образование изотропных водных растворов высших первичных аминов [36]. В этом случае также наблюдалось разделение фаз за счет добавления растворов высаливающих агентов. Такую систему использовали для автоматизированного определения тетрациклина в пробах мочи методом ВЭЖХ–УФ. Микроэкстракцию проводили в экстракционной камере ЦИА, в которую с помощью шприцевого насоса последовательно подавали пробу, 1-октиламин (экстрагент) и раствор хлорида натрия. Электролит инициировал разделение фаз и микроэкстракционное концентрирование аналита в мицеллярную фазу 1-октиламина, обеспечивая при этом устранение негативного влияния матрицы пробы.
В случае высших карбоновых кислот для выделения фазы из гомогенного раствора требуется лишь изменение рН раствора, что можно легко осуществить в условиях проточного анализа. В щелочной среде происходит практически полная ионизация экстрагентов, за счет чего они растворяются в водной фазе. При подкислении гомогенного раствора соль карбоновой кислоты переходит в гидрофобную форму, образуя собственную фазу, что позволяет использовать высшие карбоновые кислоты в качестве экстрагентов. Разработан новый полностью автоматизированный метод определения офлоксацина в моче, включающий микроэкстракционное выделение аналита в высшую карбоновую кислоту для последующего ВЭЖХ-определения с флуоресцентным детектированием [37]. В этом экстракционном методе показана возможность использования насыщенных жирных кислот в качестве ЭПГ. Конверсию жирной кислоты из ее гидрофобной формы в гидрофильную осуществляли за счет добавления к экстракционной смеси избытка карбоната натрия. При этом Na2CO3 выполнял тройную функцию: обеспечивал требуемую щелочную среду, способствовал перемешиванию и разделению фаз за счет выделения диоксида углерода в кислой среде. Следует отметить, что высшие карбоновые кислоты представляют особый интерес с точки зрения “зеленой” аналитической химии, так как они обладают низкой летучестью и нетоксичны.
Для автоматизации микроэкстракционных методов, рассмотренных в данном обзоре, разработаны гидравлические схемы ЦИА, которые включают общедоступное оборудование и материалы, такие как многоходовые краны-переключатели, шприцевые и перистальтические насосы, трубки для создания потоков и коммуникаций. К используемому оборудованию и материалам предъявляются следующие требования: устойчивость в среде применяемых органических растворителей и отсутствие “эффектов памяти”. Краны-переключатели и трубки для коммуникаций, изготовленные из политетрафторэтилена, стеклянные шприцевые насосы и трубки для перистальтических насосов из модифицированного поливинилхлорида обеспечили возможность автоматизации методов КМЭ, ДЖМЭ и ЖЭГР. Кроме того, ЦИА позволяет включать дополнительные стадии промывки гидравлических схем с целью устранения “эффектов памяти”.
На основании базы данных Scopus® можно сделать вывод, что методы ДЖМЭ и ЖЭГР нашли наиболее широкое применение в проточном анализе (рис. 4). Во всех методиках равновесного проточного анализа, включающих ДЖМЭ и ЖЭГР [22, 24, 25, 31, 36, 37], использовали дополнительное перемешивание водной и органической фаз потоком газа с целью интенсификации массопереноса и достижения равновесных условий. Сообщается [38, 39], что при автоматизации ДЖМЭ на принципах последовательного инжекционного анализа, который относится к неравновесным проточным методам, в гидравлические схемы для разделения фаз включали колонки с пористым сорбентом или экстракционные камеры, при этом дополнительное перемешивание фаз для достижения равновесных условий не применяли.
Рис. 4.
Распределение опубликованных с 1996 г. работ по автоматизированным микроэкстракционным методам.
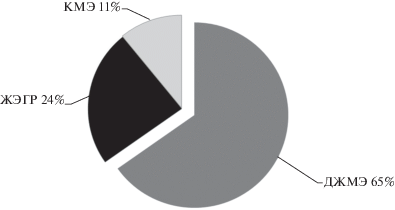
Несмотря на то, что метод КМЭ является первым из автоматизированых микроэкстракционных методов [18], широкого практического применения в проточном анализе он не нашел (рис. 4). Кроме автоматизированной КМЭ на принципах ЦИА [19], описаны методики последовательного инжекционного анализа [40] и проточного анализа “в шприцевом насосе” [41], включающие КМЭ. Во все разработанные гидравлические схемы включали экстракционные камеры, в которых каплю экстрагента дозировали в водную фазу с помощью шприцевого насоса. В отличие от аналогов, в ЦИА экстракционная камера сообщается с атмосферой, что позволяет выполнять замену легколетучего растворителя после КМЭ при подаче потока газовой фазы.
Авторы выражают благодарность РФФИ (грант 18-33-20004) за финансовую поддержку.
Список литературы
Horstkotte B., Miró M., Solich P. Where are modern flow techniques heading to? // Anal. Bioanal. Chem. 2018. V. 140. P. 6361.
Цизин Г.И., Статкус М.А. Проточный химический анализ. Гл. 7. М.: Наука, 2014. 428 с.
Крылов В.А., Крылов А.В., Мосягин П.В., Маткивская Ю.О. Жидкофазное микроэкстракционное концентрирование примесей // Журн. аналит. химии. 2011. Т. 6. № 4. С. 341. (Krylov V.A., Krylov A.V., Mosyagin P.V., Matkivskaya Yu.O. Liquid-phase microextraction preconcentration of impurities // J. Analyt. Chem. 2011. V. 66. P. 331.)
Campillo N., López-García I., Hernández-Córdoba M., Viñas P. Food and beverage applications of liquid-phase microextraction // Trends Anal. Chem. 2018. V. 109. P. 116.
Hashemi B., Zohrabi P., Kim K.-H., Shamsipura M., Deep A., Hong J. Recent advances in liquid-phase microextraction techniques for the analysis of environmental pollutants // Trends Anal. Chem. 2017. V. 97. P. 83.
Yaminia Y., Rezazadehb M., Seidi Sh. Liquid-phase microextraction – The different principles and configurations // Trends Anal. Chem. 2019. V. 112. P. 264.
Anthemidis A.N., Giakisikli G., Mitani C. Flow injection dual-syringe sorbent extraction platform for metal determination in environmental matrices utilizing a new strong cation exchange sorbent micro-cartridge and flame atomic absorption spectrometry // Int. J. Environ. Anal. Chem. 2012. V. 92. P. 1276.
Acebal C.C., Sklenářová H., Škrlíková J., Šrámková I., Andruch V., Balogh I.S., Solich P. Application of DV-SIA manifold for determination of thiocyanate ions in human saliva samples // Talanta. 2012. V. 96. P. 107.
Lomonte C., Currell M., Morrison R.J.S., McKelvie I.D., Kolev S.D. Sensitive and ultra-fast determination of arsenic(III) by gas-diffusion flow injection analysis with chemiluminescence detection // Anal. Chim. Acta. 2007. V. 583. P. 72.
Bloch C., Simon J., Moskvin L.N., Rodinkov O.V. The properties of chromatomembrane cells in flow systems coupled to gas chromatography-analysis of volatile organic compounds // Talanta. 2000. V. 52. P. 123.
Tajik M., Yamini Y., Esrafili A., Ebrahimpour B. On-line extraction and determination of two herbicides: Comparison between two modes of three-phase hollow fiber microextraction // J. Sep. Sci. 2015. V. 38. P. 649.
Maya F., Horstkotte B., Estela J.M., Cerdà V. Lab in a syringe: Fully automated dispersive liquid-liquid microextraction with integrated spectrophotometric detection // Anal. Bioanal. Chem. 2012. V. 404. P. 909.
Alexovič M., Horstkotte B., Solich P., Sabo J. Automation of static and dynamic non-dispersive liquid phase microextraction. Part 1: Approaches based on extractant drop-, plug-, film- and microflow-formation // Anal. Chim. Acta. 2016. V. 906. P. 22.
Alexovič M., Horstkotte B., Solich P., Sabo J. Automation of static and dynamic non-dispersive liquid phase microextraction. Part 2: Approaches based on impregnated membranes and porous supports // Anal. Chim. Acta. 2016. V. 907. P. 18.
Alexovič M., Horstkotte B., Šrámková I., Solich P., Sabo J. Automation of dispersive liquid–liquid microextraction and related techniques. Approaches based on flow, batch, flow-batch and in-syringe modes // Trends Anal. Chem. 2017. V. 86. P. 39.
Vakh Ch., Falkova M., Timofeeva I., Moskvin A., Moskvin L., Bulatov A. Flow analysis: A novel approach for classification // Crit. Rev. Anal. Chem. 2016. V. 46. P. 374.
Булатов А.В., Москвин А.Л., Москвин Л.Н., Вах К.С., Фалькова М.Т., Шишов А.Ю. Автоматизация и миниатюризация химического анализа на принципах проточных методов // Научное приборостроение. 2015. Т. 25. С. 3.
Liu H.H., Dasgupta P.K. Analytical chemistry in a drop. Solvent extraction in a microdrop // Anal. Chem. 1996. V. 68. P. 1817.
Timofeeva I., Medinskaia K., Nikolaeva L., Kirsanov D., Bulatov A. Stepwise injection potentiometric determination of caffeine in saliva using single-drop microextraction combined with solvent exchange // Talanta. 2016. V. 150. P. 655.
Andruch V., Balogh I.S., Kocúrová L., Šandrejová J. Five years of dispersive liquid–liquid microextraction // Appl. Spectrosc. Rev. 2013. V. 48. P. 161.
Kocúrová L., Balogh I.S., Šandrejová J., Andruch V. Recent advances in dispersive liquid–liquid microextraction using organic solvents lighter than water. A review // Microchem. J. 2012. V. 102. P. 11.
Bulatov A., Medinskaia K., Aseeva D., Garmonov S., Moskvin L. Determination of antipyrine in saliva using the dispersive liquid-liquid microextraction based on a stepwise injection system // Talanta. 2015. V. 133. P. 66.
Lasarte-Aragonés G., Lucena R., Cárdenas S., Valcárcel M. Effervescence assisted dispersive liquid–liquid microextraction with extractant removal by magnetic nanoparticles // Anal. Chim. Acta. 2014. V. 807. P. 61.
Medinskaia K., Vakh Ch., Aseeva D., Andruch V., Moskvin L., Bulatov A. A fully automated effervescence assisted dispersive liquid-liquid microextraction based on a stepwise injection system. Determination of antipyrine in saliva samples // Anal. Chim. Acta. 2016. V. 902. P. 129.
Timofeeva I., Timofeev S., Moskvin L., Bulatov A. A dispersive liquid-liquid microextraction using a switchable polarity dispersive solvent. Automated HPLC−FLD determination of ofloxacin in chicken meat // Anal. Chim. Acta. 2017. V. 949. P. 35.
Xu X.-Y., Ye J.-q., Nie J., Li Z.-G., Lee M.-R. A new liquid-liquid microextraction method by ultrasound assisted salting-out for determination of triazole pesticides in water samples coupled by gas chromatography-mass spectrometry // Anal. Methods. 2015. V. 7. P. 1194.
Feng H., Ezeji T., Blaschek H. Sugaring-out separation of acetonitrile from its aqueous solution // Chem. Eng. Technol. 2008. V. 31. № 12. P. 1869.
Takagai Y., Kubota T., Akiyama R., Aoyama E., Igarashi S. Preconcentration technique for nonylphenol using cellulose cotton with homogenous liquid–liquid extraction for liquid chromatographic analysis // Anal. Bioanal. Chem. 2004. V. 380. P. 351.
Gao Y., Zhou Q., Xie G., Yao Z. Temperature-controlled ionic liquid dispersive liquid-phase microextraction combined with HPLC with ultraviolet detector for the determination of fungicides // J. Sep. Sci. 2012. V. 35. P. 3569.
Shahvandi S.K., Banitaba H.M., Ahmar H. Development of a new pH assisted homogeneous liquid-liquid microextraction by a solvent with switchable hydrophilicity: Application for GC−MS determination of methamphetamine // Talanta. 2018. V. 184. P. 103.
Nugbienyo L., Malinina Y., Garmonov S., Kamencev M., Salahov I., Andruch V., Moskvin L., Bulatov A. Automated sugaring-out liquid-liquid extraction based on flow system coupled with HPLC−UV for the determination of procainamide in urine // Talanta. 2017. V. 167. P. 709.
Timofeeva I., Shishov A., Kanashina D., Dzema D., Bulatov A. On-line in-syringe sugaring-out liquid-liquid extraction coupled with HPLC−MS/MS for the determination of pesticides in fruit and berry juices // Talanta. 2017. V. 167. P. 761.
Pochivalov A., Vakh Ch., Andruch V., Moskvin L., Bulatov A. Automated alkaline-induced salting-out homogeneous liquid-liquid extraction coupled with in-line organic-phase detection by an optical probe for the determination of diclofenac // Talanta. 2017. V. 169. P. 156.
Vanderveen J.R., Durellea J., Jessop Ph.G. Design and evaluation of switchable-hydrophilicity solvents // Green Chem. 2014. V. 16. P. 1187.
Shih H.K., Shu T.Y., Ponnusamy V.K., Jen J.F. A novel fatty-acid-based in-tube dispersive liquid – liquid microextraction technique for the rapid determination of nonylphenol and 4-tert-octylphenol in aqueous samples using high-performance liquid chromatography – ultraviolet // Anal. Chim. Acta. 2015. V. 854. P. 70.
Cherkashina K., Vakh Ch., Lebedinets S., Pochivalov A., Moskvin L., Lezov A., Bulatov A. An automated salting-out assisted liquid-liquid microextraction approach using 1-octylamine: On-line separation of tetracycline in urine samples followed by HPLC−UV determination // Talanta. 2018. V. 184. P. 122.
Vakh Ch., Pochivalov A., Andruch V., Moskvin L., Bulatov A. A fully automated effervescence-assisted switchable solvent-based liquid phase microextraction procedure: Liquid chromatographic determination of ofloxacin in human urine samples // Anal. Chim. Acta. 2016. V. 907. P. 54.
Anthemidis A.N., Ioannou K.-I.G. On-line sequential injection dispersive liquid–liquid microextraction system for flame atomic absorption spectrometric determination of copper and lead in water samples // Talanta. 2009. V. 79. P. 86.
Andruch V., Acebal C.C., Škrlíková J., Sklenářová H., Solich P., Balogh I.S., Billes F., Kocurova L. Automated on-line dispersive liquid–liquid microextraction based on a sequential injection system // Microchem. J. 2012. V. 100. V. 77.
Anthemidis A.N., Adam I.S.I. Development of on-line single-drop micro-extraction sequential injection system for electrothermal atomic absorption spectrometric determination of trace metals // Anal. Chim. Acta. 2009. V. 632. P. 216.
Šrámková I.H., Horstkotte B., Fikarová K., Sklenářová H., Solich P. Direct-immersion single-drop microextraction and in-drop stirring microextraction for the determination of nanomolar concentrations of lead using automated Lab-In-Syringe technique // Talanta. 2018. V. 184. P. 162.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


