Журнал аналитической химии, 2019, T. 74, № 2, стр. 83-90
Флуориметрическое определение артемизинина с использованием системы пиронин-Б–микропероксидаза-11
С. В. Мугинова 1, Е. С. Вахранева 1, Д. А. Мясникова 2, Т. Н. Шеховцова 1, *
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, ГСП-2, Ленинские горы, 1, стр. 3, Россия
2 Йокогамский национальный университет, факультет инженерии
240-8501
Йокогама, Ходогая-ку, Токивадай 79-5, Япония
* E-mail: tnshekh@yandex.ru
Поступила в редакцию 16.11.2017
После доработки 10.04.2018
Принята к публикации 10.04.2018
Аннотация
С использованием биомиметика пероксидазной активности микропероксидазы-11 разработана чувствительная, экспрессная и простая флуориметрическая методика определения артемизинина в диапазоне концентраций 0.1–7 мкМ, sr = 0.008 (при сн, n = 5), смин = 7.1 нМ (3s0). Определение основано на тушении флуоресценции катионного ксантенового красителя пиронина Б (штерн-фольмеровская константа тушения − 0.101 мкМ−1) в присутствии микропероксидазы-11. Разработанная методика апробирована при анализе биологически активной добавки на основе экстракта полыни Artemisia annua. Правильность результатов флуориметрического определения артемизинина в биологически активной добавке подтверждена методом ВЭЖХ-масс-спектрометрии. Применение олигопептида микропероксидазы-11 вместо гемсодержащих белков (гемоглобина, цитохрома с и пероксидазы хрена) позволяет сократить продолжительность определения артемизинина в 2 раза при сохранении чувствительности и селективности.
Согласно данным Всемирной организации здравоохранения наиболее эффективными средствами для лечения тропической малярии во всем мире являются комбинированные фармацевтические препараты на основе артемизинина и его производных [1]. Артемизинин представляет собой сесквитерпеновый лактон с 1,2,4-триоксановым гетероциклическим ядром (рис. 1, структура I). Этот фрагмент молекулы, так называемый “фармакофор”, содержит эндопероксидный мостик, который определяет антималярийную активность артемизинина [2]. Сырьем для получения артемизинина служит полынь однолетняя Artemisia annua L., которую культивируют в Восточной Азии и Африке в медицинских целях [3]. В Российской Федерации полынь Artemisia annua L. произрастает на территории Республики Бурятия [4]. За исследования по выделению артемизинина из полыни однолетней, установление его структуры и обнаружение антималярийного действия (1972 г.) китайский фармаколог Ту Юю была удостоена Нобелевской премии по физиологии и медицине в 2015 г.
В последние годы повышенный научный интерес к артемизинину обусловлен его способностью подавлять не только активность малярийного плазмодия, но и раковых клеток, ряда вирусов, микробов, грибков, а также простейших и гельминтов [5]. Хотя содержащие артемизинин биологические добавки (БАД) и Artemisia annua чай пока не рекомендованы к использованию в традиционной медицине в России и за рубежом, отмечен эффективный ответ раковых опухолей у человека in vitro [6, 7] и животных in vivo [8] на лечение растительными препаратами на основе артемизинина. Есть мнение, что как и в случае малярийного плазмодия, гем опухолевой клетки (точнее Fe(II) в нем) может служить возможным медиатором и молекулярной мишенью артемизинина [2]. В индикаторных системах для химического анализа гемсодержащие белки могут имитировать гем малярийного плазмодия или опухолевой клетки при взаимодействии с артемизинином.
Ранее для чувствительного косвенного флуоресцентного определения артемизинина в плазме крови и моче использовали гемсодержащие белки (гемоглобин и цитохром с), а также металлоферменты (пероксидаза хрена и тирозиназа) в сочетании с катионным красителем пиронином Б (ПБ) (рис. 1, структура II) [9–12]. Разработанные методики основаны на тушении флуоресценции ПБ артемизинином при 545–547 нм (в зависимости от природы белка), λвозб = 345 нм. По мнению авторов работ [9–12], биомолекулы служили катализаторами реакции окисления ПБ артемизинином, который выступал в роли субстрата-окислителя подобно H2O2. Заметим, что артемизинин при указанных выше условиях не флуоресцирует. Спектр поглощения его водного раствора с концентрацией 10 мкМ характеризуется интенсивным максимумом поглощения вне ближней УФ-области (λ < 200 нм), прилегающим к нему плечом (ε220 ~ 103) и очень слабым “хвостом” в области >300 нм [13].
Для настоящего исследования мы выбрали микропероксидазу-11 (МП) из лошадиного сердца, водорастворимый олигопептид, полученный протеолитическим расщеплением цитохрома с. Каталитический центр МП представляет собой железопорфирин с ковалентно связанными с ним одиннадцатью аминокислотными остатками (рис. 1, структура III) [14]. Микропероксидазу-11 успешно применяют для определения Н2О2 в амперометрических биосенсорах [15] и оптических биосенсорах на основе поверхностного плазмонного резонанса [16]. Основное преимущество МП перед цитохромом с и другими гемсодержащими белками (гемоглобином, пероксидазой хрена) состоит в стерически незатрудненном пространственном окружении гема, что, по нашему мнению, должно облегчать подход молекулы артемизинина к железу(II). Благодаря применению МП совместно с ПБ мы рассчитывали улучшить аналитические характеристики методик флуориметрического определения артемизинина, в том числе и недавно разработанной нами методики на основе системы Mn(II)−додецилсульфат натрия−ПБ [17]. Исследования по созданию чувствительных и простых оптических аналитических систем для определения артемизинина в фармацевтических препаратах, БАДах, экстрактах и растительном сырье по-прежнему актуальны в связи с потребностью экспрессного контроля качества указанных объектов.
Цель настоящего исследования состояла в разработке методики флуоресцентного определения артемизинина с использованием системы ПБ−МП и апробация ее при анализе БАД на основе экстракта полыни Artemisia annua. Дополнительный научный интерес представляло сравнение аналитических возможностей МП и использованных ранее гемсодержащих белков и металлоферментов для флуоресцентного определения артемизинина в системах с ПБ, оценка возможности их взаимозаменяемости.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные вещества. Из-за низкой растворимости артемизинина в воде (1.21 мг/мл при 37°С [18]) его исходные 5 мМ растворы готовили растворением навесок препарата (Сигма, США) в этаноле, метаноле и диметилсульфоксиде (ДМСО) (ч. д. а., Химмед, Россия) в посуде из темного стекла. Исходные растворы артемизинина хранили при 4°С и использовали в течение 5 дней. Рабочие 3 и 30 мкМ растворы артемизинина готовили разбавлением исходных растворов водой и использовали в день приготовления. Для приготовления всех водных растворов использовали деионированную воду, очищенную на установке Миллипор (Франция), с удельным сопротивлением не более 18.2 МОм см (25°С).
Для обеспечения мономерной формы ПБ в водном растворе и предотвращения возможной агрегации красителя [19] его рабочий 30 мкМ раствор готовили ежедневно растворением в воде навески твердого препарата (ОАО “Опытно-экспериментальный завод” ИРЕА, Москва). Качество препарата ПБ проверяли методом ТСХ путем нанесения 1%-ного водного раствора красителя на нормально-фазовую силикагелевую пластинку со стеклянной подложкой Аналтех (Ньюарк, США), подвижная фаза − смесь н-бутанол−вода−CH3COOH (10 : 2 : 1, по объему) [20]. После полного высыхания ТСХ-пластинки на воздухе получали одно пятно розового цвета с Rf = 0.81. Отсутствие ионов Fe(III) в препарате ПБ подтверждали качественной реакцией с NH4SCN. Рабочий 50 мкМ раствор МП готовили растворением твердого препарата двунатриевой соли МП из лошадиного сердца (Mr = 1861.92, pI 4.7; Сигма, США) в 10 мМ фосфатном буферном растворе (ФБР) с рН 7.0 и использовали в день приготовления. Концентрацию раствора МП устанавливали спектрофотометрически, ε395 = 1.76 × 105 [21]. Твердый препарат МП хранили при −20°С. Универсальный буферный раствор (УБР) готовили смешением 0.04 М растворов уксусной, борной и ортофосфорной кислот с добавлением необходимого количества 0.2 М раствора NaOH в зависимости от требуемого pH. Цитратный, цитратно-фосфатный буферные растворы и ФБР (0.1 М и 10 мМ) готовили, как описано в работе [22]. Применяли 11.2 М раствор Н2О2 без стабилизатора (Мерк, Германия), точную концентрацию которого устанавливали спектрофотометрически, ε230 = 72.7 [23]. Рабочие растворы Н2О2 с меньшими концентрациями готовили ежедневно разбавлением концентрированного раствора водой. Рабочие 0.1 М растворы глюкозы и фруктозы готовили растворением навесок их твeрдых препаратов (Сигма, США) в воде и использовали в день приготовления. Рабочие растворы солей Fe(III), Co(II), Cu(II) и Mg(II) с концентрацией ионов металлов 1 мг/мл готовили разбавлением водой государственных стандартных образцов № 7766-2000, 7784-2000, 7764-2000 и 7767-2000 (Экоаналитика, Россия) соответственно. Рабочий раствор Fe(II) (1 мг/мл) готовили разбавлением водой стандартизованного по дихромату калия раствора соли Мора.
Аппаратура. Спектры флуоресценции регистрировали на спектрофлуориметре Шимадзу RF 5301 (Япония, l = 1 см, ширина входной и выходной щелей – 5 нм). Для регистрации спектров поглощения растворов и изучения кинетики реакции использовали спектрофотометр Шимадзу UV mini-1240A (Япония, l = 1 см) с погрешностью ±0.0003 опт. ед. Измеряли рН буферных растворов на рН-метре–иономере Эксперт–001 (Россия) с погрешностью ±0.01 ед. рН. Для проведения экстракции использовали шейкер ЕLMIS-3.16L (Латвия). Для фиксирования времени проведения реакций использовали секундомер фирмы Агат (Россия), погрешность ±0.2 с. Для отбора определенных объемов растворов реагентов применяли микродозаторы Биохит (Финляндия) и Эппендорф (США).
Методика выполнения реакции между пиронином Б и артемизинином в присутствии микропероксидазы-11. В пробирку емк. 5 мл последовательно вносили 75–1200 мкл 30 мкМ раствора ПБ, 12.5–500 мкл 50 мкМ раствора МП, 0–100 мкл 30 мкМ водно-органического раствора артемизинина (95 : 5, по объему), 0–100 мкл органического растворителя (метанол, этанол или ДМСО) так, чтобы объем органического растворителя оставался постоянным и равным 100 мкл, и необходимое количество буферного раствора с рН 3.5–6.8 до конечного объема 3.0 мл. Раствор перемешивали, переливали в кювету, выдерживали 1 мин и либо регистрировали спектры флуоресценции в интервале длин волн 500–650 нм, либо измеряли величины интенсивности флуоресценции в отсутствие (I0) и в присутствии (I) артемизинина (λфл/λвозб = 569/345 нм). При проведении контрольного опыта вместо раствора артемизинина вводили такой же объем органического растворителя. Для расчeта погрешности отношений интенсивностей флуоресценции (I0/I) здесь и далее применяли программу GraphPad.
Методика определения артемизинина в модельных растворах методом градуировочной зависимости. В пробирку емк. 5 мл последовательно вносили 200 мкл 30 мкМ раствора ПБ; 240 мкл 50 мкМ раствора МП; 0, 10, 20, 30, 40, 50, 60, 70 мкл 30 мкМ или 10, 50 мкл 3 мкМ этанольного раствора артемизинина; затем такой объем этанола, чтобы его общий объем в системе оставался постоянным (100 мкл), после чего объем реакционного раствора доводили до 3.00 мл с помощью УБР с рН 5.9. Раствор перемешивали, переливали в кювету, выдерживали 1 мин и измеряли интенсивность флуоресценции (λфл/λвозб = 569/345 нм) в отсутствие и в присутствии артемизинина. По полученным данным рассчитывали отношение интенсивностей и строили градуировочную зависимость в координатах I0/I–сартемизинин (мкМ).
Подготовка БАД к анализу. Для извлечения артемизинина из образца БАД использовали экстракцию этанолом [17]. Белый порошок из капсул БАД помещали в фарфоровую ступку и тщательно растирали. Затем навеску порошка (0.2540 г) растворяли в 20.0 мл этанола в течение 2 ч при постоянном встряхивании на шейкере. Не растворившиеся в этаноле целлюлозу и стеарат магния (вспомогательные компоненты БАД) отфильтровывали через фильтр марки “синяя лента”. Далее 30 мкл фильтрата разбавляли этанолом до 1.5 мл. Аликвоты полученного раствора вводили в реакционную смесь.
Методика определения артемизинина в БАД методом добавок. В пробирку емк. 5 мл вводили последовательно 200 мкл 30 мкМ раствора ПБ, 240 мкл 50 мкМ раствора МП, 10 мкл анализируемого раствора и 10 мкл стандартного раствора артемизинина в качестве добавки (концентрации в реакционной смеси 0.5, 1.0, 1.5, 2.0, 2.5 мкМ). Суммарный объем реакционной смеси после ее разбавления УБР с рН 5.9 составлял 3.0 мл. Градуировочную зависимость строили в координатах (I0/I − 1)–сартемизинин (мкМ) в диапазоне концентраций артемизинина 0.5–2.5 мкМ. Погрешность определения артемизинина методом добавок оценивали методом экстраполяции, как указано в работе [24]. Правильность определения артемизинина в БАД подтверждали методом ВЭЖХ–масс-спектрометрии (МС), используя описанную нами ранее методику [17].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
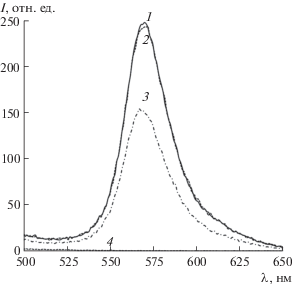
Выбор условий регистрации флуоресценции в системе пиронин Б−микропероксидаза-11−артемизинин. Действие артемизинина на флуоресцентный сигнал ПБ в присутствии МП исследовали в условиях, описанных для цитохрома с [9]. Спектры флуоресценции реакционных растворов смеси ПБ–МП в отсутствие и в присутствии 5 мкМ артемизинина (рис. 2) регистрировали после облучения их светом с длиной волны 345 нм, как рекомендовано для систем с применением других биомолекул [9–12]. Как видно из рис. 2 (спектр 1), в условиях нашего эксперимента максимум свечения ПБ лежит при 569 нм, т.е. батохромно сдвинут относительно полосы испускания красителя 545–547 нм [9–12]. На наш взгляд, этот сдвиг может быть обусловлен применением твердого препарата ПБ другого производителя. При добавлении артемизинина к смеси ПБ−МП в УБР (рН 6.0) интенсивность флуоресценции ПБ в максимуме уменьшается на 90 усл. ед. по сравнению с контрольным опытом (в отсутствие артемизинина и в присутствии этанола) (рис. 2, спектры 2 и 3). В интервале длин волн 550–590 нм, в котором ПБ интенсивно флуоресцирует, МП уменьшает флуоресценцию красителя не более чем на 2 усл. ед. в отсутствие собственного излучения (рис. 2, спектры 2 и 4 соответственно). Это свидетельствует о перспективности использования системы ПБ−МП для разработки методики определения артемизинина по тушению флуоресценции ПБ (λфл/λвозб = = 569/345 нм). Отметим, что при возбуждении флуоресценции ПБ при длине волны 552 нм, соответствующей характеристическому максимуму его поглощения в водном и водно-спиртовых растворах [25, 26], интенсивности флуоресценции ПБ в максимуме (574 нм) в отсутствие и в присутствии артемизинина различались не более чем на 15 усл. ед. при прочих равных услових. Таким образом, для возбуждения флуоресценции ПБ в целях определения артемизинина лучше использовать излучение с λвозб = 345 нм, которое соответствует значительно менее интенсивному по сравнению с основным (552 нм) максимуму поглощения красителя. Более того, возбуждение свечения в системе ПБ−МП−артемизинин при 345 нм позволяет адекватно сравнивать степень тушения флуоресценции ПБ артемизинином в присутствии олигопептида и исследованных ранее белков [9–12].
Рис. 2.
Спектры флуоресценции системы ПБ−МП в отсутствие (1, 2) и в присутствии артемизинина (3) и МП (4). Условия реакции: УБР, рН 6.0, сПБ = 2 мкМ (1–3), сМП = 5 мкМ (1–4), сартемизинина = 5 мкМ (3), сэтанола = 5 об.% (1–3), продолжительность реакции 2 мин; λвозб = 345 нм.
При выборе условий (рН и природа буферного раствора, концентрации ПБ и МП, природа и содержание органического растворителя в растворе артемизинина и время реакции), при которых тушение флуоресценции ПБ артемизинином в присутствии МП наиболее эффективно, придерживались методики, описанной в “Экспериментальной части”. Работу проводили при постоянной концентрации артемизинина в реакционном растворе, равной 5 мкМ. Оптимальными считали параметры, при которых достигались наибольшая степень тушения флуоресценции ПБ, характеризуемая отношением I0/I, и высокая воспроизводимость результатов. Работу проводили при комнатной температуре для обеспечения постоянной степени агрегации МП.
Выбор рН и природы буферного раствора. Как видно из представленной на рис. 3 зависимости I0/I от рН, степень тушения флуоресценции ПБ артемизинином в УБР максимальна в диапазоне рН 5.3−6.2, однако наилучшая воспроизводимость результатов измерений достигалась при рН 5.9 (sr = 0.003, n = 5). Кроме того, при рН 5.9 величина I0/I возрастает в ряду буферных растворов: ФБР (1.13) = цитратный (1.13) < цитратно-фосфатный (1.26) < УБР (1.47). Таким образом, в качестве рабочего буферного раствора обоснованно выбрали УБР с рН 5.9.
Рис. 3.
Зависимость величины I0/I в системе ПБ−МП от рН. Условия реакции: УБР, сПБ = 2 мкМ, сМП = 5 мкМ, сарт-емизинина = 5 мкМ, продолжительность реакции 2 мин; λфл/λвозб = 569/345 нм; n = 5, P = 0.95.

Выбор природы и содержания органического растворителя. Поскольку ПБ [26] и МП [27] чувствительны к присутствию органического растворителя в системе, изучили зависимость интенсивности флуоресценции ПБ от природы органического растворителя, использованного для приготовления исходного раствора артемизинина. В работе применяли 30 мкМ рабочие растворы артемизинина, содержащие 5 об. % одного из органических растворителей (метанол, этанол или ДМСО). Растворимость артемизинина (мг/мл) при 25°С повышается в ряду: ДМСО (10) < < метанол (12.8) < этанол (28.3) [28, 29]. Ранее влияние природы органического растворителя на степень тушения флуоресценции ПБ артемизинином в системах с белками [9–12] не изучали. Установили, что наилучшим растворителем для артемизинина является этанол, применение которого обеспечивает не только самый высокий сигнал контрольного опыта (I0 = 247 ± 2 усл. ед., n = 3, P = 0.95), но и наибольшую степень тушения флуоресценции красителя. Так, отношение I0/I возрастает в ряду растворителей: метанол (1.24) < ДМСО (1.31) < этанол (1.61).
При увеличении содержания этанола в рабочем растворе артемизинина в диапазоне 5–100 об. % степень тушения флуоресценции ПБ артемизинином практически не изменяется, однако ухудшается воспроизводимость результатов. В дальнейшем использовали рабочие растворы артемизинина, содержащие 5 об. % этанола.
Выбор концентраций пиронина Б и микропероксидазы-11. В качестве оптимальной выбрали концентрацию красителя 2 мкМ, выше которой величина I0/I постоянна (рис. 4, столбцы серого цвета). При концентрациях красителя менее 2 мкМ сигналы в отсутствие и в присутствии артемизинина значимо не различаются. При концентрации МП 4 мкМ значение отношения I0/I довольно велико (1.61) и достаточно для разработки методики определения артемизинина, основанной на тушении флуоресценции ПБ. Кроме того, величина I0/I хорошо воспроизводима, sr = 0.009, n = 3 (рис. 4, столбцы белого цвета).
Рис. 4.
Зависимость величины I0/I в системе ПБ−МП от концентраций ПБ и МП. Условия реакции: УБР, рН 5.9, сПБ = 2 мкМ (столбцы серого цвета), сМП = 5 мкМ (столбцы белого цвета), сартемизинина = 5 мкМ, продолжительность реакции 2 мин; λфл/λвозб = 569/345 нм; n = 3, P = 0.95.

Выбор времени проведения реакции. Величина I0/I уже за 1 мин достигает максимального значения (1.55) и далее в течение 10 мин значимо не изменяется. В течение изученного интервала времени сигнал контрольного опыта остается постоянным. В качестве удобного времени проведения реакции выбрали 1 мин, при этом достигаются максимальная воспроизводимость результатов (sr = = 0.009, n = 3) и высокая экспрессность анализа.
Таким образом, выбраны следующие условия определения артемизинина на основе тушения флуоресценции ПБ в присутствии МП: УБР с рН 5.9, концентрации ПБ и МП 2 и 4 мкМ соответственно, содержание этанола в рабочем растворе артемизинина 5 об. %, время проведения реакции – 1 мин.
Флуориметрическое определение артемизинина в модельных растворах. В выбранных условиях реакции разработали методику определения артемизинина. Градуировочная зависимость описывается уравнением:
Сопоставление диапазонов определяемых концентраций (ДОК) и значений смин для разработанной методики и приведенных в литературе (табл. 1) показало, что системы на основе ПБ с применением белков и их миметиков позволяют определять артемизинин практически в одном и том же диапазоне концентраций. Это свидетельствует о потенциальной возможности применения любого из имеющихся в наличии реагентов.
Таблица 1.
Аналитические характеристики методик флуориметрического определения артемизинина с использованием ПБ в растворе
Прямопропорциональная зависимость в координатах Штерна–Фольмера, I0/I–cартемизинина свидетельствует о существовании в растворе флуорофора одного типа. График отсекает на оси ординат отрезок, равный единице, а его наклон соответствует штерн-фольмеровской константе тушения 0.101 мкМ−1.
Селективность определения артемизинина. Селективность разработанной методики изучали при постоянной концентрации артемизинина (1 мкМ) и варьируемых концентрациях посторонних компонентов: Н2О2 (продукт разложения артемизинина под действием УФ-излучения [30]), ионов металлов – Fe(II), Fe(III), Mn(II), Cu(II), Mg(II), а также глюкозы и фруктозы (наполнителей порошков и таблеток). Перечисленные компоненты способны взаимодействовать с артемизинином [31] и/или влиять на эффективность действия МП [14–16]. Полагали, что посторонний компонент не мешает определению, если в присутствии артемизинина относительная погрешность отношения I0/I (Δ, %) изменяется менее чем на ±5% по сравнению с этой величиной в его отсутствие. Из табл. 2 видно, что это условие выполняется в присутствии всех изученных веществ, но при их различных концентрационных соотношениях с артемизинином. Пероксид водорода мешает определению артемизинина уже при 2-кратном избытке. Однако H2O2, так же, как и ионы переходных металлов при концентрациях, превышающих указанные в табл. 2, не могут присутствовать в БАДах и фармацевтических препаратах на основе артемизинина. Мешающее действие глюкозы и сахарозы, ограниченно растворимых в этаноле при комнатной температуре, можно устранить на этапе пробоподготовки БАД.
Таблица 2.
Селективность флуоресцентного определения артемизинина (с = 1 мкМ) с использованием системы ПБ−МП
| Посторонний компонент | сопр. в-ва : спостор. компонент (М) | Δ*, % (n = 5) | |
|---|---|---|---|
| знак | величина | ||
| Fe(II) | 1 : 10 | + | 4.8 |
| Fe(III) | 1 : 10 | + | 4.5 |
| Co(II) | 1 : 20 | + | 4.0 |
| Mn(II) | 1 : 20 | + | 4.1 |
| Cu(II) | 1 : 15 | + | 4.9 |
| Mg(II) | 1 : 30 | − | 4.7 |
| Фруктоза | 1 : 50 | − | 4.6 |
| Глюкоза | 1 : 103 | + | 4.7 |
| Н2О2 | 1 : 2 | + | 4.9 |
Определение артемизинина в БАД выполняли методом добавок по методике, приведенной в “Экспериментальной части”. Уравнение градуировочной зависимости: (I0/I − 1) = (0.280 ± 0.004)c + (0.358 ± ± 0.007) (n = 5, P = 0.95), r = 0.9991.
Результаты флуориметрического определения артемизинина в БАД методом добавок (108 ± ± 13 мг/капсула; sr не превышает 0.03; n = 5, P = = 0.95) и альтернативным методом ВЭЖХ–МС [17] (110 ± 5 мг/капсула; n = 4, P = 0.95), а также заявленные производителем данные (100 мг/капсула) хорошо согласуются между собой. Критерий Стьюдента показал незначимое различие средних значений содержания артемизинина, найденных флуоресцентным и хроматографическим методами: tрасч = 1.035 (P = 0.95, f = 7) < tкрит = = 2.365 (P = 0.95, f = 7), что свидетельствует о правильности анализа. Время анализа БАД, включающего 2.5-часовую пробоподготовку, не превышает 6 ч.
* * *
Таким образом, разработана экспрессная флуориметрическая методика определения артемизинина с использованием системы пиронин Б−микропероксидаза-11, которая по чувствительности и селективности сопоставима с ранее описанными методиками на основе тушения артемизинином флуоресценции пиронина Б в присутствии гемсодержащих белков [9–12] и комплекса Mn(II)–додецилсульфат натрия [17]. Для проведения флуоресцентной реакции и одного измерения аналитического сигнала в растворе требуется не более 2 мин. Это выгодно отличает разработанную методику от наиболее чувствительных методик определения артемизинина методом ВЭЖХ с хемилюминесцентным детектированием, в которых используют до- или послеколоночную дериватизацию артемизинина, что значительно увеличивает продолжительность анализа [32, 33]. Методики определения артемизинина на основе ВЭЖХ–МС [33, 34] чувствительны, селективны и экспрессны, но требуют дорогостоящего оборудования. Нижняя граница определяемых концентраций артемизинина по предложенной методике по крайней мере в 4 и 10 раз ниже этой величины для спектрофотометрических методик с использованием 30-минутной реакции щелочной дериватизации артемизинина в присутствии ДМСО [35] и системы из трех сопряженных реакций [36] соответственно. Только применение графитового электрода, модифицированного in situ полимеризованной молекулярно-импринтированной мембраной [37], позволяет определять артемизинин на уровне концентраций, в десять раз меньших, чем сн по предложенной флуоресцентной методике.
Авторы выражают благодарность к. х. н., научному сотруднику кафедры аналитической химии химического факультета МГУ имени М.В. Ломоносова А.Н. Ставрианиди за помощь в проведении анализа БАД методом ВЭЖХ–МС.
Работа выполнена при финансовой поддержке РФФИ (проект № 15-03-05-064а).
Список литературы
World Health Organization. Artemisinin and artemisinin-based combination therapy resistance: status report. Geneva: World Health Organization, 2017. 11 p.
O’Neill P.M., Barton V.E., Ward S.A. The molecular mechanism of action of artemisinin — the debate continues // Molecules. 2010. V. 15. № 3. P. 1705.
Ellman A. Cultivation of Artemisia annua in Africa and Asia // Outlooks on Pest Management. 2010. V. 21. № 2. P. 84.
Соктоева Т.Э., Рыжова Г.Л., Дычко К.А., Хасанов В.В., Жигжитжапова С.В., Раднева Л.Д. Содержание артемизинина в экстрактах Artemisia annua L., полученных разными методами // Химия растит. сырья. 2011. № 4. С. 131.
Ho W.E., Peh H.Y., Chan T.K., Wong W.S. Artemisinins: pharmacological actions beyond anti-malarial // Pharmacol. Ther. 2014. V. 142. № 1. P. 126.
Yang X., XZ W. Main anti-tumor angiogenesis agents isolated from Chinese herbal medicines // Mini Rev. Med. Chem. 2015. V. 15. № 12. P. 1011.
Das A.K. Anticancer effect of antimalarial artemisinin compounds // Ann. Med. Health Sci. Res. 2015. V. 5. № 2. P. 93.
Breuer E., Efferth T. Treatment of iron-loaded veterinary sarcoma by Artemisia annua // Nat. Prod. Bioprospect. 2014. V. 4. № 2. P. 113.
Chen L., Yin H., Yang Z., Zhang K., Liu L., Shen H. Fluorescence determination of artemisinin using cytochrome c as catalyst and pyronine B as indicator // Chin. J. Anal. Chem. 2006. V. 36. № 2. P. 173.
Chen L., Zhang Y., Yin H., Liu L., Yang Z., Shen H. Fluorescence determination of artemisinin using hemoglobin as catalyst and pyronine B as substrate // Wuhan Univ. J. Natural Sci. 2006. V. 11. № 3. P. 704.
Chen L., Liu L., Shen H. Spectrofluorimetric determination of artemisinin with pyronine B as the substrate for horseradish peroxidase // Chin. Sci. Bulletin. 2005. V. 50. № 17. P. 1834.
Chen L., Yin H., Yang Z., Zhang K., Liu L., Shen H. Fluorescence determination of artemisinin using tyrosinase as catalyst and pyronine B as monitor // Chin. J. Anal. Chem. 2005. V. 23. № 8. P. 1047.
Marconi G., Monti S., Manoli F., Esposti A.D., Mayer B. A circular dichroism and structural study of the inclusion complex artemisinin-β-cyclodextrin // Chem. Phys. Lett. 2004. V. 383. № 5–6. P. 566.
Marques H.M. Insights into porphyrin chemistry provided by the microperoxidases, the haempeptides derived from cytochrome c // Dalton Trans. 2007. № 39. P. 4371.
Yarmann A., Neumann B., Bosserdt M., Gajovich-Eichelmann N., Scheller F.W. Peroxidase-dependent analyte conversion by the heme prostetic group, the heme peptide microperoxidase-11 and cytochrome c on chitosan capped gold nanoparticles modified electrodes // Biosensors. 2012. V. 2. № 2. P. 189.
Miyazaki C.M., Shimizu F.M., Mejía-Salazar J.R., Jr O.N.O., Ferreire M. Surface plasmon resonance biosensor for enzymatic detection of small analytes // Nanotechnology. 2017. V. 28. № 14. P. 145501.
Muginova S.V., Vakhraneva E.S., Myasnikova D.A., Kazarian S.G., Shekhovtsova T.N. Fluorescence-based artemisinin sensing using pyronin B-doped cellulose film reconstituted from ionic liquid // Anal. Lett. 2018. V. 51. № 6. P. 870.
Jung M., Lee K., Kendrick H., Robinson B.L., Croft S.L. Synthesis, stability, andantimal arial activity of new hydrolytically stable and water-soluble (+)–deoxoartelinic acid // J. Med. Chem. 2002. V. 45. № 2. P. 4940.
Gür B., Meral K. The effect of poly(vinyl alcohol) on the photophysical properties of pyronin dyes in aqueous solution: A spectroscopic study // Spectrochim. Acta A. 2013. V. 101. № 1. P. 306.
Titford M. Comparison of historic Grübler dyes with modern counterparts using thin layer chromatography // Biotech. Histochem. 2007. V. 82. № 4–5. P. 227.
Oyadomari M., Kabuto M., Wariishi H., Tanaka H. Manganese (II) oxidation by microperoxidase-11 in hydrophilic organic media // Biochem. Eng. J. 2003. V. 15. № 3. P. 159.
Досон Р., Эллиот Д., Эллиот У., Джонс К. Справочник биохимика. М.: Мир, 1991. 429 с.
Gaspar S., Popescu I.C., Gazaryan I.G., Bautista A.G., Sakharov I.Y., Mattiasson B., Csoregi B. Biosensors based on novel plant peroxidases; a comparative study // Electrochim. Acta. 2000. V. 46. № 2. P. 255.
Bruce G.R., Gill P.S. Estimates of precision in a standard additions analysis // J. Chem. Educ. 1999. V. 76. № 6. P. 805.
Onganer Y., Quitevis E. Effect of solvent on nonradiative in xanthene dyes: pyronin B in alcohols and alcohol-water mixtures // J. Phys. Chem. 1992. V. 96. № 20. P. 7996.
Toprak M., Arik M. An investigation of energy transfer between coumarin 35 and xanthene derivatives in liquid medium // Turk. J. Chem. 2010. V. 34. № 2. P. 285.
O'Reilly N., Magner E. The effect of solvent on the catalytic properties of microperoxidase-11 // Phys. Chem. Chem. Phys. 2011. V. 13. № 12. P. 5304.
Liu Y., Lu H., Pang F. Solubility of artemisinin in seven different pure solvents from (283.15 to 323.15) K // J. Chem. Eng. Data. 2009. V. 54. № 3. P. 762.
https://www.caymanchem.com/pdfs/11816.pdf (01.01.2018)
Amponsaa-Karikari A., Kishikawa N., Ohba Y., Nakashima K., Kuroda N. Determination of artemisinin in human serum by high-performance liquid chromatography with on-line UV irradiation and peroxyoxalate chemiluminescence detection // Biomed. Chromatogr. 2006. V. 20. № 11. P. 1157.
Денисов Е.Т., Солодова С.Л., Денисова Е.Г. Радикальная химия артемизинина // Усп. химии. 2010. Т. 79. № 11. С. 1065. (Denisov E.T., Solodova S.L., Denisova E.G. Radical chemistry of artemisinin // Russ. Chem. Rev. 2010. V. 79. № 11. P. 981.)
Green M.D., Mount D.L., Todd G.D., Capomacchia A.C. Chemiluminescent detection of artemisinin. Novel endoperoxide analysis using luminol without hydrogen peroxide // J. Chromatogr. A. 1999. V. 695. № 2. P. 237.
Wang M., Park C., Wu Q., Simon J.E. Analysis of artemisinin in Artemisia annua L. by LC-MS with selected ion monitoring // J. Agric. Food. Chem. 2005. V. 53. № 18. P. 7010.
Liu C-Z., Zhou H-Y., Zhao Y. An effective method for the fast detection of artemisinin in Artemisia annua L. by high performance liquid chromatography with evaporative light scattering detection // Anal. Chim. Acta. 2007. V. 581. № 2. P. 298.
Bharati A., Sabat S.C. A spectrophotometric assay for quantification of artemisinin // Talanta. 2002. V. 82. № 3. P. 1033.
Sreevidya T.V., Narayana B. Spectrophotometric determination of artemisinin and dihydroartemisinin // Indian J. Chem. Tech. 2008. V. 15. № 1. P. 59.
Bai H., Wang C., Chen J., Peng J., Cao Q. A novel sensitive electrochemical sensor based on in situ polymerized molecularly imprinted membranes at graphene modified electrode for artemisinin determination // Biosens. Bioelectron. 2015. V. 64. № 2. P. 352.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии



