Журнал аналитической химии, 2019, T. 74, № 2, стр. 103-124
Безреагентные импедансометрические сенсоры на основе аминофенилборных кислот
Е. А. Андреев 1, *, М. А. Комкова 1, 2, В. Н. Никитина 1, А. А. Карякин 1
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
2 Московский государственный университет имени М.В. Ломоносова, факультет наук о материалах
119991 Москва, Ленинские горы, 1, стр. 73, Россия
* E-mail: andreev@analyt.chem.msu.ru
Поступила в редакцию 12.03.2018
После доработки 18.07.2018
Принята к публикации 18.07.2018
Аннотация
Обзор работ авторов посвящен безреагентным сенсорам на основе полимеров 2- и 3-аминофенилборной кислоты. В отличие от большинства кондукто- и импедансометрических систем, разработанный сенсор позволяет дифференцировать специфические и неспецифические процессы: аналитический отклик сенсора проявляется в увеличении проводимости, направленном противоположно сигналу фона. Увеличение проводимости в результате специфических процессов продемонстрировано для разработанных сенсоров впервые и подтверждено физико-химическими исследованиями. Безреагентные сенсоры применимы не только в водной, но и в воздушной среде. Анализ пота человека разработанными сенсорами позволил определить концентрацию лактата (маркер гипоксии, второй по важности метаболит в клинической диагностике после глюкозы) в диапазоне от 10 до 40 мМ. Кроме того, разработанные сенсоры позволяют выполнять безреагентное определение плесневых грибов в биоаэрозоле с концентрациями в диапазоне от 200 до 800 КОЕ/м3, включающем гигиенический норматив для населенных мест (500 КОЕ/м3).
Материалы на основе фенилборной кислоты (ФБК) широко применяют в качестве синтетических рецепторов, распознающих 1,2- и 1,3-диольные фрагменты. Их функциональность используют как для анализа биологически важных объектов, бóльшая часть из которых принадлежит к классу углеводов [1, 2], так и для контролируемого захвата–высвобождения клеток [3], а также определения бактерий [4]. Безреагентные сенсоры, разработанные на основе полимера ФБК [5], позволяют проводить потенциометрическое определение сахаров [6, 7]. Однако практическое применение этих сенсоров невозможно по причине низкой величины максимального отклика на глюкозу на уровне 1.5–2.0 мВ, что не дает возможность получать достоверные результаты.
Высокая чувствительность электрохимических сенсоров может быть достигнута за счет применения спектроскопии электрохимического импеданса (СЭХИ). Импедансометрические сенсоры созданы на основе ФБК [8–10] и структурно родственного ей боронат-замещенного полианилина [11–14]. Основным недостатком таких сенсоров является использование увеличения сопротивления сенсора в качестве аналитического сигнала, поскольку отличить полезный сигнал от результата неспецифических процессов, также приводящих к увеличению сопротивления, не представляется возможным. Таким образом, разработка новых сенсоров на основе ФБК является актуальной задачей.
Нами разработаны новые сенсоры на основе аминофенилборных кислот. Показано, что специфическое связывание аналитов с поли(аминофенилборными кислотами) приводит к уменьшению сопротивления, что противоположно аналитическому сигналу фона. Настоящий обзор посвящен изучению аналитических характеристик электрохимических сенсоров на основе 2- и 3-аминофенилборных кислот и их практическому применению.
Фенилборные кислоты как синтетические рецепторы. Фенилборные кислоты – соединения, представляющие собой монозамещенную арилборную кислоту Ph–В(ОН)2, – обладают сродством к соединениям, имеющим нуклеофильные группы или являющимся основаниями Льюиса или донорами электронов [15]. В нейтральной форме борной кислоты sp2-гибридизованный атом бора имеет незаполненный внешний электронный уровень (6 валентных электронов – 3 собственных и 3 от ковалентно связанных соседних атомов) и обладает электроноакцепторными свойствами, благодаря свободной p-орбитали. Эта низкоэнергетическая орбиталь расположена ортогонально остальным трем заместителям при атоме бора, которые обладают тригональной планарной геометрией [16].
Обладая электроноакцепторными свойствами, атом бора может активно реагировать с основаниями Льюиса, формируя устойчивую электронную конфигурацию октета. Благодаря этому свойству, борные кислоты способны обратимо связываться в устойчивые комплексы с простыми основаниями Льюиса (фторид-, гидроксид- и цианид-ионы), а также с 1,2- и 1,3-замещенными основаниями Льюиса, содержащими гидроксильные и карбоксильные группы [17]. Следствием этих уникальных свойств является применение борных кислот в качестве рецепторных групп для связывания с углеводами, α-гидроксикислотами, цианидом и фторидом. Ниже будут рассмотрены борные кислоты в качестве рецепторов в реакциях с соединениями, содержащими диольные фрагменты, например моносахаридами, полиолами и α-гидроксикислотами.
При рассмотрении взаимодействия борных кислот с 1,2- и 1,3-цис-диольными фрагментами следует учитывать факторы, влияющие на селективность сенсоров. В первую очередь, селективность обусловлена процессом связывания аналита с чувствительным элементом. Традиционно селективность достигается путем выбора чувствительного элемента сенсора, для которого термодинамически предпочтительнее связывание с целевой молекулой, нежели, например, с другими компонентами пробы. Помимо этого, селективность сенсора может проявляться в природе аналитического сигнала. При этом аффинность целевой молекулы к сенсору может быть не самой высокой среди интерферирующих соединений, однако взаимодействие “хозяин–гость” целевой молекулы создает уникальный отклик сенсора [18]. Максимальная эффективность сенсора, очевидно, будет достигаться в случае сочетания обоих факторов. Например, при проявлении только уникальной природы аналитического сигнала в присутствии определяемого вещества интерферирующие соединения будут давать отрицательный вклад в итоговый отклик из-за конкурентного связывания. В случае поли(аминофенилборными кислот) проявляется уникальный отклик сенсора на аналиты, что будет подробнее рассмотрено ниже.
Кислотно-основное равновесие с участием фенилборной кислоты. Проявление кислотных свойств фенилборной кислоты несколько отличается от привычной кислотности по Брёнстеду, заключающейся в ионизации путем высвобождения протона. В протонных растворителях кислотность борной кислоты обусловлена реакцией с молекулой растворителя с образованием анионного тетрагонального бороната и высвобождением протона (схема 1 ).
Схема 1 . Взаимодействие фенилборной кислоты с 1,2-цис-диолом.
Депротонированию гидроксильной группы фенилборной кислоты соответствует более высокое значение рКа, чем для взаимодействия с молекулой воды или спирта с образованием отрицательно заряженного бороната, и протекание такого процесса затруднительно, особенно после образования анионного комплекса. Таким образом, кислотность борной кислоты сама по себе является следствием ее льюисовской кислотности. В апротонных растворителях борная кислота проявляет исключительно свойства кислоты Льюиса. Она может реагировать с различными основаниями Льюиса, содержащими гидроксидные группы, фторид- и цианид-ионами. В ходе реакции фенилборной кислоты с молекулами, содержащими диольные фрагменты, образуется соответствующий простой эфир, который также обладает кислотными свойствами из-за незавершенного электронного уровня атома бора.
Взаимодействие фенилборной кислоты с диолом с образованием простого эфира традиционно рассматривают в рамках pqr-схемы:
(1)
${\text{pA}} + {\text{qD}} + {\text{r}}{{{\text{H}}}^{ + }} = {{{\text{A}}}_{{\text{p}}}}{{{\text{D}}}_{{\text{q}}}}{{{\text{H}}}_{{\text{r}}}},$В широком диапазоне значений рН необходимо принимать во внимание процессы депротонирования фенилборной кислоты и диола, а также образование двух форм эфиров: нейтральную тригональную и анионную тетраэдрическую [20]. В разбавленных водных растворах доля тригональной формы незначительна [21], поэтому в дальнейших рассуждениях пренебрежем этим процессом. Одновременно протекают три процесса: кислотно-основное равновесие с участием фенилборной кислоты ArB(OH)2 с константой кислотной диссоциации $K_{{\text{a}}}^{{\text{B}}}$ [уравнение (2)], диссоциация диола D(OH)2 по первой ступени с константой диссоциации $K_{{\text{a}}}^{{\text{D}}}$ [уравнение (3)] и реакция образования эфира ArB(O)2D(OH)‾ согласно приведенной выше схеме 1 c константой равновесия β11–1 :
(2)
${\text{ArB(OH}}{{)}_{2}} + {{{\text{H}}}_{2}}{\text{O}} \rightleftarrows {\text{ArB(OH}})_{3}^{ - } + {{{\text{H}}}^{ + }}(K_{{\text{a}}}^{{\text{B}}}),$(3)
${\text{D(OH}}{{{\text{)}}}_{{\text{2}}}} \rightleftarrows {\text{D(OH)}}{{{\text{O}}}^{ - }}{\text{ + }}{{{\text{H}}}^{{\text{ + }}}}{\text{(}}K_{{\text{a}}}^{{\text{D}}}{\text{),}}$(4)
$\begin{gathered} {\text{ArB(OH}}{{{\text{)}}}_{{\text{2}}}}{\text{ + D(OH}}{{{\text{)}}}_{{\text{2}}}} \rightleftarrows \\ \rightleftarrows \,\,{\text{ArB(O}}{{{\text{)}}}_{{\text{2}}}}{\text{D(OH}}{{{\text{)}}}^{ - }}{\text{ + }}{{{\text{H}}}^{{\text{ + }}}}{\text{(}}{{{\beta }}_{{{\text{11}} - {\text{1}}}}}{\text{)}}. \\ \end{gathered} $С учетом образования тетраэдрического комплекса ${\text{ArB}}({\text{OH}}){{_{{\text{3}}}^{ - }}_{{}}},$ можно записать выражение для Kтетр связывания депротонированной кислоты с нейтральным диолом D(OH)2 :
(5)
${\text{ArB(OH)}}_{{\text{3}}}^{ - }{\text{ + D(OH}}{{{\text{)}}}_{{\text{2}}}} \rightleftarrows {\text{ArB(O}}{{{\text{)}}}_{{\text{2}}}}{\text{D(OH}}{{{\text{)}}}^{ - }}({{K}_{{{\text{т е т р }}}}}).$Соответственно для Ктетр получаем :
(6)
$\begin{gathered} {{K}_{{{\text{т е т р }}}}} = \frac{{{{\beta }_{{11 - 1}}}}}{{K_{{\text{a}}}^{{\text{B}}}}}\,\,\,\,{\text{и л и }} \\ {\text{log}}{{K}_{{{\text{т е т р }}}}} = {\text{log}}{{\beta }_{{11 - 1}}} + {\text{p}}K_{{\text{a}}}^{{\text{B}}}. \\ \end{gathered} $Важным экспериментальным параметром, отражающим степень протекания реакции образования эфира при данных условиях, является наблюдаемая константа связывания фенилборной кислоты с диолом (Kнабл), определяемая с помощью суммарных концентраций всех компонентов, уравнение (7). Индекс Σ символизирует суммарные концентрации протонированной и депротонированной форм фенилборной кислоты и диола, а так как реакция протекает преимущественно по пути образования тетраэдрического эфирного комплекса [21], его концентрация совпадает с равновесной.
(7)
${{K}_{{{\text{н а б л }}}}} = \frac{{{\text{[ArB(O}}{{{\text{)}}}_{{\text{2}}}}{\text{D(OH}}{{{\text{)}}}^{ - }}{\text{]}}}}{{{{{{\text{[(ArB(OH}}{{{\text{)}}}_{{\text{2}}}}{\text{)]}}}}_{\sum }}{{{{\text{[D(OH}}{{{\text{)}}}_{{\text{2}}}}{\text{]}}}}_{\sum }}}}.$Комбинируя уравнение (7) с уравнениями баланса масс и выражениями для $K_{{\text{a}}}^{{\text{B}}}$ и $K_{{\text{a}}}^{{\text{D}}},$ получаем выражение для ${{K}_{{{\text{н а б л }}}}}{\text{:}}$
(8)
${{K}_{{{\text{н а б л }}}}} = \frac{{{{\beta }_{{11 - 1}}}[{{{\text{H}}}^{ + }}]}}{{(K_{{\text{a}}}^{{\text{D}}} + [{{{\text{H}}}^{ + }}])(K_{{\text{a}}}^{{\text{B}}} + [{{{\text{H}}}^{ + }}])}}.$Таким образом, зависимость Kнабл от рН является кривой с экстремумом, положение которого отвечает рН наиболее эффективного связывания:
(9)
${\text{p}}{{{\text{H}}}_{{{\text{о п т }}}}} = \frac{{({\text{p}}K_{{\text{a}}}^{{\text{D}}}) + {\text{p}}K_{{\text{a}}}^{{\text{B}}})}}{2},$(10)
$K_{{{\text{н а б л }}}}^{{\max }} = \frac{{{{{{\beta }_{{11 - 1}}}} \mathord{\left/ {\vphantom {{{{\beta }_{{11 - 1}}}} {{\text{p}}K_{{\text{a}}}^{{\text{D}}}}}} \right. \kern-0em} {{\text{p}}K_{{\text{a}}}^{{\text{D}}}}}}}{{{{{\left( {1 + \sqrt {{{K_{{\text{a}}}^{{\text{B}}}} \mathord{\left/ {\vphantom {{K_{{\text{a}}}^{{\text{B}}}} {K_{{\text{a}}}^{{\text{D}}}}}} \right. \kern-0em} {K_{{\text{a}}}^{{\text{D}}}}}} } \right)}}^{2}}}}.$Следует отметить, что величина константы комплексообразования между остатком борной кислоты с диолом напрямую зависит от стереохимии последнего и числа 1,2- и 1,3-цис-диольных групп. Так, значения наблюдаемой константы связывания для фенилборной кислоты с различными соединениями при рН 7.4 изменяются следующим образом (М–1): глюкоза – 4.6, галактоза – 15, сорбитол – 370 [22].
В нейтральной среде только 30% всей фенилборной кислоты образует комплекс с глюкозой [7]. Для аналитических приложений, где чаще всего содержание сахаров невелико и образование комплекса незначительно, важной задачей является увеличение сродства фенилборной кислоты к диолу. Одним из подходов увеличения констант связывания является введение электроноакцепторной группы в бензольное кольцо. Проводящий полианилин, основная цепь которого также обладает электроноакцепторными свойствами, также можно применять для этих целей.
Другим подходом к увеличению сродства борной кислоты к диолсодержащему соединению является имитация многоточечного связывания. Многоточечное связывание является одним из ключевых принципов молекулярного распознавания в биологических системах. Действительно, многоточечное связывание двух мультивалентных (например, фермент–субстрат) объектов часто обладает бóльшей аффинностью, чем сумма отдельных моновалентных взаимодействий. Аналогичное явление известно из координационной химии как хелатный эффект.
Такой подход может быть легко реализован в случае фенилборных кислот – при включении их в полимерную цепь образуется, в сущности, полидентатный лиганд, в котором множество соседних борнокислых групп способны связываться с молекулой сахара. Такой подход имитирует кластерный гликозидный эффект полипептидной цепи лектиновых рецепторов, имеющих множество центров связывания [23]. Таким образом, включение фенилборных кислот в полимерную цепь может повысить сродство борнокислой группы к диольным фрагментам.
Идея применения боронат-замещенного полианилина в сенсорной системе перспективна с точки зрения биомиметики и электрохимической сенсорики. С одной стороны, фенилборные кислоты выступают в качестве синтетических рецепторов по отношению к диольным фрагментам углеводов. Однако известные системы для определения сахаров с использованием фенилборных кислот в качестве чувствительного элемента имеют различные ограничения. Это – низкие чувствительность и стабильность, использование медиаторов, невозможность дискриминировать полезный аналитический и неспецифический сигналы [8–10, 24].
С другой стороны, образование заряженных комплексов с участием заместителей основной цепи – например, при связывании сахара с борнокислой группой – может влиять на проводящие свойства полимера. Это дает возможность использовать в качестве отклика системы проводимость полимера, отказаться от использования медиаторов и создать безреагентный сенсор.
Электрополимеризация аминофенилборных кислот. Электрополимеризацию 3-аминофенилборной кислоты (3-АФБК) проводили из кислых растворов, содержащих фторид-ион, в условиях, аналогичных приведенным в работе [5].
Нами подобран оптимальный потенциал для полимеризации, составляющий 0.9 В (здесь и далее потенциалы приведены относительно хлоридсеребряного электрода (ХСЭ) сравнения Ag|AgCl|1 M KCl, если не указано особо), что на 0.2 В ниже, чем в работе [7]. Это позволяет снизить вклад процессов деградации при высоких потенциалах в ходе полимеризации и повысить проводимость получающегося материала.
В молекуле 3-АФБК группа –В(ОН)2, находящаяся в мета-положении к аминогруппе (схема 2 , а), обладает слабыми электроноакцепторными свойствами и за счет электронных и стерических эффектов блокирует электрофильную атаку катион-радикала анилина на соседний атом углерода в бензольном кольце, находящемся в пара-положении к аминогруппе, тем самым ингибируя рост полимера, который протекает в направлении “голова к хвосту”. Введение избытка фторид-ионов по отношению к мономеру позволяет получить вместо –В(ОН)2 заместитель $--{\text{В F}}_{{\text{3}}}^{ - }$ с электронодонорными свойствами (схема 2 , б), который активирует электрофильную атаку в пара-положение к аминогруппе [25].
Схема 2 . 3-Аминофенилборная кислота в исходном состоянии (а) и в избытке F– (б).
В ходе оптимизации состава ростового раствора проанализированы данные по полимеризации 3-аминофенилборной кислоты в присутствии различных концентраций фторид-иона и серной кислоты в фоновом электролите. Найден оптимальный состав ростового раствора для электрополимеризации 3-АФБК: 0.04 М мономер в присутствии 0.2 М фторида натрия в 0.1 М серной кислоте [26]. Согласно константам равновесия для фенилборных кислот, приведенным в работе [27], в условиях синтеза группы –B(OH)2 переходят в $--{\text{BF}}_{{\text{3}}}^{ - }$ практически количественно.
Полимеризация проводящих полимеров сопровождается процессами нуклеации при высоких потенциалах, что находит отражение в циклических вольтамперограммах электрополимеризации 3-АФБК (рис. 1) – первые циклы осаждения сопровождаются возникновением “нуклеационной петли” [28]. Кроме того, в области анодных потенциалов (около 0.9 В) ток возрастает с числом циклов, что связано с увеличением проводящей поверхности в ходе синтеза.
Рис. 1.
Электрополимеризация 3-аминофенилборной кислоты в 0.2 М растворе NaF в 0.1 М H2SO4; скорость развертки потенциала 40 мВ/с. Вставка: циклические вольтамперограммы электродов, модифицированных поли(3-аминофенилборной кислотой), в 0.1 M растворе KCl в 0.1 M HCl.

В случае 2-аминофенилборной кислоты (2-АФБК) электрополимеризация в условиях, оптимизированных для 3-АФБК, не приводит к образованию проводящего полимера. Группа борной кислоты в 2-АФБК находится в мета-положении, и, как отмечено выше, введение фторид-ионов приводит к образованию электронодонорного заместителя $--{\text{BF}}_{{\text{3}}}^{ - }$ вместо слабой электроноакцепторной группы –В(ОН)2 и активации электрофильного замещения в пара-положении к аминогруппе.
В отличие от 3-АФБК, в молекуле 2-АФБК активации не происходит, поскольку пара-положение аминогруппы, которое преимущественно участвует в полимеризации, теперь находится не в орто-, а в мета-положении к электронодонорной группе $--{\text{BF}}_{{\text{3}}}^{ - },$ в котором электронная плотностя не повышена (схема 3 ).
Схема 3 . 2-Аминофенилборная кислота в исходном состоянии (а) и в присутствии избытка фторид-ионов (б).
Таким образом, в отличие от 3-АФБК, группа –В(ОН)2 нейтральной формы мономера 2-АФБК не инактивирует рост полианилина в отсутствие фторид-ионов. Для подтверждения этой гипотезы проведена электрополимеризация 2-АФБК в присутствии и в отсутствие фторид-ионов.
Для полученного материала регистрировали циклические вольтамперограммы (ЦВА) в фоновом электролите в отсутствие мономера (рис. 2, вставка): в отсутствие фторида получен полимер с двумя интенсивными парами пиков, в то время как материал, полученный в присутствии фторида, демонстрирует незначительную электроактивность [29].
Рис. 2.
Электрополимеризация 2-аминофенилборной кислоты на стеклоуглеродном электроде в отсутствие фторид-ионов; скорость развертки потенциала 40 мВ/с. Вставка: циклические вольамперограммы электродов, модифицированных поли(2-аминофенилборной кислотой), в 0.1 M растворе KCl в 0.1 M HCl в ходе электрополимеризации: (—) – в отсутствие фторид-ионов, (– –) – со фторид-ионами.

Следует отметить, что ЦВА полимера, полученного путем электрополимеризации 2-АФБК в отсутствие фторида имеет тот же вид, области электроактивности характеризуется теми же потенциалами переходов, что и ЦВА полимера, полученного при электрополимеризации 3-АФБК в присутствии фторида, что говорит об идентичности структуры и окислительно-восстановительных состояний синтезированных в разных условиях полимеров.
Изменение сопротивления поли(3-аминофенилборной кислоты) в результате специфических и неспецифических взаимодействий. Выше отмечено (схема 1 ), что при взаимодействии 1,2- или 1,3-цис-диольных фрагментов с фенилборной кислотой образуется отрицательно заряженный тетраэдрический комплекс. Остаток борной кислоты при включении в полимерную цепь сохраняет способность к образованию заряженных комплексов с 1,2- или 1,3-цис-диолами, в том числе с сахарами, полиолами или гидроксикислотами. Влияние образования данных комплексов на проводящие свойства разработанного сенсора на основе поли(3-АФБК) исследовали с помощью СЭХИ, которая является одним из самых эффективных, информативных и малодеструктивных методов регистрации проводящих свойств полимеров. Наиболее распространенной вариацией этого метода является применение к исследуемой системе синусоидальной развертки потенциала E(t) малой амплитуды (обычно 5 мВ) с набором фиксированных значений угловой частоты колебаний ω и последующее измерение силы тока I(t) на той же частоте. В результате прохождения через систему ток приобретает разность фаз ϕ относительно напряжения, что отражается в величине итогового импеданса системы Z:
(11)
$\begin{gathered} Z(\omega ) = \frac{{E(t,\omega )}}{{I(t,\omega )}} = \frac{{{{E}_{{\text{M}}}}{\text{sin(}}\omega t)}}{{{{I}_{{\text{M}}}}\sin (\omega t + \phi )}} = \\ = \operatorname{Re} (Z) + j{\text{lm(}}Z{\text{),}} \\ \end{gathered} $Диаграммы Найквиста для полимерных пленок 3-АФБК демонстрируют высокую стабильность (не менее трех последовательно зарегистрированных диаграмм при данных условиях совпадают). При добавлении глюкозы в буферный раствор диаметр высокочастотной полуокружности на диаграмме уменьшается, что свидетельствует об уменьшении сопротивления полимера Rп (рис. 3, ◼). При замене буферного раствора на не содержащий глюкозу наблюдается возврат диаграммы к первоначальному виду (рис. 3, △). Это означает, что отклик системы обратим, а сенсор может быть использован многократно.
Рис. 3.
Диаграммы Найквиста модифицированного торцевого электрода в фосфатном буферном растворе с рН 7.0 при Edc = 50 мВ: (◻) – в отсутствие глюкозы, (◼) – в присутствии 50 мМ глюкозы, (△) – при замене раствора на не содержащий глюкозу; (–) – теоретические кривые описания диаграмм эквивалентной схемой Рэндлса (на вставке).

Для решения аналитических задач количественные характеристики сенсоров получают путем аппроксимации диаграмм подходящей эквивалентной схемой. Эквивалентная схема представляет собой, в сущности, обычную электрическую схему, состоящую, как правило, из резисторов и конденсаторов, моделирующих собой физико-химические процессы, происходящие в исследуемой системе. Иногда в схемах используют элементы, не имеющие аналогов в обычных электрических схемах, моделирующие электрокинетические процессы, диффузию, геометрию поверхностей и прочие особенности. Часто схемы содержат параллельный участок, возникающий из-за одновременного протекания процесса зарядки двойного электрического слоя, обычно представляемого конденсатором CДС, и фарадеевского процесса, и последовательно соединенного резистора RΩ, соответствующего омическому сопротивлению раствора. Для случая проводящих полимеров фарадеевский импеданс представляют последовательно соединенным омическим сопротивлением полимера RП и диффузионным импедансом W [30].
В результате описания приведенных диаграмм согласно простейшей модели для случая проводящих полимеров – схемы Рэндлса с диффузионным элементом (рис. 3, вставка) – получены значения параметров аппроксимации (табл. 1). Как видно, наиболее значимо в результате связывания остатка борной кислоты поли(3-АФБК) с глюкозой изменяется сопротивление полимера Rп (почти в 1.5 раза). Разницу величин сопротивлений Rп из первоначальной диаграммы в исходном буферном растворее и диаграммы в присутствии глюкозы целесообразно рассматривать в качестве аналитического отклика.
Таблица 1.
Изменение параметров эквивалентной схемы для описания диаграмм Найквиста (рис. 3) до и после добавления глюкозы, а также после замены буферного раствора на не содержащий глюкозу
| Элемент | 0 мМ глюкоза | 50 мМ глюкоза | 0 мМ глюкоза (замена буферного раствораа) | |||
|---|---|---|---|---|---|---|
| значение | sr, % | значение | sr, % | значение | sr, % | |
| RΩ, Ом см2 | 5.4 | 2 | 5.3 | 3 | 5.4 | 2 |
| Cдс, мкФ/см | 23 | 2 | 22 | 2 | 23 | 3 |
| Rп, Ом см2 | 4.3 | 1 | 3.1 | 2 | 4.6 | 1 |
| W0-R, Ом см2 | 9.7 | 4 | 7.0 | 4 | 9.3 | 5 |
| W0-T, мс | 48 | 6 | 43 | 6 | 48 | 7 |
| W0-P | 0.35 | 1 | 0.35 | 1 | 0.36 | 1 |
Подобное увеличение проводимости полимера при добавлении диолсодержащего соединения можно объяснить, проведя аналогию с допированием полианилина при введении в бензольное кольцо ионогенных групп. Образующийся анионный комплекс локализует отрицательный заряд в цепи полимера, что приводит к повышению проводимости поли(3-АФБК). Итак, специфические взаимодействия глюкозы с полимером приводят к увеличению проводимости поли(3-АФБК).
Неспецифические взаимодействия не приводят к заметным изменениям сопротивления полимера, в отличие от результатов специфического связывания. Например, с ацетатом натрия циклический эфир образовываться не может, поскольку одной ОН-группы недостаточно для связывания с борными кислотами, наиболее энергетически выгодно образовывать 5- и 6-членный циклы, для которых необходимо наличие 1,2- или 1,3-цис-диольного фрагмента. Кроме того, в присутствии глюкозы сопротивление незамещенного полианилина незначительно увеличивается, причем необратимо. Эти результаты указывают на то, что именно функциональная группа борной кислоты обеспечивает эффект увеличения проводимости полимера в присутствии соединений, содержащих 1,2- или 1,3-цис-диольные группы.
В работах других авторов результатом связывания фенилборной кислоты с полиолами было увеличение сопротивления сенсора [11, 31], что не позволяло дифференцировать отклик системы в результате взаимодействия с определяемым объектом на фоне деградации чувствительного слоя или неспецифического связывания.
Таким образом, разработанные сенсоры позволяют дифференцировать специфические и неспецифические процессы в отличие от большинства кондукто- и импедиметрических систем. Обратимое изменение сопротивления полимера при связывании с аналитом, определяемое из диаграмм Найквиста, предложено использовать в качестве аналитического отклика системы.
Для поли(2-АФБК) специфическое связывание также приводит к увеличению проводимости. Таким образом, наблюдаемый обратимый отклик сенсора в сторону увеличения проводимости полиАФБК является универсальным, так как не зависит от исходного мономера.
Определение Кнабл для взаимодействия глюкозы с поли(3-аминофенилборной кислотой). Последовательно регистрируя диаграммы Найквиста полимера 3-АФБК на поверхности торцевого электрода в буферном растворе с известным рН при различных концентрациях диолсодержащего соединения в нем, можно затем определить сопротивление полимера (параметр в аналоге модели Рэндлса с диффузионным элементом) для каждой из диаграмм и построить соответствующие концентрационные зависимости для Rп (рис. 4).
Рис. 4.
Градуировочная зависимость сопротивления полимера Rп, определенного из диаграмм Найквиста, от концентрации глюкозы в растворе, аппроксимированная уравнением (11) (n = 3, P = 0.95).

Исходя из предположения о линейной зависимости сигнала от концентрации связанных и не связанных в комплекс групп борной кислоты получаем уравнение:
(12)
${{R}_{{\text{п }}}}([{\text{S]) = }}\frac{{{{R}_{{{\text{п ,0}}}}} + {{R}_{{{\text{п ,}}\infty }}},{{K}_{{{\text{н а б л }}}}}[{\text{S]}}}}{{1 + {{K}_{{{\text{н а б л }}}}}[{\text{S]}}}},$Из аппроксимации зависимости экспериментально определенного сопротивления полимера от концентрации диола в растворе получили значение Кнабл = 20 ± 2 М–1 (n = 3, P = 0.95). Погрешности аппроксимации экспериментальных данных теоретической кривой не превышают нескольких процентов, что позволяет сделать вывод о целесообразности использования предложенной модели их описания.
Из данных аппроксимации соответствующих диаграмм Найквиста и градуировочных зависимостей для различных веществ (глюкоза, лактат, галактоза, фруктоза, сорбитол) были определены аналитические характеристики сенсора на основе поли(3-АФБК). Диапазоны определяемых содержаний составляют (мМ): для глюкозы – от 6 до 250, для лактата – от 2 до 100, для галактозы –от 2 до 50, для фруктозы – от 0.5 до 35, для сорбитола – от 0.02 до 0.34. Пределы обнаружения, мМ: глюкозы – 3, лактата – 1, галактозы – 1, фруктозы – 0.2, сорбитола – 0.01. Чувствительность сенсоров на основе полиАФБК рассчитывали как тангенс угла наклона касательной в начальной точке нелинейной градуировочной зависимости (рис. 4). Чувствительность определяется константой связывания с аналитами и сопротивлением при полностью связанных в комплекс боронатных группах. В табл. 2 представлены аналитические характеристики сенсоров на основе полиаминофенилборных кислот, электрополимеризованных в разных условиях: поли(2-АФБК) получен из 2-АФБК в отсутствие фторид-ионов, поли(3-АФБК) –из 3-АФБК в присутствии фторид-ионов.
Таблица 2.
Аналитические характеристики сенсоров на основе полиаминофенилборной кислот: (а) – поли(2-аминофенилборная кислоты), (б) – поли(3-аминофенилборная кислота)
| Аналит | Коэффициент чувствительности, мМ–1 | Диапазон определяемых содержаний, мМ | Предел обнаружения, мМ | |||
|---|---|---|---|---|---|---|
| (а) | (б) | (а) | (б) | (а) | (б) | |
| Глюкоза | 2 ± 1 | 5 ± 1 | 20–250 | 8–130 | 7.5 | 2.9 |
| Лактат | 8 ± 1 | 14 ± 1 | 14–200 | 10–130 | 2.0 | 1.1 |
| Фруктоза | 29 ± 3 | 73 ± 2 | 9–150 | 3–90 | 1.5 | 0.1 |
Рассчитаны величины Кнабл, из данных СЭХИ для различных соединений с поли(3-АФБК) (М–1, n = 3, P = 0.95): для глюкозы – 20 ± 2, для лактата – 45 ± 3, для галактозы – 100 ± 15, для фруктозы 220 ± 12, для сорбитола – 6500 ± 500.
Для поли(2-АФБК) также рассчитаны значения Кнабл для глюкозы, фруктозы, лактата. Ниже приведены значения наблюдаемых констант связывания, найденные из градуировочных зависимостей для полиАФБК с полиолами и оксикислотами (табл. 3). Тенденция к увеличению констант связывания поли(3-АФБК) и поли(2-АФБК) в ряду глюкоза < лактат < фруктоза аналогична таковой для фенилборной кислоты [22].
Таблица 3.
Наблюдаемые константы связывания фенилборной кислоты и полиаминофенилборных кислот с глюкозой, фруктозой и лактатом
| Kнабл, M–1 | Глюкоза (pH 7) | Лактат (pH 6) | Фруктоза (pH 7) |
|---|---|---|---|
| Фенилборная кислота [20] | 2 | 18.5 | 92 |
| Электрополимеризованная 2-АФБК (без фторида) | 2.5 ± 1.5 | 19 ± 4 | 98 ± 10 |
| Электрополимеризованная 3-АФБК (со фторидом) | 20 ± 2 | 45 ± 3 | 220 ± 12 |
Поведение наблюдаемых констант связывания для полиАФБК указывает на то, что эффект увеличения проводимости является результатом взаимодействия диолсодержащих соединений с борнокислой группой.
Зависимость Кнабл от рН для взаимодействия различных веществ с полиаминофенилборными кислотами. Равновесные концентрации диола и борной кислоты в свободном и связанном виде, как показано выше, зависят от кислотности среды [см. уравнения (2)–(4)]. В результате связывания диола с борной кислотой образуются заряженный комплекс и протон (схема 1 ), что указывает на зависимость равновесий в системе от pH. Для фенилборных кислот рН-зависимости связывания с различными молекулами, содержащими диольные группы, досконально изучены, тогда как для полимера таких данных нет. Мы исследовали рН-зависимость в диапазоне pH 5.4–7.4 наблюдаемой константы связывания поли(3-АФБК) с соединениями, имеющими диольные группы, с различными ${\text{р }}К _{{\text{а }}}^{{\text{D}}}.$ Для расчета Кнабл использовали значения сопротивления полимера при различных концентрациях диолсодержащего соединения. Выбор диапазона рН буферных растворов объясняется следующими фактами. При высоких значениях рН (>7.4) полимер склонен к дедопированию. При рН < 5.4 (слабокислая среда) проводимость полимера становится слишком высокой, что не позволяет достоверно рассчитывать сопротивление полимера и его изменения при связывании полимера с диолами. На рис. 5 представлены полученные зависимости наблюдаемых констант связывания поли(3-АФБК) с диолом от рН.
Рис. 5.
Зависимости наблюдаемых констант связывания поли(3-аминофенилборной кислоты) с глюкозой (а) и лактатом (б) от pH. (◼) – экспериментально полученные данные; (––, – – ) – аппроксимация теоретически предсказанными кривыми (n = 3, P = 0.95).

Из уравнения (8) следует, что зависимости Kнабл от рН раствора должны иметь вид кривых с максимумом, положение которого определяется константой кислотной диссоциации диольной группы $K_{{\text{a}}}^{{\text{D}}}$ и борнокислого заместителя основной цепи полианилина $K_{{\text{a}}}^{{\text{B}}}.$ В случае большой разницы между pKa диолсодержащего соединения и ${\text{p}}K_{{\text{a}}}^{{\text{B}}}$ поли(3-АФБК) Kнабл практически не изменяется при рН, близких к pH для $K_{{{\text{н а б л }}}}^{{{\text{max}}}},$ т.е. экстремум не выражен. Для соединений с pKa > 12, например, для глюкозы, зависимость имеет вид кривой с насыщением. Из уравнения (8) следует, что при $K_{{\text{a}}}^{{\text{D}}} \ll [{{{\text{H}}}^{ + }}]$ (для глюкозы при рН < 11) зависимость Кнабл от кислотности приобретает вид:
(13)
${{K}_{{{\text{н а б л }}}}} = \frac{{{{\beta }_{{11 - 1}}}}}{{K_{{\text{a}}}^{{\text{B}}} + [{{{\text{H}}}^{ + }}]}},$(14)
${\text{li}}{{{\text{m}}}_{{[{{{\text{H}}}^{ + }}] \to 0}}}{{K}_{{{\text{н а б л }}}}} = {{{{\beta }_{{11 - 1}}}} \mathord{\left/ {\vphantom {{{{\beta }_{{11 - 1}}}} {K_{{\text{a}}}^{{\text{B}}}}}} \right. \kern-0em} {K_{{\text{a}}}^{{\text{B}}}}} = {{K}_{{{\text{т е т р }}}}}.$Для соединений с pKa > 12 степень депротонирования при рН < 7.5 незначительна, поэтому рН-профиль приобретает форму возрастающей сигмоидной кривой с точкой перегиба при рН, равном ${\text{p}}K_{{\text{a}}}^{{\text{B}}}.$ В свою очередь α-гидроксикислоты с pKa < 4 полностью депротонированы во всем рассматриваемом диапазоне рН, а Kнабл должна уменьшаться с ростом рН согласно уравнению (8). Действительно, экспериментально полученные из данных СЭХИ константы связывания демонстрируют тенденцию к увеличению Kнабл с ростом рН для сахаров с высокими $K_{{\text{a}}}^{{\text{D}}}$ и понижению Kнабл с ростом рН для α-гидроксикислоты. Рассмотрим процесс комплексообразования более подробно для каждого из соединений.
Предположим, что атом бора находится как в тригональном (в виде –B(OH)2), так и в тетраэдрическом окружении (в виде $ - {\text{B}}({\text{OH}})_{{\text{3}}}^{--}$). Комплексообразование полимера с диолом протекает как по пути образования тетраэдрического эфирного комплекса, так и тригонального (схема 4 ). Для наблюдаемой константы получаем уравнение:
(15)
${{K}_{{{\text{н а б л }}}}} = \frac{{{\text{[ArB(O}}{{{\text{)}}}_{{\text{2}}}}{\text{D(OH}}{{{\text{)}}}^{ - }}{\text{] + [ArB(O}}{{{\text{)}}}_{{\text{2}}}}{\text{D]}}}}{{{{{{\text{[D]}}}}_{\sum }}{{{{\text{[B]}}}}_{\sum }}}}.$С учетом изложенного выше, а также используя уравнения (2), (3) и (5) и условие нейтральности среды [D(OH)O‾] = 0, получаем:
(16)
${{K}_{{{\text{н а б л }}}}} = \frac{{{{{{K}_{{{\text{т е т р }}}}} + {{K}_{{{\text{т р и г }}}}}[{{H}^{ + }}]} \mathord{\left/ {\vphantom {{{{K}_{{{\text{т е т р }}}}} + {{K}_{{{\text{т р и г }}}}}[{{H}^{ + }}]} {K_{{\text{a}}}^{{\text{B}}}}}} \right. \kern-0em} {K_{{\text{a}}}^{{\text{B}}}}}}}{{{{1 + [{{H}^{ + }}]} \mathord{\left/ {\vphantom {{1 + [{{H}^{ + }}]} {K_{{\text{a}}}^{{\text{B}}}}}} \right. \kern-0em} {K_{{\text{a}}}^{{\text{B}}}}}}}.$Зависимость Kнабл от рН для глюкозы характеризуется более выраженным ростом константы с увеличением рН, чем это следует из уравнения (16) (рис. 5а).
Экспериментальные точки намного лучше описываются следующим выражением, аналогичным уравнению (16) (рис. 5а, кривая – –):
(17)
${{K}_{{{\text{н а б л }}}}} = \frac{{{{{{K}_{{{\text{т е т р }}}}} + {{K}_{{{\text{т р и г }}}}}{{{[{{{\text{H}}}^{ + }}]}}^{2}}} \mathord{\left/ {\vphantom {{{{K}_{{{\text{т е т р }}}}} + {{K}_{{{\text{т р и г }}}}}{{{[{{{\text{H}}}^{ + }}]}}^{2}}} {K_{{\text{а }}}^{{'{\text{В }}}}}}} \right. \kern-0em} {K_{{\text{а }}}^{{'{\text{В }}}}}}}}{{{{1 + {{{[{{{\text{H}}}^{ + }}]}}^{2}}} \mathord{\left/ {\vphantom {{1 + {{{[{{{\text{H}}}^{ + }}]}}^{2}}} {K_{{\text{а }}}^{{'{\text{В }}}}}}} \right. \kern-0em} {K_{{\text{а }}}^{{'{\text{В }}}}}}}}.$Пропорциональность квадрату [H+] может быть обусловлена образованием бисборонатного комплекса, который, вероятно, реализуется для глюкофуранозы.
Схема 4 . Схема протекания реакции между поли(3-аминофенилборной кислотой) и 1,2-цис-диолом.
При этом два остатка борной кислоты одновременно связываются с молекулой глюкозы, образуя дианионный комплекс (с выделением двух протонов). ${\text{p}}K_{{\text{а }}}^{{'{\text{В }}}}$ отражает депротонирование двух групп и должна превышать ${\text{p}}K_{{\text{а }}}^{{\text{В }}}$ примерно в 2 раза, что и наблюдается при аппроксимации зависимости Kнабл – рН для глюкозы уравнением (17): ${\text{p}}K_{{\text{а }}}^{{'{\text{В }}}} = {\text{11}}.{\text{9}} \pm 0.{\text{1}},$ Kтетр = 20 ± ± 2 М–1 и Kтриг = 0.
Схема 5 . Схема реакции связывания аминофенилборной кислоты и лактата.
Молочная кислота (pKa = 3.86) при рассматриваемых значениях рН полностью депротонирована и взаимодействует с остатком борной кислоты в виде аниона, образуя тетраэдрический анионный эфирный комплекс с константой равновесия $K_{{{\text{т е т р }}}}^{'}$ (схема 5 ).
Наблюдаемая константа комплексообразования приобретает вид:
(18)
${{K}_{{{\text{н а б л }}}}} = \frac{{{{K_{{{\text{т е т р }}}}^{'}[{{{\text{H}}}^{ + }}]} \mathord{\left/ {\vphantom {{K_{{{\text{т е т р }}}}^{'}[{{{\text{H}}}^{ + }}]} {K_{{\text{a}}}^{{\text{B}}}}}} \right. \kern-0em} {K_{{\text{a}}}^{{\text{B}}}}}}}{{{{1 + [{{{\text{H}}}^{ + }}]} \mathord{\left/ {\vphantom {{1 + [{{{\text{H}}}^{ + }}]} {K_{{\text{a}}}^{{\text{B}}}}}} \right. \kern-0em} {K_{{\text{a}}}^{{\text{B}}}}}}}.$Приведенная рН-зависимость Кнабл для лактата согласуется с уравнением (18), поскольку при понижении [H+] наблюдаемая константа связывания уменьшается (рис. 5б).
Таким образом, в случае веществ, образующих с борнокислой группой полимера заряженный комплекс (глюкоза, галактоза, сорбитол, лактат), сопротивления полимера понижается. В случае если вещество не содержит 1,2- и или 1,3-цис-диольного фрагмента, как, например, в молекуле ацетата, специфического связывания вещества в заряженный комплекс не происходит и изменение сопротивления полимера не наблюдается. Тот факт, что изменение сопротивления связано с борнокислым заместителем, подтверждает также то, что в случае с незамещенным полианилином сопротивление полимера, наоборот, незначительно повышается, причем необратимо.
Зависимости от pH наблюдаемых констант связывания поли(2-АФБК) с сахарами и оксикислотами также имеют вид, характерный для фенилборных кислот (рис. 6): наблюдается уменьшение константы связывания с лактатом с ростом рН, в то время как для фруктозы имеет место обратная зависимость. Таким образом, полученные константы связывания поли(2-АФБК) с полиолами и гидроксикислотами, а также рН-профили этих констант подчиняются общим тенденциям для фенилборных кислот. Этот факт подтверждает, что наблюдаемое увеличение сопротивления поли(2-АФБК) при ее взаимодействии с аналитами является результатом образования боронатного эфира между остатками борной кислоты в полимере и диольными фрагментами гидроксикислот или полиолов.
Рис. 6.
Зависимости от pH наблюдаемой константы связывания электрополимеризованной 2-аминофенилборной кислоты с фруктозой (⚫) и лактатом (▲) (n = 3, P = 0.95).

Несмотря на то, что молекулярное строение полиАФБК не зависит от исходного мономера (3-АФБК или 2-АФБК), полученные полимерные материалы обладают различной аффинностью к сахарам и гидроксикислотам. Тенденция изменения констант связывания электрополимеризованной 2-АФБК с сахарами и гидроксикислотами аналогична таковой для фенилборной кислоты, являющейся структурным фрагментом полиАФБК, в то время как константы связывания для электрополимеризованной 3-АФБК в 2–10 раз выше (табл. 3). Чувствительность сенсоров на основе последней также выше в 4–10 раз. Таким образом, возможно, именно участие фторид-иона в синтезе влияет на аналитические характеристики сенсоров. Эффект повышения чувствительности полимера, полученного из 3-АФБК, к некоторым аналитам позволяет предположить, что фторид-ион способен создавать удобную для последующего связывания с аналитами конфигурацию и ориентацию реакционных центров в структуре полимера. Поскольку радиус фторид-иона небольшой, то решающим фактором является стерический эффект: связывание остатка борной кислоты со фторидом меняет конфигурацию атома бора из тригональной sp2 на тетраэдрическую sp3. Известно, что константы связывания сахаров и гидроксикислот с фенилборной кислотой в тетраэдрической конфигурации превышают константы связывания с тригональной формой фенилборной кислоты, поэтому изменение конфигурации атома бора в процессе синтеза повышает сродство результирующего полимера к аналитам.
Определенные экспериментально значения pKa для полиАФБК составляют 6.1–6.6, т.е. значительно ниже pKa фенилборной кислоты (≈8.9), что делает возможным и эффективным использование систем на основе полиАФБК в нейтральных средах. Подобное понижение pKa можно объяснить электроноакцепторными свойствами основной цепи полианилина [20], контролирующими связывание диольного фрагмента с полимером.
Полученный результат имеет большую практическую значимость для аналитических приложений. Большинство кондукто- и импедиметрических сенсоров на основе фенилборной кислоты оперирует в качестве аналитического сигнала повышением сопротивления сенсора, которое наблюдается также и в случае, например, деградации чувствительного слоя. Тем самым, данные системы неспособны различать аналитический и фоновый сигналы, что значительно понижает их практическую ценность. Сенсоры, разработанные нами, позволяют дифференцировать специфические и неспецифические взаимодействия, в отличие от указанных выше систем.
Можно заключить, что поведение констант связывания различных соединений с полиАФБК аналогично закономерностям связывания фенилборной кислоты с соединениями, содержащими 1,2- или 1,3-цис-диольные фрагменты. Таким образом, увеличение проводимости поли(3-АФБК) действительно является результатом специфического взаимодействия сахаров, полиолов и гидроксикислот с борнокислыми группами полимера.
Поли(3-аминофенилборная кислота) с молекулярными отпечатками. Недостаточная специфичность полиАФБК, обусловленная сродством последней к целому ряду важнейших соединений (сахара, гидроксикислоты и пр.), ограничивает применимость сенсоров на ее основе. Повышение селективности и чувствительности синтетических материалов к определенному веществу является ключевой задачей в аналитической практике. Для решения таких задач применяют полимеры с молекулярными отпечатками аналитов в матрице. Синтез выполняют непосредственно в присутствии определяемых молекул или их структурных аналогов. При проведении полимеризации в присутствии молекул-шаблонов с их последующей экстракцией в матрице полимера остаются полости, комплементарные по форме и размеру этим молекулам. Полимер с молекулярными отпечатками обладает повышенным сродством к соединению, в присутствии которого он был синтезирован, благодаря сформировавшейся в процессе синтеза стереохимической ориентации реакционных центров полимера.
Использование непосредственно сахаров или гидроксикислот в качестве молекул-шаблонов при полимеризации АФБК позволит обеспечить, помимо выгодной тетраэдрической конфигурации борной кислоты, полости соответствующего размера в матрице полиАФБК.
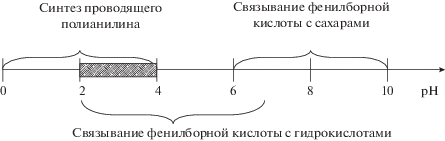
Проводящие производные полианилина можно получить исключительно в кислой среде (pH < 4) [32], а оптимум связывания моносахаридов с полиАФБК лежит в области нейтральных pH, что видно из рН-зависимостей наблюдаемых констант связывания на рис. 5 и 6. В работе [33] предложен электрохимический синтез полиАФБК с молекулярными отпечатками фруктозы. Константа связывания фруктозы с фенилборной кислотой достаточно высока, однако при рН синтеза (рН 5) она значительно снижается. Кроме того, при проведении полимеризации в фосфатном буферном растворе можно получить только непроводящие полимерные пленки полианилина, непригодные для электрохимического детектирования методом спектроскопии импеданса. По этой причине использование сахаров для создания молекулярных отпечатков в боронат-замещенном полианилине неэффективно.
Гидроксикислоты, в отличие от моносахаридов, имеют достаточно высокие константы связывания с ФБК уже в слабокислой среде, удовлетворяющей условию полимеризации проводящего полианилина, поэтому для создания полимеров с молекулярными отпечатками целесообразно использовать исключительно гидроксикислоты, но не сахара (рис. 7).
Рис. 7.
Сравнение оптимальных значений рН для полимеризации проводящего анилина и для связывания фенилборной кислоты с сахарами и гидроксикислотами.
В работе [34] нами разработаны условия электрохимического синтеза проводящего боронат-замещенного полианилина в присутствии фторида и гидроксикислот (тартрат, лактат). Показано, что, варьируя молекулы в растворе для полимеризации 3-АФБК, можно изменять аналитические характеристики сенсоров и не только увеличивать чувствительность, но и управлять селективностью сенсоров. Для анализа методом СЭХИ с использованием электродов, модифицированных проводящими полимерами, необходимым условием является получение на поверхности электрода полимера, обладающего проводимостью. Нами показано, что получить проводящие пленки полиАФБК с молекулярными отпечатками на поверхности электродов можно в том случае, если при полимеризации 3-АФБК заменить фторид-ион на гидроксикислоту. Для создания молекулярных отпечатков использовали соли гидроксикислот: лактат, тартрат, а также цитрат, которые способны ковалентно связываться с 3-АФБК при рН 2–4.
Так как комплексы диолов с фенилборной кислотой образуются преимущественно в анионной форме (константы устойчивости тетраэдрических заряженных комплексов выше, чем нейтральных тригональных [20]), при взаимодействии 3-АФБК с гидроксикислотой равновесие смещается в сторону образования тетраэдрического отрицательно заряженного боронатного эфира. Как и в случае с фторидом, при появлении на атоме бора отрицательного заряда ориентация электрофильного замещения в ароматической системе 3-АФБК становится согласованной для реализации механизма роста проводящего полианилина (схема 6 ).
Схема 6 . Образование тетраэдрического боронатного эфира при взаимодействии 3-аминофенилборной кислоты с гидроксикислотой.
По этой причине для синтеза полиАФБК с молекулярными отпечатками подходит только мета-изомер АФБК, синтез проводящего полимера из которого возможен только при наличии отрицательного заряда на атоме бора. В свою очередь, связывание орто-изомера с сахаром в процессе синтеза препятствует полимеризации 2-АФБК, поэтому таким способом полимер с молекулярным отпечатком получить не удается.
Мы синтезировали проводящий полианилин из 3-АФБК в присутствии темплатирующих агентов: тартрата натрия и лактата калия [34], а также цитрата натрия. Факт образования проводящего полимерного покрытия на поверхности электрода подтверждает ковалентное связывание молекулы мономера (3-АФБК) с гидроксикислотой при полимеризации, а, следовательно, и включение молекулы-шаблона в матрицу полимера.
Очевидно, что на связывание аминофенилборной кислоты с гидроксикислотами по реакции на схеме 6 влияет соотношение равновесных концентраций мономера и депротонированной формы гидроксикислоты в растворе для полимеризации. Долю незаряженной формы 3-АФБК при рН синтеза 2–4 можно считать равной 100%, так как рКа аминофенилборной кислоты составляет 8.9. Концентрация ионизованной формы гидроксикислоты при соответствующих значениях рН определяется значением ее рКа.
Экспериментально показано, что существует оптимальное значение рН ростового раствора для синтеза проводящей поли(3-АФБК) с молекулярными отпечатками. Оптимум достигается при максимальной скорости роста проводящего полимера, о которой можно судить по высоте острого катодного пика на ЦВА модифицированных электродов. Видно, что pH-профили скорости роста имеют куполообразную зависимость, причем максимум лежит вблизи первой pKa гидроксикислот.
Свойства полиАФБК с молекулярными отпечатками изучены методом спектроскопии электрохимического импеданса. Аналогично поли(2-АФБК) и поли(3-АФБК), проводимость полимеров, синтезированных в присутствии гидроксикислот, возрастает при взаимодействии с аналитами, что на диаграмме Найквиста отражается уменьшением диаметра высокочастотной полуокружности, соответствующей Rп. Константы связывания сахаров и гидроксикислот с полимерами с молекулярными отпечатками, определенные из концентрационных зависимостей, приведены в табл. 4.
Таблица 4.
Наблюдаемые константы связывания (М–1) поли(3-аминофенилборной кислоты), обладающей и не обладающей молекулярными отпечатками, с глюкозой, фруктозой и лактатом
| Аналит | Поли(3-АФБК) | Поли(3-АФБК) с отпечатками различных темплатов | ||
|---|---|---|---|---|
| тартрат | лактат | цитрат | ||
| Глюкоза, pH 7 | 2.5 ± 1.5 | 35 ± 3 | 32 ± 4 | 25 ± 4 |
| Фруктоза, pH 7 | 98 ± 10 | 420 ± 30 | 410 ± 40 | 190 ± 20 |
| Лактат, pH 6 | 19 ± 4 | 14 ± 3 | 150 ± 20 | 48 ± 3 |
Поскольку получить полиАФБК в отсутствие молекул, способных связываться с борнокислыми группами при рН синтеза, можно только при полимеризации орто-изомера, полимером без молекулярных отпечатков следует считать только тот полимер, который получен бесфторидным способом полимеризации 2-АФБК. Эффект молекулярного отпечатка можно оценить путем сравнения наблюдаемых констант связывания с аналитами полиАФБК, полученных в разных условиях. Из табл. 4 видно, что в случае полимеров с молекулярными отпечатками константы связывания с глюкозой увеличиваются примерно в 10–14 раз, с фруктозой – в 2–4 раза. Константы связывания глюкозы с полиАФБК, синтезированной в присутствии лактат- и тартрат-ионов, в 2 раза выше, чем с полиАФБК, полученной в присутствии фторид-иона. ПолиАФБК с молекулярными отпечатками цитрата и полиАФБК с отпечатками фторида обладают близкими константами связывания с глюкозой и фруктозой. Таким образом, молекулярные отпечатки гидроксикислот способствуют более высокой аффинности полиАФБК к моносахаридам. Аналитические характеристики электродов, модифицированных полимерами с отпечатками различных гидроксикислот, для определения глюкозы и лактата приведены в табл. 5 и 6. Видно, что предел обнаружения глюкозы понижен в случае полиАФБК с молекулярными отпечатками гидроксикислот, а диапазон определяемых концентраций сдвинут в область более низких концентраций глюкозы. Тем не менее, чувствительность к глюкозе не зависит от природы гидроксикислоты, использованной при синтезе полиАФБК для создания отпечатка. В то же время по сравнению с полиАФБК, полученной в присутствии фторида, коэффициенты чувствительности для полимера с отпечатками гидроксикислот в 2 раза выше.
Таблица 5.
Аналитические характеристики электродов, модифицированных поли(3-аминофенилборной кислотой), при определении глюкозы
| Характеристика | Поли(3-АФБК) | Поли(3-АФБК) с отпечатками различных темплатов | ||
|---|---|---|---|---|
| тартрат | лактат | цитрат | ||
| Коэффициент чувствительности, мМ–1 | 2 ± 1 | 11 ± 2 | 9 ± 2 | 10 ± 1 |
| Предел обнаружения, мМ | 7.5 | 1.3 | 1.6 | 1.4 |
| Диапазон определяемых концентраций, мМ | 20–250 | 5–150 | 6–100 | 6–280 |
Таблица 6.
Аналитические характеристики сенсоров при определении лактата
| Характеристика | Поли(3-АФБК) | Поли(3-АФБК) с молекулярными отпечатками | ||
|---|---|---|---|---|
| тартрат | лактат | цитрат | ||
| Коэффициент чувствительности, мМ–1 | 8 ± 1 | 13 ± 4 | 48 ± 5 | 26 ± 3 |
| Предел обнаружения, мМ | 2.0 | 1.1 | 0.3 | 0.6 |
| Диапазон определяемых концентраций, мМ | 14–200 | 3–90 | 1–35 | 1.5–70 |
Наибольший эффект молекулярного отпечатка проявляется при определении лактата. Из табл. 4 видно, что константа связывания с лактатом полиАФБК с отпечатками цитрата повышена в 2.5 раза по сравнению с полиАФБК без отпечатков. Молекулярные отпечатки самого лактата позволили увеличить константу связывания полимера с лактатом в 8 раз.
Противоположный эффект получен для полимера с молекулярными отпечатками тартрата: константа связывания нового материала с лактатом не изменилась и, следовательно, оказалась в 2 раза ниже по сравнению с поли(3-АФБК), полученной в присутствии фторида. Из табл. 6 следует, что предел обнаружения лактата удалось понизить с 2 до 0.3 мМ при использовании полимера с молекулярными отпечатками лактата.
Таким образом, путем синтеза поли(3-АФБК) с молекулярными отпечатками гидроксикислот можно варьировать сродство полимера к аналитам и достигать желаемой чувствительности и селективности сенсора в зависимости от поставленной задачи.
Различия в чувствительности полимеров с отпечатками гидроксикислот позволяют селективно определять сахара и гидроксикислы в смеси, что продемонстрировано на примере смеси лактата и фруктозы. С помощью двух сенсоров с наиболее различающейся селективностью: поли(3-АФБК) с отпечатками лактата и полиАФБК с отпечатками фторида проанализированы модельные смеси лактата и фруктозы в соотношениях 1 : 1 и 3 : 2. В предположении отсутствия кооперативного эффекта аналитов на импедиметрический отклик сенсоров изменение сопротивления полимера в смеси можно представить в виде суммы выражений, описывающих градуировочную зависимость согласно уравнению (12). Концентрации аналитов в смеси рассчитаны с использованием параметров нелинейной градуировочной зависимости ($R_{{\text{п }}}^{0},$ $R_{{\text{п }}}^{\infty },$ Кнабл) для двух сенсоров путем решения системы из двух уравнений с двумя неизвестными. Минимальная степень извлечения составила 89% (табл. 7).
Таблица 7.
Результаты анализа модельных смесей фруктозы и лактата
| Введено, мM | Найдено, мM | Степень извлечения, % | |||
|---|---|---|---|---|---|
| фруктоза | лактат | фруктоза | лактат | фруктоза | лактат |
| 1.5 | 1.5 | 1.6 ± 0.4 | 1.7 ± 0.4 | 96.6 | 88.8 |
| 4.0 | 4.0 | 3.9 ± 0.9 | 3.8 ± 0.9 | 97.1 | 95.6 |
| 1.0 | 1.5 | 1.1 ± 0.2 | 1.6 ± 0.4 | 93.5 | 92.8 |
Таким образом, возможность управления аналитическими характеристиками сенсоров на основе полифенилборных кислот, варьируя молекулы-шаблоны при электрополимеризации, открывает перспективы для осуществления селективного безреагентного определения сахаров и гидроксикислот с помощью синтетических рецепторов.
Неферментативный сенсор на основе полиаминофенилборных кислот для анализа пота. Успехи, достигнутые для полиАФБК с молекулярными отпечатками, позволяют применить разработанные сенсоры для решения актуальных задач в области медицины. Так, полиАФБК можно использовать для определения лактата, одного из важнейших низкомолекулярных аналитов в клинической диагностике. Известно, что повышение концентрации лактата в крови является признаком гипоксии (кислородного голодания) органов и тканей. Кроме того, возросший интерес к методам неинвазивной диагностики позволяет рассматривать в качестве объектов анализа не только кровь, но и другие экскреторные жидкости [35, 36]. Создан сенсор на основе полиАФБК для определения концентрации лактата в поте. Содержание лактата в крови коррелирует с его содержанием в поте, при этом потовая железа способна концентрировать лактат таким образом, что его концентрация в поте на порядок выше, чем в крови.
Неферментативные сенсоры на основе фенилборных кислот можно применять для анализа пота, так как лактат является преобладающим компонентом пота (табл. 8). Импедиметрический отклик электродов, модифицированных боронат-замещенным полианилином, наблюдается при связывании полимера исключительно с полиолами, сахарами и 1,2-гидроксикислотами. Аминокислоты, карбоновые кислоты, 1,3-гидроксикислоты, кетокислоты, а также неорганические анионы (за исключением фторид-иона) не влияют на характеристики сенсоров на основе фенилборных кислот и не мешают определению лактата. Среди содержащихся в поте веществ, способных связываться с полиАФБК в условиях анализа пота, можно отметить лишь глюкозу и фторид-ион, однако их концентрация на 2–3 порядка ниже концентрации лактата. Кроме того, константа связывания полиАФБК с глюкозой при рН < 7 уменьшается, в то время как для лактата повышается. Наилучшими аналитическими характеристиками для определения лактата обладает полиАФБК с молекулярными отпечатками лактата. Селективность такого полимера к лактату по сравнению с глюкозой можно оценить по соотношению соответствующих констант связывания: При рН 6.0 коэффициент селективности составил Kлактатглюкоза < 3 × 10–2.
Таблица 8.
Состав человеческого пота [36]
| Компонент | Средняя концентрация, M |
|---|---|
| Лактат | 1.4 × 10–2 |
| Глюкоза | 1.7 × 10–4 |
| Фторид | 1.1 × 10–5 |
| Пируват | 1.8 × 10–4 |
| Ацетат | 1.3 × 10–4 |
| Аминокислоты | (1.7–7.8) × 10–4 |
| Мочевина | 1.0 × 10–2 |
| Хлорид | 2.3 × 10–2 |
| Фосфат | 3.1 × 10–4 |
| Бикарбонат | 3.0 × 10–3 |
В работе [36] на основе синтеза полиаминофенилборной кислоты с молекулярными отпечатками лактата на планарных трехэлектродных структурах создан неферментативный сенсор для определения концентрации лактата в поте. Импедиметрический сенсор на основе полиАФБК с молекулярными отпечатками лактата обладает следующими аналитическими характеристиками: чувствительность 17 ± 3 М–1, предел обнаружения 1.5 мМ, диапазон определяемых концентраций 3–100 мМ. Его преимуществом по сравнению с биосенсорами является стабильность аналитических характеристик при хранении на воздухе при комнатной температуре в течение 6 мес.
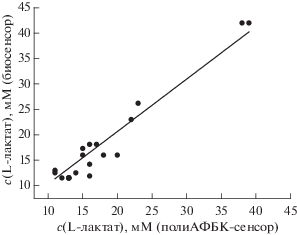
С помощью разработанного неферментативного сенсора проанализировали 17 образцов пота 7 добровольцев. Найденные концентрации лактата в поте лежат в рабочем диапазоне сенсора от 10 до 40 мМ. Правильность определения концентрации лактата для всех образцов пота подтверждена сравнением с данными, полученными с использованием высокоселективного биосенсора на основе фермента лактатоксидазы (рис. 8).
Рис. 8.
Корреляция результатов определения концентраций лактата в поте, полученных с помощью сенсора на основе полиаминофенилборной кислоты и биосенсора.
Таким образом, на основе полиАФБК с молекулярными отпечатками разработан неферментативный сенсор для определения лактата в поте. Невысокая специфичность фенилборных кислот не ограничивает практическую применимость сенсора. Во-первых, лактат является основным компонентом пота, и его концентрация на два порядка превышает концентрацию потенциально мешающих полиолов, в частности глюкозы. Во-вторых, создание молекулярных отпечатков лактата в поли(аминофенилборной кислоте) позволило повысить селективность сенсора к лактату (коэффициент селективности глюкоза/лактат снижен на порядок). Сенсор демонстрирует высокую стабильность при хранении на воздухе при комнатной температуре. Кроме того, образец пота, как и при использовании биосенсоров, не требует предварительной пробоподготовки за исключением двукратного разбавления буферным раствором. Все это делает возможным применение неферментативного сенсора на основе полиАФБК с молекулярными отпечатками в клинической практике для неинвазивной диагностики гипоксии.
Обнаружение микроорганизмов с использованием поли(3-аминофенилборной кислоты). Для функционирования модифицированного торцевого электрода как электрохимического сенсора необходимы внешний электрод сравнения и вспомогательный электрод. Это ограничивает применение такой системы в аналитической практике и затрудняет миниатюризацию всей системы в целом и использование за пределами лаборатории. В связи с этим предложена конструкция электродов, позволяющая устранить эти ограничения. Вместо торцевых стеклоуглеродных электродов выбраны гребенчатые золотые микроэлектроды, характеристики и модификация которых чувствительным слоем поли(3-АФБК) оптимизированы нашей научной группой [37].
Использование гребенчатых микроэлектродов дает несколько ключевых преимуществ по сравнению с подобной системой на основе торцевых электродов. Во-первых, гребенчатые микроэлектроды состоят из двух независимых электродов и могут функционировать по двухэлектродной схеме без использования внешнего электрода сравнения [38]. После модификации чувствительным слоем такие микроструктуры становятся полноценными электрохимическими сенсорами, поскольку содержат в себе все необходимые для функционирования элементы. Во-вторых, микросенсоры заметно облегчают миниатюризацию прототипа сенсорной системы по сравнению с классическими электродами и открывают обширные возможности для встраивания системы в помещения или коммуникации.
После перехода на принципиально другую конструкцию электродов исследовали изменение сопротивления поли(3-АФБК) в жидкой среде в присутствии диолсодержащих соединений на примере глюкозы. В присутствии глюкозы на диаграммах Найквиста происходит уменьшение диаметра высокочастотной полуокружности (рис. 9а), свидетельствующее об увеличении проводимости полимера, аналогично наблюдаемому на модифицированных торцевых стеклоуглеродных электродах (рис. 3). Таким образом, при переходе к иной конструкции электродов эффект увеличения проводимости в жидкой среде при связывании с глюкозой сохраняется.
Рис. 9.
Диаграммы Найквиста в жидкости (а) или в аэрозоле (б) для микросенсоров: (◻) – в отсутствие глюкозы, (◼) – в присутствии глюкозы, (△) – при замене раствора на не содержащий глюкозу.

Наиболее перспективным практическим применением системы является анализ аэрозоля. Обнаружение микроорганизмов, например, в жидкости, невозможно в случае продолжительных и in situ экспериментов. С течением времени жидкость испаряется, что влияет на проводящие свойства полимера, и сопоставить изменение проводимости с присутствием или отсутствием микроорганизмов в системе становится невозможно. В общем случае в электрохимических системах жидкая среда (чаще всего, раствор фонового электролита) выполняет роль проводника, обеспечивая электрический контакт между электродами, поэтому наличие жидкостного контакта часто является необходимым условием функционирования всей системы. Для системы гребенчатых микроэлектродов модификация проводящим полимером позволяет отказаться от использования раствора электролита в системе и обеспечивает необходимый электрический контакт даже на воздухе. Как видно из микрофотографии модифицированных микроэлектродов (рис. 10), в ходе роста полимер образует нити, соединяющие оба гребенчатых микроэлектрода и создающие электрический контакт, что позволяет проводить эксперименты без внесения сенсора в раствор электролита.
Рис. 10.
Микрофотографии поверхности гребенчатых микроэлектродов: (а) – до модификации; (б) – после модификации.

Пригодность микросенсоров для анализа аэрозоля оценивали путем анализа изменений сопротивления полимера в потоке аэрозоля с глюкозой. Итоговые диаграммы Найквиста представлены на рис. 9б.
Таким образом, эффект увеличения проводимости сенсора на основе 3-АФБК в результате специфического взаимодействия наблюдается как для модифицированных торцевых электродов, так и для модифицированных гребенчатых микроэлектродов (микросенсоров), что указывает на универсальность полученного эффекта. В случае микросенсоров эффект увеличения проводимости наблюдается не только в водной, но и в воздушной среде, что позволяет применять их для анализа жидких сред и аэрозоля.
Применение микросенсоров для обнаружения микроорганизмов в водной среде. Контроль содержания микроорганизмов является важной задачей в области охраны труда и здравоохранения. Проблема микробного заражения воздушного пространства актуальна практически во всех сферах человеческой деятельности и повседневной жизни. Микроорганизмы являются причиной микозов, сопутствующих аллергических реакций, бронхиальной астмы [39–41]. Помимо угрозы здоровью человека они негативно влияют на процессы пищевых, лекарственных и микроэлектронных производств. Среди наиболее распространенных в воздушной среде рабочих и жилых помещений микроорганизмов выделяют грибы родов Penicillium и Aspergillus [42, 43]. В настоящее время для микробиологического контроля применяют несколько основных методов: культивирование на питательных средах, микроскопические исследования [44], взаимодействие с ДНК [45, 46], АТФ-биолюминесценцию [47], масс-спектрометрию [2] и проточную цитометрию [48]. Основные недостатки существующих методов – необходимость использования дополнительных реагентов, биораспознающих элементов, длительные стадии анализа, дорогостоящее высокотехнологичное оборудование – ограничивают их практическое применение и обусловливают интерес к созданию простых, безреагентных и экспрессных методов обнаружения микроорганизмов. Кроме того, перечисленные выше методы чаще всего неприменимы для задач длительного мониторинга. Для устранения указанных недостатков можно применить не требующие пробоподготовки и пригодные для работы вне лаборатории электрохимические методы, использующие простое и миниатюрное, но чувствительное и недорогое оборудование. В рамках данного обзора рассмотрим применение электрохимических методов для определения микроорганизмов при помощи безреагентных сенсоров на основе поли(3-АФБК).
Клеточная стенка большинства микроорганизмов, в том числе и спор Penicillium chrysogenum, более чем на 60% состоит из олиго- и полисахаридов, содержащих 1,2- или 1,3-цис-диольные фрагменты [49, 50]. Использование боронат-замещенного полианилина или поли(3-АФБК) в качестве чувствительного элемента, обладающего сродством к составляющим поверхности клеточной стенки, позволит применить безреагентный сенсор для обнаружения микроорганизмов.
Для экспериментов с микроорганизмами готовили водные суспензии Penicillium chrysogenum (фосфатный буферный раствор с рН 7.0). Содержание микроорганизмов в суспензии определяли методом посева на чашки Петри с селективной питательной средой с последующей культивацией и подсчетом колоний. Суспензию с содержанием 50 000 КОЕ/мл исследовали при помощи автоматического лазерного дифракционного анализатора частиц. В суспензии в основном присутствуют частицы размером порядка 3 мкм, что соответствует размеру единичной споры Penicillium chrysogenum [51]. Частицы крупных размеров (10–100 мкм) не обнаружили, распределение частиц по размерам при инкубации в ходе анализа оставалось неизменным. Этот факт позволяет утверждать, что основная составляющая суспензии (95%) – споры микромицетов.
Споры Penicillium chrysogenum в водной среде обнаруживали методом спектроскопии импеданса с применением трехэлектродной схемы с рабочим торцевым электродом, модифицированным поли(3-АФБК). После погружения электрода в фосфатный буферный раствор с рН 7.0 применяли синусоидальную развертку потенциала с постоянным значением 0.05 В относительно хлоридсеребряного электрода и амплитудой колебаний 5 мВ. Последовательно регистрировали диаграммы Найквиста для сенсоров в буферном растворе до тех пор, пока они не становились статистически неотличимыми. Затем исходный раствор заменяли суспензией плесневых грибов с различными концентрациями, определенными методом посева. После этого для каждой концентрации микроорганизмов снова регистрировали диаграммы Найквиста.
В качестве аналитического сигнала выбрали сопротивление полимера Rп, рассчитанное из диаметра полуокружности высокочастотной области диаграммы (рис. 11а). При продолжительной регистрации импеданса в чистом фосфатном буферном растворе наблюдается незначительный рост Rп – примерно 5% за 1 ч, т.е. фоновые процессы приводят к увеличению сопротивления (или уменьшению проводимости). В отличие от неспецифических процессов, присутствие микроорганизмов вызывает увеличение проводимости полимера, что крайне важно для практического использования.
Рис. 11.
(а): Диаграммы Найквиста для сенсора в суспензиях с различными концентрациями плесневых грибов (КОЕ/мл): (1) – 0, (2) – 1200, (3) – 7000, (4) – 22 000, (5) – 26 000 (n = 3, P = 0.95). (б): Градуировочная зависимость сопротивления полимера от концентрации микроорганизмов, аппроксимированная уравнением (12).

С увеличением концентрации микроорганизмов в суспензии сопротивление полимера Rп уменьшается. Вычислив сопротивление полимера, можно построить градуировочную зависимость Rп от концентрации микромицетов. Как и в случае с соединениями, содержащими 1,2- или 1,3-цис-диольные фрагменты, зависимость аппроксимирована уравнением (12), как показано на рис. 11б.
Обнаружение микроорганизмов в водной среде с использованием микросенсоров проводили по двухэлектродной схеме; в роли вспомогательного электрода и электрода сравнения выступал второй микроэлектрод гребенчатой конструкции. Микросенсор погружали в раствор фосфатного буферного раствора с рН 7.0, после чего регистрировали диаграммы Найквиста для различных концентраций микроорганизмов до тех пор, пока последовательно снятые диаграммы не становились статистически неотличимыми. По значениям приведенных на диаграммах частот видно, что в отсутствие микроорганизмов и при концентрациях 300 и 600 КОЕ/мл наблюдается фрагмент высокочастотной полуокружности, которая полностью проявляется при более высоких концентрациях (рис. 12а). С увеличением концентрации плесневых грибов в суспензии уменьшается диаметр высокочастотной полуокружности. Это говорит об уменьшении Rп в присутствии плесневых грибов для микросенсоров, функционирующих по двухэлектродной схеме, как и при обнаружении микроорганизмов по трехэлектродной схеме.
Рис. 12.
(а): Диаграммы Найквиста для микросенсора с концентрацией микроорганизмов в растворе (КОЕ/мл): (◻) – 0, (◆) – 300, (◼) – 600, (⚫) – 1200, (▲) – 2100 (n = 3, P = 0.95). (б): Градуировочная зависимость сопротивления полимера от концентрации микроорганизмов, аппроксимированная уравнением (12).
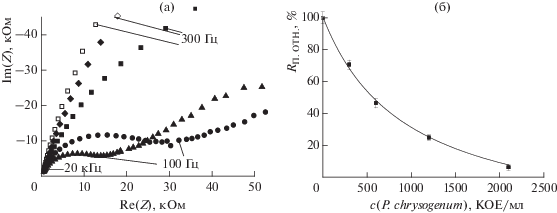
Сравнение градуировочных зависимостей для сенсора и микросенсора показывает, что чувствительность обнаружения микроорганизмов для последнего значительно выше: содержание плесневых грибов в 1200 КОЕ/мл вызывает понижение сопротивления модифицированного микроэлектрода в 5 раз (рис. 12б), тогда как для торцевых электродов такая же суспензия вызывает понижение сопротивления на 5% (рис. 11б).
Увеличение проводимости в присутствии микроорганизмов, вероятно, обусловлено связыванием борнокислых групп полимера с диольными группами клеточных стенок микроорганизмов. Данный эффект проявляется для различных типов электродов и определяемых объектов (моносахаридов, полиолов, гидроксикислот, микроорганизмов), следовательно, явление повышения проводимости полимера при связывании с 1,2- или 1,3-цис-диольными группами носит универсальный характер.
Применение микросенсоров для обнаружения микроорганизмов в аэрозоле. Аэрозоль, содержащий микроорганизмы, (или биоаэрозоль) создавали путем пропускания потока воздуха через стеклянную промывную склянку с водной суспензией Penicillium chrysogenum. Для обнаружения микроорганизмов в потоке аэрозоля микросенсор закрепляли на пути воздушного потока. В начале эксперимента в склянке содержался чистый фосфатный буферный раствор. Для каждой концентрации микроорганизмов (в том числе для чистого фосфатного буферного раствора) измеряли импеданс до тех пор, пока последовательно зарегистрированные диаграммы не становились статистически неотличимыми. В качестве аналитического отклика использовали, как и в других экспериментах, сопротивление полимера Rп.
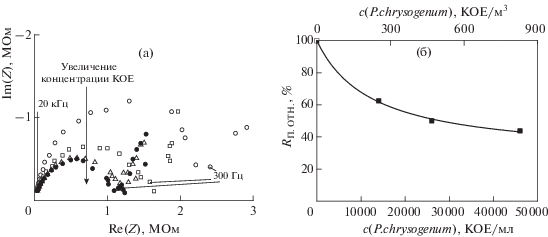
В ходе обнаружения микроорганизмов зарегистрировали диаграммы Найквиста в потоке аэрозоля, создаваемого из суспензий с концентрациями от 14 000 до 46 000 КОЕ/мл (рис. 13а). С увеличением концентрации плесневых грибов в насыщающем растворе для создания аэрозоля диаметр высокочастотной полуокружности уменьшается (рис. 13б). Это свидетельствует о понижении сопротивления поли(3-АФБК) в присутствии микроорганизмов в аэрозоле, аналогично экспериментам по обнаружению микроорганизмов в жидкости (рис. 11б, 12б).
Рис. 13.
(а): Диаграммы Найквиста для микросенсора в аэрозоле из насыщающих растворов с концентрациями (КОЕ/мл): (⚪) – 0, (◻) – 14 000, (▲) – 26 000, (⚫) – 46 000 (n = 3, P = 0.95). (б): Градуировочная зависимость сопротивления полимера от концентрации микроорганизмов в насыщающем растворе, аппроксимированная уравнением (12).
Итак, эксперименты по обнаружению Penicillium chrysogenum в биоаэрозоле показали, что поли(3-АФБК) при специфических взаимодействиях с определяемыми объектами понижает свое сопротивление, тогда как при фоновых процессах, связанных, например, с деградацией и дедопированием, сопротивление повышается.
На основании посева проб аэрозоля с различными концентрациями микроорганизмов рассчитали объемные концентрации микромицетов в аэрозоле. Диапазон определяемых в воздушной среде концентраций составляет от 200 до 800 КОЕ/м3. Это делает микросенсор пригодным для обнаружения микроорганизмов в концентрациях, соответствующих гигиеническому нормативу для атмосферного воздуха населенных мест (500 КОЕ/м3).
Таким образом, создан безреагентный электрохимический микросенсор, пригодный для простого и экспрессного обнаружения микроорганизмов (на примере Penicillium chrysogenum) непосредственно в воздушной среде [52]. При этом не требуется дополнительная пробоподготовка, связанная с разрушением клеточной стенки или мембраны, или специальной окраской, а вся процедура, включая построение градуировочной зависимости, занимает около 3 ч. Надежность обнаружения микроорганизмов обеспечивается генерацией электрохимических сигналов: в случае специфических взаимодействий с компонентами клеточной стенки сопротивление полимера понижается, а в случае фоновых процессов сопротивление увеличивается. Для функционирования микросенсора не требуется дополнительных электродов или специальной ячейки, что позволит сконструировать электроаналитическую систему для применения in situ.
* * *
Разработанные нами безреагентные сенсоры на основе 2- и 3-аминофенилборной кислоты перспективны для применения в аналитической практике. В большинстве импедансометрических и кондуктометрических (био)сенсоров аналитическим сигналом является уменьшение их проводимости. Однако неспецифические сигналы также приводят к уменьшению проводимости, не позволяя, таким образом, достоверно отличать, например, низкие концентрации аналита от высокой концентрации интерферирующих соединений. Для преодоления этих проблем приходится маскировать интерферирующие соединения путем создания высокой ионной силы, экстремальных значений рН, введения поверхностно-активных веществ и др. При этом анализ перестает быть “безреагентным”, что ограничивает практическое применение таких систем за счет введения дополнительных стадий пробоподготовки, использования дополнительных реагентов и привлечения квалифицированного персонала. В разработанных нами сенсорах использован безреагентный принцип определения: аналитическим сигналом является увеличение проводимости используемых материалов, направленное противоположно сигналу от неспецифических фоновых процессов, приводящих к уменьшению проводимости. Данный принцип успешно применен для анализа смеси диолсодержащих соединений, пота человека, обнаружения микроорганизмов в водной среде и в аэрозоле. Кроме того, можно регулировать аналитические характеристики разработанных сенсоров, используя метод молекулярных отпечатков. Продемонстрированные приложения не ограничивают сферу применения разработанных сенсоров и принципа их функционирования, открывая новые аналитические возможности.
Авторы признательны Российскому научному фонду за финансовую поддержку проведенных исследований (грант № 18-73-00264).
Список литературы
Wu X., Li Z., Chen X.-X., Fossey J.S., James T.D., Jiang Y.-B. Selective sensing of saccharides using simple boronic acids and their aggregates // Chem. Soc. Rev. 2013. V. 42. № 20. P. 8032.
Kim J.-K., Jackson S.N., Murray K.K. Matrix-assisted laser desorption/ionization mass spectrometry of collected bioaerosol particles // Rapid Commun. Mass Spectrom. 2005. V. 19. № 12. P. 1725.
Liu H., Li Y., Sun K., Fan J., Zhang P., Meng J., Wang S., Jiang L. Dual-responsive surfaces modified with phenylboronic acid-containing polymer brush to reversibly capture and release cancer cells // J. Am. Chem. Soc. 2013. V. 135. № 20. P. 7603.
Wannapob R., Kanatharana P., Limbut W., Numnuam A., Asawatreratanakul P., Thammakhet C., Thavarungkul P. Affinity sensor using 3-aminophenylboronic acid for bacteria detection // Biosens. Bioelectron. 2010. V. 26. № 2. P. 357.
Nicolas M., Fabre B., Marchand G., Simonet J. New boronic-acid- and boronate-substituted aromatic compounds as precursors of fluoride-responsive conjugated polymer films // Eur. J. Org. Chem. 2000. V. 2000. № 9. P. 1703.
Shoji E., Freund M.S. potentiometric sensors based on the inductive effect on the pKa of poly(aniline): A nonenzymatic glucose sensor // J. Am. Chem. Soc. 2001. V. 123. № 14. P. 3383.
Shoji E., Freund M.S. Potentiometric saccharide detection based on the pKa changes of poly(aniline boronic acid) // J. Am. Chem. Soc. 2002. V. 124. № 42. P. 12 486.
Liu S., Miller B., Chen A. Phenylboronic acid self-assembled layer on glassy carbon electrode for recognition of glycoprotein peroxidase // Electrochem. Commun. 2005. V. 7. № 12. P. 1232.
Morita K., Hirayama N., Imura H., Yamaguchi A., Teramae N. Grafting of phenylboronic acid on a glassy carbon electrode and its application as a reagentless glucose sensor // J. Electroanal. Chem. 2011. V. 656. № 12. P. 192.
Wang H.-C., Zhou H., Chen B., Mendes P.M., Fossey J.S., James T.D., Long Y.-T. A bis-boronic acid modified electrode for the sensitive and selective determination of glucose concentrations // Analyst. 2013. V. 138. № 23. P. 7146.
Ma Y.,Yang X. One saccharide sensor based on the complex of the boronic acid and the monosaccharide using electrochemical impedance spectroscopy // J. Electroanal. Chem. 2005. V. 580. № 2. P. 348.
Ali S.R., Ma Y., Parajuli R.R., Balogun Y., Lai W.Y.C., He H. A nonoxidative sensor based on a self-doped polyaniline/carbon nanotube composite for sensitive and selective detection of the neurotransmitter dopamine // Anal. Chem. 2007. V. 79. № 6. P. 2583.
Plesu N., Kellenberger A., Taranu I., Taranu B.O., Popa I. Impedimetric detection of dopamine on poly(3-aminophenylboronic acid) modified skeleton nickel electrodes // React. Funct. Polym. 2013. V. 73. № 5. P. 772.
Badhulika S., Tlili C., Mulchandani A. Poly(3-aminophenylboronic acid)-functionalized carbon nanotubes-based chemiresistive sensors for detection of sugars // Analyst. 2014. V. 139. № 12. P. 3077.
Lomakina G.Y., Ugarova N.N. Abstracts of the 16th international symposium on bioluminescence and chemiluminescence (ISBC 2010) // Luminescence. 2010. V. 25. № 2. P. 192.
Batey R.A., Carboni B., Carreaux F., Chan D.M.T., Cho B.T., Gao X., Hayashi T., Ishihara K., Ishiyama T., James T., Kennedy J.W.J., Lam P.Y.S., Matteson D., Miyaura N., Suzuki A., Wang B., Yang W., Yoshida K. Boronic Acids: Preparation and Applications in Organic Synthesis and Medicine. Wiley-VCH Verlag GmbH & Co. KGaA, 2005. 572 p.
Yang X., Cheng Y., Jin S., Wang B. / Boronic Acid-Based Receptors and Chemosensors. Artificial Receptors for Chemical Sensors / Eds. Mirsky V.M., Yatsimirsky A.K. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA, 2010. P. 169.
Bencini A., Lippolis V. Probing biologically and environmentally important metal ions with fluorescent chemosensors: Thermodynamic versus optical response selectivity in some study cases // Coord. Chem. Rev. 2012. V. 256. № 1–2. P. 149.
Schneider H.-J., Yatsimirsky A. Principles and Methods in Supramolecular Chemistry. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA, 1999. 362 p.
Martínez-Aguirre M.A., Villamil-Ramos R., Guerrero-Alvarez J.A., Yatsimirsky A.K. Substituent effects and pH profiles for stability constants of arylboronic acid diol esters // J. Org. Chem. 2013. V. 78. № 10. P. 4674.
Bosch L.I., Fyles T.M., James T.D. Binary and ternary phenylboronic acid complexes with saccharides and Lewis bases // Tetrahedron. 2004. V. 60. № 49. P. 11175.
Springsteen G., Wang B.H. A detailed examination of boronic acid-diol complexation // Tetrahedron. 2002. V. 58. № 26. P. 5291.
Tatara Y., Kakizaki I., Suto S., Ishioka H., Negishi M., Endo M. Chondroitin sulfate cluster of epiphycan from salmon nasal cartilage defines binding specificity to collagens // Glycobiology. 2014. V. 25. № 5. P. 557.
Zayats M., Katz E., Willner I. Electrical contacting of flavoenzymes and NAD(P)+-dependent enzymes by reconstitution and affinity interactions on phenylboronic acid monolayers associated with Au-electrodes // J. Am. Chem. Soc. 2002. V. 124. № 49. P. 14724.
Berionni G., Morozova V., Heininger M., Mayer P., Knochel P., Mayr H. Electrophilic aromatic substitutions of aryltrifluoroborates with retention of the BF3 group: Quantification of the activating and directing effects of the trifluoroborate group // J. Am. Chem. Soc. 2013. V. 135. № 16. P. 6317.
Andreyev E.A., Komkova M.A., Nikitina V.N., Zaryanov N.V., Voronin O.G., Karyakina E.E., Yatsimirsky A.K., Karyakin A.A. Reagentless polyol detection by conductivity increase in course of self-doping of boronate-substituted polyaniline // Anal. Chem. 2014. V. 86. № 23. P. 11690.
Yuchi A., Sakurai J.K., Tatebe A., Hattori H., Wada H. Performance of arylboronic acids as ionophore for inorganic anions studied by fluorometry and potentiometry // Anal. Chim. Acta. 1999. V. 387. № 2. P. 189.
Heinze J., Rasche A., Pagels M., Geschke B. On the origin of the so-called nucleation loop during electropolymerization of conducting polymers // J. Phys. Chem B. 2007. V. 111. № 5. P. 989.
Nikitina V.N., Kochetkov I.R., Karyakina E.E., Yatsimirsky A.K., Karyakin A.A. Tuning electropolymerization of boronate-substituted anilines: Fluoride-free synthesis of the advanced affinity transducer // Electrochem. Commun. 2015. V. 51. P. 121.
Inzelt G., Láng G.G. / Electrochemical Impedance Spectroscopy (EIS) for Polymer Characterization. Electropolymerization: Concepts, Materials and Applications / Eds. Cosnier S., Karyakin A.A. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA. 2010. P. 51.
Park J.-Y., Chang B.-Y., Nam H., Park S.-M. selective electrochemical sensing of glycated hemoglobin (HbA1c) on thiophene-3-boronic acid self-assembled monolayer covered gold electrodes // Anal. Chem. 2008. V. 80. № 21. P. 8035.
MacDiarmid A.G., Epstein A.J. Polyanilines: A novel class of conducting polymers // Faraday Discuss. 1989. V. 88. P. 317.
Deore B., Freund M.S. Saccharide imprinting of poly(aniline boronic acid) in the presence of fluoride // Analyst. 2003. V. 128. № 6. P. 803.
Nikitina V.N., Zaryanov N.V., Kochetkov I.R., Karyakina E.E., Yatsimirsky A.K., Karyakin A.A. Molecular imprinting of boronate functionalized polyaniline for enzyme-free selective detection of saccharides and hydroxy acids. // Sens. Actuators B: Chemical. 2017. V. 246. P. 428.
Karyakin A.A., Nikulina S.V., Vokhmyanina D.V., Karyakina E.E., Anaev E.K.H., Chuchalin A.G. Non-invasive monitoring of diabetes through analysis of the exhaled breath condensate (aerosol) // Electrochem. Commun. 2017. V. 83. P. 81.
Zaryanov N.V., Nikitina V.N., Karpova E.V., Karyakina E.E., Karyakin A.A. nonenzymatic sensor for lactate detection in human sweat // Anal. Chem. 2017. V. 89. № 21. P. 11198.
Komkova M.A., Andreyev E.A., Nikitina V.N., Krupenin V.A., Presnov D.E., Karyakina E.E., Yatsimirsky A.K., Karyakin A.A. A novel reagentless label-free detection principle for affinity interactions resulted in conductivity increase of conducting polymer // Electroanalysis. 2015. V. 27. № 9. P. 2055.
Liu D., Perdue R.K., Sun L., Crooks R.M. Immobilization of DNA onto poly(dimethylsiloxane) surfaces and application to a microelectrochemical enzyme-amplified dna hybridization assay // Langmuir. 2004. V. 20. № 14. P. 5905.
Dacarro C., Picco A.M., Grisoli P., Rodolfi M. Determination of aerial microbiological contamination in scholastic sports environments // J. Appl. Microbiol. 2003. V. 95. № 5. P. 904.
Newson R., Strachan D., Corden J., Millington W. Fungal and other spore counts as predictors of admissions for asthma in the Trent region // Occup. Environ. Med. 2000. V. 57. № 11. P. 786.
Ren P., Jankun T.M., Belanger K., Bracken M.B., Leaderer B.P. The relation between fungal propagules in indoor air and home characteristics // Allergy. 2001. V. 56. № 5. P. 419.
Beguin H., Nolard N. Mould biodiversity in homes I. Air and surface analysis of 130 dwellings // Aerobiologia. 1994. V. 10. № 2. P. 157.
Żukiewicz-Sobczak W.A. The role of fungi in allergic diseases // Adv. Dermatol. Allergol. 2013. V. 30. № 1. P. 42.
Chi M.-C., Li C.-S. Fluorochrome and fluorescent in situ hybridization to monitor bioaerosols in swine buildings // Aerosol Sci. Technol. 2005. V. 39. № 11. P. 1101.
Gilbert Y., Veillette M., Duchaine C. Airborne bacteria and antibiotic resistance genes in hospital rooms // Aerobiologia. 2010. V. 26. № 3. P. 185.
Schulze H., Rubtsova M., Bachmann T.T. / DNA Microarrays for Pathogen Detection. Modern Techniques for Pathogen Detection / Eds. Popp J., Bauer M. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA, 2015. P. 113.
Lee S.J., Park J.S., Im H.T., Jung H.-I. A microfluidic ATP-bioluminescence sensor for the detection of airborne microbes // Sens. Actuators B: Chemical. 2008. V. 132. № 2. P. 443.
Hernlem B.J., Ravva S.V. Application of flow cytometry and cell sorting to the bacterial analysis of environmental aerosol samples // J. Environ. Monitor. 2007. V. 9. № 12. P. 1317.
Rizza V., Kornfeld J.M. Components of conidial and hyphal walls of Penicillium chrysogenum // Microbiology. 1969. V. 58. № 3. P. 307.
Hamilton P.B., Knight S.G. An analysis of the cell walls of Penicillium chrysogenum // Arch. Biochem. Biophys. 1962. V. 99. № 2. P. 282.
Ramírez C., Martinez A.T. Manual and Atlas of the Penicillia. Amsterdam; New York, N.Y.: Elsevier Biomedical Press, 1982. 874 p.
Andreev E.A., Komkova M.A., Shavokshina V.A., Presnov D.E., Krupenin V.A., Karyakin A.A. Reagentless microsensor based on conducting poly(3-aminophenylboronic acid) for rapid detection of microorganisms in aerosol // Electroanalysis. 2018. V. 30. № 4. P. 602.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии








