Журнал аналитической химии, 2019, T. 74, № 4, стр. 285-296
Наноиониты – модификаторы хроматографических фаз и источники аналитического сигнала
А. М. Долгоносов 1, *, Р. Х. Хамизов 1, Н. К. Колотилина 1
1 Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
* E-mail: amdolgo@mail.ru
Поступила в редакцию 19.03.2018
После доработки 18.09.2018
Принята к публикации 18.09.2018
Аннотация
Разработан способ получения наноразмерных ионообменников (наноионитов, НИО) в виде стабильных во времени водных золей заданной ионной формы двух типов: нанокатионитов и наноанионитов. Наноиониты по физико-химическим свойствам являются одновременно растворенными гиперзаряженными ионами и микроскопическими твердыми ионообменниками, способными к твердофазному ионному обмену. В хроматографических и других методах анализа НИО могут служить модификаторами неподвижной и подвижной фаз, обеспечивая высокую емкость первой и особые буферные свойства второй. Приведены некоторые результаты использования НИО для создания полимодальных фаз для ионной хроматографии, в качестве модификатора в капиллярном электрофорезе и для люминесцентного метода определения тяжелых металлов (на примере меди) в водных растворах.
Свойства частиц ионообменных смол нанометрового диапазона до настоящего времени практически не изучали. Это связано с трудоемкостью синтеза функционализированных нанополимеров, сложностью работы с ними и отсутствием задач их применения. Между тем, эти объекты интересны не только высокими кинетическими свойствами, но и как объекты, создающие очень устойчивые золи и сочетающие в себе свойства гиперзаряженных ионов и твердых ионитов. В отличие от обычных ионитов, наноионообменники или наноиониты могут проходить через макропористые мембраны и фильтрующие материалы, а наличие большого заряда при малой массе позволяет управлять их движением и распределением на фазовых границах. Наиболее интересны специфические нанохимические качества НИО, объединяющие свойства твердых сорбентов и гиперзаряженных полимерных ионов.
Известны попытки синтезировать функционализированные полимеры на базе сополимера стирола и дивинилбензола нанометровых размеров [1]. Синтез частиц непривитого сополимера размерами в несколько десятков нанометров проходил успешно, однако при модификации с целью получения сульфокатионита или высокоосновного анионита частицы растворялись. Подобные исследования [2] позволяют оценить размер критического зародыша при синтезе ионитов около 60–80 нм. Если рассмотреть проблему получения наноионитов с другой стороны – путем размола крупной фракции готовых ионитов, то возникает вопрос: как это сделать при помощи истирающих поверхностей с микронной шероховатостью? Возникает сомнение в существовании НИО, т.е. в возможности получить частицы с размерами меньше критического зародыша при синтезе и мельче неровностей истирающей поверхности при размоле.
Тем не менее, решение проблемы лежит как на пути совершенствования синтеза, так и измельчения материала с требуемыми химическими свойствами: для этого вместо истирания необходимо использовать размол в шаровой мельнице. В последнем случае осколки, образующиеся при ударе шаром по частице размером в несколько микрон, могут оказаться в десятки и сотни раз меньше, в частности, попасть в нанометровый диапазон. Этот способ получения наноионитов применяется в наших исследованиях [3].
Для ионной хроматографии используют микрочастицы ионообменников размером порядка 10 мкм, а также частицы субмикронных размеров в качестве модификаторов твердой фазы (см., например, [4]). Примеры применения в аналитической химии частиц меньших размеров до недавнего времени в литературе отсутствовали.
Настоящая работа посвящена исследованиям применения в аналитической химии нового класса материалов – наноразмерных ионообменников.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Строение наноионита. Структура полимерного ионита в общем виде представляет собой объемную сетку, в узлах которой расположены молекулы сшивающего агента, а на цепочках равномерно распределены функциональные группы – фиксированные ионы. Участок полимерной цепи между двумя соседними узлами является периодом сетки. Период полимерного ионита АВ-17 со сшивкой 8% соответствует фрагменту, изображенному на рис. 1. Введены следующие условные обозначения: С – стирол, СЧАО – стирол с четвертичным аммониевым основанием, ДВБ – дивинилбензол; пунктиром обозначена другая полимерная цепь, связанная с рассматриваемой через ДВБ; обозначены расстояние между функциональными группами (b) и размер периода полимера (p). Молярная масса фрагмента, изображенного на рис. 1, за вычетом половины массы ДВБ 130/2 Да, относящейся к другому фрагменту, обозначенному пунктиром, равна ${{M}_{p}}$ = 759 Да. Отношение этих величин дает правильную величину степени сшивки: 8.6%. Размер участка цепи между двумя функциональными группами $b \approx 1.0$ нм. Размер радикала ДВБ – примерно ${b \mathord{\left/ {\vphantom {b 2}} \right. \kern-0em} 2}.$ Средний радиус поперечного сечения звена оценивается как ван-дер-ваальсов радиус атома углерода: $t \approx 0.34$ нм.
Рис. 1.
Модель полимера АВ-17 с содержанием сшивающего агента (дивинилбензола) 8%. Обозначения приведены в тексте.
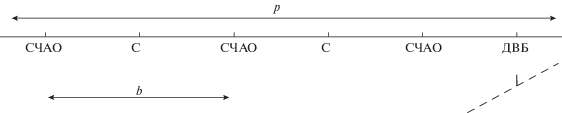
Длина периода p складывается из трех одинаковых отрезков длиной b, расположенных под тетраэдрическими углами друг к другу. Возможны всего две конформации [5]. Наиболее длинная конформация – транс-зигзаг, для которой найдем ${{p}_{N}} = b\sqrt {{{19} \mathord{\left/ {\vphantom {{19} 3}} \right. \kern-0em} 3}} \approx 2.52b \approx $ 2.5 нм. Длина гош-конформации существенно меньше: ${{p}_{V}} = b\sqrt {{{11} \mathord{\left/ {\vphantom {{11} 3}} \right. \kern-0em} 3}} \approx 1.91b \approx $ ≈ 1.9 нм. В хорошем растворителе, каковым является вода, цепь ионита в наибольшей степени распрямлена с $p \approx {{p}_{N}}.$
Полимер можно представить вложенным в кубическую решетку. Принципиально эта возможность подтверждается правильной оценкой максимального изменения объема сшитого полимера. Куб отношения периодов решетки, полученных для случаев транс- и гош-конформаций периода полимера, равен 2.3, что соответствует предельному набуханию ионита с 8%-ной сшивкой. Трехмерную сетку полимера можно разместить в кубической решетке по непересекающимся диагоналям граней, например, как показано на рис. 2.
Так как в узлах этой сетки ДВБ соединяет две касающиеся цепи полимера, степень узла равна 4. Сетка на рис. 2 удовлетворяет этому условию: каждая узловая точка является точкой касания двух линейных цепей. Звенья каждой цепи сочленяются под углом 120°. Отличие валентных углов от тетраэдрических (110°) должно приводить к напряжениям в цепи и соответственно к деформации решетки. Менее значимые в энергетическом отношении торсионные углы между звеньями цепи равны 70.5° вместо 60°. Однако следует иметь в виду, что в модели молекула ДВБ представлена точкой. Учет ее размеров и угловых степеней свободы приводит к возможности создания слабо напряженной конформации с почти правильными плоскими и двугранными углами. При точечной сшивке диагональ грани равна p, шаг решетки – ${p \mathord{\left/ {\vphantom {p {\sqrt 2 }}} \right. \kern-0em} {\sqrt 2 }}.$ Размер ДВБ, ${b \mathord{\left/ {\vphantom {b 2}} \right. \kern-0em} 2},$ служит добавкой к шагу решетки: ${p \mathord{\left/ {\vphantom {p {\sqrt 2 }}} \right. \kern-0em} {\sqrt 2 }} + {b \mathord{\left/ {\vphantom {b 2}} \right. \kern-0em} 2} \approx 2.25$ нм.
Из рис. 2 видно, что повторяющийся элемент уложенной в кубическую решетку тетраэдрической полимерной сетки содержит 4 звена длиной p и помещается в куб со стороной в 4 шага решетки. Именно этот размер (9 нм) можно считать минимальным размером кубической частицы ионита, а минимальным диаметром сферической частицы 13–15 нм. Проверка этих параметров в расчете плотности полимера даст 2 г/см3, что приемлемо, так как менее чем вдвое превышает реальную величину. Найденные минимальные размеры характеризуют критический зародыш твердой фазы только в случае, если частица получена как осколок уже готовой сетки. Если же частица получена путем эмульсионной полимеризации, то неравномерное радиальное распределение внутри капли эмульсии компонентов смеси мономеров с разной поверхностной активностью нарушает их пропорции, важные при синтезе. В частности, приповерхностные слои будут обогащены водорастворимыми компонентами и обеднены сшивающим агентом. Такое расслоение достигает десятков нанометров и поэтому критический зародыш будет иметь гораздо бóльшие размеры – по нашим оценкам не менее 60 нм.
Относительный поверхностный заряд ионита. Размеры НИО в диапазоне 10–100 нм (для частиц неправильной формы верхняя граница отодвинута до 200 нм), обусловливают их двойственную природу, т.е. существование в виде “твердых ионов”. Важно различать полный и реальный заряд НИО. Полный заряд равен суммарному заряду функциональных групп частицы. Реальный же заряд определяется диссоциацией функциональных групп на поверхности частицы, которая для сильнокислотных катионитов и высокоосновных анионитов протекает полностью. Таким образом, на границе раздела фаз происходит пространственное разделение фиксированных зарядов, расположенных на поверхности частицы, и противоионов, выходящих в раствор (рис. 3).
Рис. 3.
Ионообменник, имеющий нескомпенсированный заряд того же знака, что и у фиксированных групп вследствие диссоциации противоионов.

Например, у кубической частицы со стороной 10 нм при среднем расстоянии между соседними функциональными группами 1 нм полный заряд по абсолютной величине оценивается в ${{10}^{3}}$ а. е. (атомная единица равна заряду электрона), а реальный заряд, равный суммарному заряду поверхностных групп, составляет 600 а. е., т.е. примерно вдвое меньше. Для частиц размером 100 нм эти величины равны соответственно ${{10}^{6}}$ и $6 \times {{10}^{4}}$ а. е. Во втором случае реальный заряд составляет лишь 6% от полного. Отношение реального к полному заряду ионообменника, относительный поверхностный заряд (ОПЗ), является количественным параметром, выражающим ионную природу частицы. Очевидно, что частицы с ОПЗ менее 5% вряд ли имеет смысл рассматривать как ионы. Эта граница, как видно, совпадает с предельными по размеру НИО.
Итак, по величине ОПЗ возможна следующая классификация заряженных частиц (табл. 1): <5% – классические ионообменники (к которым относятся микро- и макроиониты), >50% – ионы, а между 5 и 50% – НИО. Выделенная в классических ионообменниках группа микроионитов относится по размерам к хроматографическим неподвижным фазам, а макроиониты используются в ионообменной технологии. Отметим, что согласно приведенным ниже экспериментам ОПЗ макроионитов почти не зависит от размера гранул и составляет 0.05–0.1%.
Таблица 1.
Классификация заряженных частиц по относительному поверхностному заряду при среднем расстоянии между фиксированными зарядами внутри ионита 1 нм
| Название частицы/гранулы | Характерные размеры, нм | ОПЗ, % |
|---|---|---|
| Ион | 0.1–10 | 50–100 |
| Наноионит | 10–200 | 5–50 |
| Микроионит | 200–20000 | 0.1–5 |
| Макроионит | >20 000 | <0.1 |
Правая граница области существования НИО объясняется также устойчивостью их гидрозолей: более крупные частицы подвержены седиментации. Из-за слишком малого ОПЗ в этой области электростатическое отталкивание частиц не препятствует гравитационной силе. На этой границе устанавливается равновесие двух потоков – броуновской диффузии JD и седиментации Jsed:
(1)
${{J}_{{{\text{sed}}}}} = \frac{{2g\Delta \rho {{r}^{2}}}}{{9\eta }}c = \frac{{{{k}_{B}}T}}{{6\pi \eta r}}\frac{{{\text{d}}c}}{{{\text{d}}H}} = {{J}_{D}},$Решение уравнения (1) выражается барометрической формулой:
где $H = {\text{const}}$ – высота столба суспензии, на которой концентрация частиц с падает в e раз (в направлении снизу–вверх). Для ионообменников с внутренней пористостью около 50% и при реальной плотности полимера 1.2 г/см3 имеем разность $\Delta \rho \approx 0.1$ г/см3. Интересующая нас область концентраций гидрозоля охватывает интервал от ${{10}^{{ - 5}}}$ до 1 М (по функциональным группам). Высота столба растворов, содержащих НИО, в наших экспериментах не превышает 10 см. В соответствии с формулой (2) и с учетом сделанных оценок для правой границы размеров НИО получим $r \approx 50$ нм. Эта оценка соответствует диаметру 100 нм для сферических частиц. Для частиц в виде пластинок максимальный размер будет примерно вдвое больше, что согласуется с табл. 1.Кинетика и динамика ионного обмена с участием наноионитов. Из-за сравнительно большой массы диффузионная подвижность наночастиц намного ниже, чем у обычных молекул или ионов. В связи с этим в процессе сорбции НИО макроионитом противоположной полярности на первый план выходит конвективный массоперенос наночастиц, который сильно зависит от градиента температуры и вихревого движения жидкой фазы.
Другой процесс, связанный с обменом ионными формами НИО и макроионита той же полярности, в значительной степени включает внутреннюю диффузию. В нем частица НИО играет роль коиона, следовательно, характерный период достижения равновесия в такой системе включает сумму времен диффузии внутрь макроионита и внутрь НИО. Последняя величина оценивается в области десятков миллисекунд, что намного ниже первой величины. Процесс обмена ионными формами характеризуется увеличенной внешнедиффузионной областью в связи с сильным отталкиванием НИО от поверхности той же полярности при низкой ионной силе раствора.
Рассмотрим важную задачу для химии наноионитов: гидрозоль НИО, находящийся в произвольном по составу растворе, требуется перевести в золь с любой наперед заданной ионной формой в соответствующем растворе или в чистой воде. Ее решение иллюстрирует следующая теоретическая схема. Нами введены буквенные обозначения для ионитов, где вторая буква x (от “exchanger”), а первая буква a или c соответствует аниониту или катиониту, причем прописная буква – для обозначения макроионитов, а строчная – для обозначения наноионитов.
Пусть дан, для определенности, нанокатионит (НИК) в форме B (${\mathbf{c}}{{{\mathbf{x}}}^{ - }}{{B}^{ + }}$) в равновесии с раствором соли AB. Требуется получить НИК в форме X+ в равновесии с раствором XY. Проведем следующие динамические процессы:
• обмен коионов ${{A}^{ - }}$ на анионообменной колонне ${\mathbf{A}}{{{\mathbf{x}}}^{ + }}$ в форме ${{Y}^{ - }}{\text{:}}$
(3)
$\begin{gathered} \left( {1 + p} \right){\mathbf{A}}{{{\mathbf{x}}}^{ + }}{{Y}^{ - }} + {\mathbf{c}}{{{\mathbf{x}}}^{ - }}{{B}^{ + }} + {{A}^{ - }}{{B}^{ + }} \Leftrightarrow {\mathbf{A}}{{{\mathbf{x}}}^{ + }}{{A}^{ - }} + \\ + \,\,p{\mathbf{A}}{{{\mathbf{x}}}^{ + }}{\mathbf{c}}{{{\mathbf{x}}}^{ - }} + \left( {1 - p} \right){\mathbf{c}}{{{\mathbf{x}}}^{ - }}{{B}^{ + }} + \left( {1 + p} \right){{B}^{ + }}{{Y}^{ - }}, \\ \end{gathered} $• обмен противоионов ${{B}^{ + }}$ на катионообменной колонне ${\mathbf{C}}{{{\mathbf{x}}}^{ - }}$ в форме ${{X}^{ + }}{\text{:}}$
(4)
$\begin{gathered} {\mathbf{C}}{{{\mathbf{x}}}^{ - }}{{X}^{ + }} + {\mathbf{c}}{{{\mathbf{x}}}^{ - }}{{B}^{ + }} + {{B}^{ + }}{{Y}^{ - }} \Leftrightarrow {\mathbf{C}}{{{\mathbf{x}}}^{ - }}{{B}^{ + }} + \\ + \,\,{\mathbf{c}}{{{\mathbf{x}}}^{ - }}{{X}^{ + }} + {{X}^{ + }}{{Y}^{ - }}. \\ \end{gathered} $Таким образом, метод дает долю $1 - p$ целевого продукта ${\mathbf{c}}{{{\mathbf{x}}}^{ - }}{{X}^{ + }}$ в растворе XY с несколько увеличенной концентрацией – в $1 + p$ раз.
Реакция (3) протекает в системе с двумя твердыми фазами и общей жидкой фазой. Продукт взаимодействия твердых фаз представляет собой нанокомпозит ${\mathbf{A}}{{{\mathbf{x}}}^{ + }}{\mathbf{c}}{{{\mathbf{x}}}^{ - }},$ у которого поверхность макроионита не блокируется, предоставляя для обмена противоионов весь его объем.
Удерживание наноионитов. Существуют два механизма удерживания частиц наноионитов: электростатический, за счет притяжения противоположно заряженных поверхностей, и адсорбционно-механический, за счет помещения наночастицы “гостя” в потенциальную яму ван-дер-ваальсовых сил внутри макропоры поверхности “хозяина”. Первый случай описан выше как удерживание наноионитов на колонках макроионитов противоположной полярности. Он описывается параметром p в уравнении (3). Второй механизм реализуется при использовании макропористых адсорбентов с порами, превышающими по диаметру размер наночастиц.
Твердофазный ионный обмен. Попытки наблюдения и изучения твердофазного ионного обмена для систем с макроионитами ранее затруднялись очень низкой скоростью. В системах с наноионитами кинетика твердофазного ионного обмена характеризуется временами значительно меньше 1 с, что позволяет проводить его в обычном для динамических сорбционных экспериментов режиме. В таких системах твердофазный ионный обмен осуществляется между макроионитом, наполняющим колонку, и раствором наноионита той же полярности.
Реакция (4) в отсутствие электролита имеет вид:
(5)
${\mathbf{C}}{{{\mathbf{x}}}^{ - }}{{X}^{ + }} + {\mathbf{c}}{{{\mathbf{x}}}^{ - }}{{B}^{ + }}\mathop \Leftrightarrow \limits^{{{{\text{H}}}_{{\text{2}}}}{\text{O}}} {\mathbf{C}}{{{\mathbf{x}}}^{ - }}{{B}^{ + }} + {\mathbf{c}}{{{\mathbf{x}}}^{ - }}{{X}^{ + }}.$Она необычна, так как предполагает прямой обмен ионными формами между двумя твердыми фазами. То, что такой процесс возможен, вытекает из двух модельных представлений:
• если частицу НИО представить как коион, то реакция (5) будет обычной реакцией ионного обмена;
• если макро- и наночастицы объединить в рамках одной частицы макроионита, то реакция (5) будет описывать процесс внутренней диффузии.
Отличие от модельных систем заключается в кинетике: в реальной системе обмен происходит медленнее. При сравнении второй модели с первой найдем, что добавляется диффузия внутрь НИО. Кроме того, среднее расстояние между макро- и наночастицами в реальной системе больше, чем во второй модели. Очевидно, что реальная систем будет приближаться к указанным моделям при уменьшении размеров наночастиц и с увеличением их концентрации.
Особый случай реакции (3) описывает взаимодействие гидроксильной формы макроионита ${{Y}^{ - }} = {\text{O}}{{{\text{H}}}^{ - }}$ с водородной формой НИО на фоне воды:
(6)
${\mathbf{A}}{{{\mathbf{x}}}^{ + }}{\text{O}}{{{\text{H}}}^{ - }} + {\mathbf{c}}{{{\mathbf{x}}}^{ - }}{{{\text{H}}}^{ + }} \Leftrightarrow {\mathbf{A}}{{{\mathbf{x}}}^{ + }}{\mathbf{c}}{{{\mathbf{x}}}^{ - }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$Продукт этой реакции нанокомпозит ${\mathbf{A}}{{{\mathbf{x}}}^{ + }}{\mathbf{c}}{{{\mathbf{x}}}^{ - }}$ представляет собой биполярный сорбент с тонким катионообменным слоем, который может служить высокоэффективной фазой в хроматографии. Для реакции (6) характерна большая константа равновесия не только потому, что образуется устойчивый нанокомпозит, но и потому, что одним из ее продуктов является вода.
Сила взаимодействия в системах макрокатионит–наноанионит (НИА) или макроанионит–НИК многократно превышает силу взаимодействия обычного иона с ионообменником. Система стремится к состоянию нанокомпозита, в котором функцию “хозяина” выполняет макроионит, а роль “гостя” – НИО. У ионита-“хозяина” доступными для ионита-“гостя” являются только внешняя поверхность и макропоры. Выше отмечено, что для макроионита емкость поверхности составляет очень малую долю всей емкости, распределенной по объему, так что ионит-“гость” не препятствует процессу ионного обмена на “хозяине”.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В ряде экспериментов путем размола в шаровой мельнице и последующего центрифугирования водных суспензий получены золи сульфокатионита КУ-2 × 8 (х. ч., Россия и высокоосновного анионита АВ-17 × 8 (х. ч., Россия) с матрицей сополимера стирола и 8% дивинилбензола. Размеры частиц варьировались в диапазоне 50–250 нм (рис. 4). Концентрация золей по функциональным группам составляла от 7 до 40 мМ.
Относительную концентрацию гидрозоля определяли с помощью фотометра КФК-2 (ЗОМЗ, Россия) по оптической плотности при длине волны 315 нм.
Электропроводность и состав ионных смесей определяли с помощью ионного хроматографа Цвет-3006 (ДОКБА, Россия), оснащенного катионной и анионной двухколоночными системами и кондуктометрическим детектором.
Эксперименты по люминесценции проводили с использованием флуориметра Флюорат-М (ЛЮМЕКС, Россия) с шириной щели 10 нм и полосой возбуждения 272 нм.
Динамические сорбционные эксперименты проводили с использованием стеклянных колонок диаметром 4 мм с загрузкой из макроионитов объемом 1–5 мл. Подачу жидкой фазы осуществляли перистальтическим насосом. На выходе из колонки отбирали и анализировали небольшие порции раствора.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Оценка $\zeta $-потенциала частицы наноионита. Из-за однородности распределения функциональных групп в объеме полимера эффективному заряду можно поставить в соответствие отношение заряд/масса, которое является характеристикой подвижности частицы, т.е. диффузионная подвижность наночастиц пропорциональна эффективному заряду. Взяв за основу эти соображения, можно оценить $\zeta $-потенциал частицы НИО в разбавленном водном растворе по емкости ионита ${{a}_{0}}$ (мэкв/мл) и диаметру частицы $d$ (нм) по формуле $\zeta \sim 10\,{{a}_{0}}d$ (мВ) в диапазоне 300–1000 мВ.
Оценки электростатического потенциала вблизи поверхностей ионообменников известны из литературы. Например, для соседних групп высокоосновного анионита, находящихся на расстоянии 1 нм, найден потенциал $\zeta \sim 250$ мВ [6] из эксперимента с гомогенной мембраной AMX-SB в Cl-форме и сильно разбавленным раствором NaCl, а также рассчитан с помощью модифицированного уравнения Гельмгольца–Смолуховского [7].
Охарактеризованный здесь $\zeta $-потенциал обеспечивает высокую устойчивость золей НИО, которые сохраняются в течение многих лет. Та же электростатическая природа заставляет эти устойчивые золи НИА и НИК при смешении быстро (за секунды) коагулировать. Рис. 5 иллюстрирует плотные ветвистые структуры, которые возникают при смешении разнополярных НИО.
Концентрация частиц НИО может быть поставлена в соответствие концентрации функциональных групп ${{c}_{{{\text{fg}}}}}$ через емкость твердой фазы:
где ${{c}_{{{\text{sp}}}}}$ – концентрация частиц НИО (г/л), ${{a}_{{0{\text{sp}}}}}$ – емкость твердой фазы (моль/г), т.е. плотность функциональных групп в матрице полимера. Величина емкости твердой фазы может быть постоянной для частиц и известной как емкость исходного ионита при способе получения наноионитов путем измельчения. В таком случае концентрацию НИО удобно определять как ${{c}_{x}}$(М), при необходимости легко пересчитываемую в ${{c}_{{{\text{sp}}}}}.$Пример. Образец НИК/Н имеет концентрацию 10.7 мМ по результатам титрования щелочью. Выпаривание 15 мл гидрозоля до воздушно-сухого состояния дало осадок массой 37.9 мг, откуда массовая концентрация НИК 2.53 г/л. Отношение полученных величин дает 4.23 ммоль/г, что соответствует емкости исходного катионита КУ-2-8.
Электропроводность и форма частиц. Отношение k электропроводности, создаваемой наноионитом в форме ионов I (НИО/I), к электропроводности раствора IJ с концентрацией $c$ равно:
(8)
$k = \frac{{{{c}_{x}}{{\lambda }_{{xI}}}}}{{c\left( {{{\lambda }_{I}} + {{\lambda }_{J}}} \right)}},$Объединяя выражения (7)–(9), выразим ОПЗ через k:
(10)
$\gamma = \frac{{{{\lambda }_{{xI}}}}}{{{{\lambda }_{I}}}} = k\frac{c}{{{{c}_{x}}}}\left( {1 + \frac{{{{\lambda }_{J}}}}{{{{\lambda }_{I}}}}} \right).$Пример. В эксперименте измеряли электропроводность золя в воде НИК/Н, полученной из КУ-2-8/Н, и 0.025 М раствора HCl. Концентрация НИК в пересчете на функциональные группы ${{c}_{x}} = $ 0.038 М найдена титрованием раствором щелочи. Подстановка измеренного значения $k = 0.35$ вместе с эквивалентными электропроводностями ионов в формулу (10) дала $\gamma $ = 0.28. Если бы частицы были сферическими, то такой относительный заряд соответствовал бы $d = 22$ нм (подставляется среднее расстояние 1 нм между ближайшими функциональными группами). Предположение о форме частицы в виде таблетки высотой h дает более реалистичные величины: $h = 10,$ $d = 50$ нм.
Динамика обмена и удерживание наноионита. Для работы с наноионитами удобно использовать НИО в стандартном состоянии – в форме ионов воды (НИК/Н, НИА/ОН) на фоне чистой воды: такой гидрозоль легко количественно перевести в другие формы, оставляя фоном чистую воду, используя кислотно-основное титрование. Например, если требуется получить натриевую форму НИК, то к раствору НИК/Н добавляют эквивалентное количество раствора NaOH; если требуется получить хлоридную форму НИА, то к раствору НИА/ОН добавляют эквивалентное количество HCl. В связи с этим измельчаемые макроиониты предварительно переводили в форму соответствующих ионов воды. До тех пор, пока не выработаны приемы восстановления стандартных состояний, золи НИО необратимо расходуются при работе в ионообменных процессах. Ниже показано, что стандартные состояния можно восстановить с помощью реакций (3), (4).
Для экспериментальной реализации теоретической схемы, соответствующей реакции (3), снимали выходную кривую сорбции наночастиц КУ-2/Н с добавкой электролита HCl на колонке с макроионитом АВ-17/ОН. Концентрация НИК в пересчете на функциональные группы ${{c}_{x}}$ = 0.038 М, концентрация HCl 0.025 М; объем загрузки макроанионита АВ-17/ОН в колонке 1 мл, диаметр колонки 4 мм, свободный объем колонки 1.71 мл; расход подвижной фазы 0.22 мл/мин. В результате эксперимента получили модифицированный биполярный слой с емкостью по анионам 0.95 мэкв/мл и по катионам – менее 0.1 мэкв/мл. Параметр p составил менее 0.01.
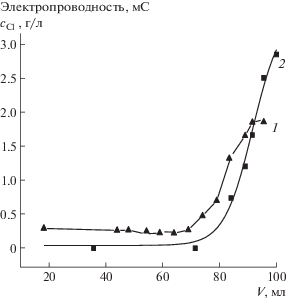
Реакцию (4) осуществляли совместно с реакцией (3) на системе последовательно соединенных колонок с макроанионитом АВ-17/OH и макрокатионитом КУ-2/H (рис. 6). Снимали выходные кривые сорбции наночастиц НИК (КУ-2) с электролитом NaCl. Измеряли электропроводность (1) и содержание хлорид-иона методом ионной хроматографии (2) (хроматограф Цвет-3006, ДОКБА, Россия). Концентрация НИК в интервале объемов пропущенного раствора 6–80 мл по результатам титрования щелочью составляла 0.038 мэкв/мл. В результате эксперимента в указанном интервале выходной кривой получили чистую форму НИК/Н на фоне деионированной воды. Таким образом, описанный процесс позволил восстановить стандартное состояние гидрозоля.
Рис. 6.
Выходная кривая сорбции гидрозоля наночастиц КУ-2 (НИК), загрязненного электролитом Na-Cl, на системе последовательно соединенных колонок с макроанионитом АВ-17/OH и макрокатионитом КУ-2/H. Измеряли электропроводность (1) и содержание хлорид-иона (2) методом ионной хроматографии.
Для реализации реакции (6) снимали выходную кривую сорбции гидрозоля НИА АВ-17/OH на колонке с макроионитом КУ-2/H зернением 0.45 мм. Измеряли оптическую плотность раствора при длине волны λ = 315 нм. В результате определили емкость КУ-2 по НИА: 0.002 мэкв/мл. Эта величина соответствует ОПЗ макрокатионита 0.07%.
Твердофазный ионный обмен. Принципиальная возможность протекания реакции (5) показана в эксперименте, в котором гидрозоль НИО, не содержащий электролита, использовался для переноса противоионов из одной колонки в другую (рис. 7).
Экспериментальная установка содержала две последовательно расположенные одинаковые колонки с высокоосновным ионитом АВ-17 × 8 зернением 0.3–0.5 мм в разных ионных формах: первая – в хлоридной, вторая – в гидроксильной. Объем загрузки колонок внутренним диаметром 4 мм составлял 6 мл. Через эту систему колонок пропускали гидрозоль НИА АВ-17, очищенный от примесей электролитов, имевший на входе ОН-форму. Концентрация гидрозоля 0.0025 мэкв/мл. На выходе из второй колонки собирали раствор и по титрованию кислотой определяли долю ОН-формы вышедшего гидрозоля, которая всегда определялась как 100%. После пропускания 50 мл золя (скорость потока 0.7 мл/мин) процесс останавливали. Путем регенерации второй колонки щелочью определяли количество перенесенного хлорид-иона. Это количество (смыто 0.130 ± ± 0.005 мэкв хлорид-иона) было строго эквивалентно количеству пропущенного гидрозоля (посажено 0.125 мэкв, 2% от емкости), что однозначно доказывает протекание реакции (5). Регенерацию проводили 0.1 М NaOH, пропущено 145 мл, скорость потока 0.7 мл/мин.
Применение наноразмерных ионитов в аналитической химии. Ионная хроматография и капиллярный электрофорез в настоящее время – хорошо развитые методы, однако для них существуют проблемы дорогостоящих и недостаточно эффективных фаз, недостаточной селективности, линейности и чувствительности, что приводит к низкой производительности и высокой стоимости ионного анализа. Решение подобных проблем возможно при использовании в качестве модификаторов фаз НИО, отличительной особенностью которых являются высокие равновесные и кинетические свойства, поверхностная инактивность.
В отличие от обычных ионитов, наноиониты могут проходить через макропористые мембраны и фильтрующие материалы, а наличие большого заряда при малой массе позволяет управлять их движением и распределением на фазовых границах.
Ионная хроматография на катионообменной колонке НАКАТЕКС. Идея модификации поверхности частиц колоночной загрузки микронных размеров суспензией субмикрочастиц за счет электростатического закрепления последних на поверхности известна со времен открытия метода ионной хроматографии и постоянно развивается [8–10]. При создании катионообменной колонки NACATEX добивались образования структуры сорбционной поверхности, отличительным признаком которой является закрепление наночастиц катионита-модификатора в порах анионита-основы [3, 11, 12]. В наших исследованиях реализованы следующие основные принципы [11, 12]:
1. в качестве основы выбирается макропористый ионит, поверхность которого складывается из внутрипоровой и внешней;
2. в качестве модификатора выбирается ионит требуемой для хроматографии селективности, полярность которого противоположна полярности основы;
3. размер частиц модификатора выбирается меньшим, чем размер пор основы, для обеспечения возможности проникновения частиц во внутрипоровое пространство;
4. модификация основы проводится динамическим способом, для чего через хроматографическую колонку, наполненную основой, пропускается наносуспензия модификатора до ее проскока в фильтрат;
5. фиксация частиц модификатора на поверхности основы происходит по механизму взаимодействия противоположных электрических зарядов;
6. ионные формы основы и модификатора обеспечивают протекание реакции нейтрализации при их взаимодействии, что формирует крутой фронт динамического процесса и прочное удерживание наночастиц в порах основы;
7. внешняя поверхность основы очищается от модификатора путем промывки водой, этанолом, концентрированными растворами кислот и щелочей.
На рис. 8 представлена микрофотография частиц основы, на которой видны вкрапления модификатора, утопленные в макропорах анионита. Такой тип структуры поверхности характеризуется стабильностью ее сорбционных свойств и химической устойчивостью, что является преимуществом по сравнению с полифункциональным сорбентом на основе силикагеля, описанным в работе [10].
Рис. 8.
Электронная микрофотография зерен загрузки колонки НАКАТЕКС (светлые вкрапления соответствуют частицам модификатора).

В процессе испытания на ионном хроматографе аналитических свойств хроматографической колонки выбраны условия разделения и определения щелочных элементов и катиона аммония. Пределы обнаружения аналитов составили десятки мкг/л. Параметры эксперимента: разделяющая колонка НАКАТЭКС $150 \times 4.6$ мм, подавительная колонка с анионитом АВ-17 × 8 в ОН-форме, элюент 2.5 мМ HNO3, расход 1.5 мл/мин. Хроматограмма представлена на рис. 9.
Рис. 9.
Хроматограмма модельной смеси катионов щелочных элементов: 1 – Li+ (1 мг/л), 2 – Na+ (5 мг/л), 3 – ${\text{NH}}_{4}^{ + }$ (5 мг/л), 4 – K+ (5 мг/л), 5 – Rb+ (10 мг/л), 6 – Cs+ (15 мг/л). Условия разделения: $150 \times 4.6$ мм колонка НАКАТЭКС, элюент: 2.5 мМ HNO3, расход 1.5 мл/мин, кондуктометрическое детектирование с химическим подавлением.

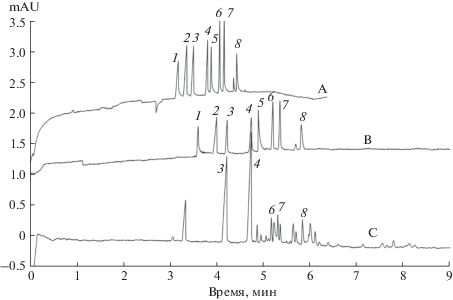
Капиллярный электрофорез. В работах Карцовой с сотр. [13, 14] приготовленный нами образец НИА использовали в качестве модификатора фонового электролита в капиллярном электрофорезе и стенок капилляра в электрокинетической хроматографии для разделения смесей неорганических и органических анионов. Выявлено влияние концентрации наноионита в составе фонового электролита на величину и знак электроосмотического потока, а также эффективность и факторы разрешения при электрофоретическом разделении неорганических анионов. Впервые установлено, что добавка высокоосновного наноанионита в фоновый электролит в концентрации, превышающей 0.01 мМ по функциональным группам, приводит к обращению электроосмотического потока. Это свидетельствует о динамической модификации стенок кварцевого капилляра и приводит к росту эффективности и селективности разделения неорганических анионов по сравнению с результатами, получаемыми с традиционным катионным детергентом бромидом цетилтриметиламмония. Продемонстрировано селективное и высокоэффективное разделение смесей неорганических и органических анионов с использованием НИА. Методика использована для определения органических кислот в вине (рис. 10).
Рис. 10.
Электрокинетическая хроматограмма модельной смеси анионов карбоновых кислот (A, B) и пробы вина, разбавленной в 200 раз (С): 1 – оксалат, 2 – формиат, 3 – тартрат, 4 – малеат, 5 – цитрат, 6 – сукцинат, 7 – лактат, 8 – ацетат. Фоновый электролит: 10 мМ бензойная кислота, 9 мМ диэтаноламин, 0.5 мМ бромид цетилтриметиламмония (ЦТАБ). A – капилляр обработан ЦТАБ; B, C – капилляр обработан наноанионитом (НИА). Косвенное УФ-детектирование, 254 нм.
Фотолюминесценция наноионита. Сильно разбавленные растворы НИО на полистирольной основе являются люминофорами. Наибольший сигнал соответствует НИО в стандартном состоянии. Некоторые ионные формы, широко распространенные в природе, не влияют на этот сигнал, однако формы, содержащие атомы переходных металлов, тушат его [15]. Частички НИО многократно концентрируют такие ионы, поэтому пробы, в которые дозируется НИО, можно проанализировать люминесцентным методом с хорошей чувствительностью [16]. Новый способ определения тяжелых металлов в водах основан на принципе тушения люминесценции и является косвенным с ограниченным динамическим диапазоном (1–2 порядка по концентрации аналита), что можно отнести к его недостаткам. Его преимущества заключаются в возможности передвигать динамический диапазон выбором дозируемого количества НИО и в универсальности по отношению к различным тяжелым металлам.
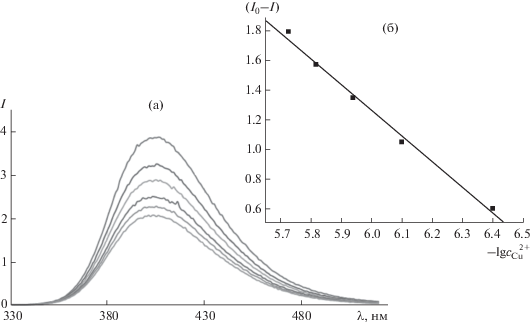
Изучена возможность определения меди(II). Для этого НИА предварительно переводили в форму анионов сульфосалициловой кислоты (ССК). Модельные растворы содержали 26 мкМ НИА/ССК, в которые дозировали ионы Cu2+ с концентрациями 0.4–2 мкМ. Спектр люминесценции имеет максимум при 405 нм (рис. 11а). Аналитический сигнал ионов меди представляет собой разность между сигналом чистой воды (I0) и пробы. Градуировочный график (рис. 11б) аппроксимируется уравнением: ${{I}_{0}} - I = 11.71 + \lg {{c}_{{{\text{C}}{{{\text{u}}}^{{{\text{2}} + }}}}}},$ где ${{c}_{{{\text{C}}{{{\text{u}}}^{{{\text{2}} + }}}}}}$ – концентрация ионов меди, М.
Рис. 11.
Спектры люминесценции НИА в форме сульфосалицилата с добавками ионов меди (а) и градуировочный график (б).
Работа выполнена при финансовой поддержке Программ фундаментальных исследований Президиума РАН: № 8 “Химический анализ и исследование структуры веществ: фундаментальные основы и новые методы” на 2015–2017 гг. и № 26 “Фундаментальные основы и новые эффективные методы химического анализа и исследования структуры веществ и материалов” на 2018–2020 гг.
Список литературы
Turner S.R., Weiss R.A., Lundberg R.D. The emulsion copolymerization of styrene and sodium styrene sulfonate // J. Polym. Sci. Polym. Chem. Ed. 1985. V. 23. P. 535.
Brijmohan S.B., Swier S., Weiss R.A., Shaw M.T. Synthesis and characterization of crosslinked sulfonated polystyrene nanoparticles // Ind. Eng. Chem. Res. 2005. V. 44. P. 8039.
Долгоносов А.М., Колотилина Н.К., Ядыков М.С. Способ приготовления высокоэффективных колонок для ионной хроматографии. Патент № 2499628 РФ // Б.и. 2013. № 33.
IonPac AG14A Guard Column and AS14A Analytical Column. Product Manual, DIONEX Corp., 2002. P. 16. http://www.thermofisher.com/order/catalog/ product/056899 (19.03.2018).
Дашевский В.Г. Конформационный анализ органических молекул. М.: Химия, 1982. 272 с.
Nebavskaya K.A., Sarapulova V.V., Sabbatovskiy K.G., Sobolev V.D., Pismenskaya N.D., Sistat P., Cretin M., Nikonenko V.V. Impact of ion exchange membrane surface charge and hydrophobicity on electroconvection at underlimiting and overlimiting currents // J. Membrane Sci. 2017. V. 523. P. 36.
Yaroshchuk A., Ribitsch V. Role of channel wall conductance in the determination of ζ-potential from electrokinetic measurements // Langmuir. 2002. V. 18. P. 2036.
Small H., Stevens T., Bauman W. Novel ion exchange chromatographic method using conductometric detection // Anal. Chem. 1975. V. 47. № 11. P. 1801.
Sarzanini C. Recent developments in ion chromatography // J. Chromatogr. A. 2002. V. 956. P. 3.
Liu X., Pohl C., Woodruff A., Chen J. Chromatographic evaluation of reversed-phase/anion-exchange/cation-exchange trimodal stationary phases prepared by electrostatically driven self-assembly process // J. Chromatogr. A. 2011. V. 1218. P. 3407.
Долгоносов А.М., Колотилина Н.К., Ядыков М.С., Бурмистров А.А. Композиты с пористой биполярной поверхностью для ионной хроматографии // Журн. аналит. химии. 2013. Т. 68. № 5. С. 490. (Dolgonosov A.M., Kolotilina N.K., Burmistrov A.A., Yadykov M.S. Composites with a porous bipolar surface for ion chromatography // J. Analyt. Chem. 2013. Т. 68. № 5. С. 444.)
Dolgonosov A.M., Khamizov R.Kh. Properties and application of nano-ion-exchangers / Ion Exchange – a Continuing Success Story (IEx 2016). Extended Abstracts / Ed. Cox M. Cambridge: Robinson College Publ., 2016. P. 135.
Дзема Д.В., Карцова Л.А., Поликарпова Д.А. Применение высокоосновного наноионита в капиллярном электрофорезе для разделения и концентрирования неорганических анионов // Аналитика и контроль. 2017. Т. 21. № 1. С. 41.
Polikarpova D., Makeeva D., Kartsova L., Dolgonosov A., Kolotilina N. Nano-sized anion-exchangers as a stationary phase in capillary electrochromatography for separation and on-line concentration of carboxylic acids // Talanta. 2018. V. 188. P. 744.
Farzin L., Shamsipur M., Sheibani Sh. Aptamer-based analytical strategies using the nanomaterials for environmental and human monitoring of toxic heavy metals. A review // Talanta. 2017. V. 174. P. 619.
Долгоносов А.М., Хамизов Р.Х., Колотилина Н.К., Шайхина С.У., Евстигнеева П.В. Получение, свойства и применение коллоидных растворов наноразмерных ионитов // Сорбционные и хроматографические процессы. 2016. Т. 16. № 4. С. 400.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии






